骨髓间充质干细胞对氧化应激损伤心肌细胞凋亡、自噬的影响▲
王琛琛 郭彩茹 牛宇杰 王 皓 续 畅 亓 民
[1 首都医科大学附属北京世纪坛医院临床基因与细胞工程中心,北京市 100038;2 河南省肿瘤免疫与再生医学国际联合实验室(郑州大学附属洛阳中心医院),河南省洛阳市 471009;3 洛阳市心脑组织损伤与修复重点实验室,河南省洛阳市 471009;4 首都医科大学附属北京世纪坛医院药物及医疗器械临床试验机构,北京市 100038]
心肌梗死是冠状动脉粥样硬化斑块破裂和继发血栓形成导致冠状动脉供血减少或中断,进而引起严重的心肌缺血和心肌坏死。心肌梗死的病理过程不可逆转且预后极差,已成为影响人类健康的主要问题[1]。急诊冠状动脉介入治疗和溶栓治疗等干预虽然可以在一定程度上减轻心肌损伤,但因无法修复坏死心肌而难以获得最佳治疗效果。随着再生医学领域的临床转化进程不断推进,干细胞的再生潜能为心肌再生提供了可能[2]。骨髓间充质干细胞(bone marrow mesenchymal stem cell,BMSC)具有多向分化潜能,有助于受损心肌细胞的修复或再生,阻止心脏重构和心力衰竭的发生,在此过程中BMSC的旁分泌功能发挥重要作用[3-5]。细胞自噬是细胞成分的自我降解,其通过细胞膜包裹衰老、受损或失去功能的蛋白质及细胞器,形成自噬溶酶体后降解包裹的内容物,为细胞代谢提供原料,进而促进细胞的存活。自噬对维持心肌细胞内稳态非常重要[6]。BMSC对缺血再灌注修复的作用机制目前尚未明确,细胞自噬可能发挥了关键作用。据此,本研究拟通过将BMSC与H2O2诱导的氧化应激损伤心肌细胞间接共培养,探讨BMSC修复氧化应激损伤心肌细胞的机制,并分析细胞自噬在该过程中的作用,从而为心肌再灌注损伤的治疗提供新思路,为预防和逆转缺血再灌注损伤的发生、发展提供理论与数据支持。
1 材料与方法
1.1 材料
1.1.1 实验细胞:SD大鼠BMSC[赛业(广州)生物科技有限公司,货号:RASMX-01001];大鼠心肌细胞H9c2(上海富衡生物科技有限公司,货号:FH1004)。
1.1.2 主要试剂:高效RIPA组织/细胞裂解液(货号:R0010)、CCK-8试剂盒(货号:CA1210)、AnnexinⅤ-FITC/PI凋亡试剂盒(货号:CA1020)、二喹啉甲酸(bicinchoninic acid,BCA)蛋白浓度测定试剂盒(货号:PC0020)均购自北京索莱宝科技有限公司;3% H2O2购自Sigma-Aldrich Lab &Production Materials公司(货号:102131391);FastKing一步法除基因组cDNA第一链合成预混试剂盒(货号:KR118)、SuperReal彩色荧光定量预混试剂增强版(货号:FP205)均购自天根生化科技(北京)有限公司;TRIzol总RNA提取试剂盒(货号:R0016)、微管相关蛋白1轻链3(microtubule-associated protein 1 light chain 3,LC3)B兔多克隆抗体(货号:AL221)、Beclin-1兔多克隆抗体(货号AF5123)、GAPDH 兔多克隆抗体(货号:AF1186)、辣根过氧化物酶标记山羊抗兔IgG(货号:A0192)均购自北京碧云天科技有限公司。
1.1.3 主要仪器:微量核酸检测仪(Thermo Fisher Scientific公司,型号:NanoDrop 2000);酶标仪(PerkinElmer公司,型号:VICTOR X3);流式细胞仪(Becton,Dickinson and Company,型号:BD FACSCanto Ⅱ);实时荧光定量PCR仪(Applied Biosystems公司,型号:StepOnePlus);电泳仪(Bio-Rad公司,型号:Bio-Rad Mini-PROTEAN Tetra Systems);蛋白转印仪(Bio-Rad公司,型号:Bio-Rad Mini Trans-Blot);凝胶成像仪(上海天能科技有限公司,型号:Tanon 5200 Multi)。
1.1.4 细胞培养基:大鼠BMSC的培养使用SD大鼠BMSC完全培养基[赛业(广州)生物科技有限公司,货号:RASMX-90011];大鼠心肌细胞H9c2的培养使用含10%胎牛血清(杭州四季青生物工程材料有限公司,货号:11011-6125)和1%青霉素-链霉素双抗的低糖DMEM(HyClone公司,货号:SH30021.01)。
1.2 实验方法
1.2.1 细胞培养:取出大鼠心肌细胞H9c2和大鼠BMSC,复苏后接种于相应培养基,置于37 ℃、5% CO2培养箱中培养,每2 d换液1次,待细胞密度达到90%时进行传代培养,选择第3~5代细胞进行实验。
1.2.2 H2O2诱导氧化应激损伤心肌细胞模型的浓度筛选:将对数生长期的大鼠心肌细胞H9c2按5×104个/mL、100 μL/孔接种在24孔板中,置于37 ℃、5% CO2的培养箱中过夜培养,次日使用PBS清洗,用含1%胎牛血清的低血清培养基饥饿培养24 h后,更换为终浓度含0 μmol/L、50 μmol/L、100 μmol/L、300 μmol/L、500 μmol/L、700 μmol/L H2O2的培养基,分别孵育6 h、9 h、12 h后每孔加入10 μL CCK-8试剂,放入37 ℃、5% CO2培养箱中孵育3 h。采用酶标仪检测各孔在450 nm波长处的吸光度,细胞活力=给药组吸光度值/0 μmol/L H2O2组吸光度值×100%。
1.2.3 实验分组及干预:取对数生长期的大鼠心肌细胞H9c2按5×104个/mL、1 000 μL/孔接种在24孔板中,并将细胞分成H2O2组、BMSC+H2O2组、对照组,置于37 ℃、5% CO2的培养箱中过夜培养。取出H2O2组和BMSC+H2O2组的24孔板,加入500 μmol/L的H2O2处理12 h以建立氧化应激损伤心肌细胞模型;使用PBS清洗细胞3次后加入低糖DMEM(300 μL/孔),将两组的24孔板置于Transwell小室,然后在两组的小室中加入低糖DMEM(200 μL/孔),BMSC+H2O2组的小室中同时加入对数生长期大鼠BMSC(1×105个/mL、200 μL/孔);将两组小室置于37 ℃、5% CO2恒温培养箱中,培养24 h。取出对照组的24孔板并置于Transwell小室,在小室中加入低糖DMEM(200 μL/孔),然后将小室置于37 ℃、5% CO2恒温培养箱,培养24 h。
1.2.4 流式细胞术检测细胞凋亡情况:取干预24 h后的各组细胞,用0.25%胰酶溶液消化,收集至流式管中,以1 200 r/min离心5 min,弃上清液。加入4 ℃预冷的PBS重悬,1 200 r/min离心5 min,弃上清液,依次加入5 μL Annexin Ⅴ-FITC及5 μL PI,混匀后避光孵育20 min,然后加入300 μL结合缓冲液重悬。于1 h内用流式细胞仪检测细胞凋亡情况。每组设置3个复孔,实验重复3次。
1.2.5 实时荧光定量PCR检测自噬相关基因的表达情况:取干预24 h后的各组细胞,用0.25%胰酶溶液消化,12 000 r/min离心5 min后收集细胞沉淀,用PBS冲洗3次,5 min/次,采用TRIzol总RNA提取试剂盒提取细胞总RNA,使用微量核酸检测仪测定总RNA浓度,按照FastKing一步法除基因组cDNA第一链合成预混试剂盒说明书进行cDNA合成,按照SuperReal彩色荧光定量预混试剂增强版说明书进行实时荧光定量PCR实验。引物由深圳华大基因股份有限公司合成,引物序列见表1。反应体系包括2×SuperReal PreMix Plus 10 μL,正向引物(10 μmol/L)0.6 μL、反向引物(10 μmol/L)0.6 μL、cDNA模板1.5 μL、50×ROX Reference Dye 2 μL、RNase-free ddH2O 5.3 μL,总共20 μL。反应条件为 95 ℃预变性15 min;95 ℃变性10 s,60 ℃退火30 s,60 ℃延伸30 s,共40个循环。采用2-ΔΔCt法计算Beclin-1、LC3B的mRNA相对表达水平。每组设置3个复孔,实验重复3次。
1.2.6 Western blot检测自噬相关蛋白的表达情况:取干预24 h后的各组细胞,用25%胰酶溶液消化,然后加入高效RIPA组织/细胞裂解液裂解各组细胞,提取细胞总蛋白,利用BCA蛋白浓度测定试剂盒测定蛋白浓度。取80 μg蛋白,进行12% SDS-PAGE(60~80 V)分离蛋白,然后在300 mA、90 min的条件下将目的蛋白转移至PVDF膜;5%脱脂牛奶室温封闭PVDF膜1 h。分别加入5 μL LC3B兔多克隆抗体(稀释比为1 ∶1 000)、5 μL Beclin-1兔多克隆抗体(稀释比为1 ∶1 000)、5 μL GAPDH兔多克隆抗体(稀释比为1 ∶800),4 ℃孵育过夜;TBST洗膜4次,10 min/次;加入5 mL辣根过氧化物酶标记山羊抗兔IgG二抗(稀释比为1 ∶1 000),室温孵育1 h,TBST洗膜(同上)。以GAPDH为内参,ECL显影成像后利用Quantity One软件对条带灰度值进行分析。每组设置3个复孔,实验重复3次。
1.3 统计学分析 采用SPSS 20.0软件进行统计学分析。计量资料以(x±s)表示,多组间比较采用单因素方差分析,两两比较采用LSD-t检验或Dunnett-t法。以P<0.05为差异有统计学意义。
2 结 果
2.1 H2O2诱导氧化应激损伤心肌细胞模型的浓度和干预时间筛选结果 不同浓度H2O2干预不同时间后,大鼠心肌细胞H9c2活力差异均有统计学意义(均P<0.05)。其中,在500 μmol/L H2O2干预12 h时,细胞活力约为50%,较能体现药效差异,且多次造模结果稳定,见表2。因此选取500 μmol/L H2O2处理12 h的方法构建氧化应激损伤心肌细胞模型。
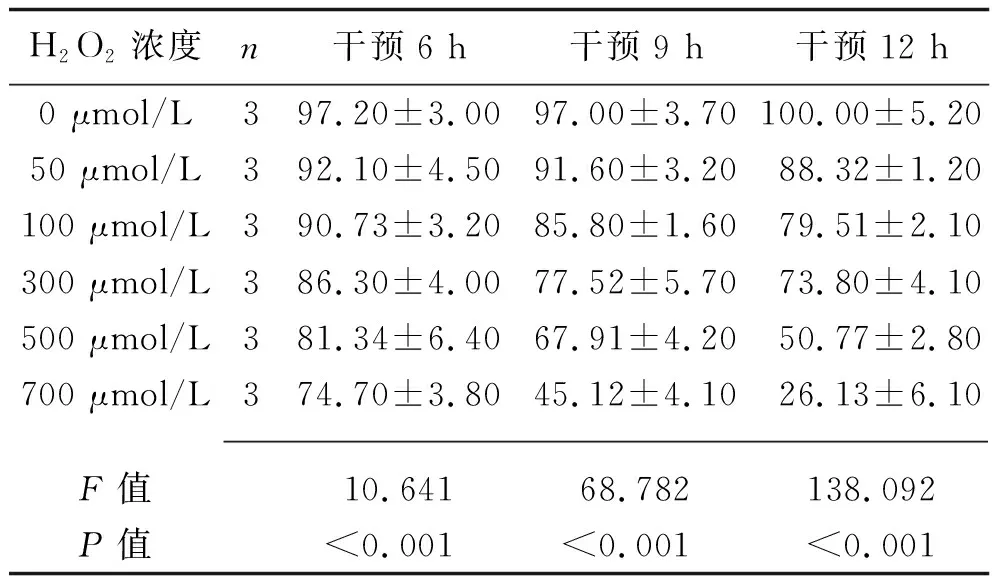
表2 不同浓度H2O2干预后大鼠心肌细胞H9c2活力的比较(x±s,%)
2.2 3组大鼠心肌细胞H9c2凋亡情况的比较 干预24 h后,与对照组相比,H2O2组细胞凋亡率升高(P<0.05);与H2O2组相比,BMSC+H2O2组细胞凋亡率降低(P<0.05)。见图1和表3。
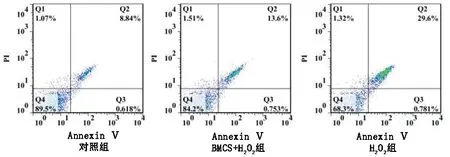
图1 3组大鼠心肌细胞H9c2的凋亡情况
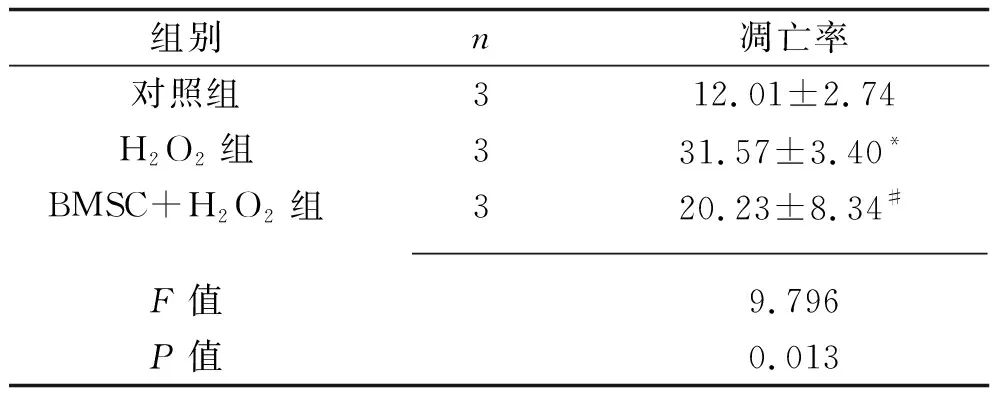
表3 3组大鼠心肌细胞H9c2凋亡率的比较(x±s,%)
2.3 3组大鼠心肌细胞H9c2自噬相关基因表达情况的比较 干预24 h后,与对照组、H2O2组比较,H2O2+BMSC组Beclin-1和LC3B mRNA表达水平均升高(均P<0.05)。见表4。
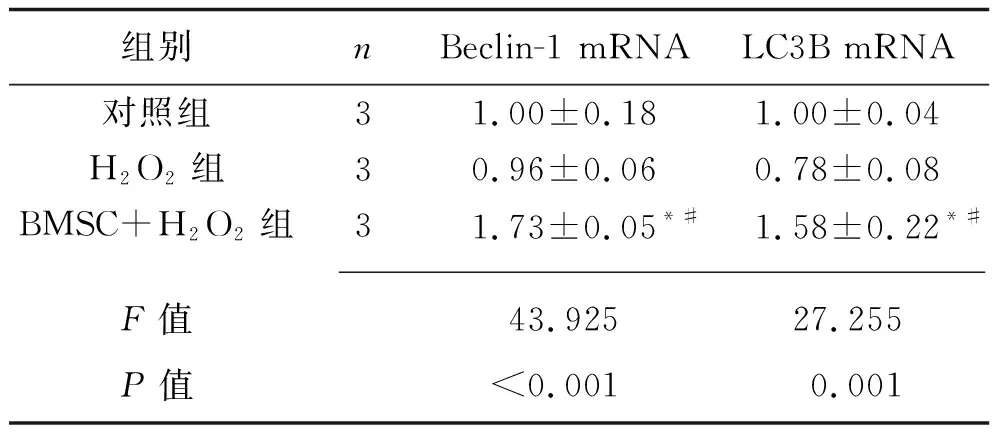
表4 3组Beclin-1和LC3B mRNA相对表达水平的比较(x±s)
2.4 3组大鼠心肌细胞H9c2自噬相关蛋白表达情况的比较 干预24 h后,H2O2组Beclin-1蛋白表达水平高于对照组,LC3B蛋白表达水平低于对照组(均P<0.05);与对照组、H2O2组比较,BMSC+H2O2组Beclin-1蛋白和LC3B蛋白表达水平均升高(P<0.05)。见表5和图2。
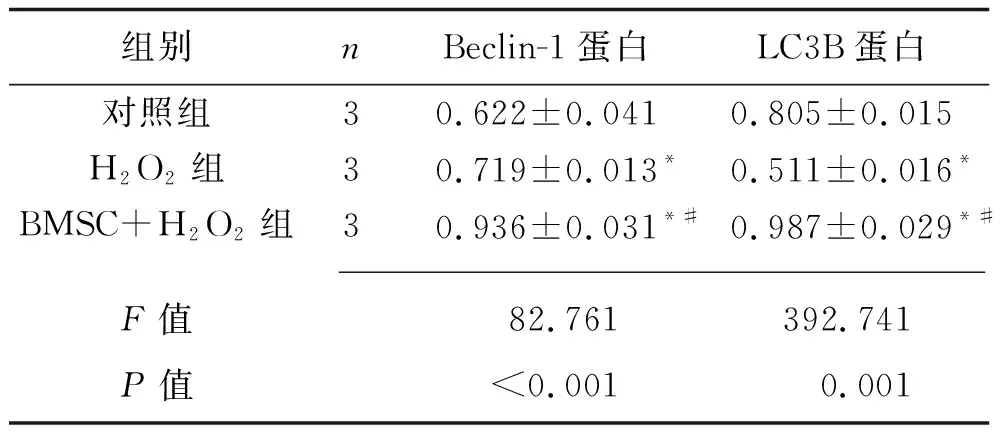
表5 3组Beclin-1、LC3B蛋白相对表达水平的比较(x±s)

图2 3组Beclin-1蛋白和LC3B蛋白的表达水平
3 讨 论
研究表明,缺血再灌注产生的过量活性氧簇主要是来自线粒体转运链[7-8],这些活性氧簇可直接损伤生物分子(脂质、蛋白质和DNA),也可通过促凋亡途径间接引起生物分子损伤,导致细胞死亡[9]。动物实验及临床实验已证实,BMSC可修复缺血再灌注受损的心肌细胞,改善心脏功能[10-11]。此外,BMSC旁分泌的趋化因子、抗炎因子、生长因子、外泌体等,通过发挥抗炎、抗凋亡、促进新生血管再生等作用对梗死心肌进行修复,从而改善心脏功能[12]。本研究采用H2O2诱导大鼠心肌细胞H9c2建立氧化应激损伤心肌细胞模型,探讨BMSC修复氧化应激损伤心肌细胞的途径。结果显示,与对照组相比,H2O2组细胞凋亡率升高(P<0.05);与H2O2组相比,BMSC+H2O2组细胞凋亡率降低(P<0.05)。由此可见,BMSC可通过抑制心肌细胞凋亡来减轻氧化应激对心肌细胞的损伤,这与既往研究结果[13]相似。
自噬是一种细胞内降解过程,在减小梗死面积、保护心肌细胞和维持左心室功能方面发挥重要作用[14-16]。许多研究表明,缺氧性或缺血性损伤后自噬增强可以保护心肌细胞免受损伤[17-20],心肌细胞自噬水平的上调可以减轻缺血再灌注损伤[21-22]。而在缺血后的再灌注期间,活性氧簇的过量产生可导致细胞自噬功能障碍[23]。本研究结果显示,与对照组、H2O2组比较,H2O2+BMSC组Beclin-1、LC3B mRNA和蛋白表达水平均升高(P<0.05),表明BMSC可通过提高心肌细胞的自噬水平来发挥心肌保护作用。
综上所述,BMSC可以通过抑制心肌细胞凋亡及增强心肌细胞自噬水平,来减轻氧化应激对心肌细胞的损伤,从而发挥心肌保护作用。BMSC对心肌细胞自噬水平的促进作用虽未得到更多的研究证实,但其对心肌细胞的保护作用已有较多的相关报告[24-26]。BMSC通过哪种途径调节心肌细胞的自噬与凋亡,以及具体的作用机制如何,还需要进一步的研究来证实。

