NaCl-KCl-MgCl2-Cu2S 熔体中铜电沉积的电化学机理
闵定伟, 陈功, 文棠根, 石忠宁, 黄义鹏, 杨少华
(江西理工大学材料冶金化学学部,江西 赣州 341000)
面对能源与环境危机的挑战,绿色冶金技术成为业内关注的焦点[1-5]。 铜是现代工业重要的基础原材料, 在自然界中主要以辉铜矿 (Cu2S)、 黄铜矿(CuFeS2)和斑铜矿(Cu5FeS4)等硫化物形式赋存[6]。一直以来,工业上以含硫铜矿石为原料,主要通过火法冶炼从中提取金属铜[7-9]。 火法炼铜的基本原理是硫离子(S2-)被氧选择性氧化,生成铜和二氧化硫,如以辉铜矿为原料的火法炼铜的基本反应:
火法炼铜过程中会产生大量的有害气体SO2,需要另外的工艺和能源消耗,将SO2转化成硫酸副产品处理,以符合工业生产的环保要求[10]。 采用湿法冶金工艺,通过浸出、萃取和电积从硫化铜矿中提取铜,能够避免SO2产生,但是铜电沉积的电流密度通常限制在0.018~0.03 A/cm, 而且生产占地面积和资金成本也相对较大。另一种可以避免SO2生成的方法是将铜的硫化物直接电解成铜和单质硫, 类似于制取铝、稀土金属、硅等材料的熔盐电解方法[11-17],其电化学反应可描述为:
由于硫化物熔盐电解方法体现出重要的绿色冶金潜力, 研究者围绕这个课题开展了广泛的探索,报道铝、钒、钛、钨、钼、铜及铜合金等金属可以从金属硫化物或硫化矿中通过熔盐电解提取出来[18-26]。 关于金属铜的熔盐电解提取,一类是基于FFC 熔盐电解法,将Cu2S 或铜矿原料制备成固态阴极, 在 CaCl2-NaCl、NaCl-KCl 熔体中进行电解[25,27];另一类是为了获得液态金属产物, 在熔点更高的含Cu2S 组分的BaS、CaCl2-NiS 等熔盐体系中直接电解[24,26,28]。 相比而言,低温熔盐电解质体系具有更高的经济性,但目前FFC 法低电流效率的特征也成为这种技术的一个限制方面[29]。Cu2S 在 MgCl2-NaCl-KCl 熔体中有良好的溶解性,并且属于物理溶解[30],这成为低温熔融盐电解Cu2S 的有利条件。
采用循环伏安法 (Cyclic Voltammetry,CV)、方波伏安法(Square Wave Voltammetry,SWV)、计时电流法(Chronoamperometry,CA)等电化学研究方法和X 射线衍射仪分析(XRD)、扫描电子显微镜(SEM)测试分析技术研究熔融NaCl-KCl-MgCl2-Cu2S 熔盐中Cu2S 电分解沉积金属铜的阴极电极过程及产物物相和形貌,旨在探明电极反应机理、过程速率控制步骤和电结晶成核机理等电化学行为,期望为绿色铜冶炼技术开发提供一定的基础依据。
1 实 验
实验使用的化学试剂 NaCl、KCl、MgCl2和 Cu2S来源于上海阿拉丁生化科技股份有限公司,纯度等级均为分析纯。 使用前, 将试剂置于真空干燥箱中在150 ℃下干燥12 h,除去附着水。
电化学实验研究采用三电极体系,使用Autolab电化学工作站(AUTOLAB PGSTAT302)进行测量,电解质熔盐组分为26%NaCl-32% KCl-40%MgCl2-2%Cu2S(指质量分数),实验温度 700 ℃。 其中,工作电极为钨丝电极(直径1 mm),参比电极为铂丝电极(直径1 mm), 辅助电极为直径6 mm 的高纯石墨电极。 实验使用刚玉坩埚作为电解池,置于不锈钢坩埚中,通入高纯氩气,使整个实验过程在氩气惰性气氛中进行, 避免阳极产物氧化产生氧化硫气体。 另外,在不锈钢坩埚上部通过冷却水,促进系统内产生的气态硫冷凝。 电化学实验装置示意如图1所示。

图1 电化学实验装置示意Fig. 1 Schematic diagram of electrochemical experimental device
在上述实验电解质体系和温度条件下,采用钨丝电极和石墨电极分别作为阴极、阳极进行恒电流电解实验,制取阴极产物,利用X 射线粉末衍射仪(Bruker D8 Advance)、扫描电子显微镜(EVO MA 10)表征产物样品的物相及微观形貌。
2 结果与讨论
2.1 循环伏安法
NaCl-KCl-MgCl2-Cu2S 电解质熔体中钨电极上的循环伏安曲线(CV 曲线)如图2 所示(图 2 中实线),实验测量以0.1 V/s 的扫描速率从-0.5 V 开始向负电位方向扫描, 电位范围为 0 ~-2.5 V。 通过与NaCl-KCl-MgCl2电解质体系的CV 曲线对比, 可以发现,Cu2S 组分的加入使CV 曲线上出现新的还原电流峰c1和氧化电流峰a1、a2。显然,它们对应着体系中Cu2S 电分解的电极过程,还原电流峰c1对应Cu+还原的电极过程,电极反应可描述为式(5),而氧化电流峰a1则对应还原产物Cu 氧化的电极过程;氧化电流峰a2为S2-电化学氧化反应的电流,电极反应如式(3)所描述。 另外,可以注意到在电流峰a1与a2之间存在一个弱的氧化电流峰,可能是由体系中的氧杂质放电所致。

图2 NaCl-KCl-MgCl2-Cu2S 电解质熔体中钨电极上的循环伏安曲线(扫描速度:0.1 V/s;参比电极:Pt;温度:700 ℃)Fig. 2 Cyclic voltammetry curves on tungsten electrode in NaCl-KCl-MgCl2-Cu2S electrolyte melt(Scan rate: 0.1 V/s; Reference electrode: Pt electrode; Temperature: 700 ℃)
理论上,在当前的实验体系中,Cu2S 分解的电化学反应可描述为式(6),其理论分解电压为0.50 V,而图 2 中电流峰 a2、 c1起始电位 (分别为-0.42 V 和-0.93 V)的差值为0.51 V,二者数值接近,进一步证明Cu2S 在支持电解质NaCl-KCl-MgCl2熔体中发生电化学分解。
采用循环伏安法研究Cu 析出的电极过程,不同扫描速率的 CV 曲线如图 3(a)所示。 从图 3(a)中可以看到, 在扫描电位范围内存在一对氧化还原电流峰,但还原电流峰峰形不规则,并且在不同扫描速率条件下,还原电流峰峰电位没有随扫描速率变化而发生明显位移(图 3(a)插图)。 通过分析发现,还原电流峰与氧化电流峰的峰值比|jp,c|/|jp,a|≈为1。 此外,进一步分析还原电流峰值与扫描速率的关系发现,| jp,c|与扫描速率平方根v1/2呈现良好的线性关系 (图3(b))。由此判断,该电化学体系中Cu 析出的电极反应为可逆反应,并且电极过程受扩散传质控制。

图3 钨电极上Cu+电还原的CV 曲线和|jp,c|-v1/2 关系(参比电极:Pt 电极;温度:700℃)Fig. 3 CV curve of Cu+electroreduction on tungsten electrode and | jp,c|-v1/2 relationship(Reference electrode: Pt; Temperature: 700 ℃)
根据 Randle-Sevick[31]方程(式(7)),结合图 3(b)中拟合的线性关系斜率,可计算出Cu+还原的电极过程扩散系数 D(Cu+)为 1.23×10-5cm2/s(电解质体系 Cu+浓度为 2.51×10-4mol/cm3)。
式(7)中:jp为峰电流密度,A/cm2;n 为转移电子数;F 为法拉第常数,96 485 C/mol;C0为反应粒子浓度,mol/cm3;R 为气体常数,8.314 J/(mol·K);T 为实验温度,K;D 为反应粒子扩散系数,cm2/s;v 为扫描速率,V/s。
2.2 方波伏安法
方波伏安法是一种比循环伏安法更灵敏的暂态电化学研究方法,也常用于电极过程分析。 由于前述CV 曲线中还原电流峰c1的形状不规则,为了更好地了解Cu+还原的阴极过程,采用方波伏安法进一步研究 c1峰处的电极过程。 在-0.5~-1.4 V 扫描电位范围内,频率分别为 15、20、25 Hz 的方波伏安曲线(SWV曲线)如图4 所示。 从图4 中可看出,在与前面的循环伏安图相同的电位范围内显示出一个单峰, 峰电位约为-0.94 V。 该电流峰并不像理论上的高斯型峰那样完全对称[32],这是由于成核效应所致,电极过程初期,固相铜的形核导致无电流成核过电压, 延迟了电流的上升,这在循环伏安曲线中也可观察到。

图4 钨电极上Cu+电还原的方波伏安曲线(频率:15、20、25 Hz;方波振幅:10 mV;参比电极:Pt电极;温度:700 ℃)Fig. 4 Square wave voltammetric curve of Cu+electroreduction on tungsten electrode(Frequency: 15, 20 and 25 Hz; Square wave amplitude: 10 mV; Reference electrode: Pt electrode; Temperature: 700 ℃)
在SWV 曲线中, 高斯型电流峰的峰半宽(W1/2)与转移电子数n 存在关联,对于可逆电极体系,可以用式(8)描述[33]。 针对图 4 中 SWV 电流峰特征,采用Gaussian 函数拟合(图 4 中插图),得到 W1/2,进一步通过式(8)计算转移电子数,计算结果见表1。 计算的转移电子数 ncal分别为 1.25、1.18 和 1.15,取整数为1。分析结果表明, 电流峰c1处的电极过程为一个具有成核特征的一步单电子转移的电极反应过程, 即为Cu+的电化学还原过程, 与前述循环伏安法分析结果一致。
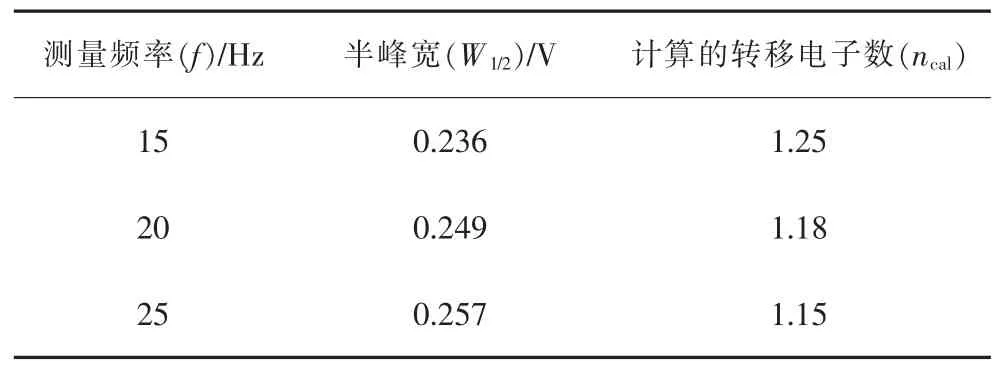
表1 不同频率SWV 曲线的半峰宽 W1/2 和转移电子数计算值Table 1 Half peak widths W1/2 and the calculated electron transfer numbers of SWV curves at different frequencies
式 (8) 中:W1/2为电流峰半峰宽,V;R 为气体常数,8.314 J/(mol·K);T 为实验温度,K;n 为电子转移数;F 为法拉第常数,96 485 C/mol。
2.3 计时电流法
涉及相形成的电极过程通常与二维或三维成核过程有关,通过电流瞬态分析,可以确定电沉积过程的成核生长机理。 前述分析已经表明Cu 电沉积涉及电化学成核生长过程,根据图3(a)中CV 曲线,选择在还原电流峰峰电位及其左、 右两侧电位下测量电流瞬态曲线;同时,为了保证电极过程受扩散控制,控制较大的过电位极化条件。极化电位为-1.10、-1.15、 -1.20、-1.23 V 的计时电流曲线(CA 曲线)如图5(b)所示。 从图 5(a)中可以看到,极化时间持续到0.2 s 后, 电流基本恒定, 电极过程达到稳态扩散,并且电流衰减符合 Cottrell 方程(图 5(b))。 通过Cottrell 方程的 I-t-1/2线性关系分析发现:①电极过程早期阶段的电流轨迹偏离Cottrell 方程规律;②I-t-1/2线性关系的斜率随着极化过电位增加而增大,这些主要是由电极表面固相产物的成核和生长所致。

图5 -1.10 、-1.15、-1.20、-1.23 V 极化电位下的计时电流曲线和I-t-1/2 关系(电极面积:0.48 cm2;工作电极:W 电极;参比电极:Pt电极;温度:700 ℃)Fig. 5 Chronoamperometry curves recorded at polarization potentials of-1.10,-1.15,-1.20 、-1.23 V and the I-t-1/2 relationship(Electrode area: 0.48 cm2;Work electrode: W electrode; Reference electrode:Pt electrode; Temperature: 700 ℃)
基于瞬态电流I(t)-tn线性关系判别电沉积成核生长机理的报道较多,扩散控制的三维成核生长是金属电沉积最常见的方式, 特别是对于导电性良好的沉积相。对于扩散控制的三维成核生长,SCHARIFKER[34]和HILLS[35]提出的模型(SH 模型)是一种较好的方法。 在极限情况下(即在成核早期很短的时间内),瞬时成核符合 I(t)-t1/2线性关系(式(9)),连续成核符合 I(t)-t3/2线性关系(式(10))[34-35]。
式(9)、式(10)中:I(t)为电流,A;t 为时间,s;nF 为电沉积物的摩尔电荷数,96 485 n C/mol;D 为扩散系数,cm2/s;C 为反应物本体浓度,mol/cm3;M 和 ρ 分别为电沉积物的摩尔质量和密度,g/mol、g/cm3;N0为总的成核数,cm-2;A 为每个活性位点的成核速率常数,s-1;N∞为活性位点数量密度,cm-2。
图6 所示为-1.10、-1.15、-1.20、-1.23 V 极化电位下电流-时间曲线成核阶段的I-t1/2和I-t3/2关系线。 从图6 中可以看到,I-t1/2关系呈现良好的线性关系,线性拟合的相关系数R2≥0.968 8。 由此可以判定,在该电化学体系中,Cu 电沉积的成核方式为三维瞬时成核。
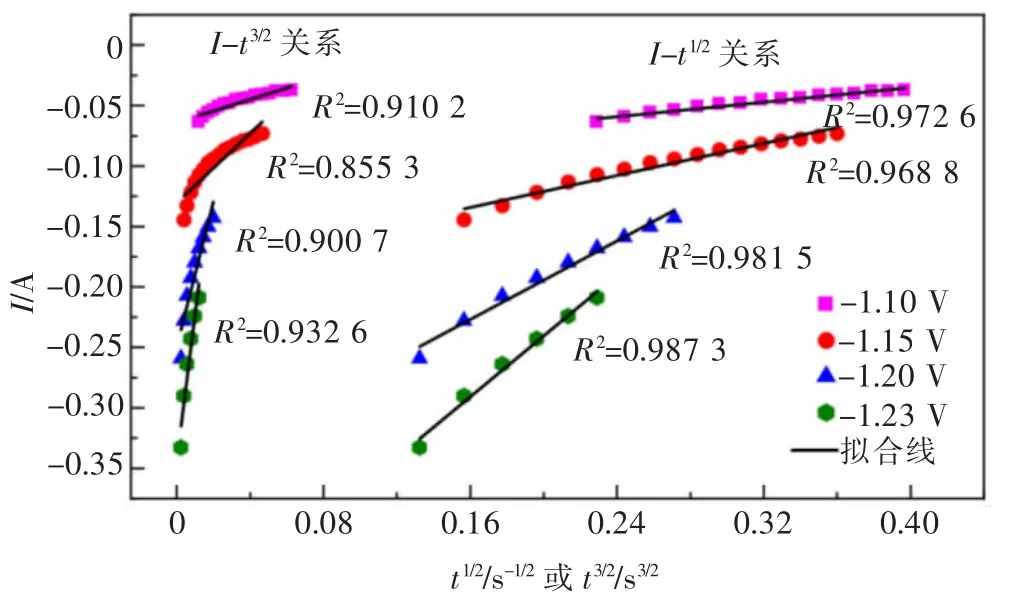
图6 计时电流曲线成核阶段瞬态电流的I-t-1/2 或I-t3/2 关系线性拟合Fig. 6 Linear fitting of I-t-1/2 or I-t3/2 relationships of transient current during nucleation stage in chronoamperometry curves
2.4 电沉积产物表征
在前述实验条件下,以钨丝为阴极、石墨棒为阳极,控制2 A(初始电流密度约为3.2 A/cm2)恒电流进行电解制取阴极产物, 电解过程槽电压维持在3.0 V左右。 产物样品经去离子水冲洗、干燥后计算得出电流效率约为88.61%, 对阴极产物进行物相和形貌表征分析。 图7 所示为电解产物实物光学照片和XRD图谱。从图7 中可以看出,电解产物为黄褐色金属,由分枝结构聚集构成,质地较软。 X 射线衍射仪物相分析结果表明电解产物为金属 Cu, 除 Cu 的(111)、(200)、(220)和(311) 晶面衍射线以外,图谱上未显示存在其他物相的衍射线。
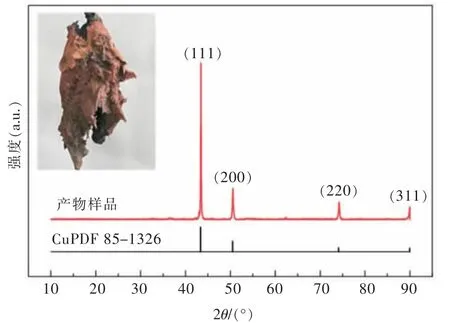
图7 电解产物的XRD 图谱Fig. 7 XRD pattern of electrolytic products
通过扫描电子显微镜进行微观形貌和元素能谱分析,结果如图8 所示。从图8 中可看到,电解产物为形状不均一的颗粒状聚集体, 大颗粒尺寸在微米级,其表面附着的小颗粒尺寸在几十纳米范围内。这表明Cu 电沉积以三维成核生长方式进行, 与计时电流法分析结果一致。 对观察区域的a 微区进行EDS 面扫描,分析元素分布,结果显示该区域内主要为Cu 元素,此外还存在 Mg、O、S 元素。 痕量的 Mg、O 元素是由电解时与Cu 共析出的金属Mg 在自然环境中发生氧化引入;S 元素来源于夹杂的电解质成分Cu2S。

图8 电解产物的SEM-EDS 谱图(SEM 图像Mag=50 000×)Fig. 8 SEM image and EDS spectrum of the electrolytic product (SEM image Mag=50 000×)
3 结 论
1) 在 NaCl-KCl-MgCl2-Cu2S 熔盐体系中可以通过电解法制取金属Cu。 在700 ℃下制取的产物为由分枝状构成的黄褐色Cu 聚集体,质地较软,并且产物容易与电解质分离、清洁。
2) 在当前的电化学体系中,Cu+通过一步单电子转移还原成金属Cu,电极过程为可逆过程,并且受扩散传质控制, 在700 ℃实验条件下的扩散系数为1.23×10-5cm2/s。 Cu 电沉积的成核机理为扩散传质控制的三维瞬时成核机理,形核生长成几十纳米到数微米的不规则颗粒,构成微观结构形貌。

