有关共沸现象的宏微分析和应用介绍
叶益晨




摘要: 中学阶段仅提出了共沸现象,并未对共沸原理作出解释。基于宏微结合的视角,结合物质结构理论解释共沸现象产生的可能原因,并以两种物质(硫酸、乙酸乙酯)的工业制备过程为例,阐述了共沸原理在工业上的应用价值,以供有兴趣的师生多维度地认识共沸现象。
关键词: 共沸原理; 分子团簇; 宏微分析; 工业应用
文章编号: 1005-6629(2023)04-0094-04
中图分类号: G633.8
文献标识码: B
共沸是蒸馏操作中的常见现象,是指两组分或多组分的液体混合物以特定比例组成时,在恒定压力下沸騰,其蒸气组成比例与溶液相同的现象,其对应的温度称为共沸温度或共沸点,同时由于共沸现象的存在,共沸物是难以通过常规的蒸馏或分馏手段加以分离的。
1 共沸现象的几种情况
根据柯诺瓦洛夫-吉布斯定律说明:“假如在液态混合物中增加某组分后,在一定压力下液体的沸点下降(或一定温度下蒸气总压增加),则该组分在气相中的含量大于它在平衡液相中的含量”。“在温度-组成图(或压力-组成图)中的最低点或最高点,液相和气相的组成相同”[1]。
在恒定压力下,实验测定一系列不同组成液体的沸腾温度及平衡时气、液两相的组成,即可作出该压力下的温度-组成图。可得以下三类溶液的溶液组成和蒸气组成的关系图,见图1。
可以看出,在溶液的温度-组成图中,(1)各种类型溶液的蒸气组成曲线应在溶液组成曲线的上面;(2)在极大点或极小点时,溶液组成曲线和平衡蒸气的组成曲线应合而为一。
2 共沸现象的微观本质
本文重点讨论图1中存在共沸现象的后面两类情况。
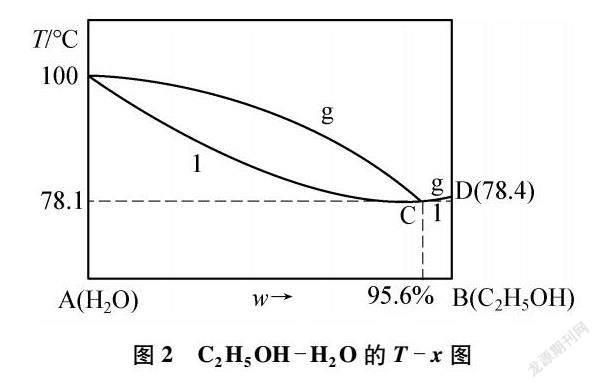
第一类:存在最低点的温度-组成图。例如:C2H5OH-H2O体系,见图2。
常压下,对C2H5OH-H2O的二元体系进行蒸馏,一段时间后将达到最低点C点,此点组成的液相在该指定压力下沸腾时产生的气相与液相组成相同,故沸腾时温度恒定,且这一温度又是液态混合物沸腾的最低温度,故称之为最低共沸点(78.1℃),在体系达到其共沸点时,体系便无法“跨越”C点到达D点。对共沸物的组分进行分析,表明其组成为质量百分浓度95.6%的乙醇与4.4%的水的混合物,由于其沸腾所产生的气体部分之成分比例与液体部分完全相同,因此无法继续以普通的蒸馏方法获得更高纯度的乙醇。
GIFUJ研究组通过计算[2]指出C2H5OH分子和H2O分子可通过分子间氢键和次级分子间作用力形成稳定的超分子团簇(C2H5OH)n·H2O,该过程的ΔG整体上小于零,为热力学自发过程,具体数据见表1。且该研究组结合计算数据分析,认为该体系有明显的趋势可以形成(C2H5OH)9·H2O团簇。目前已在C2H5OH-H2O的共沸体系中发现(C2H5OH)9·H2O超分子团簇的存在,该分子团簇稳定性高,有着类似于化合物的物理性质,如恒定的“沸点”,即共沸点。
在(C2H5OH)9·H2O分子团簇中,C2H5OH和H2O两种分子的分子数之比为9∶1,转化成质量比约为95.8%∶4.2%,与共沸物的实际组成比例(95.6%∶4.4%)相当,即共沸体系中主要以(C2H5OH)9·H2O分子团簇形式存在。由于生成超分子团簇,其超分子内部的氢键、次级分子作用力得以保留,无需破坏,故体系的沸点下降(与氟化氢汽化形成多聚HF,所需破坏的氢键数减少,实际沸点偏低的情况类似)。(C2H5OH)9·H2O分子团簇的存在从微观结构角度直观解释了C2H5OH-H2O二元体系的共沸物特定组分和共沸物沸点降低的原因。
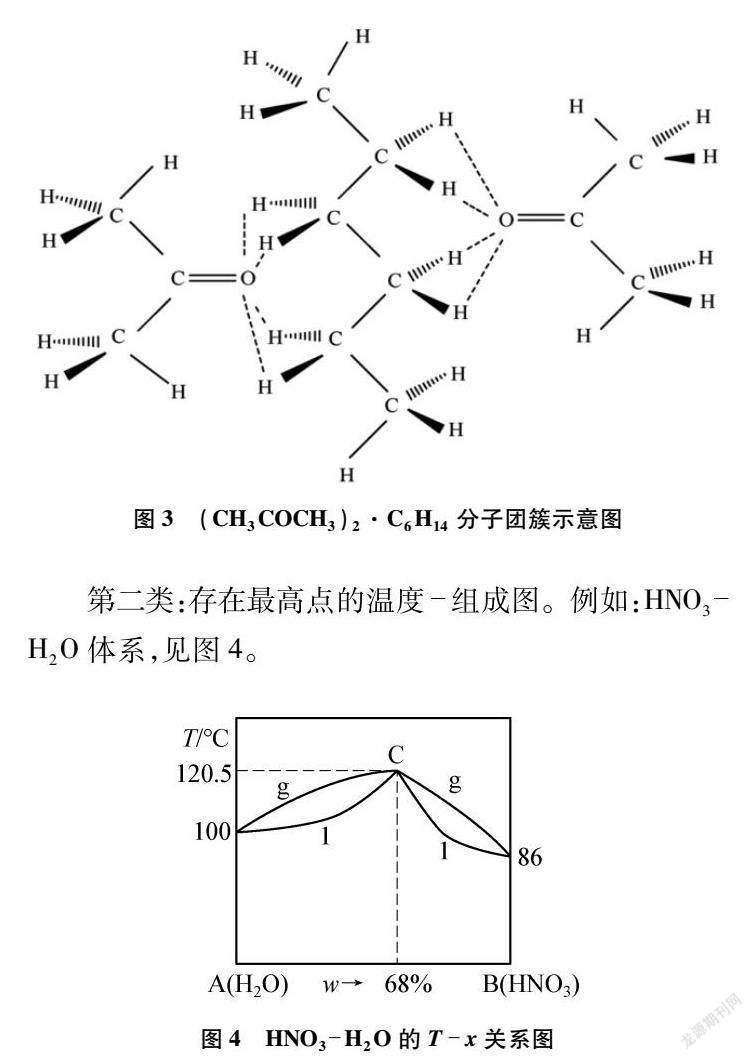
类似的例子还有许多,如丙酮(CH3COCH3)和正己烷(C6H14)可以形成组成质量比为64%∶46%,共沸点为50℃的二元共沸体系。实验观测结果[3]表明在其共沸体系中存在超分子团簇(CH3COCH3)2·C6H14,见图3。该分子团簇的组成比例与上述二元恒沸物一致,且该超分子团簇的形成同样会导致体系的沸点降低。
第二类:存在最高点的温度-组成图。例如:HNO3-H2O体系,见图4。
对HNO3-H2O二元共沸体系的组分进行分析,表明其为质量比为68%HNO3:32%H2O的二元混合体系(即市售浓硝酸)。与C2H5OH-H2O体系不同的是,HNO3-H2O体系表现为沸点升高,存在一个最高共沸点(120.5℃)。相关原因分析如下:在稀硝酸体系中,HNO3完全电离(HNO3H++NO-3),离子与水分子的相互作用(如:H2OH+…OH2:150kJ·mol-1)明显强于原溶剂水分子之间的相互作用(HOH…OH2:18.8kJ·mol-1),故体系沸点升高;而在高浓度的硝酸体系中,仅存在微弱的自耦电离(2HNO3NO+2+NO-3+H2O),体系中离子占比小,故微粒间的相互作用力减小,导致其沸点降低。结合上述分析可知,HNO3-H2O体系的沸点随x(HNO3)的增加呈现先上升后下降的趋势,且存在一个沸点最高的共沸点。该体系中也会形成大分子团簇,但是由于其结构比例受温度(或压强)影响较大,与上述讨论的C2H5OH-H2O类型不同,所以HNO3-H2O的二元共沸物比例受温度影响大,沸点移动幅度也大。
此外,相关实验结果表明:若向HNO3-H2O体系加入硝酸盐,如KNO3或Ca(NO3)2等,可在抑制硝酸分子自身电离的同时,也可破坏超分子团簇,从而获得硝酸分子占比更高的共沸化合物。
3 共沸原理在工业上的应用
3.1 硫酸的工业制备
实验室常用的98.3%的浓硫酸本质上也是H2SO4-H2O的二元共沸物,其最高共沸点为338.8℃,见图5。
接触法制硫酸的一个重要环节是在吸收塔设备中用98.3%的浓硫酸来吸收接触室中产生的SO3气体,而不是使用水或更高浓度的硫酸直接吸收。实验表明,吸收塔设备中使用水吸收三氧化硫的效率很低,这是因为水表面有很大的水蒸气分压,导致在气相中含有许多H2O分子,通入的SO3分子可与H2O分子迅速结合,生成H2SO4分子。同时由于来不及溶解在水里,在气相中即发生H2SO4蒸气的过饱和现象而凝成酸雾,酸雾尺寸比硫酸分子大得多,且又悬浮于气相中,运动速率慢,使进一步吸收SO3变得更加困难。当使用稀硫酸时,发生的情况与用水作吸收剂相似,且吸收的酸越稀,则酸的液面上的水蒸气分压越大,生成酸雾的可能性就越大,SO3的吸收也就越不完全。当硫酸的质量分数高于98.3%时,H2SO4和SO3的蒸气压都随着酸液质量分数的增加而加大,这时气相中就存在大量的H2SO4分子和SO3分子存在,此时若通入的气体中SO3的质量分数较小,质量分数高于98.3%的硫酸本身可放出SO3,故用这样的高浓度的H2SO4吸收SO3气体,显然是难以吸收完全的。
常壓下,由于98.3%的硫酸溶液具有最高共沸点(338.8℃),此时气液两相的平衡组成相等,同一温度下溶液的饱和蒸气压(H2O和SO3、 H2SO4蒸气的分压之和)为最小,气泡内水蒸气很少,生成的酸雾少,从而保证了三氧化硫的吸收较其他浓度酸液吸收得完全。由于气泡内SO3分子被吸收,气泡内的压强也相应地减小,气泡由大变小,最后气泡内的气体(大量的N2、少量的O2和极微量的SO3、 H2SO4蒸气等)自液面逸出成为尾气经进一步处理后释放。
综上,吸收三氧化硫既不宜用水,也不宜用浓度低于或高于98.3%的硫酸溶液,而以98.3%的硫酸溶液最合适,这是由硫酸工业生产中对三氧化硫吸收的要求和该共沸体系的特点共同决定的。
3.2 乙酸乙酯的工业制备
2018年4月份的浙江化学选考卷中出现过有关乙酸乙酯的工业制备的考查,题目节选如下:
乙酸乙酯一般通过乙酸和乙醇酯化合成:
CH3COOH(l)+C2H5OH(l)浓H2SO4△CH3COOC2H5(l)+H2O(l) ΔH=-2.7kJ·mol-1
已知纯物质和相关恒沸混合物的常压沸点如表2所示。
工业上多采用乙酸过量的方法,将合成塔中乙酸、乙醇和硫酸混合液加热至110℃左右发生酯化反应并回流,直到塔顶温度达到70~71℃,开始从塔顶出料。
题中提到工业制备乙酸乙酯需达到“乙酸过量”“塔顶温度控制70~71℃”等条件,笔者认为还可从共沸角度进行解释:一般乙酸过量(醇与酸摩尔比为1∶6),除能使乙醇平衡转化率提高,反应速率加快(乙酸沸点较高,可以使酯化温度提高),还可以避免形成含乙醇的共沸体系,如表格中的“乙酸乙酯-乙醇”或“乙酸乙酯-乙醇-水”等共沸体系,而形成乙酸乙酯-水的二元共沸体系。由于乙酸乙酯92.0%和水8.0%形成的二元共沸物,其共沸点为70.4℃,因此控制酯化塔顶温度为70~71℃,酯化塔顶出来的主要是乙酸乙酯和水的共沸物,产物不断被移走,反应更趋完全。乙酸乙酯的含水饱和溶液为乙酸乙酯96.8%和水3.2%,蒸出二元共沸物,有利于后续产物的分离。
4 结语
本文从宏观和微观相结合的视角对共沸现象进行分析,相关讨论将复杂的物理化学现象和具体的例子相结合,并结合超分子团簇结构的直观呈现,分析了共沸现象的可能本质,为广大师生对共沸原理的认识提供了不同的视角,同时对共沸原理在工业上的应用介绍也拓宽了学生的视野。
参考文献:
[1]印永嘉, 物理化学简明教程(第3版)[M]. 北京: 高等教育出版社, 2000: 209~211.
[2]Kevin N. Chacón, Juan F. Espinal, M. Merced Montero-Campillo, Manuel Yez, and Sol M. Mejía Chica. Looking for the Azeotrope: A Computational Study of (Ethanol)6- Water, (Methanol)6-Water, (Ethanol)7 and (Methanol)7 Heptamers [J]. The Journal of Physical Chemietry A, 2020, (8): 1~23.
[3]M.R. Jalilian. Spectra and structure of binary azeotropes III. Acetone-n-hexane [M]. Spectrochimica Acta Part A, 2007: 976~978.

