脑乳酸水平与肝性脑病的关系
刘玉琴 陈密 唐兰燕 周丽智 黄鑫 张磐
摘要:
肝性脑病(HE)是肝硬化患者常见的并发症,也是肝硬化患者死亡的独立危险因素。脑乳酸水平与HE的进展及严重程度相关,对于脑乳酸水平的研究有助于进一步解释HE的发病机制。本文通过总结脑乳酸代谢过程、脑乳酸水平与HE的关系、HE潜在治疗靶点,为临床医生进一步系统地评估HE患者的病情进展、治疗效果及预后情况提供一定的参考依据,旨在减轻患者医药负担,改善HE患者预后。
关键词:
肝性脑病; 乳酸; 血脑屏障; 脑水肿
基金项目:湖南省自然科学基金面上项目 (2020JJ4862)
Research advances in brain lactate level and hepatic encephalopathy
LIU Yuqin, CHEN Mi, TANG Lanyan, ZHOU Lizhi, HUANG Xin, ZHANG Pan. (Department of Infectious Diseases, The Third Xiangya Hospital of Central South University, Changsha 410000, China)
Corresponding author:
ZHANG Pan, zhangp2017@163.com (ORCID:0000-0001-8778-4079)
Abstract:
Hepatic encephalopathy (HE) is a common complication and an independent risk factor for death in patients with liver cirrhosis. Brain lactate level is associated with the progression and severity of HE, and research on brain lactate level may help to further explain the pathogenesis of HE. This article summarizes the metabolic process of brain lactate, the association between brain lactate level and HE, and the potential therapeutic targets for HE and provides a reference for clinicians to further systematically evaluate the progression, treatment outcome, and prognosis of patients with HE, in order to reduce the medical burden of patients and improve the prognosis of patients with HE.
Key words:
Hepatic Encephalopathy; Lactic Acid; Blood-Brain Barrier; Brain Edema
Research funding:
Natural Science Foundation of Hunan Province (2020JJ4862)
肝性脑病 (hepatic encephalopathy,HE) 是指急、慢性肝功能严重障碍或门-体分流异常引起的脑功能障碍,表现为轻重程度不同的神经或精神异常,如轻度认知障碍、明显的定向障碍、意识模糊甚至昏迷[1]。近年来我国学者对HE包括轻微肝性脑病(minimal hepatic encephalopathy,MHE)的流行病学进行的多中心研究[2-3]显示, 在住院的肝硬化患者中约40%有MHE;30%~45%的肝硬化患者和10%~50%的经颈静脉肝内门-体分流术后患者发生过显性HE。血液中的乳酸主要在肝脏中代谢,乳酸可以反映肝脏的氧代谢水平、微循环状态和组织灌注情况[4],而脑乳酸水平的增高与 HE 的进展和严重程度有关[5]。目前HE的发病机制中处于中心地位的学说是“氨中毒学说”,然而对于部分HE患者而言,以降氨为主的治疗方案效果不佳, 进一步探究脑乳酸水平与HE的关系并探索HE的潜在治疗靶点有助于更好地改善患者预后。
1 脑乳酸代谢
乳酸可通过组织中的氧化应激、丙酮酸无氧糖酵解[6]以及通过肾上腺素相关的肌膜 Na+/K+-ATP酶刺激产生[7],并被烟酰胺腺嘌呤二核苷酸依赖性乳酸脱氢酶代谢为丙酮酸,随后在线粒体中被氧化为二氧化碳和水,并生成ATP。静息状态下,乳酸主要由皮肤(25%)、肌肉(25%)、红细胞(20%)、中枢神经系统(20%)和胃肠道(10%)产生[8],而在剧烈运动期间,骨骼肌成为产生乳酸的主力军。糖原是大脑重要的能量储备物质,主要储存在星形胶质细胞中,其主要的代谢产物并非葡萄糖,而是乳酸。研究发现儿茶酚胺类神经递质能够调节脑内葡萄糖的摄取、利用和糖酵解反应,脑内的去甲肾上腺素主要来自蓝斑,Tang等[9]发现,脑内低水平的乳酸能刺激蓝斑神经元增加细胞内Ca2+,提高放电率,释放去甲肾上腺素,并介导糖原分解,从而为星形胶质细胞的激活提供能量。乳酸是脑能量代谢的重要组成部分,星形胶质细胞和神经元均可产生乳酸。“星形胶质细胞-神经元乳酸穿梭”假说提出在神经元活动期间,星形胶质细胞通过突触处摄取谷氨酸从而触发有氧糖酵解并导致葡萄糖摄取和乳酸释放,随后乳酸转运至神经元作为首选的能量来源[10]。外周乳酸和脑乳酸之间相互循环,相互影响,静息时大脑呈净产乳酸状态,脑乳酸能向大脑提供7%的能量,此时脑内乳酸浓度略高于外周血乳酸浓度,在这种浓度差作用之下,脑乳酸可通过跨膜运输到细胞外液间隙中,再通过间隙内的淋巴系统或微血管引流到血液中,从而进入到全身循环中参与代谢。而在運动和乳酸灌注时,外周血乳酸浓度升高,高于脑乳酸浓度,此时大脑会转变成净摄取乳酸状态,外周血乳酸通过血脑屏障上的单羧酸转运蛋白(monocarboxylate transporter,MCT)转运进入中枢神经系统,脑乳酸浓度增高,脑细胞摄取乳酸增加同时也在清除外周血乳酸,此时脑乳酸可为大脑提供高达25%的能量,并且运动状态下大脑对乳酸的清除可高达11%[11]。不同亚型的MCT与乳酸的结合力不同,高亲和力的转运体更容易在细胞内低浓度时摄取细胞外乳酸,低亲和力的转运体可运出乳酸降低胞内乳酸浓度[12],正常生理情况下,脑乳酸维持着相对稳定的水平。
2 脑乳酸水平与HE的关系
2.1 脑乳酸水平与HE的相互作用机制
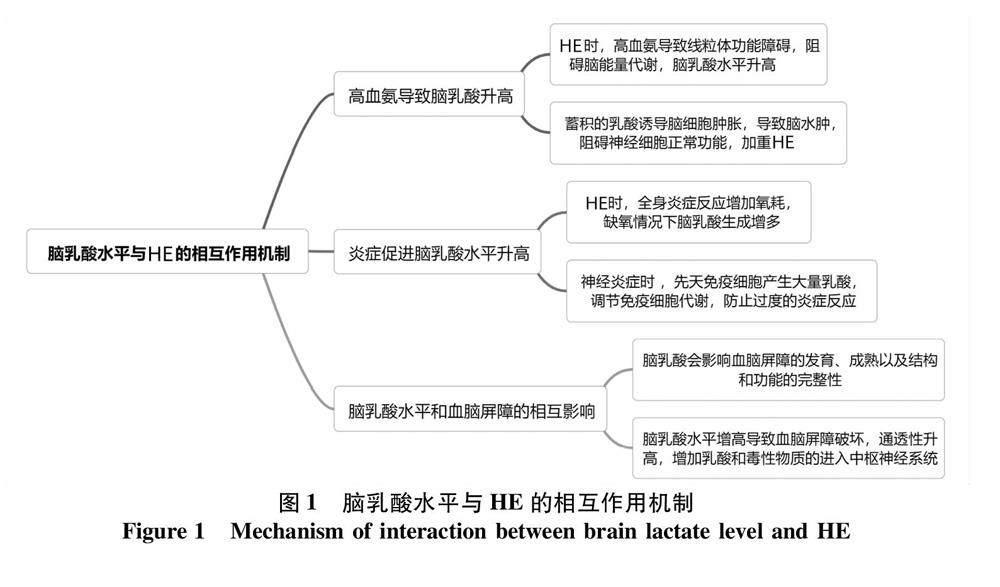
2.1.1 高血氨导致脑乳酸升高 HE发生的具体机制尚不明确,“氨中毒学说”是目前众多假说中最为被广泛接受的。氨通过介导细胞肿胀、炎症刺激、氧化应激反应、线粒体功能障碍、干扰能量代谢、影响pH 值的变化和膜电位的改变等途径发挥其有害作用[13]。氨抑制大脑皮层线粒体中的α-酮戊二酸脱氢酶、丙酮酸脱氢酶和异柠檬酸脱氢酶等三羧酸循环酶,影响三羧酸循环的运行速率以及随后的电子传输链。由于丙酮酸脱氢酶被抑制,导致糖酵解产生的丙酮酸增加,然而增加的丙酮酸不能以乙酰辅酶 A 的形式进入三羧酸循环,被乳酸脱氢酶还原成乳酸,而在HE和高氨血症患者中也发现乳酸水平增高[14]。原代培养的小鼠脑皮质星形胶质细胞经氨处理后检测发现乳酸水平显著增加,丙酮酸/乳酸比值降低[15]。 Lerchundi等[16]发现神经元以活动依赖性方式产生NH+4,生理水平的NH+4通过线粒体丙酮酸分流诱导星形胶质细胞快速产生和释放乳酸,并且 NH+4还可将乳酸从星形胶质细胞转移到神经元。星形胶质细胞是大脑内分布最广泛的细胞,具有调节细胞外微环境、维持血脑屏障功能、影响神经兴奋性等功能[17],星形胶质细胞还在调节脑能量代谢中起关键作用,与大脑记忆形成、神经保护、抗氧化应激等功能有关[18]。研究[19]发现乳酸会导致培养的星形胶质细胞肿胀。高氨阻碍脑能量代谢,乳酸水平随之升高,乳酸的蓄积导致细胞肿胀,是脑水肿的基础。乳酸可导致与脑氨水平升高相关的一些细胞功能障碍[20]。当脑能量代谢障碍时,乳酸是神经元重要的供能物质,但大脑中乳酸水平过度增加与脑水肿的发展和颅内压增高紧密相关。
2.1.2 炎症促进脑乳酸水平升高 炎症因子导致HE发生的机制仍旧未完全明确,有研究[21-22]发现,多种促炎因子如TNF-α、IL-1、IL-6、IL-12、内毒素等增多与HE的发生有关。 Manzhalii等[23]也发现炎性因子与HE的发生和严重程度紧密相关。失代偿肝硬化患者因肠道通透性增加、菌群易位导致体内多种炎症因子升高,继发全身炎症反应。感染是HE的诱因,一方面血脑屏障对炎症刺激高度敏感,细胞因子和炎症反应分子可损伤脑血管内皮细胞并破坏血脑屏障,导致血脑屏障通透性升高,氨和炎性介质更易进入大脑,激活中枢神经炎症,诱发HE[24];另一方面炎症反应导致氧耗增加,缺氧情况下乳酸生成增多,脑乳酸水平升高导致脑组织水肿和神经元功能障碍,进而影响大脑正常功能,最终导致HE发生[25]。抗感染治疗降低炎症反应可明显改善HE患者的症状,Agusti等[26]通过对门腔分流术导致的HE大鼠进行抗炎治疗,结果提示消除神经炎症、降低炎症因子的水平可以明显改善小鼠的认知功能障碍,并帮助其恢复运动协调。此外,在炎症过程中,先天免疫细胞会大量产生和分泌乳酸,而乳酸可调节免疫细胞的代谢,可起到负反馈信号的作用,以防止过度的炎症反应[27],这也可以解释神经炎症时促进脑乳酸水平进一步升高。
2.1.3 脑乳酸水平和血脑屏障的相互影响 脑内糖原的主要代谢产物为乳酸,有研究显示乳酸可渗透通过血脑屏障[28],也可经过不同的MCT 跨细胞膜转运[29],中枢神经系统中,MCT1在血管内皮细胞、星形胶质细胞和少突胶质细胞上均有表达,MCT2则主要分布在神经元细胞,在轴突及树突中均有表达,而MCT4主要在星形胶质细胞上表达[30]。当血脑屏障破坏,通透性升高,动脉血乳酸水平可能会影响到脑乳酸水平,进一步导致脑水肿加重。在严重急性肝衰竭(ALF)和脑水肿患者中发现,脑微透析液(细胞外)乳酸浓度受动脉血乳酸浓度的影响[31]。其次,多种证据表明乳酸会影响血脑屏障的发育、成熟,以及结构和功能的完整性。大脑中的内皮细胞或星形胶质细胞产生的乳酸可通过MCT转运到细胞外基质,并可能通过特定的乳酸受体作用于相邻细胞。星形胶质细胞中的活性糖酵解是支持神经元活动和血管生成所必需的,而内皮细胞能调节脑细胞对乳酸的利用度以及乳酸通过血脑屏障的双向转运[32]。当脑乳酸水平增高导致血脑屏障系统发生障碍,会增加乳酸和一些毒性物质的进入,引起中枢神经系统细胞的死亡,进一步加重神经系统功能障碍,最终导致HE的发生。
现将脑乳酸水平与HE的相互作用机制进行总结,见图1。
2.2 脑乳酸水平与HE的进展和严重程度相关 正常生理条件下,脑乳酸有多种生物学功能[33]:(1)参与脑能量代谢,在葡萄糖供能异常时,乳酸是脑内重要的能量补充物质;(2)乳酸在星形胶质细胞和神经元之间的信号传递对长期记忆的形成有重要作用[34];(3)参与脑内pH及呼吸功能调节[35];(4)参与脑血管张力调节[36];(5)参与体液平衡调节[37];(6)作为一个信号分子,参与中枢神经系统的脑能量代谢、神经递质传递,以及神经血管偶联等活动信号传递[38]等。当病理情况下,脑乳酸水平升高,上述的生物学功能障碍可能会影响大脑正常运转。有研究[39]发现乳酸是慢加急性肝衰竭患者预后的独立危险因素,与HE存在相关性。ALF时,HE和高氨血症患者血液及大脑的乳酸水平均升高[40]。肝病患者乳酸升高一方面与肝脏受损对乳酸清除减少、肝细胞坏死释放乳酸增加相关,另一方面可能与有效循环血量减少、微循环功能障碍、能量代谢障碍有关[41]。乳酸是无氧糖酵解的产物,也是参与神经元能量代谢的底物,由于糖酵解活性增加或脑组织能量衰竭,脑乳酸水平增加,可渗透性诱导脑内入水量增加,从而导致脑水肿,甚至颅内高压,而脑水肿是HE 的神经病理学特征,脑乳酸的增多可能会诱导HE的发生。Wang等[33]发现乳酸水平升高会刺激海马神经干细胞激活,损害新生神经元的终末分化,最终导致海马神经干细胞耗竭及认知受损,并且研究还发现破坏大脑内皮细胞中的MCT1 基因后,乳酸转运受限,蓄积在脑内,阻碍海马神经的发生以及导致认知功能受损,进一步证实维持脑乳酸稳态有助于成人海马神经的发生和保持正常的认知功能。脑乳酸的增加与 HE 的进展和严重程度有关。Chatauret等[42]發现在ALF 的大鼠和猪的脑中检测到细胞外乳酸水平与脑水肿严重程度平行增加。Bosoi等[43]研究证明,在患有脑水肿和 MHE 的肝硬化大鼠模型中,脑乳酸增加才是脑水肿发病机制的关键因素。Dienel[44]发现干预性高剂量注射乳酸可导致cAMP介导的神经元功能下调,抑制神经元放电,并影响星形胶质细胞和神经元的氧化还原和代谢。脑内乳酸蓄积,诱导脑细胞肿胀,干扰神经细胞的正常能量代谢,导致神经元功能障碍,促进HE的发生,并且随着乳酸生成增加,HE的程度越严重,维持脑乳酸的动态平衡对改善HE至关重要。
3 脑乳酸可能是治疗HE的潜在靶点
在暴发性肝功能衰竭患者中,脑乳酸水平的增加与颅内压升高相关,而治疗性干预措施,如低温、白蛋白透析,可减少脑乳酸的水平以及脑水肿的程度,从而影响HE的进展[45]。实验发现亚低温可以选择性地阻止ALF大鼠额叶皮层能量和葡萄糖代谢的改变,降低氧耗,防止脑乳酸水平增高,可延缓脑水肿和脑病的发作[42]。二氯乙酸 (DCA) 可刺激体内丙酮酸氧化,降低血浆乳酸浓度,并缓解细胞内酸中毒,研究发现DCA安全有效地减弱了原位肝移植期间的乳酸堆积并缓解酸中毒[46]。在患有脑水肿和 MHE 的胆管结扎致肝硬化的大鼠模型中也发现,用DCA 治疗的大鼠的脑水肿和脑乳酸减少,脑乳酸增加是慢性肝病脑水肿发病机制的关键[43]。脑乳酸可通过跨膜转运、淋巴系统引流入血液循环中,脑乳酸和动脉血乳酸之间相关影响,改善大脑的缺血缺氧状态,减少脑乳酸的生成,或许是治疗HE 的一个新的潜在靶点。
4 小结
HE是导致肝硬化患者住院和反复再入院的最常见并发症,与肝病的其他并发症相比,HE占用了更多的医疗资源,并且HE的相关医疗保健负担较重。HE的发生是多种因素作用的结果,而其中脑乳酸水平与HE的进展过程密切相关。乳酸不仅是评估肝病患者预后的良好预测指标,而且在中枢神经系统的代谢及生物学功能中发挥着举足轻重的作用。脑乳酸的增加是脑水肿发病机制的关键因素,并且与 HE 的进展和严重程度相关,但是脑乳酸在HE中的具体机制尚未明确,针对于乳酸的治疗仍处于探索阶段,改善大脑缺血缺氧的状态,减少乳酸生成可能是治疗 HE 的一个新的潜在靶点。进一步探究脑乳酸水平与HE的内在联系,对进一步解释HE的作用机制及临床治疗和预防HE有着重要意义。
利益冲突声明:本文不存在任何利益冲突。
作者贡献声明:刘玉琴负责选题,收集分析资料,撰写文章;陈密、唐兰燕、周丽智、黄鑫参与收集资料,修改论文;张磐拟定写作方向和思路,指导文章撰写,提供修改意见并最终定稿。
参考文献:
[1]
Chinese Society of Hepatology, Chinese Medical Association. Guidelines on the management of hepatic encephalopathy in cirrhosis[J]. J Clin Hepatol, 2018, 34(10): 2076-2089. DOI: 10.3969/j.issn.1001-5256.2018.10.007.
中华医学会肝病学分会. 肝硬化肝性脑病诊疗指南[J]. 临床肝胆病杂志, 2018, 34(10): 2076-2089. DOI: 10.3969/j.issn.1001-5256.2018.10.007.
[2]GUO JS. Epidemiology,diagnosis and treatment of minimal hepatic encephalopathy[J]. Chin J Hepatol, 2014, 22(2): 92-93. DOI: 10.3760/cma.j.issn.1007-3418.2014.02.005.
郭津生. 重視轻微型肝性脑病的流行病学及诊断与治疗[J]. 中华肝脏病杂志, 2014, 22(2): 92-93. DOI: 10.3760/cma.j.issn.1007-3418.2014.02.005.
[3]LIU SY, LI LH, LI SX, et al. Predictive value of controlled nutritional status score for overt hepatic encephalopathy after transjugular intrahepatic portosystemic stent-shunt of Budd-Chiari syndrome[J]. Chin J Dig Surg, 2023, 22(2): 251-259. DOI:10.3760/cma.j.cn115610-20221205-00733.
刘胜炎, 李路豪, 李素新, 等. 控制营养状况评分对布-加综合征患者行经颈静脉肝内门腔内支架分流术后发生显性肝性脑病的预测价值[J]. 中华消化外科杂志, 2023, 22(2): 251-259. DOI:10.3760/cma.j.cn115610-20221205-00733.
[4]JANSEN TC, van BOMMEL J, BAKKER J. Blood lactate monitoring in critically ill patients: a systematic health technology assessment[J]. Crit Care Med, 2009, 37(10): 2827-2839. DOI: 10.1097/CCM.0b013e3181a98899.
[5]ROSE CF. Increase brain lactate in hepatic encephalopathy: cause or consequence?[J]. Neurochem Int, 2010, 57(4): 389-394. DOI: 10.1016/j.neuint.2010.06.012.
[6]ANDERSEN LW, MACKENHAUER J, ROBERTS JC, et al. Etiology and therapeutic approach to elevated lactate levels[J]. Mayo Clin Proc, 2013, 88(10): 1127-1140. DOI: 10.1016/j.mayocp.2013.06.012.
[7]LEVY B. Lactate and shock state: the metabolic view[J]. Curr Opin Crit Care, 2006, 12(4): 315-321. DOI: 10.1097/01.ccx.0000235208.77450.15.
[8]JUEL C. Lactate-proton cotransport in skeletal muscle[J]. Physiol Rev, 1997, 77(2): 321-358. DOI: 10.1152/physrev.1997.77.2.321.
[9]TANG F, LANE S, KORSAK A, et al. Lactate-mediated glia-neuronal signalling in the mammalian brain[J]. Nat Commun, 2014, 5: 3284. DOI: 10.1038/ncomms4284.
[10]BASTIAN C, ZERIMECH S, NGUYEN H, et al. Aging astrocytes metabolically support aging axon function by proficiently regulating astrocyte-neuron lactate shuttle[J]. Exp Neurol, 2022, 357: 114173. DOI: 10.1016/j.expneurol.2022.114173.
[11]VAN HALL G. Lactate kinetics in human tissues at rest and during exercise[J]. Acta Physiol (Oxf), 2010, 199(4): 499-508. DOI: 10.1111/j.1748-1716.2010.02122.x.
[12]JHA MK, MORRISON BM. Lactate transporters mediate glia-neuron metabolic crosstalk in homeostasis and disease[J]. Front Cell Neurosci, 2020, 14: 589582. DOI: 10.3389/fncel.2020.589582.
[13]BOSOI CR, ROSE CF. Identifying the direct effects of ammonia on the brain[J]. Metab Brain Dis, 2009, 24(1): 95-102. DOI: 10.1007/s11011-008-9112-7.
[14]RAMA RAO KV, NORENBERG MD. Brain energy metabolism and mitochondrial dysfunction in acute and chronic hepatic encephalopathy[J]. Neurochem Int, 2012, 60(7): 697-706. DOI: 10.1016/j.neuint.2011.09.007.
[15]KALA G, HERTZ L. Ammonia effects on pyruvate/lactate production in astrocytes-interaction with glutamate[J]. Neurochem Int, 2005, 47(1-2): 4-12. DOI: 10.1016/j.neuint.2005.04.001.
[16]LERCHUNDI R, FERNNDEZ-MONCADA I, CONTRERAS-BAEZA Y, et al. NH4(+) triggers the release of astrocytic lactate via mitochondrial pyruvate shunting[J]. Proc Natl Acad Sci U S A, 2015, 112(35): 11090-11095. DOI: 10.1073/pnas.1508259112.
[17]QIN ZW, LIU JT, FAN XH, et al. Relationship between intestinal flora and hepatic encephalopathy[J]. Chin J Gastroenter Hepatol, 2021, 30(1): 34-37. DOI: 10.3969/j.issn.1006-5709.2021.01.008.
秦子文, 劉晶涛, 范晓红, 等. 肠道菌群与肝性脑病的关系[J]. 胃肠病学和肝病学杂志, 2021, 30(1): 34-37. DOI: 10.3969/j.issn.1006-5709.2021.01.008.
[18]BEARD E, LENGACHER S, DIAS S, et al. Astrocytes as key regulators of brain energy metabolism: New therapeutic perspectives[J]. Front Physiol, 2021, 12: 825816. DOI: 10.3389/fphys.2021.825816.
[19]LOMNETH R, MEDRANO S, GRUENSTEIN EI. The role of transmembrane pH gradients in the lactic acid induced swelling of astrocytes[J]. Brain Res, 1990, 523(1): 69-77. DOI: 10.1016/0006-8993(90)91636-u.
[20]ANDERSSON AK, ADERMARK L, PERSSON M, et al. Lactate contributes to ammonia-mediated astroglial dysfunction during hyperammonemia[J]. Neurochem Res, 2009, 34(3): 556-565. DOI: 10.1007/s11064-008-9819-1.
[21]LIU PF, BAO J. Changes of intestinal flora and serum inflammatory factor levels of patients with subclinical hepatic encephalopathy and the intervention effect of probiotics[J]. Chin J Microecol, 2020, 32(2): 180-182, 6. DOI: 10.13381/j.cnki.cjm.202002012.
柳萍飛, 包健. 亚临床肝性脑病患者肠道菌群和血清炎症因子水平变化及益生菌的干预作用[J]. 中国微生态学杂志, 2020, 32(2): 180-182, 6. DOI: 10.13381/j.cnki.cjm.202002012.
[22]XIE NW, LU J, HE JQ, et al. IL-6, IL-10, TNF in patients with HBV-ACLF hepatic encephalopathy- α Horizontal expression and significance[J]. Chongqing Med, 2017, 46(9): 1268-1271. DOI: 10.3969/j.issn.1671-8348.2017.09.038.
谢能文, 炉军, 何金秋, 等. HBV-ACLF肝性脑病患者IL-6、IL-10、TNF-α水平表达及意义[J]. 重庆医学, 2017, 46(9): 1268-1271. DOI: 10.3969/j.issn.1671-8348.2017.09.038.
[23]MANZHALII E, VIRCHENKO O, FALALYEYEVA T, et al. Hepatic Encephalopathy Aggravated by Systemic Inflammation[J]. Dig Dis, 2019, 37(6): 509-517. DOI: 10.1159/000500717.
[24]ARROYO V, ANGELI P, MOREAU R, et al. The systemic inflammation hypothesis: Towards a new paradigm of acute decompensation and multiorgan failure in cirrhosis[J]. J Hepatol, 2021, 74(3): 670-685. DOI: 10.1016/j.jhep.2020.11.048.
[25]HUANG X, HUSSAIN B, CHANG J. Peripheral inflammation and blood-brain barrier disruption: effects and mechanisms[J]. CNS Neurosci Ther, 2021, 27(1): 36-47. DOI: 10.1111/cns.13569.
[26]AGUSTI A, HERNNDEZ-RABAZA V, BALZANO T, et al. Sildenafil reduces neuroinflammation in cerebellum, restores GABAergic tone, and improves motor in-coordination in rats with hepatic encephalopathy[J]. CNS Neurosci Ther, 2017, 23(5): 386-394. DOI: 10.1111/cns.12688.
[27]RATTER JM, ROOIJACKERS H, HOOIVELD GJ, et al. In vitro and in vivo effects of lactate on metabolism and cytokine production of Human primary PBMCs and monocytes[J]. Front Immunol, 2018, 9: 2564. DOI: 10.3389/fimmu.2018.02564.
[28]DALSGAARD MK, QUISTORFF B, DANIELSEN ER, et al. A reduced cerebral metabolic ratio in exercise reflects metabolism and not accumulation of lactate within the human brain[J]. J Physiol, 2004, 554(Pt 2): 571-578. DOI: 10.1113/jphysiol.2003.055053.
[29]GERHART DZ, ENERSON BE, ZHDANKINA OY, et al. Expression of monocarboxylate transporter MCT1 by brain endothelium and glia in adult and suckling rats[J]. Am J Physiol, 1997, 273(1 Pt 1): E207-E213. DOI: 10.1152/ajpendo.1997.273.1.E207.
[30]BERGERSEN LH. Lactate transport and signaling in the brain: potential therapeutic targets and roles in body-brain interaction[J]. J Cereb Blood Flow Metab, 2015, 35(2): 176-185. DOI: 10.1038/jcbfm.2014.206.
[31]TOFTENG F, LARSEN FS. Monitoring extracellular concentrations of lactate, glutamate, and glycerol by in vivo microdialysis in the brain during liver transplantation in acute liver failure[J]. Liver Transpl, 2002, 8(3): 302-305. DOI: 10.1053/jlts.2002.32283.
[32]SALMINA AB, KUVACHEVA NV, MORGUN AV, et al. Glycolysis-mediated control of blood-brain barrier development and function[J]. Int J Biochem Cell Biol, 2015, 64: 174-184. DOI: 10.1016/j.biocel.2015.04.005.
[33]WANG J, CUI YX, YU ZX, et al. Brain endothelial cells maintain lactate homeostasis and control adult hippocampal neurogenesis[J]. Cell Stem Cell, 2019, 25(6): 754-767. DOI: 10.1016/j.stem.2019.09.009.
[34]REX A, BERT B, FINK H, et al. Stimulus-dependent changes of extracellular glucose in the rat hippocampus determined by in vivo microdialysis[J]. Physiol Behav, 2009, 98(4): 467-473. DOI: 10.1016/j.physbeh.2009.07.015.
[35]ERLICHMAN JS, HEWITT A, DAMON TL, et al. Inhibition of monocarboxylate transporter 2 in the retrotrapezoid nucleus in rats: a test of the astrocyte-neuron lactate-shuttle hypothesis[J]. J Neurosci, 2008, 28(19): 4888-4896. DOI: 10.1523/JNEUROSCI.5430-07.2008.
[36]GORDON GR, CHOI HB, RUNGTA RL, et al. Brain metabolism dictates the polarity of astrocyte control over arterioles[J]. Nature, 2008, 456(7223): 745-749. DOI: 10.1038/nature07525.
[37]OHBUCHI T, SATO K, SUZUKI H, et al. Acid-sensing ion channels in rat hypothalamic vasopressin neurons of the supraoptic nucleus[J]. J Physiol, 2010, 588(Pt 12): 2147-2162. DOI: 10.1113/jphysiol.2010.187625.
[38]BERGERSEN LH, GJEDDE A. Is lactate a volume transmitter of metabolic states of the brain?[J]. Front Neuroenergetics, 2012, 4: 5. DOI: 10.3389/fnene.2012.00005.
[39]YANG S, LIU K, YANG L, et al. Value of lactate level in predicting the short-term prognosis of patients with acute-on-chronic hepatitis B liver failure[J]. J Clin Hepatol, 2022, 38(7): 1482-1488. DOI: 10.3969/j.issn.1001-5256.2022.07.007.
楊烁, 刘坤, 杨兰, 等. 乳酸水平对HBV相关慢加急性肝衰竭患者短期预后的预测价值[J]. 临床肝胆病杂志, 2022, 38(7): 1482-1488. DOI: 10.3969/j.issn.1001-5256.2022.07.007.
[40]WALSH TS, MCLELLAN S, MACKENZIE SJ, et al. Hyperlactatemia and pulmonary lactate production in patients with fulminant hepatic failure[J]. Chest, 1999, 116(2): 471-476. DOI: 10.1378/chest.116.2.471.
[41]ENGELMANN C, CLRIA J, SZABO G, et al. Pathophysiology of decompensated cirrhosis: Portal hypertension, circulatory dysfunction, inflammation, metabolism and mitochondrial dysfunction[J]. J Hepatol, 2021, 75(Suppl 1): S49-S66. DOI: 10.1016/j.jhep.2021.01.002.
[42]CHATAURET N, ZWINGMANN C, ROSE C, et al. Effects of hypothermia on brain glucose metabolism in acute liver failure: a H/C-nuclear magnetic resonance study[J]. Gastroenterology, 2003, 125(3): 815-824. DOI: 10.1016/s0016-5085(03)01054-0.
[43]BOSOI CR, ZWINGMANN C, MARIN H, et al. Increased brain lactate is central to the development of brain edema in rats with chronic liver disease[J]. J Hepatol, 2014, 60(3): 554-560. DOI: 10.1016/j.jhep.2013.10.011.
[44]DIENEL GA. The metabolic trinity, glucose-glycogen-lactate, links astrocytes and neurons in brain energetics, signaling, memory, and gene expression[J]. Neurosci Lett, 2017, 637: 18-25. DOI: 10.1016/j.neulet.2015.02.052.
[45]CHATAURET N, ROSE C, BUTTERWORTH RF. Mild hypothermia in the prevention of brain edema in acute liver failure: mechanisms and clinical prospects[J]. Metab Brain Dis, 2002, 17(4): 445-451. DOI: 10.1023/a:1021982523691.
[46]SHANGRAW RE, WINTER R, HROMCO J, et al. Amelioration of lactic acidosis with dichloroacetate during liver transplantation in humans[J]. Anesthesiology, 1994, 81(5): 1127-1138. DOI: 10.1097/00000542-199411000-00006.
收稿日期:
2022-09-25;錄用日期:2022-11-14
本文编辑:王亚南
引证本文:
LIU YQ, CHEN M, TANG LY, et al.
Research advances in brain lactate level and hepatic encephalopathy
[J]. J Clin Hepatol, 2023, 39(7): 1728-1733.
刘玉琴, 陈密, 唐兰燕, 等.
脑乳酸水平与肝性脑病关系的研究进展
[J]. 临床肝胆病杂志, 2023, 39(7): 1728-1733.

