复方灵丹胶囊对肝纤维化小鼠模型肝功能及纤维化程度的影响
涂芷馨 王妍 黄剑洁 金清龙

摘要:目的 研究復方灵丹胶囊对肝纤维化小鼠模型血清生化指标及肝脏纤维化程度的影响。方法 125只SPF级雄性C57BL/6小鼠随机分为正常对照组(n=5);CCl4模型组(n=15),CCl4造模低、中、高剂量给药组(0.8、1.6、3.2 mg·g-1·d-1)(每组各15只);DDC模型组(n=15),DDC造模低、中、高剂量给药组(0.8、1.6、3.2 mg·g-1·d-1)(每组各15只)。造模成功后,给药组予以相应剂量复方灵丹胶囊混悬液灌胃,正常对照组及模型组以等量生理盐水灌胃,连续给药4周,眼球取血,留取血清,检测AST、ALT、白蛋白、胆红素,留取肝右叶同一部位组织进行病理观察及天狼星红、α1-Ⅰ型胶原蛋白抗体及α-平滑肌肌动蛋白抗体染色。计量资料多组间比较采用单因素方差分析,进一步两两比较采用Bonferroni法。结果 与模型组对比,复方灵丹胶囊给药后,各剂量组小鼠血清ALT明显下降、白蛋白升高(P值均<0.05),中、高剂量给药组血清AST、胆红素水平均降低 (P值均<0.05),且各指标高剂量组较低剂量组差异更显著(P值均<0.05)。各剂量组小鼠肝组织病理变化均得到不同程度的改善,天狼星红染色阳性细胞显著减少,α-平滑肌肌动蛋白、α1-Ⅰ型胶原蛋白表达出现不同程度的下降。结论 复方灵丹胶囊能够改善肝纤维化小鼠肝功能、降低其肝纤维化程度。
关键词:肝硬化; 小鼠, 近交C57BL; 复方灵丹胶囊
基金项目:国家自然科学基金(81270484)
Effect of Compound Lingdan Capsule on liver function and fibrosis degree in mice with liver fibrosis
TU Zhixin, WANG Yan, HUANG Jianjie, JIN Qinglong. (Department of Hepatology, The First Hospital of Jilin University, Changchun 130000, China)
Corresponding author:
JIN Qinglong, jinql@jlu.edu.cn(ORCID:0000-0002-4626-9828)
Abstract:
Objective To investigate the effect of Compound Lingdan Capsule on serum biochemical parameters and liver fibrosis degree in a mouse model of liver fibrosis. Methods A total of 125 specific pathogen-free male C57BL/6 mice were randomly divided into normal control group with 5 mice, CCl4 model group with 15 mice, low-, middle-, and high-dose CCl4 groups (0.8, 1.6, and 3.2 mg·g-1·d-1) with 15 mice in each group, DDC model group with 15 mice, and low-, middle-, and high-dose DDC groups (0.8, 1.6, and 3.2 mg·g-1·d-1) with 15 mice in each group. After successful modeling, the mice in the administration groups were given Compound Lingdan Capsule suspension at the respective doses by gavage, and those in the normal control group and the model group were given an equal volume of normal saline by gavage, for 4 consecutive weeks. Blood samples were collected from the eyeballs, and serum was used to measure aspartate aminotransferase (AST), alanine aminotransferase (ALT), albumin, and bilirubin. Liver tissue samples were collected at the same site of the right lobe of the liver for pathological observation, Sirius Red staining, α-SMA antibody staining, and COL1A1 antibody staining. A one-way analysis of variance was used for comparison of continuous data between multiple groups, and the Bonferroni method was used for further comparison between two groups. Results Compared with the model group, each dose group had significant reductions in the serum level of ALT and a significant increase in the serum level of albumin after the administration of Compound Lingdan Capsule (all P<0.05), the levels of AST and bilirubin in the middle and high dose groups were lower (all P<0.05), and the difference of each index in the high dose group was more significant than that in the low dose group (all P<0.05). Each dose group had varying degrees of improvement in the pathological changes of the liver and a significant reduction in the number of Sirius Red staining-positive cells, as well as varying degrees of reduction in the protein expression of α-SMA and COL1A1. Conclusion Compound Lingdan Capsule can improve liver function and reduce liver fibrosis degree in mice with liver fibrosis.
Key words:
Liver Cirrhosis; Mice, Inbred C57BL; Compound Lingdan Capsule
Research funding:National Natural Science Foundation of China(81270484)
肝纤维化是由各种因素引起的肝细胞慢性损伤和细胞外基质过度沉积所致,肝纤维化的进一步进展可导致肝硬化甚至肝细胞癌的发生[1-2]。肝纤维化及其并发症给人类带来了巨大的医疗和经济负担,然而,即便是晚期肝纤维化也是可以逆转的[2-4]。肝纤维化的基本治疗策略是病因治疗联合抗肝纤维化治疗[5-6]。然而在临床上,针对肝纤维化确切有效的药物较少,而中药被认为在逆转肝纤维化方面具有一定的优势。本单位自主研制的处方药“复方灵丹胶囊”治疗肝纤维化、肝硬化已有数年的用药经验,治疗患者达数千例,有明显疗效。本研究旨在通过建立肝纤维化小鼠模型,观察其血清生化指标及肝脏病理形态、α-平滑肌肌动蛋白(α-SMA)及α1-Ⅰ型胶原蛋白(COL1A1)表达等,验证复方灵丹胶囊对小鼠肝功能及肝纤维化程度的影响。现将观察结果报道如下。
1 材料与方法
1.1 动物 SPF级雄性C57BL/6小鼠125只,许可证编号:SYXK(吉)2016-0001,體质量18~22 g,由吉林大学实验动物中心提供。
1.2 药物与试剂 复方灵丹胶囊由吉林大学第一医院制备,批号20100701。AST、ALT、胆红素、白蛋白ELISA试剂盒,α-SMA抗体、COL1A1抗体均由长春莱格瑞生物技术有限公司提供。
1.3 方法
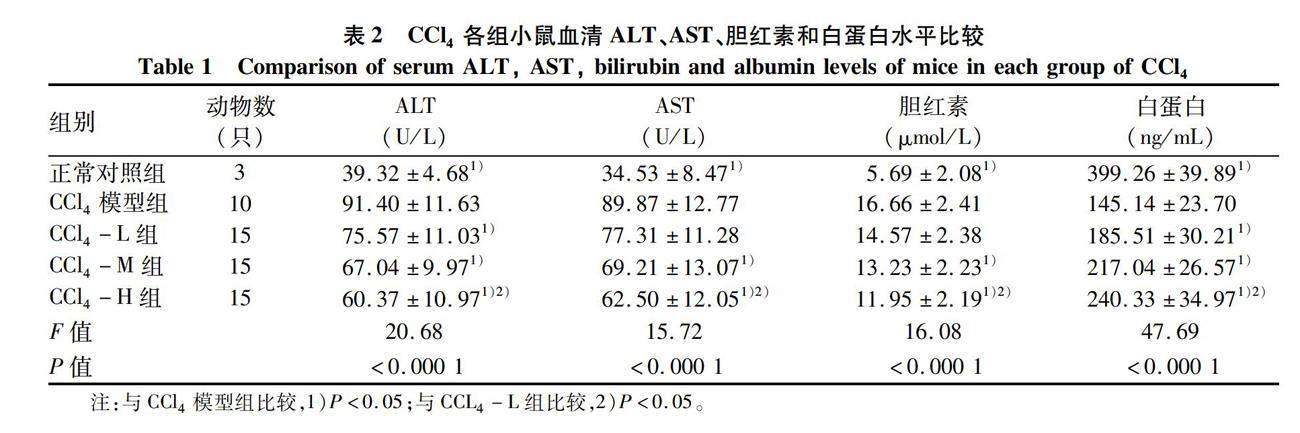
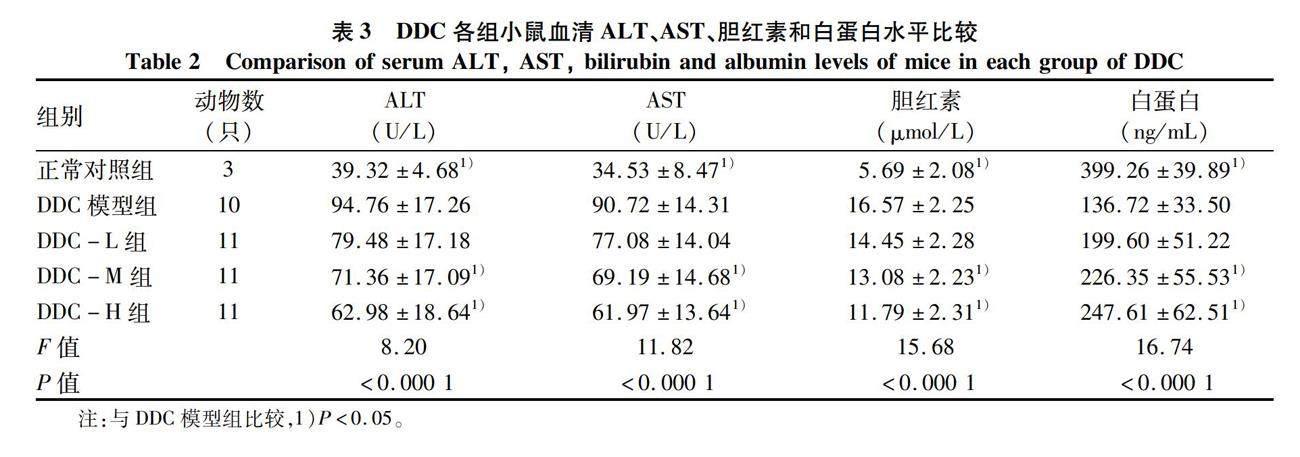
1.3.1 分组、造模及给药 将小鼠用简单随机化分组法分为正常对照组、CCl4造模组、DDC造模组。CCl4造模组随机分为CCl4模型组、CCl4-L组、CCL4-M组、CCL4-H组,DDC造模组随机分为DDC模型组、DDC-L组、DDC-M组、DDC-H组(表1)。
1.3.2 血清生化指标检测 末次给药12 h后,小鼠禁食12 h,眼球取血,采用低温离心方法收集血清样本,利用ELISA试剂盒检测小鼠血清内AST、ALT、胆红素及白蛋白的含量。
1.3.3 HE及天狼星红染色 4周后麻醉小鼠,取肝右叶同一部位组织,用4%甲醛溶液固定,常规石蜡包埋,分别作HE、天狼星红染色处理,镜下观察肝组织形态。
1.3.4 免疫组化 4周后麻醉小鼠,取肝右叶同一部位组织,用4%甲醛溶液固定,常规石蜡包埋、切片,将组织切片按标准流程进行α-SMA、COL1A1抗体染色,镜下观察。
1.3.5 统计学方法 采用SPSS 25.0和Graghpad Prism 9.0软件进行数据统计分析和作图。计量资料以x±s表示,多组间比较采用单因素方差分析,进一步两两比较采用Bonferroni法。P<0.05为差异有统计学意义。
2 结果
2.1 血清ALT、AST、胆红素、白蛋白水平 与正常对照组相比,CCl4模型组血清ALT、AST和胆红素水平均明显升高,白蛋白水平显著下降(P值均<0.05),提示CCl4造模造成小鼠明显肝损伤。与CCl4模型组相比,复方灵丹胶囊各剂量给药组小鼠血清ALT显著降低,白蛋白水平均提升(P值均<0.05),中、高剂量给药组血清AST、胆红素水平均降低(P值均<0.05),且各指标高剂量组较低剂量组差异更明显(P值均<0.05)(表2)。
与正常对照组相比,DDC模型组小鼠血清ALT、AST和胆红素水平均明显升高,白蛋白水平明显下降(P值均<0.05),提示DDC造模造成小鼠明显肝损伤。与DDC模型组相比,复方灵丹胶囊中、高剂量给药组小鼠血清ALT、AST和胆红素水平明显降低,白蛋白水平明显升高(P值均<0.05)(表3)。
2.2 各组小鼠肝组织不同染色结果
HE染色:正常对照组小鼠肝细胞索以中央静脉为中心向四周呈放射性排列,肝细胞间联系紧密,肝细胞核大而圆,无炎性细胞浸润;DDC和CCl4诱导小鼠肝纤维化造模组可见汇管区和小胆管周围淋巴细胞、浆细胞浸润,胆管上皮细胞变性坏死,基底膜不完整;复方灵丹胶囊给药后,低剂量组、中剂量组、高剂量组小鼠肝组织病理变化均得到不同程度的改善。
天狼星红染色:与造模组相比,各剂量组阳性细胞显著减少。
α-SMA抗体染色:与正常对照组相比,造模组小鼠肝组织中α-SMA蛋白表达增加,复方灵丹胶囊给药后,肝组织中α-SMA蛋白表达出现不同程度的下降。
COL1A1抗体染色:各剂量组复方灵丹胶囊可以降低小鼠肝组织胶原蛋白的分泌(图1)。
3 讨论
各种原因所致的慢性肝病若不及时治疗会导致肝纤维化,并发展为肝硬化,最终可发展致肝衰竭和肝细胞癌,这与肝脏相关病死率密切相关[7-8]。肝纤维化的改善与更好的预后及10年生存率的显著增加密切相关,因此,有效的抗肝纤维化治疗是非常必要的,即使在晚期肝纤维化患者中也是如此[7]。
在抗肝纤维化治疗中,最重要的是病因治疗。研究[9-13]表明,病因的有效控制可减轻对肝脏的持续损伤,从而促进纤维化肝组织的修复。然而,控制和清除慢性肝损伤的病因并不能立即逆转肝纤维化,可能需要数年的时间才能实现显著的肝纤维化消退,而包括门静脉高压和肝细胞癌在内的肝纤维化并发症可能会进一步进展,因此,病因的有效控制和清除不足以改善所有肝纤维化患者的临床结局,这说明了在病因治疗前、治疗时及控制或清除病因后采用直接有效的抗肝纤维化治疗是十分必要的[1,6]。然而,临床上目前尚无公认有效的抗肝纤维化的化学药物或生物制剂[2,6],但中药在该领域具有一定的优势,国内已有多种注册适应证为肝纤维化的中成药上市并用于临床治疗[14]。
本单位自主研制的中成药复方灵丹胶囊由丹参、灵芝、山豆根、葫芦素四味中药组成,其功能为“扶正补虚、活血化瘀、清热利湿”,主治正虚血瘀兼湿热证所致的病毒性肝炎、肝纤维化等疾病。本制剂按君、臣、佐、使组方原则,分析处方配伍,方中丹参,味苦、微寒,入心、肝经,活血化瘀,为君药;灵芝,味甘、平,入心、肺、肝、肾经,扶正固本、补气养血,山豆根,味苦、寒,入肺、胃经,清热解毒、消肿止痛,两药并用,祛除热、毒、瘀等有形之邪,为臣药;葫芦素,为佐药,可助臣药清利湿热、解毒退黄;诸药合用,标本兼治,共同起到“扶正固本、活血化瘀、清利湿热”之功效。本制剂安全可靠、疗效确切、标准明确、质量可控,符合中医药理论和应用标准,体现中药多成分、多靶点产生作用的特点。
本研究在前期工作的基础上进一步深入研究,分析了在两种肝纤维化模型小鼠中复方灵丹胶囊给药后的效果,并从肝脏病理、免疫组化层面进一步证明复方灵丹胶囊对肝纤维化的疗效[15]。本研究表明,复方灵丹胶囊可降低肝纤维化模型小鼠血清AST、ALT、胆红素水平,提升白蛋白水平,减轻肝小叶结构的破坏及纤维组织增生,可见其有减轻肝损伤、改善肝功能、抑制肝纤维化的作用。免疫组化结果表明,复方灵丹胶囊各剂量组均不同程度地降低了α-SMA和COL1A1蛋白的表达。先前研究[2,16-17]表明,肝细胞受损致肝星状细胞(HSC)活化,在促纤维形成介质的刺激下,HSC上调α-SMA和其他肌成纤维细胞内微丝的表达,促使HSC迁移到损伤部位并分泌细胞外基质,其中TGFβ是最有效的促纤维化细胞因子,以SMAD2或SMAD3依赖的方式驱动HSC活化,而COL1A1基因被鉴定为活化HSC中TGFβ的靶点[2,16-17]。这表明复方灵丹胶囊改善肝纤维化的作用机制可能与调控上述细胞因子及其相关信号通路有关。本课题组前期工作表明,复方灵丹胶囊联合恩替卡韦治疗代偿期乙型肝炎肝硬化患者后,其门静脉宽度及瞬时弹性成像Fibroscan明显下降,可见复方灵丹胶囊能够改善其肝纤维化程度、延缓病情进展。
综上所述,复方灵丹胶囊能够改善肝纤维化小鼠肝功能、降低其肝纤维化程度,具有良好的临床应用价值。但目前尚不清楚复方灵丹胶囊延缓及逆转肝纤维化的具体机制及调控作用,更进一步的研究还有待进行。
伦理学声明:本研究方案于2019年6月1日经由吉林大学实验动物伦理委员会审批,批号:SY201906010,符合实验室动物管理与使用准则。
利益冲突声明:本研究不存在研究者、伦理委员会成员以及与公开研究成果有关的利益冲突。
作者贡献声明:涂芷馨负责课题设计,资料分析,撰写论文;王妍、黄剑洁参与收集数据,修改论文;金清龙负责拟定写作思路,指导撰写文章并最后定稿。
参考文献:
[1]FRIEDMAN SL. Liver fibrosis—from bench to bedside[J]. J Hepatol, 2003, 38(Suppl 1): S38-S53. DOI: 10.1016/s0168-8278(02)00429-4.
[2]
KISSELEVA T, BRENNER D. Molecular and cellular mechanisms of liver fibrosis and its regression[J]. Nat Rev Gastroenterol Hepatol, 2021, 18(3): 151-166. DOI: 10.1038/s41575-020-00372-7.
[3]
WEISKIRCHEN R, WEISKIRCHEN S, TACKE F. Recent advances in understanding liver fibrosis: bridging basic science and individualized treatment concepts[J]. F1000Res, 2018, 7: F1000 Faculty Rev-921. DOI: 10.12688/f1000research.14841.1.
[4]
DU WT, REN WL, HU DD, et al. Research progress on reversible animal model of liver fibrosis[J/CD]. Chin J Liver Dis (Electronic Version), 2022, 14(3): 18-21. DOI: 10.3969/j.issn.1674-7380.2022.03.005.
杜文濤, 任万雷, 胡豆豆, 等. 肝纤维化可逆转动物模型研究进展[J/CD]. 中国肝脏病杂志(电子版), 2022, 14(3): 18-21. DOI: 10.3969/j.issn.1674-7380.2022.03.005.
[5]
Chinese Society of Hepatology, Chinese Medical Association; Chinese Society of Gastroenterology, Chinese Medical Association; Chinese Society of Infectious Diseases, Chinese Medical Association. Consensus on the diagnosis and therapy of hepatic fibrosis (2019)[J]. J Clin Hepatol, 2019, 35(10): 2163-2172. DOI: 10.3969/j.issn.1001-5256.2019.10.007.
中华医学会肝病学分会, 中华医学会消化病学分会, 中华医学会感染病学分会. 肝纤维化诊断及治疗共识(2019年)[J]. 临床肝胆病杂志, 2019, 35(10): 2163-2172. DOI: 10.3969/j.issn.1001-5256.2019.10.007.
[6]Liver Disease Committee, Chinese Association of Integrative Medicine. Guidelines for the diagnosis and treatment of liver fibrosis in integrative medicine practice (2019)[J]. J Clin Hepatol, 2019, 35(7): 1444-1449. DOI: 10.3969/j.issn.1001-5256.2019.07.007.
中国中西医结合学会肝病专业委员会. 肝纤维化中西医结合诊疗指南(2019年版)[J]. 临床肝胆病杂志, 2019, 35(7): 1444-1449. DOI: 10.3969/j.issn.1001-5256.2019.07.007.
[7]
PAROLA M, PINZANI M. Liver fibrosis: Pathophysiology, pathogenetic targets and clinical issues[J]. Mol Aspects Med, 2019, 65: 37-55. DOI: 10.1016/j.mam.2018.09.002.
[8]
LAI M, AFDHAL NH. Liver fibrosis determination[J]. Gastroenterol Clin North Am, 2019, 48(2): 281-289. DOI: 10.1016/j.gtc.2019.02.002.
[9]
HAMMEL P, COUVELARD A, OTOOLE D, et al. Regression of liver fibrosis after biliary drainage in patients with chronic pancreatitis and stenosis of the common bile duct[J]. N Engl J Med, 2001, 344(6): 418-423. DOI: 10.1056/NEJM200102083440604.
[10]ARTHUR MJ. Reversibility of liver fibrosis and cirrhosis following treatment for hepatitis C[J]. Gastroenterology, 2002, 122(5): 1525-1528. DOI: 10.1053/gast.2002.33367.
[11]
KWEON YO, GOODMAN ZD, DIENSTAG JL, et al. Decreasing fibrogenesis: an immunohistochemical study of paired liver biopsies following lamivudine therapy for chronic hepatitis B[J]. J Hepatol, 2001, 35(6): 749-755. DOI: 10.1016/s0168-8278(01)00218-5.
[12]
DIXON JB, BHATHAL PS, HUGHES NR, et al. Nonalcoholic fatty liver disease: Improvement in liver histological analysis with weight loss[J]. Hepatology, 2004, 39(6): 1647-1654. DOI: 10.1002/hep.20251.
[13]
CZAJA AJ, CARPENTER HA. Decreased fibrosis during corticosteroid therapy of autoimmune hepatitis[J]. J Hepatol, 2004, 40(4): 646-652. DOI: 10.1016/j.jhep.2004.01.009.
[14]
ZHANG Y, LYU WL. Visual analysis of traditional Chinese medicine in the treatment of hepatic fibrosis based on CiteSpace[J]. China Med Herald, 2022, 19(19): 129-132, 137.
張亚, 吕文良. 基于CiteSpace中医药治疗肝纤维化的可视化分析[J]. 中国医药导报, 2022, 19(19): 129-132, 137.
[15]
WANG HY, NIU JQ, ZHANG WY, et al. Experimental study on the anti-hepatic fibrosis effect of Compound Lingdan Capsule[J]. Chin Traditional Patent Med, 2014, 36(1): 168-171. DOI: 10.3969/j.issn.1001-1528.2014.01.042.
王化宇, 牛俊奇, 张炜煜, 等. 复方灵丹胶囊抗肝纤维化作用的实验研究[J]. 中成药, 2014, 36(1): 168-171. DOI: 10.3969/j.issn.1001-1528.2014.01.042.
[16]
FALLOWFIELD JA, MIZUNO M, KENDALL TJ, et al. Scar-associated macrophages are a major source of hepatic matrix metalloproteinase-13 and facilitate the resolution of murine hepatic fibrosis[J]. J Immunol, 2007, 178(8): 5288-5295. DOI: 10.4049/jimmunol.178.8.5288.
[17]
DOOLEY S, DELVOUX B, STRECKERT M, et al. Transforming growth factor beta signal transduction in hepatic stellate cells via Smad2/3 phosphorylation, a pathway that is abrogated during in vitro progression to myofibroblasts. TGFbeta signal transduction during transdifferentiation of hepatic stellate cells[J]. FEBS Lett, 2001, 502(1-2): 4-10. DOI: 10.1016/s0014-5793(01)02656-4.
收稿日期:
2022-09-07;录用日期:2022-10-24
本文编辑:林姣

