氚水对鼠细胞及整体致癌效应的系统评价与Meta 分析
徐凯 李梅 王春平 卢海丽 单文萍 秦秀军

摘 要:采用系统评价与Meta 分析的方法探讨鼠摄入氚水( HTO) 与致癌效应之间的关系,计算机检索PubMed、Embase、The Cochrane Library、Web of Science、中国知网、中国生物医学文献数据库、万方和维普数据库,自数据库建立至2021 年2 月15 日发表的有关鼠摄入氚水后致癌作用的文献。采用Endnote 9. 2 进行文献管理;应用毒理学数据可靠性评价工具:ToxRTool 评价标准进行文献质量评价。结果共纳入10 篇实验研究,其中4 篇文献报道了体外实验,7 篇文献报道体内实验( 其中1 篇文献体内、体外实验均有报道) 。体外实验中,随着细胞受照剂量的增加,细胞生存分数呈指数下降,所拟合直线方程为lnSF = 0. 047-0. 270D( P<0. 001) ,R2 = 0. 850;以细胞受照剂量为自变量,细胞恶性转化分数( foci/ dishes) 为因变量拟合方程,方程为y = 0. 205+0. 195x( P <0. 001) , R2 =0. 853;剂量反应关系Meta 分析显示,随细胞受照剂量的增加,细胞恶性转化风险呈先快速上升后平缓的趋势。体内实验中,腹腔注射途径给药,随着注射药物的放射性活度的增大,中位生存期或平均生存期降低。氚水( HTO) 不论对细胞还是对整体动物的致癌效应是确切的,并且导致了生存状况的下降,但极低剂量氚水摄入的致癌效应,还待进一步研究。
关键词:鼠;氚水;致癌;系统评价;Meta 分析
中图分类号:Q691. 5 文献标识码:A
核设施运行产生的废水通过净化处理后,主要含有放射性核素氚[1] ,即放射性核素氚很难被净化处理。氚是氢的放射性同位素(符号3 H, 常用符号T),半衰期约为12. 33 a,氚属于低毒放射性核素,放出低能β 粒子。在环境中氚主要以氚水形式存在[2] 。氚有两个来源:自然来源和人工来源。近数万年来,自然来源的氚的产生率基本保持恒定[3] 。核设施附近,特别是重水反应堆附近,氚活度高于背景值;核事故后,也观察到环境中氚浓度的升高[4] 。氚的毒性主要来自于氚的辐射效应,包括确定性效应和随机性效应[5] 。随着核能事业的不断发展,核反应堆的建立日益增多,氚向环境中排放量将不断增加。特别是随着国内外可控热核聚变研究的大力发展,可控热核聚变反应装置也可能在不远的将来投入商业化运营[6] 。而聚变堆产氚量约为现在核电站使用的裂变堆的104 数量级倍,因此即使只有一部分释放到环境中,氚的排放量也将成百倍地增加[7] 。所以,氚对人类健康的影响应持续关注。目前,开展动物实验的系统评价/ Meta 分析已被认为是探索提升动物实验对临床研究指导价值的有效途径[8] 。故本文研究细胞或整体动物摄入氚水后的致癌效应,以明确氚水的致癌效应。
1 资料与方法
1. 1 纳入标准
利用PICOS 原则[ Participants( 研究对象),Intervention( 干预), Control ( 对照), Outcome ( 结局),Study design ( 研究设计)] 确定纳入标准:①研究类型为毒理学实验研究(包括体外实验和体内实验);②鼠或鼠细胞摄入氚水;③报道摄入氚水后结局;④体外实验报道细胞恶性转化率或恶性转化分数;体内实验报告全身总肿瘤发病率;⑤可获取全文;⑥不限制文献的语言。
1. 2 排除标准
①综述类文章;②体内实验结局仅报告某些器官的肿瘤发病率;③数据明显异常或数据缺失而未能联系上作者进一步补充的研究;③同一数据,重复发表的仅纳入信息最为完整的研究; ④文献研究质量评价按照ToxRTool 评价标准,体内实验:得分< 13 分或不满足所有红色标准;体外实验:得分<11 分或不满足红色标准者。
1. 3 检索策略
利用计算机检索PubMed、Web of Science、TheCochrane Library、Embase、中國知网、中国生物医学文献数据库、万方数据库和维普数据库,自数据库建立至2021 年2 月15 日发表的有关氚对鼠致癌作用的文献。检索采用主题词加自由词的策略进行检索(以下检索词均只注明主题词),中文检索词为:“癌或肿瘤、氚、鼠”,英文检索式为:① AND,② AND, ③,(Carcinogenesis) OR (Carcinogeneses) OR (Tumorigenesis)OR ( Tumorigeneses ) OR ( Oncogenesis ) OR(Oncogeneses) OR ( Carcinogenic); ② ( Tritiatedwater) OR ( HTO) OR ( Tritium); ③ ( Mus) OR(Mouse) OR (Mice) OR (Rat) OR (Rattus) OR(rats)。
1. 4 数据提取
对入选的研究由两人仔细进行资料提取,必要时联系研究作者以澄清报告中的数据。描述性、定性和定量数据从符合条件的研究中提取;分歧通过讨论解决,必要时通过该领域的专家讨论或独立摘录。对于无确切数据的图表资料,在无法联系研究作者以澄清报告时, 利用GetDataGraph Digitizer 进行摘录[9] 。
1. 5 文献质量评价
纳入的文献质量,采用ToxRTool 评价标准进行评价[10-11] 。此标准分为5 大类:实验物质的鉴定、实验对象(体系) 的特征、研究设计的描述、实验结果的记录、研究设计和结果的合理性。将大类进行分级细化之后,具体的评价标准体内实验为21 条,体外实验为18 条。
1. 6 统计学方法
按纳入文献的实验类型分为体外、体内实验两种,分别统计分析。在体外实验中:探讨细胞受照剂量与细胞生存分数关系;探讨细胞受照剂量与细胞恶性转化的关系;细胞受照剂量与细胞恶性转化风险的剂量反应关系Meta 分析。在体内实验中,按给药途径不同,分为腹腔注射给药和经口给药。腹腔注射给药:探讨注射剂量与鼠生存状况关系;探讨注射剂量和肿瘤发病情况的关系。经口给药:探讨经口摄入氚水的放射性浓度与鼠存活和肿瘤发病的关系。
应用Excel 对提取数据进行管理,利用SPSS26 进行卡方检验、方差分析和方程的拟合及评价,Stata 15. 1 软件进行剂量反应关系Meta 分析。本文按照动物实验系统评价和Meta 分析的推荐报告指南[12] 撰写。
1. 6. 1 体外实验
利用从文献中提取的氚放射性浓度(Bq/ mL或Ci/ mL),计算每小时的辐射剂量(Gy/ h)[13] ,根据下式计算氚水辐射剂量率:
cGy/ h = (MBq/ mL) × 0. 329 × 0. 84
其中,0. 329 是转换因子(1×106 d·s-1 ·MBq-1 ×60×60 s·h-1 ×5. 7×103 eV·d-1 ×1. 602×10-19 J·eV-1 ×1×105 cGy·J-1 ·g);0. 84 是细胞的含水量(mL·g-1 )。细胞含水量采用[羧基-14 C] 菊粉测定细胞外含水量的方法测定[13] 。最后与暴露持续时间h 相乘,得到辐射剂量(Gy)。Yamaguchi(1989)报道了37 ℃ 与4 ℃ 下细胞生存与恶性转化情况,且不同温度下,细胞生存与恶性转化情况差异较大,故只纳入其37 ℃ 数据以拟合方程。
1. 6. 1. 1细胞受照剂量与细胞生存分数(Surviving Fraction)方程的拟合
将所有可得数据整理分析,以细胞受照剂量为自变量,细胞生存分数的自然对数值和细胞生存分数分别为因变量拟合方程。将纳入文献已报道的方程与本次拟合的方程进行对比。
1. 6. 1. 2 細胞受照剂量与细胞恶性转化率(foci/dishes)方程的拟合
采用卡方检验,检验相同受照剂量,不同暴露持续时间的细胞生存分数与恶性转化率有无差异;将所有可得数据整理分析,以细胞受照剂量为自变量,细胞恶性转化率为因变量拟合方程。
1. 6. 1. 3 细胞受照剂量与细胞恶性转化风险的剂量反应关系Meta 分析
每一篇文献中,首先计算各剂量组的RR 值及其标准误( SE ), 再计算lnRR 值与lnSE。利用stata 软件分析, 分析是基于广义最小二乘法(generalized least squares method),通过采用glst命令实现,画图采用xblc 命令实现[14] 。绘制剂量反应关系Meta 分析图。
1. 6. 2 体内实验
本文将体内实验,按给药途径不同分为腹腔注射生存状况分析、腹腔注射致肿瘤发生情况、经口摄入致肿瘤风险三部分。
腹腔注射生存状况分析:文献进行数据提取后,报告寿命表资料的,绘制寿命表,并计算其中位生存时间。对所有所纳入文献进行统计描述。腹腔注射诱导肿瘤发生情况:对纳入文献,根据其报道项目不同,进行描述。
经口摄入致肿瘤风险:由于喂饲不同放射性浓度的氚水,导致鼠生存时间不同,也影响终生肿瘤发病风险,故描述不同放射性浓度氚水喂饲下的生存时间,并计算同一研究不同剂量组的肿瘤发病风险(RR)。将经口摄入氚水放射性浓度置于X 轴,肿瘤发生率置于Y 轴,绘制散点图。
2 结果分析
2. 1 文献纳入结果及基本特征
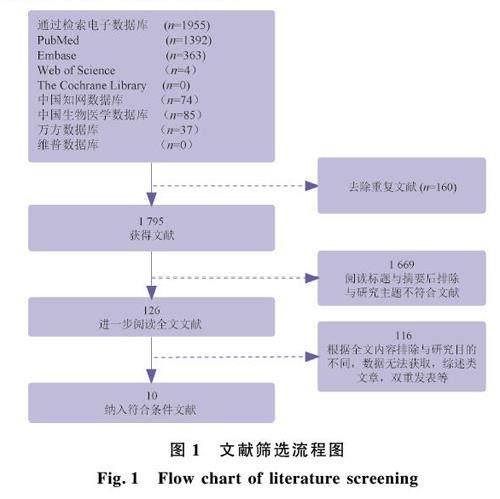
通过计算机的初步检索,共检索到1 955 篇文献,通过去除重复文献、阅读标题、摘要以及全文对文献进行筛选,初步纳入符合标准的有15 篇文献,有5 篇因发表时间过于久远未获取到全文[15-19] , 故排除, 本文最终纳入10 篇文献[13,20-28] 。具体流程见图1。
2. 2 文献质量评价结果
采用ToxRTool 评价标准[9,11] 对纳入的10 篇文献进行质量评价,文献均符合“红色标准”。其中4 篇文献涉及体外实验[13,20-21,24] ,4 篇文献得分均≥15 分,为可靠无限制类数据;7 篇文献报道体内实验[22-28](有1 篇文献既报道体内实验又包含体外实验),文献得分均≥18 分,风险相对低,纳入分析文章类型、质量评价所得分数及评价,见表1。
2. 3 体外细胞恶性转化实验
纳入文献中有4 篇文献报道了体外细胞恶性转化实验。根据方法部分提供的公式计算的剂量,利用卡方检验,检验Little(1986)[20] 所报道的,相同剂量不同暴露持续时间foci/ dishes 有无差异,卡方检验结果见表2,尚不能认为相同剂量,不同暴露时间对细胞造成的生物效应不同。
2. 3. 1 细胞受照剂量与细胞存活分数(SurvivingFraction)方程的拟合
利用Little ( 1986)[20] , Little 等( 1988) [21] ,Yamaguchi 等(1989) [13] 数据,以剂量为自变量,细胞存活分数的自然对数值(lnSF)为因变量进行回归分析并拟合方程(37 ℃ 培养)。回归模型F =135. 751, P<0. 001,建立的回归模型有统计学意义,所拟合直线方程为lnSF = 0. 047-0. 270D(P <0. 001), R2 = 0. 850,说明直线方程拟合效果较好。将纳入文献已报道的方程与本次拟合的方程进行对比, 本次拟合直线结果与Yamaguchi 等(1989) [13] 所拟合直线(红色直线lnSF = 0. 6062-0. 4381D),在同一坐标系绘制如图2。
2. 3. 2 细胞受照剂量与细胞恶性转化分数(foci/dishes)方程的拟合
将Little(1986) [20] ,Little 等(1988) [21] 报道数据,以细胞受照剂量为自变量与细胞恶性转化分数(foci/ dishes)为因变量进行线性回归分析并拟合方程,回归模型F = 86. 779, P<0. 001,建立的回归模型有统计学意义, 所拟合直线方程为y =0. 205+0. 195x, R2 = 0. 853,说明直线方程拟合效果较好。将纳入文献已报道的方程与本次拟合的方程进行对比。本次拟合直线结果与邹淑爱(1992)所拟合直线在同一坐标系绘制,见图3。Yamaguchi 等(1989) [13] 也报道了细胞受照剂量与细胞恶性转化方程(lny = -9. 986 2+0. 762 3x)。
2. 3. 3 细胞受照剂量与细胞恶性转化风险的剂量反应关系Meta 分析
细胞受照剂量与细胞恶性转化风险的剂量反应关系的研究,报道标准误或置信区间的,共两篇文章3 个研究[20-21] ,共1 241 个培养皿数。研究结果中3 个研究无明显异质性( Q = 8. 44, P =0. 67)。采用固定效应模型进行合并,建立非线性固定效应模型,利用限制性立方样条( Restrictedcubic spline)来作为链接函数[13] ,剂量区间采用百分位数法,结果见图4。
由于上述剂量反应关系Meta 分析只纳入两篇文献,本研究又将报道细胞恶性转化的文章,进行整合,以对照组恶性转化率为对照(RR = 1),计算不同剂量下的RR 值,将得到的RR 值取自然对数,见表3。
2. 4 体内实验
所纳入的10 篇文献中,有7 篇报道了整体动物体内实验[22-28] 。
2. 4. 1 腹腔注射生存状况分析
纳入文献中,有3 篇文献报道了腹腔注射后的生存状况,整理各实验的生存率及中位或平均生存期,见表4。可见报道放射性活度与鼠生存状况的文献不多,但是随着放射性活度的增大,观察到鼠中位或平均生存期或生存率降低。
2. 4. 2 腹腔注射诱导鼠产生全身肿瘤的状况
有2 篇文献报道了腹腔注射诱导鼠产生全身肿瘤的状况[22,26] ,基本特征见表5。对Johnson 等(1995)[26] 报道的腹腔注射后鼠终生肿瘤发病情况,进行卡方检验,χ2 = 138. 289,P <0. 001,可以认为各剂量组肿瘤发病率不同或不全相同,为明确哪些剂量组发病率不同,采用卡方分割,进行两两比较,Bonferroni 法调整P 值,见表6。90 MBq 与180 MBq 组肿瘤发病率无统计学差异, 这与Seyama 等[22] 文中得出的500 天后,除对照组外各组(>140 MBq)的肿瘤发病率无较大差异一致。
2. 4. 3 经口摄入氚水致肿瘤发病风险分析
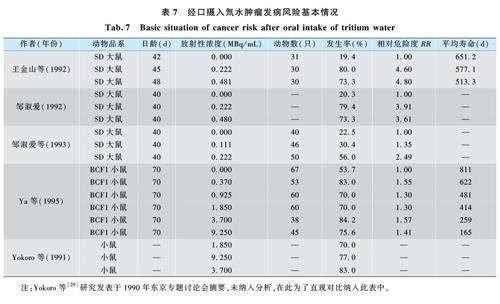
有4 篇文献报道了经口摄入氚水致肿瘤发病风险。Yokoro 等[29] 研究发表在1990 年东京专题讨论会摘要中,由于关键信息缺失,未纳入此研究,为了直观展示数据仍将其研究数据放入图表中。由于经口摄入氚水的放射性浓度不同,其平均寿命不同,也影响终生肿瘤发病风险,故描述不同放射性浓度氚水喂养下的平均寿命;由于文献中实验所用鼠品系也不尽相同,其自发肿瘤风险亦不相同,以同一研究对照组的发病率为参照,计算同一研究不同剂量组的肿瘤发病风险,进行统计描述,见表7。将经口摄入氚水放射性浓度置于X 轴,肿瘤发生率置于Y 轴,绘制散点图,见图5。散点图显示在较低浓度下,终生肿瘤发生率增加的很快,反而浓度高还有下降趋势,结合分析鼠的生存时间,可能因放射性浓度过高导致鼠过早死亡,产生了放射性浓度越高鼠肿瘤率下降的假象。同时,对纳入文献中,描述最低放射性浓度的研究(邹淑爱等,1993)进行卡方检验,χ2 = 12. 889,P =0. 002,差异有统计学意义,可以认为各组的肿瘤发病率不等或不全相等。采用卡方分割,进行两两比较,Bonferroni 法调整P 值,结果显示,对照组和0. 11 MBq/ mL 组,差异无统计学意义。
3 讨论
除未查找到全文5 篇外,本研究共纳入10 篇文献,论文质量均较高,但是纳入的最近的一篇文献为2002 年发表,时间也较久远,说明最近发表氚对鼠致癌作用的文章较少。10 篇文章中只有3篇中文文章,中文文章所占比例也较小,说明国内本领域的实验还较少。
3. 1 体外细胞恶性转化实验
3. 1. 1 细胞受照剂量与细胞生存分数(Surviving Fraction)的关系
在探索细胞受照剂量与细胞生存分数(Surviving Fraction)的关系中,所拟合直线方程为lnSF = 0. 047-0. 270D(P<0. 001),R2 = 0. 850,直线方程拟合效果较好,Yamaguchi 等[13] 所报道的拟合直线为较高剂量下所拟合的直线,在低剂量下生存率并不太符合Little 等[20] 的结果;本次拟合直线截距为0. 05,比较符合纳入文献所报道对照组的细胞生存分数。
单从生存分数与辐射剂量散点图上来看,剂量在2 Gy 以内,随着剂量升高,生存分数降低的较慢;剂量在2~4 Gy 时,随着剂量升高,生存分数降低的较快;剂量大于4 Gy 时,随着剂量升高,生存分数降低又较慢。
3. 1. 2 细胞受照剂量与细胞恶性转化分数(foci/dishes)的关系
在探索细胞受照剂量与细胞恶性转化分数(foci/ dishes) 的关系中, 所拟合直线方程为y =0. 205-0. 195x(P<0. 001),R2 = 0. 853,直线方程拟合效果极好。由于不同研究细胞恶性转化分数的测量计算方法有所差异及所用细胞系、培养时间存在差异,导致各研究所得方程有所差异。纳入文献研究大多集中在0~1 Gy 之间,同一剂量下的恶性转化分数也不尽相同。但是和邹淑爱[24] 与Yamaguchi 等(1989)[27] 研究一致,随着剂量升高,细胞恶性转化率也明显升高。
3. 1. 3 细胞受照剂量与细胞恶性转化风险的关系
在细胞受照剂量与细胞恶性转化风险的关系中,表3 结果和剂量反应关系Meta 分析所得总体趋势一致。细胞受照剂量与细胞恶性转化风险在2 Gy 内尤其在1 Gy 内增长的极快,在大于2 Gy后依然呈上升趨势,但上升较缓慢。
3. 2 体内实验
3. 2. 1 腹腔注射生存状况分析
纳入放射性活度与鼠生存状况的文献不多,但是随着放射性活度的增大,观察到鼠中位或平均生存期或生存率降低,甚至在740 MBq 及以上的放射活度氚水的注射下,鼠未生存到处理后的半个月。Brues 等[30] 通过给予小鼠单次注射0. 126~ 8. 4 GBq HTO 来研究氚的致死性,LD50/ 30(在30 天内造成50%群体死亡的剂量)约为9 Gy,对应于体重为37 MBq/ g 的氚的初始活性浓度。可见氚导致鼠生存状况下降是确切的。
3. 2. 2 腹腔注射诱导鼠产生全身肿瘤的状况
在腹腔注射诱导鼠产生全身肿瘤的状况中,Johnson 等(1995) [26] 文中,90 MBq 与180 MBq 组肿瘤发病率无统计学差异,这与Seyama 等[22] 文中得出的500 天后,除对照组外各剂量组的肿瘤发病率无较大差异一致,即在注射90 MBq 的氚水,效应(癌症发病率) 似乎已接近饱和;Yin 等人[28]使用11 日龄雄性和雌性C3H / HeN 幼崽小鼠,每只小鼠单次腹腔注射0. 23、0. 92 和3. 70 MBq 的氚水,然后观察14 个月的肿瘤发展,在雄性小鼠中,发现肝脏肿瘤的发病率显著增加,而在雌性小鼠中,仅在高剂量的雌鼠中,观察到卵巢肿瘤的发病率显著升高。说明氚导致的全身肿瘤发病率升高的结论似乎是可信的,并且各种肿瘤的发病率可能不同。
3. 2. 3 经口摄入氚水致肿瘤发病风险分析
散点图显示在较低浓度下,终生肿瘤发病率增加的很快,反而浓度高还有下降趋势,分析鼠的生存时间,可能因浓度过高导致鼠过早死亡,产生了浓度越高鼠肿瘤率下降的假象。纳入Yamamoto等人[27] 报告的研究,对雌鼠(C57BL/ 6 N)连续口饲5 种水平的HTO, 软组织剂量率为0. 01 ~0. 24 Gy/ d,在最低剂量率(0. 01 Gy/ d)下,终生肿瘤发病率已接近最高水平(83%),而自发发病率为54%,暴露在大剂量下加速了大多数肿瘤的发展,从而导致寿命大大缩短。Balonov 等人[31] 的一篇论文总结了俄罗斯对氚致癌性的研究,小鼠和大鼠在饮用水中给予HTO,剂量范围为0. 24 ~25. 3 Gy, 尽管大多数恶性肿瘤增加,但由于缺乏阳性或阴性对照,使得这些数据难以解释。对报道鼠经口摄入最低剂量的文献( 邹淑爱等,1993[25] )进行卡方检验P = 0. 002,差异有统计学意义,采用卡方分割,结果显示,对照组和0. 111MBq/ mL 组,差异无统计学意义,即经口摄入氚水放射性浓度111 MBq/ L 组和对照组,鼠终生肿瘤发病率无统计学差异。我国《生活饮用水卫生标准》(GB 5749—2022)[32] 中,饮用水中总β 放射性指导值为1 Bq/ L,可见指导值还是比较安全的。但是111 MBq 放射性浓度依然较大,人类日常几乎不能接触到,低放射性浓度摄入文献较少,经口摄入低浓度氚水的致癌效应还需持续关注。Straume[33] 对暴露于氚的风险(包括诱发癌症) 进行了文献综述,他指出由于人类无法获得相关信息,氚的致癌风险估计主要来自实验动物(主要是鼠)研究。
4 小结
本文采用了无阈模式对氚水致癌效应进行系统评价。而辐射致癌效应大致分为三种剂量效应曲线:线性无阈模式、有阈模式、兴奋效应模式。
有关辐射致癌剂量反应模型的争论也比较大,刘树铮等[34] 对低水平致癌效应阈值问题做了综述,他指出线性无阈假说与不断积累的科学资料不大适应,也有不少人群调查和科学资料提示辐射致癌有剂量阈值,同时也有资料显示低水平辐射可能产生对机体有益的效应。但未得到公认确切结论之前从辐射防护的实际出发,国际放射防护委员会(ICRP)从谨慎角度出发,继续沿用线性无阈模型[35-36] ;同时,美国环保署(EPA) 在进行致癌风险评估时,依旧采用线性无阈模型[37] 。本文研究鼠的致癌效应,对于人体辐射暴露不应掉以轻心, 也不应“ 谈核色变”, 形成“ 辐射恐怖”(radiophobia)。
本文较为系统的从体内和体外(细胞和整体动物)两个层面评价了鼠摄入氚水与致癌效应的关系,而在此之前没有系统的、较全面的研究,将以往发表的文献整合和系统评价,将以往数据拟合方程并进行剂量反应关系的Meta 分析等。通过拟合方程,Meta 分析评价两者之间的关系,并且评价了致癌有关风险。
本文也存在不足之处,文献检索仅限几个数据库,存在灰色文献未纳入分析,同时其他国家的数据库中,其他语言可能有较多符合标准文献,如日本和俄罗斯,有5 篇文献未查找到全文,并且我们纳入的文献集中在2000 年以前。本文只研究全身肿瘤发病情况,对于发生肿瘤的种类、良惡性程度,并未做相关研究。而且,本研究只研究动物实验且剂量或放射性浓度较大,因而对人类参考有限。
总之,氚水(HTO) 不论对细胞还是对整体动物的致癌效应是确切的,并且导致了生存状况的下降。但低剂量氚摄入的致癌效应,还有待进一步研究。
参考文献:
[ 1 ] 程卫亚,陈连杰,许慧萍,等. 某设施净化后含氚废水生态排放环境影响研究[J]. 中国辐射卫生,2020,29(5):550-554.
CHENG Weiya, CHEN Lianjie, XU Huiping, et al. Study on environmental impact of ecological discharge of Tritiumcontaining wastewater after purification in a facility[J]. Chin J Radiol Health, 2020, 29(5):550-554.
[ 2 ] Eyrolle F, Ducros L, Le Dizès S, et al. An updated review on tritium in the environment [J]. J Environ Radioact, 2018,181: 128-137.
[ 3 ] Jacobs D G. Sources of tritium and its behavior upon release to the environment [Z]. U. S. Atomic Energy Commission,Division of Technical Information, Tennessee, 1968.
[ 4 ] Soyfer V N, Goryachev V, Vakulovsky S,et al. Tritium studies of russia's natural waters[R]. Geos, Russia, 2007.
[ 5 ] 李圣日, 崔凤梅, 刘玉龙, 等. 氚水致癌、致突变和致畸效应研究进展[J]. 辐射防护通讯, 2019, 39(5):32-35.
LI Shengri, CUI Fengmei, LIU Yulong, et al. Advances in research on carcinogenic, mutagenic and teratogenic effects of tritiated water[J]. Radiation Protection Bulletin, 2019, 39(5):32-35.
[ 6 ] 武佳铭. 可控核聚变的研究现状及发展趋势[J]. 电子世界, 2017 (21) : 9-13.
WU Jiaming. Research status and development trend of controllable nuclear fusion [J]. Electronics World, 2017 (21) :9-13.
[ 7 ] 张蒙, 崔凤梅, 涂彧, 等 . 氚水的环境排放及生物学效应研究进展[J]. 中国辐射卫生, 2018, 27(4):302-305.
ZHANG Meng, CUI Fengmei, TU Yu, et al. Research progress on environmental emission and biological effects of tritiated water [J]. Chin J Radiol Health, 2018, 27(4):302-305.
[ 8 ] 杨克虎, 马彬. 系统评价/ Meta 分析在基础医学领域的应用[M]. 兰州:兰州大学出版社, 2018:173-174.
YANG Kehu, MA Bin. Application of systematic review/ Meta analysis in the field of basic medicine [ M]. Lanzhou:Lanzhou University Press, 2018:173-174.
[ 9 ] 王媛媛, 秦刚, 汪徐林, 等. GetData Graph Digitizer 软件在生存分析中的应用[J]. 中国卫生统计, 2016, 33(2):339-342.
WANG Yuanyuan, QIN Gang, WANG Xulin, et al. Application of GetData Graph Digitizer software in survival analysis[J]. Chinese Journal of Health Statistics, 2016, 33(2):339-342.
[10] 李敏, 徐海濱, 何来英. 基于管理毒理学的毒性实验数据的系统评价[J]. 中国食品卫生杂志, 2012, 24(2):140-144.
LI Min, XU Haibin, HE Laiying. Systematic evaluation of toxicity test data based on management toxicology [J]. Chinese Journal of Food Hygiene, 2012, 24(2):140-144.
[11] Klimisch H J, Andreae M, Tillmann U. A systematic approach for evaluating the quality of experimental toxicological and ecotoxicological data [J]. Regul Toxicol Pharmacol, 1997, 25(1): 1-5.
[12] 赵霏, 唐晓宇, 寇城坤, 等. 动物实验系统评价/ Meta 分析的质量和报告特征[J]. 中国循证医学杂志, 2018, 18(8):871-877.
ZHAO Fei, TANG Xiaoyu, KOU Chengkun, et al. Systematic evaluation of animal experiments/ quality and reporting characteristics of Meta analysis [J]. Chinese Journal of Evidence-Based Medicine, 2018, 18(8):871-877.
[13] Yamaguchi T, Yasukawa M, Terasima T, et al. Induction of malignant transformation in mouse 10T1/ 2 cells by low-doserate exposure to tritiated water and gamma-rays at two different temperatures, 4 degrees C and 37 degrees C [J]. J Radiat Res, 1989, 30(1):112-121.
[14] 罗美玲, 林希建, 刘如春, 等. 剂量反应关系Meta 分析在Stata 软件中的实现[J]. 循证医学, 2014, 14(3):182-187.
LUO Meiling, LIN Xijian, LIU Ruchun, et al. Realization of dose-response relationship Meta analysis in Stata software[J]. The Journal of Evidence-Based Medicine,2014, 14(3):182-187.
[15] Moisoi N, Petcu I. A bone marrow peroxidation study on low-dose irradiated rats[J]. Nutrition, 1995, 11(Suppl 5):585-587.
[16] Lambert B E, Phipps M L. Some effects of irradiation of mice in utero with tritiated compounds [J]. Curr Top Radiat Res Q, 1978, 12(1-4): 197-211.
[17] Mewissen D J, Furedi M, Ugarte A, et al. Comparative incorporation of tritium from tritiated water versus tritiated thymidine, uridine or leucine [J]. Curr Top Radiat Res Q, 1978, 12(1-4): 225-254.
[18] Revina V S, Voronin V S, Lemberg V K, et al. Comparative evaluation of the carcinogenic effects of chronic exposure to tritium oxide and external gamma-radiation [J]. Radiobiologiia, 1984, 24(5): 697-700.
[19] Mwissen D J, Rust J H, Rust J. Comparative incidence of reticuloendothelial tumors in C57BL mice after exposure to tritiated water[J]. C R Seances Soc Biol Fil, 1987, 181(4):439-444.
[20] Little J B. Induction of neoplastic transformation by low-dose-rate exposure to tritiated water [J]. Radiat Res, 1986, 107(2): 225-233.
[21] Little J B, Vetrovs H. Studies of ionizing radiation as a promoter of neoplastic transformation in vitro [J]. Int J Radiat Biol Relat Stud Phys Chem Med, 1988, 53(4): 661-666.
[22] Seyama T, Yamamoto O, Kinomura A, et al. Carcinogenic effects of tritiated water (HTO) in mice: In comparison to those of neutrons and gamma-rays [J]. J Radiat Res, 1991, 32(Suppl 2): 132-142.
[23] 郭豐莉, 王丽娟, 王金山. 大鼠长期摄入氚水对寿命和肿瘤发病率的影响[J]. 癌变·畸变·突变, 1992(3):1-4+61.
GUO Fengli, WANG Lijuan, WANG Jinshan. Effects of long-term intake of tritiated water on longevity and tumor incidence in rats [J]. Carcinogenesis,Teratogenesis & Mutagenesis, 1992(3):1-4+61.
[24] 邹淑爱. 氚水生物学效应研究[J]. 辐射防护通讯, 1992, 12(4):46-52+43.
ZOU Shuai. Study on biological effects of tritium water [J]. Radiation Protection Bulletin, 1992 12(4):46-52+43.
[25] 邹淑爱, 李茂河, 王蕙, 等. 大鼠长期饮用氚水的致癌效应研究[J]. 辐射防护, 1993, 13(1):64-67+71.
ZOU Shuai, LI Maohe, WANG Hui, et al. Study on the carcinogenic effect of long-term drinking tritium water in rats[J]. Radiation Protection, 1993, 13(1):64-67+71.
[26] Johnson J R, Myers D K, Jackson J S, et al. Relative biological effectiveness of tritium for induction of myeloid leukemia in CBA/ H mice[J]. Radiat Res, 1995, 144(1): 82-89.
[27] Yamamoto O, Seyama T, Jo T, et al. Oral administration of tritiated water (HTO) in mouse. II. Tumour development[J]. Int J Radiat Biol, 1995, 68(1): 47-54.
[28] Yin H, Bhattacharjee D, Roy G, et al. Tumorigenesis in infant C3H/ HeN mice exposed to tritiated water (HTO) [J]. J Radiat Res, 2002, 43(4): 345-351.
[29] FRY R J. Radiation carcinogenesis in the whole-body system [J]. Radiat Res, 1991, 126(2): 157-161.
[30] Brues A M, Stroud A N, Rietz L. Toxicity of tritium oxide to mice [J]. Proc Soc Exp Biol Med, 1952, 79(1): 174-176.
[31] Balonov M I, Muksinova K N, Mushkacheva G S. Tritium radiobiological effects in mammals: review of experiments of the last decade in Russia [J]. Health Phys, 1993, 65(6): 713-726.
[32] 國家卫生健康委员会. 生活饮用水卫生标准:GB 5749—2022 [S]. 北京:中国标准出版社,2022.
[33] Straume T. Tritium risk assessment [J]. Health Phys, 1993, 65(6): 673-682.
[34] 刘树铮. 低水平辐射致癌效应的阈值问题[J]. 辐射防护, 2008, 28(6):349-361.
LIU Shuzheng. Threshold of carcinogenic effect of low-level radiation [J]. Radiation Protection, 2008, 28(6):349-361.
[35] International Committee of Radiological Protection. Non-stochastic effects of ionising radiation[R]. ICRP Publication 41.ICRP, 1984.
[36] International Committee of Radiological Protection. The 2007 Recommendation of the International Commission onRadiological Protection[R]. ICRP Publication 103. ICRP, 2007.
[37] Calabrese E J, Golden R J. Why toxicologists resisted and radiation geneticists supported EPA'S adoption of LNT for cancer risk assessment [J]. Chem Biol Interact, 2019, 310: 108736.

