运动诱导的代谢物与脂肪棕色化的调节机制
李 林,曲雅倩,陈 敏,陈思宇,孙景权
人体主要有2 种脂肪组织:白色脂肪组织(white adipose tissue,WAT)和棕色脂肪组织(brown adipose tissue,BAT)。构成脂肪组织的脂肪细胞包括3 种类型:白色脂肪细胞(white adipose cells)、棕色脂肪细胞(brown adipose cells)和米色脂肪细胞(beige adipose cells),均由间充质干细胞(mesenchymal stem cells,MSCs)分化而来。白色脂肪细胞和米色脂肪细胞源于Myf5-前体细胞,棕色脂肪细胞与肌细胞同源于Myf5+前体细胞(黄涛 等,2016; Petrovic et al.,2010)。白色脂肪细胞广泛存在于皮下组织和内脏周围,含有储存大量甘油三酯的单脂滴,且脂滴体积占整个脂肪细胞的90%以上,线粒体数量少,主要功能是储存能量(Lee et al.,2019)。棕色脂肪细胞主要存在于颈部、锁骨上部、胸部、腋下和肩胛间等部位,细胞中含有较多的小脂滴,线粒体数量多,富含线粒体解偶联蛋白-1(uncoupling protein 1,UCP-1)。这种蛋白可使线粒体呼吸链的电子传递和三磷酸腺苷(adenosine triphosphate,ATP)生成过程进行解偶联,将脂肪酸氧化代谢产生的能量以热能的形式释放,因此,棕色脂肪组织具有产热耗能的作用(付鹏宇 等,2018; Jung et al.,2019)。米色脂肪细胞是介于白色和棕色脂肪细胞之间的细胞类型,既可以表达米色脂肪组织特有的TBX1、SLC27A1、TMEM26、CD40 和CD137 等蛋白,又可以表达白色脂肪细胞特异性蛋白[adiponectin、adipocyte protein 2 gene (AP2)和adipsin等]和棕色脂肪细胞特异性蛋白(UCP-1、CIDEA 和PGC-1α等),具有增加产热的功能(Harms et al.,2013; Kaisanlahti et al.,2019)。
在冷环境、运动和药物等因素的影响下,WAT 中白色脂肪细胞会向米色脂肪细胞转变,促进UCP-1 等棕色脂肪特异性蛋白的表达,这种现象称为脂肪棕色化(程龙等,2019)。近年来,运动训练对脂肪棕色化的影响愈发受到关注,但具体作用机制尚不明确。研究表明,运动能够引起机体血液、尿液、骨骼肌和心脏等部位中代谢组学的变化(Deda et al.,2017; Starnes et al.,2017),α-酮戊二酸、琥珀酸、乳酸等多种代谢物已被证实可以诱导脂肪棕色化的发生(Carrière et al.,2014; Mills et al.,2018; Tian et al.,2020; Wishart,2019)。可见,运动或通过诱导机体内代谢物变化参与调节脂肪棕色化进程。因此,本研究分析了运动训练对脂肪棕色化和机体内代谢物水平的影响,系统整合了代谢物诱导脂肪棕色化的生物学机制。
1 脂肪棕色化的产生机制和生理意义
1.1 诱导脂肪棕色化的生物学因素
脂肪棕色化的生物学机制涉及非常庞大和复杂的机制网络。现有研究广泛聚焦于基因转录和激素调控对脂肪棕色化的影响。在基因转录水平上,PR 结构域家族的第16 个成员转录因子(PR-domain-containing 16,PRDM16)和CCAAT/增强子结合蛋白β(CCAAT/enhancer binding proteins β,C/EBPβ)是诱导棕色脂肪细胞分化的关键分子开关(Kajimura et al.,2009);过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptors γ,PPARγ)与配体罗格列酮结合后可促进UCP-1 基因的转录(Petrovic et al.,2010);过氧化物酶体增殖物激活受体γ 共激活因子1α(peroxlsome proliferator-activated receptor-γ coactlvator-1α,PGC-1α)作为转录协同激活因子,亦可增强WAT 中UCP-1 及线粒体氧化呼吸链代谢关键酶的表达(Boström et al.,2012; Cheng et al.,2018)。在激素调控方面,白细胞介素-6(interleukin-6,IL-6)(Knudsen et al.,2014)、鸢尾素(irisin)(Boström et al.,2012)、成纤维生长因子-21(fibroblast growth factor-21,FGF-21)(王璐 等,2020; Chau et al.,2010)和心钠肽(atrial natriuretic peptide,ANP)(Carper et al.,2020)等均可促进脂肪棕色化;肾上腺素(epinephrine,E)和去甲肾上腺素(norepinephrine,NE)等儿茶酚胺类激素可通过与β3-肾上腺素能受体(β3-adrenoceptor,β3-AR)结合诱导脂肪棕色化(Choi et al.,2018; Lee et al.,2019;Wu et al.,2018)。然而,以上研究多从基因和蛋白质层面探究。鉴于代谢物可以更好地反映机体所处的环境和状态,研究也证明多种代谢物可有效诱导白色脂肪棕色化,这将为探讨脂肪棕色化机理提供新的思路。
1.2 脂肪棕色化的生理意义
脂肪棕色化作为一种适应性生热机制,对机体代谢健康有多方面的有益影响:1)增加机体能量消耗,减轻体质量。动物模型实验显示,脂肪棕色化可有效抑制高脂喂养小鼠肥胖(喻日成 等,2019; Baskaran et al.,2016)。2)提高胰岛素敏感性,改善糖耐量。有研究发现,将人类的米色脂肪细胞移植到小鼠后,其空腹血糖下降,葡萄糖耐量改善(Min et al.,2016)。3)治疗动脉粥样硬化。Roth等(2021)发现,生热脂肪的激活可降低血浆甘油三酯、总胆固醇和低密度脂蛋白,增加高密度脂蛋白以及促进动脉粥样硬化脂肪因子的分泌。4)保护心血管系统。心脏周围的脂肪组织可通过棕色化维持正常的血管紧张度和血压,调节心血管的舒张和收缩功能,从而产生心血管保护效应(Aldiss et al.,2017)。总之,脂肪棕色化可促进机体能源分解,有利于能量输出,进而改善上述代谢障碍疾病。然而,这种作用在烧伤、癌症和心脏病等超代谢疾病状态下会对机体产生有害影响,导致恶病质、肌肉萎缩、动脉粥样变形和肝硬化等发生,其与脂肪棕色化引起机体能量过度消耗相关(Abdullahi et al.,2016)。因此,对待脂肪棕色化应注意区分不同的生理状态,综合看待其生理意义。
可见,脂肪棕色化受多种因素影响,既包括PRDM16、C/EBPβ、PPARγ 和PGC-1α 等转录因子的调控,又包括IL-6、Irisin、FGF-21 和ANP 等蛋白质类激素以及E 和NE等儿茶酚胺类激素的调节,多种代谢物也会对其产生重要影响(图1)。白色脂肪棕色化对机体代谢的影响重大,未来研究应辩证性地思考脂肪棕色化的生理意义,积极探求脂肪棕色化的上下游机制,寻找不同的干预手段诱导脂肪棕色化,从而促进形成人体健康的最佳平衡点。
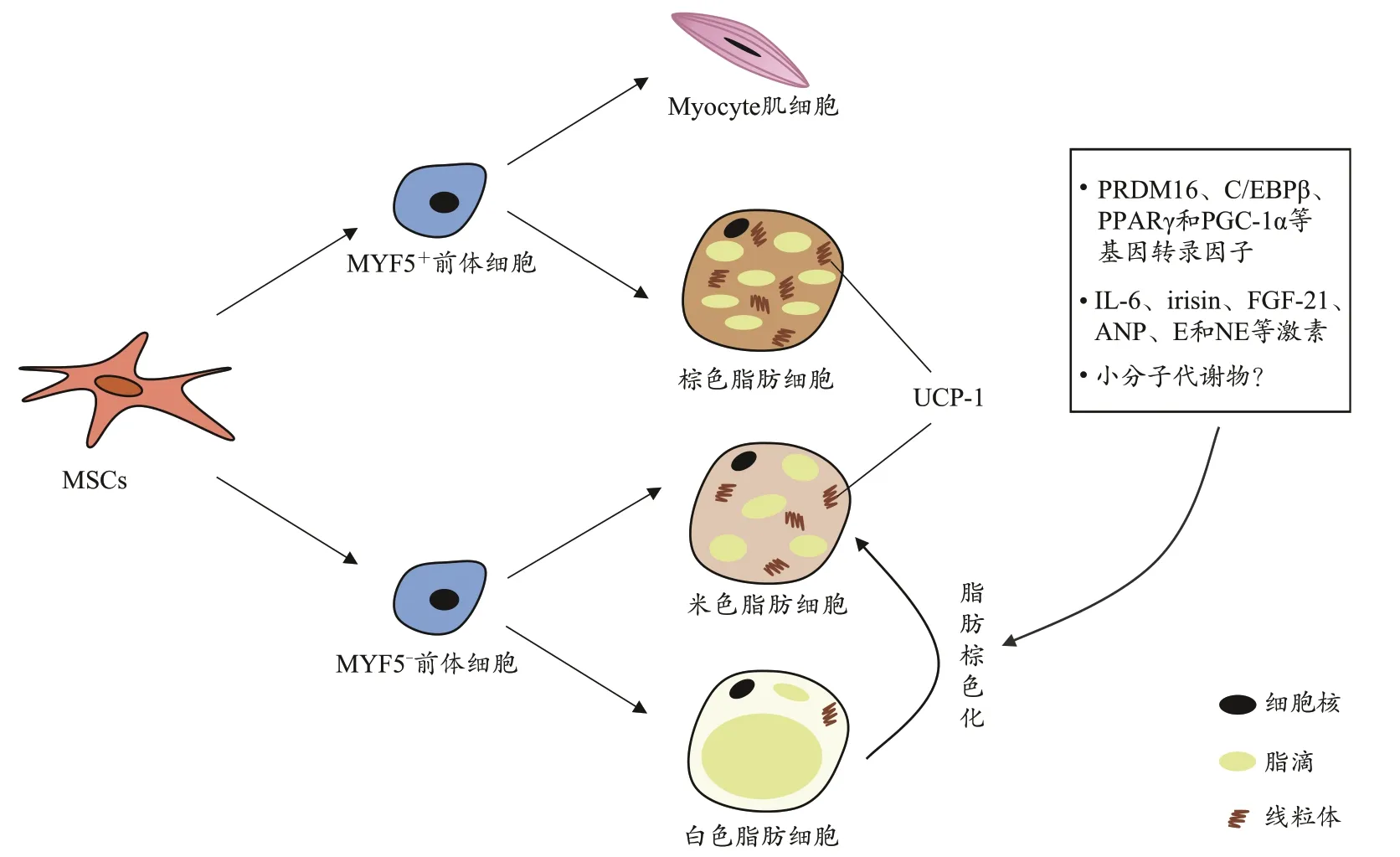
图1 脂肪细胞概况及诱导白色脂肪棕色化的生物学因素Figure 1.Profile of Adipose Cells and the Biological Factors of Inducing White Adipose Browning
2 运动对脂肪棕色化的影响
Stallknecht 等(1991)发现,运动训练会使大鼠的白色脂肪细胞匀浆变为棕色,并将这种变化归功于运动诱导WAT中线粒体酶活性的增加。Oh 等(2007)发现,6 周游泳运动可增加小鼠WAT 中UCP-1 的mRNA 和蛋白质表达水平。诸多啮齿类动物实验研究证实,不同的运动形式(跑台运动、游泳、抗阻运动等)和不同的运动周期(4~12 周)均能诱使动物模型发生白色脂肪棕色化,具体指标包括棕色及米色特异性标志物表达量增多(UCP-1、CIDEA、PRDM16、PGC-1α、Dio2 和Cox8b 等),脂肪细胞直径减小等(杨星雅等,2017; 郑佳伟 等,2020; Amano et al.,2020; Barbosa et al.,2018; Khalafi et al.,2020; Picoli et al.,2020)。
尽管运动对啮齿类动物脂肪棕色化的作用非常明显,但相关人体实验研究尚未形成统一的结论(表1)。有研究表明,受试进行12 周的自行车训练后,皮下WAT 中UCP-1、TBX1 和CPT1 等基因表达显著增加,即长期有氧运动可诱导人体发生脂肪棕色化(Otero-Diaz et al.,2018)。Tanaka 等(2020)分析了319 名成年健康男、女性的身体活动水平和棕色脂肪组织密度之间的关系,发现经常进行高强度体力活动者的BAT 密度较高(男性尤其明显),这说明高强度运动与棕色脂肪密度之间确实存在关联。但Norheim 等(2014)发现,有氧训练和力量训练并未有效促进成年男性皮下WAT 中UCP-1 蛋白表达量的增加。亦有研究表明,6 周或6 个月的有氧运动均未能明显改变人体皮下WAT 中棕色化特异性基因的表达(Ronn et al.,2014;Tsiloulis et al.,2018)。因此,运动对人体脂肪棕色化的作用尚待进一步确定,这可能与人群实验样本单一、样本量小、可控性差和偶然性高等因素有关。例如,大部分研究对象是男性,而Scalzo 等(2014)的研究表明,女性的WAT较男性有更大的棕色化反应。另外,棕色化基因在人体内脏WAT 中的表达较高,而目前大多数研究聚焦于皮下WAT(Zuriaga et al.,2017)。因此,未来研究应进一步探讨不同的运动类型、强度和时间等对不同受试和不同脂肪组织部位的影响,以期验证运动锻炼对人体脂肪棕色化的积极作用。

表1 运动影响脂肪棕色化的人体实验研究Table 1 The Human Experiments of Exercise-Induced Adipose Browning
3 运动对机体循环系统中代谢物含量的影响
虽然运动对各种代谢、炎症、心血管以及其他系统的有效性已被广泛证实,但其相关的分子作用机制尚未完全阐明。代谢物是下游生化过程的终点,代谢组学数据可以提供有关身体活动、药理学治疗、营养干预和其他生物影响的宝贵信息,为运动人体科学的研究提供全新视角(黄彩华 等,2011; Sakaguchi et al.,2019)。本研究整理了已发表的4 篇一次性运动(包含耐力和抗阻运动)对人体循环系统(血液)中代谢组含量变化的研究(表2),以探究运动对机体循环系统代谢物的影响(Contrepois et al.,2020; Karl et al.,2017; Peake et al.,2014; Stander et al.,2020)。
关于运动诱导的人体血液中代谢组学研究尚处于初步阶段,多数研究的样本量较少,因此,表2 纳入的研究未设置最小样本阈值。本研究发现,一次性运动均会增加糖代谢产物(葡萄糖、丙酮酸等),而中强度耐力训练对乳酸的影响不大;对于氨基酸代谢,有研究表明,一次性运动后氨基酸代谢增强,但也有研究对不同种类氨基酸的变化方向存在矛盾,这可能与实验设计、实验环境等因素不同相关;对于脂代谢的研究较为一致,体现在一次性运动后游离脂肪酸的上升和脂质的下降,但在一项马拉松实验中发现,运动后即刻游离脂肪酸含量下降,48 h 后才略有增加,这可能与长时运动中的能量消耗相关;三羧酸(tricar boxylic acid,TCA)代谢产物在不同的实验研究中均呈现增加趋势(表2)。因此,不同的运动类型引起的趋势大体一致,但不同运动类型和不同时长等因素会引起个别代谢物呈现不同的变化方向,恢复到基线的时间也大不相同。
4 运动调节代谢物诱导脂肪棕色化的可能生物学机制
脂肪棕色化的本质是特异性基因的选择性表达,生物体内的代谢物作为信号分子,可通过影响不同的信号通路对其进行调控。本研究发现,糖酵解代谢产物乳酸、氨基酸代谢产物犬尿喹啉酸和β-氨基异丁酸、TCA 循环代谢产物琥珀酸和α-酮戊二酸等可通过不同的机制诱导脂肪棕色化(图2)。

图2 代谢物诱导脂肪棕色化的生物学机制Figure 2.Biological Mechanisms of Adipose Browning Induced by Metabolites
琥珀酸(succinate)是TCA 循环中极其重要的代谢中间物,琥珀酸脱氢酶(succinate dehydrogenase,SDH)是TCA循环中唯一位于线粒体内膜的酶(真核生物)。在线粒体内,琥珀酸可通过与SDH 结合,将呼吸链传递与氧化磷酸化过程紧密连接起来(Murphy et al.,2018)。研究表明,肌细胞中的琥珀酸可在酸性条件下,通过单羧酸转运蛋白1(monocarboxylate transporter 1,MCT1)的转运进入血液循环,运动可以有效促进琥珀酸在骨骼肌和血液循环中含量的增加(Reddy et al.,2020)。在脂肪细胞内,线粒体中的琥珀酸可以通过SDH 的氧化分解作用诱导活性氧(reactive oxygen species,ROS)的产生(Mills et al.,2018),而ROS 可通过亚磺酰化UCP-1 的第253 位半胱氨酸激活UCP-1(Chouchani et al.,2016)。还有研究表明,琥珀酸-SUNCR1(琥珀酸的内源性配体)轴同样调节冷诱导的脂肪组织棕色化(Keiran et al.,2019)。另有研究发现,琥珀酸处理后脂肪源性干细胞出现明显的棕色化倾向,PI3KAKT 通路和AMPK 通路增强(Liu et al.,2020)。这两种通路均可上调产热基因的表达(Jeong et al.,2017)。其中,SUNCR1 是否参与脂肪细胞中AMPK 通路、PI3K-AKT 通路的信号调控有待进一步研究。
α-酮戊二酸(α-ketoglutaric acid,AKG)是TCA 循环的中心物质,也是氨基酸和碳水化合物代谢的桥梁(陈家顺等,2018)。Zhang 等(2019)表明,大鼠一次性跑步运动后腓肠肌组织液中AKG 水平上升约59%,血浆中AKG 水平增加23%~54%。还有研究发现,棕色脂肪形成过程伴随AKG 水平增加,这是因为棕色脂肪分化关键基因PRDM16启动子DNA 去甲基化过程需要AKG 的参与(Tian et al.,2020; Yang et al.,2016)。这表明了AKG 诱导脂肪棕色化发挥的重要作用。Yuan 等(2020)表明,AKG 可通过与肾上腺表达的受体OXGR1(GPR99)结合,促进肾上腺素的释放,作用于脂肪组织中表达的β3-AR 受体,引起脂肪棕色化。这些研究均说明AKG 在诱导脂肪棕色化中的重要作用。
色氨酸(tryptophan,TRP)在生物体内首先分解为犬尿氨酸(kynurenine,KYN),而KYN 与中枢神经系统的相关疾病发生有关。运动能促使骨骼肌中的KYN 转化为犬尿喹啉酸(kynurenic acid,KYNA),KYNA 不能穿越血脑屏障,可保护大脑免受KYN 的危害(Agudelo et al.,2014)。人体实验显示,公路自行车运动后,人体血浆KYNA 浓度增加63%;马拉松运动后,人体KYNA 浓度升高125%(Schlittler et al.,2016)。后续研究发现,长期KYNA 处理可诱导WAT 中UCP-1、PGC-1α、PRDM16 和CIDEA 等特异性基因增加,其受体GPR35 缺失则抑制KYNA 的这种作用(Agudelo et al.,2018)。
β-氨基异丁酸(β-aminoisobutyric acid,BAIBA)是骨骼肌分泌的一种非蛋白氨基酸,由胸腺嘧啶和缬氨酸代谢分解而来(Tanianskii et al.,2019)。研究发现,运动锻炼可有效增加机体血浆中BAIBA 的浓度(Stautemas et al.,2019)。BAIBA 处理会使脂肪细胞的脂滴数量增加和表面积减少,UCP-1、CIDEA 和PRDM16 等基因表达水平显著上调,表明BAIBA 具有诱导脂肪棕色化的作用(Colitti et al.,2018)。Roberts 等(2014)发现,BAIBA 可显著增加白色脂肪细胞中PPARα 的mRNA 表达。PPARα 是促进UCP-1 蛋白表达的关键转录基因(Komatsu et al.,2010)。
乳酸(lactate)是运动过程中糖酵解代谢的重要产物,其血液浓度一直被视为判断疲劳和恢复程度的重要标志物(赵海涛 等,2021)。乳酸不是简单的代谢废物,在生物体内起着重要的信号传递作用(Brooks,2020)。Carrière等(2014)表明,乳酸可通过单羧酸转运蛋白(MCTs)出入细胞,在PPARγ 信号的参与下促进UCP-1 的蛋白表达。这种作用可能是NADH/NAD+升高导致的,表明脂肪细胞棕色化可能是减轻氧化还原压力的一种适应性机制。另有研究发现,乳酸作用于脂肪细胞后,可通过激活P38-MAPK 信号通路促使成纤维细胞生长因子-21(FGF-21)分泌增加(Jeanson et al.,2016)。FGF-21 可以通过自分泌或旁分泌方式作用于WAT 诱导脂肪棕色化(Rodriguez et al.,2017)。
综上所述,运动可促进骨骼肌将琥珀酸、α-酮戊二酸、犬尿喹啉酸、β-氨基异丁酸和乳酸等代谢物释放到血液中,使其经由血液循环到达全身,通过不同的生物学机制上调WAT 中UCP-1、PRDM16 和PGC-1α 等特异性基因的表达,诱导脂肪棕色化的发生,进而有效促进生物体的能量消耗,改善肥胖和糖尿病等疾病的发生(图2)。
5 结论
在运动训练的影响下,白色脂肪组织可以通过脂肪棕色化对机体的能量代谢和产热进行适应性调节。目前研究发现,参与运动促进白色脂肪棕色化进程的代谢物包括TCA 循环代谢中间物琥珀酸和α-酮戊二酸、氨基酸代谢物犬尿喹啉酸和β-氨基异丁酸、糖酵解代谢物乳酸等。这些代谢物的积累可通过不同的机制通路诱导脂肪棕色化,改善脂肪代谢。深入探讨代谢物参与的运动促进脂肪棕色化的生物学机制,有助于进一步明确运动改善机体代谢稳态、缓解肥胖及慢性疾病症状的作用,这可能为探讨运动治疗肥胖、改善健康的机制探寻到新靶点。

