SIRT1介导间歇性禁食改善高脂饮食诱导的肥胖小鼠脂肪组织线粒体功能和炎症状态
邓小杰?王甜?徐芬?梁华
【摘要】目的 探讨间歇性禁食对高脂饮食诱导的肥胖小鼠白色脂肪组织线粒体功能和炎症状态的影响以及沉默信息调节因子2相关酶1(SIRT1)在其中的作用。方法 将5~6周龄雄性C57BL/6小鼠随机分为普通自由饮食组(CD组)、高脂自由饮食组(HFD组)和高脂间歇性禁食组(HFD-IF组,隔日禁食24 h),每组各5只,喂养12周。用HE染色观察各组小鼠白色脂肪组织情况,并检测白色脂肪SIRT1、磷酸化腺苷酸活化蛋白激酶(p-AMPK)、叉头转录因子1(FOXO1)、线粒体功能和炎症相关基因的表达情况。在小鼠尾静脉注射腺相关病毒(AAV)-shSirt1敲减SIRT1表达,分别给予小鼠高脂自由饮食和高脂间歇性禁食,检测上述指标。结果 HE染色结果显示HFD-IF组脂肪细胞体积减小。蛋白免疫印迹结果显示高脂自由饮食时脂肪组织SIRT1、p-AMPK、 FOXO1蛋白表达均下调,间歇性禁食后均上调(P均< 0.05)。定量PCR结果显示HFD组线粒体功能基因Tfam、Nrf1、Pgc-1a表达下调(P均< 0.001),炎症基因TNF-α、单核细胞趋化蛋白1、生长因子样模体黏液样激素样受体表达均上调(P均< 0.01),间歇性禁食后线粒体功能相关基因均上调(P均< 0.05),炎症相关基因均下调(P均< 0.05)。敲减SIRT1后,HFD-IF组的上述指标上调或下降的趋势均有所减弱甚至消失(P均< 0.05)。結论 SIRT1通过改善小鼠内脏白色脂肪组织线粒体功能和炎症状态从而介导间歇性禁食改善高脂喂养诱导的肥胖。
【关键词】间歇性禁食; 沉默信息调节因子2相关酶1;高脂饮食;白色脂肪
SIRT1-mediated intermittent fasting improves adipose tissue mitochondrial function and inflammation in high-fat diet-induced obese mice Deng Xiaojie△, Wang Tian, Xu Fen, Liang Hua.△Department of Endocrinology and Metabolism, the Third Affiliated Hospital of Sun Yat-sen University,Guangzhou 510630,China
Corresponding author, Liang Hua, E-mail: lianghua@mail.sysu.edu.cn
【Abstract】Objective To investigate the role of SIRT1 in the effect of intermittent fasting on mitochondrial function and inflammation in white adipose tissue(WAT) of obese mice induced by high-fat diet. Methods Male C57BL/6 mice aged 5-6 weeks were randomly divided into the control diet (CD) group (n = 5), high‐fat diet (HFD) group (n = 5) and high-fat diet intermittent fasting (HFD-IF, alternate-day fasting 24 h) group (n = 5) and fed for 12 weeks. The pathological changes of WAT were observed by HE staining. The expression levels of SIRT1, p-AMPK, FOXO1 and mitochondrial function, inflammation-related genes in WAT of each group were detected. AAV-shSirt1 virus was delivered by tail-vein injection into mice to knockdown SIRT1. HFD and HFD-IF were given. The parameters above were determined. Results HE staining indicated that the adipose cell volume was decreased in the HFD-IF group. Western blot showed that the expression levels of SIRT1, p-AMPK and FOXO1 in adipose tissues were significantly down-regulated in the HFD mice (all P < 0.05), which were significantly up-regulated after intermittent fasting (all P < 0.05). qPCR revealed that the expression levels of mitochondrial functional genes, including Tfam, Nrf1 and Pgc-1a were dramatically down-regulated in the HFD group (all P < 0.001), whereas those of inflammatory markers, such as TNF-α,MCP-1 and F4/80, was significantly up-regulated (all P < 0.01). After intermittent fasting, the expression levels of genes related to mitochondrial function were up-regulated (all P < 0.05), whereas those of inflammatory markers were down-regulated (all P < 0.05). After knockdown of SIRT1, the trend of up-regulating or down-regulating the expression levels of these parameters was weakened or even absent in the HFD-IF group (all P < 0.05). Conclusion SIRT1 mediates intermittent fasting in improving high-fat diet-induced obesity via ameliorating adipose tissue mitochondrial function and inflammation.
【Key words】 Intermittent fasting; SIRT1; High-fat diet; White adipose tissue
肥胖是全球重大的公共健康问题[1]。肥胖改变全身代谢并导致胰岛素抵抗,其机制涉及脂肪组织的线粒体功能损伤和炎症[2]。间歇性禁食(IF)是指在特定时间段内限定热量摄入的一种饮食管理手段[3]。研究表明,IF可以作为一种有效的行为干预方式来减少包括肥胖在内的代谢性疾病的负担及延长寿命,但具体机制尚未完全明确[4]。沉默信息调节因子2相关酶1(SIRT1)是一种依赖烟酰胺腺嘌呤二核苷酸(NAD+)的去乙酰化酶,表达受能量状态调节,NAD+高表达可改善高脂饮食诱导的肥胖和胰岛素抵抗形成,并改善脂肪组织和肝脏的线粒体功能,减轻氧化应激和炎症程度[5-10]。因此推测,SIRT1在IF改善肥胖中可能发挥重要作用。本研究通过构建隔日禁食的间歇性高脂饮食小鼠模型、利用尾静脉注射腺相关病毒(AAV)敲减SIRT1等手段,探讨IF对高脂诱导的肥胖小鼠脂肪组织线粒体功能、炎症通路的影响以及SIRT1在其中的介导作用,为揭示SIRT1在IF调控机体代谢平衡中的作用提供理论基础。
材料与方法
一、动物模型的建立及IF方案
5~6周龄雄性C57/BL6小鼠35只,体重18~22 g,购至江苏集萃药康生物科技股份有限公司。动物饲养于中山大学SPF级环境中,控制温度、湿度,进行12 h光-暗循环。小鼠经过1周适应性喂养后,将15只小鼠根据空腹血糖和体重随机分为普通自由饮食组(CD组,n = 5)、高脂自由饮食组(HFD组,n = 5)和高脂IF组(HFD-IF组,n = 5),HFD-IF组采取隔日禁食24 h、自由饮水,喂养12周。第2批小鼠适应性喂养1周后,将16只小鼠随机分为HFD组和HFD-IF组,干预4周后,通过尾静脉分别注射腺相关敲减SIRT1病毒和腺相关对照病毒,分别设为高脂自由饮食对照组(shCtrl-HFD组,n = 4)、高脂自由饮食敲减组(shSirt1-HFD组,n = 4)、高脂IF对照组(shCtrl-HFD-IF组,n = 4)、高脂IF敲减组(shSirt1-HFD-IF组,n = 4),继续喂养8周。所有小鼠实验结束后,用异氟烷麻醉后摘除眼球取血,采用颈椎脱臼法将其处死,留取小鼠附睾旁脂肪组织,切取部分组织置于4%多聚甲醛固定,将其余组织储存于-80℃冰箱。本实验通过中山大学实验动物伦理委员会审批(批件号:SYSU-IACUC-2021-000374)。
二、实验试剂和材料
1.主要试剂
高脂饲料(货号D12492)购自Research Diets公司(美国);AAV-shRNA-Sirt1和AAV-shRNA-Control购自广州东泽生物科技有限公司(中国),SIRT1干扰序列5′-TCGAACAATTCTTAAAGAT-3′,RIPA裂解液、蛋白酶抑制剂和BCA试剂盒购自Thermo Fisher公司(美国);磷酸酶抑制剂(货号CW2383S)购自康为世纪(中国);TRIzol试剂(货号T9424)购自Sigma-Aldrich公司(美国);Prime ScriptTMRT Master Mix逆轉录试剂盒(货号RR036A)购自TaKaRa公司(日本);LightCycler 480 SYBR Green I Master购自Roche公司(美国);SIRT1、腺苷酸激活蛋白激酶(AMPK)、p-AMPK、叉头转录因子O1(FOXO1)、β-actin抗体均购自Cell Signaling Technology公司(美国);IRDye 800CW二抗(货号926-32211)购自LI-COR公司(美国);甘油三酯(货号A110-1-1)、总胆固醇试剂盒(货号A111-1-1)购自南京建成生物工程研究所(中国江苏)。
2. 主要仪器
荧光倒置显微镜及体视显微镜(Leica);Nanadrop2000分光光度计(Thermo);实时荧光定量PCR仪(Roche LightCycler 480);全自动酶标仪(Thermo);双色红外成像系统Odyssey(LI-COR)。
三、方 法
1. HE染色
将小鼠脂肪组织固定,经过浸蜡、包埋、切片后,按照步骤进行二甲苯脱蜡,苏木素和0.5%伊红分别染色、脱水和封片,显微镜下观察并拍照。采用Image J软件统计脂滴大小。
2.组织蛋白提取和蛋白免疫印迹
取小鼠脂肪组织100 mg~200 μL预冷RIPA裂解液中,匀浆后采用14 000转/分于4℃离心
20 min,吸取中间清液层得到蛋白原液。用BCA试剂盒检测蛋白浓度配平后,取30 μg总蛋白进行凝胶电泳,将蛋白转移到聚偏二氟乙烯膜上,用5%脱脂牛奶室温封闭1 h后,加入相应的Ⅰ抗稀释液(1∶1 000)于4℃过夜孵育。孵育结束后用TBST洗膜3次,加入Ⅱ抗稀释液(1∶10 000)室温避光孵育1 h后,再次洗膜,使用Odyssey红外荧光成像系统扫描,并用Image J软件测量蛋白条带灰度值进行定量。
3. 组织RNA提取和RT-qPCR检测
使用TRIzol试剂提取小鼠脂肪组织总RNA,用分光光度计测定总RNA浓度和纯度,用逆转录试剂盒将RNA逆转录为cDNA。使用试剂盒并采用PCR检测仪进行PCR扩增。反应体系的配制及反应程序均按照试剂盒说明书。内参照为β-actin,结果使用2-??Ct方法分析计算目的基因的相对表达量。
4.血清检测
小鼠血清中甘油三酯(TG)和总胆固醇(TC)水平的测定按照相应试剂盒进行测定。
四、统计学处理
采用GraphPad Prism 8.0进行统计分析和图表绘制分析。数据采用 表示。数据符合正态分布,多组比较采用单因素方差分析,进一步两两比较采用LSD-t检验;P < 0.05为差异有统计学意义。
结果
一、IF能减小高脂饮食喂养小鼠脂肪细胞体积并降低血脂水平
小鼠脂肪组织HE染色和称重结果显示,与CD组相比,HFD组小鼠脂肪细胞体积增大且质量更重(F = 30.732,P < 0.001;F = 63.267,P < 0.001),而HFD-IF组小鼠脂肪细胞体积较HFD组减小且质量减轻(F = 30.732,P < 0.001;F =
63.267,P < 0.001),脂质含量明显降低,见图1。HFD组小鼠血清中TG、TC水平高于CD组[TG HFD vs. CD:(148.66±11.44)mg/dL vs.
(79.33±5.43) mg/dL,F = 22.913, P < 0.001;TC HFD vs. CD:(160.40±7.62) mg/dL vs. (100.12±2.05) mg/dL,F = 38.717, P < 0.001],而HFD-IF组较HFD组小鼠水平下降[TG HFD-IF vs. HFD:(80.96±6.69)mg/dL vs. (148.66±11.44)
mg/dL,P < 0.001;TC HFD-IF vs. HFD:(116.23±3.63)mg/dL vs. (160.40±7.62)mg/dL,P < 0.001]。
二、IF上调高脂饮食小鼠白色脂肪组织中SIRT1及激活AMPK、FOXO1通路
蛋白免疫印迹结果显示,HFD组小鼠中SIRT1、p-AMPK、FOXO1表达均较CD组降低
(F = 35.641,P < 0.001;F = 7.503,P = 0.037;F =
9.935,P = 0.012),而IF使SIRT1、p-AMPK、FOXO1水平升高(F = 35.641,P = 0.043;F = 7.503,P = 0.034;F = 9.935、P = 0.044)。见图2。
三、IF增加高脂饮食小鼠白色脂肪组织线粒体生物合成并减轻炎症程度
与CD组相比,HFD组小鼠脂肪组织中线粒体生物合成相关基因Pgc-1a、Tfam和Nrf1的mRNA相对表达量均降低(F = 23.561,P < 0.001;F = 15.872,P < 0.001;F = 24.456,P < 0.001),而炎症相关基因TNF-α、单核细胞趋化蛋白1(MCP-1)和生长因子样模体黏液样激素样受体(F4/80)的mRNA表达水平均升高(F = 16.742,P = 0.006;
F = 17.743,P = 0.003;F = 8.492,P = 0.007);与HFD组相比,HFD-IF组小鼠线粒体生物合成相关基因表达水平上升(Pgc-1a、Tfam和Nrf1分别为P = 0.003、P = 0.022、P = 0.021),炎症相关基因表达下降(TNF-α、MCP-1和F4/80分别为P < 0.001、P < 0.001、P = 0.043)。
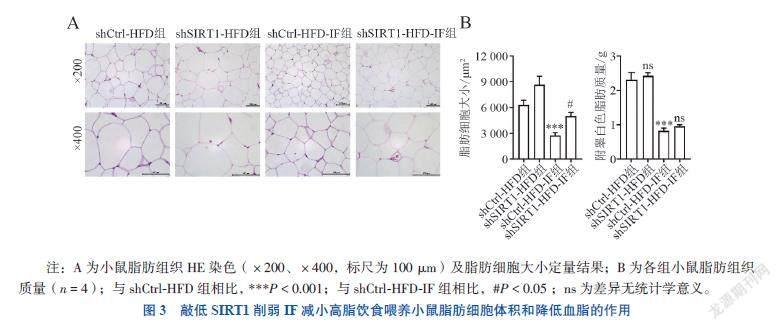
四、敲減SIRT1削弱IF减小高脂饮食喂养小鼠脂肪细胞体积和降低血脂的作用
通过尾静脉注射AAV-shSirt1敲减SIRT1表达后,shSirt1-HFD组与shCtrl-HFD组脂肪细胞体积大小比较差异无统计学意义(P > 0.05),而shSirt1-HFD-IF组与对照组相比,脂肪质量无明显变化但细胞体积减小的程度有所下降(体积F = 17.993,P = 0.047;质量F = 46.439,P =
0.881),见图3A~B。敲减SIRT1后,IF降低HFD诱导的高血脂作用被减弱(IF后TG shCtrl vs. shSirt1:(82.30±2.12) mg/dL vs. (124.74±2.94) mg/dL,F = 97.605, P < 0.001;TC shCtrl vs. shSirt1:(105.56±2.95) mg/dL vs. (144.83±5.10) mg/dL,F = 28.871, P = 0.002)。以上结果提示敲减SIRT1后,IF改善高脂饮食诱导的脂肪细胞体积增大和降低血脂的作用有所削弱。
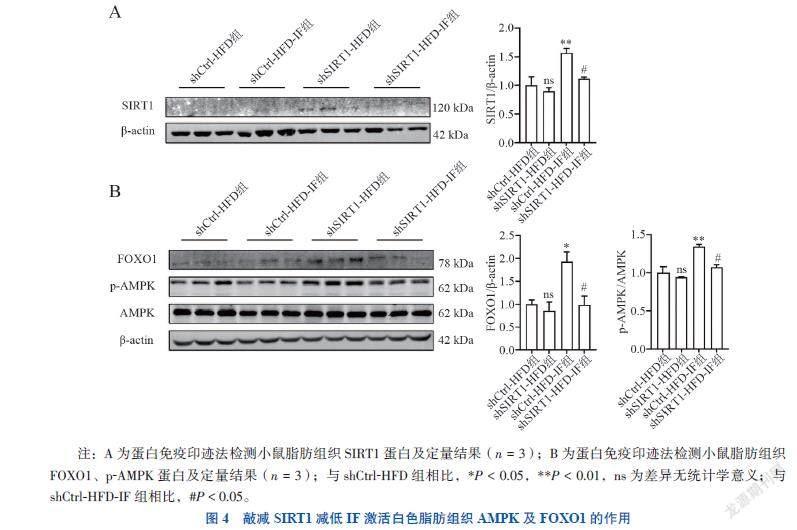
五、敲减SIRT1减低间歇性禁食激活白色脂肪组织AMPK及FOXO1的作用
蛋白免疫印迹结果显示,敲减SIRT1后,SIRT1的蛋白水平均降低(F = 9.653,P = 0.038;F = 11.307,P = 0.027),见图4A。与之前的实验结果相同,shCtrl-HFD-IF组 FOXO1、p-AMPK的蛋白水平较shCtrl-HFD组增加(F = 7.468,P = 0.028;F = 15.313,P = 0.003),敲减SIRT1后shSirt1-HFD-IF组与shCtrl-HFD-IF组相比,可以看到IF上调的FOXO1、p-AMPK表达的作用减弱(FOXO1 P = 0.026、p-AMPK P = 0.012),见图4B。
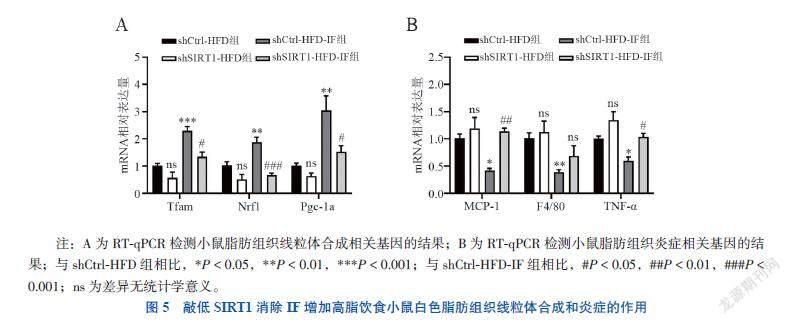
六、敲减SIRT1消除IF增加高脂饮食小鼠白色脂肪组织线粒体合成和炎症的作用
RT-qPCR结果显示,shCtrl-HFD-IF组与shCtrl-HFD组相比,线粒体功能相关基因如Tfam、Nrf1和Pgc-1a的mRNA表达均增加(F = 19.495,P < 0.001;F = 16.386,P = 0.008;F = 12.254,P =
0.002),炎癥相关基因MCP-1、F4/80和TNF-α的mRNA水平下调(F = 9.857,P = 0.014;F = 5.039,P = 0.050;F = 10.264,P = 0.047)。而敲减SIRT1后,与shCtrl-HFD-IF组相比,shCtrl-HFD-IF组IF的这种改善作用基本消失(Tfam P = 0.008、Nrf1 P < 0.001、Pgc-1a P = 0.018;MCP-1 P = 0.002、F4/80 P = 0.524、TNF-α P = 0.030)。见图5。
讨论
脂肪组织是具有能量储存和分泌功能的器官,在肥胖的发生、发展中起重要作用。脂肪组织线粒体功能与炎症和许多跟肥胖相关的疾病发生有关,如脂肪肝、脂代谢紊乱、胰岛素抵抗和糖尿病等[11-12]。IF作为一种越来越受到关注的饮食方式,已成为肥胖与代谢性疾病发病机制及干预措施研究的重要模型。既往研究显示IF具有改善葡萄糖耐量、脂代谢紊乱、脂肪组织炎症和延长寿命的作用,但具体机制尚不明确[13-14]。本研究显示SIRT1在IF改善HFD诱导的脂肪组织线粒体功能和炎症状态中发挥重要作用,可能通过激活AMPK和FOXO1通路增加线粒体生物合成发挥抗炎作用。
本课题组的前期研究证实SIRT1作为受能量代谢调控的去乙酰化蛋白,在高脂条件下其在肝脏中的表达降低,禁食时表达上调[15-16]。在本研究中,白色脂肪组织中SIRT1的蛋白表达结果与既往研究结果相似,相关研究证实,SIRT1可通过调控脂肪组织和肝脏的Pgc-1a促进线粒体生物合成,并能控制促炎基因转录从而调节脂肪组织炎症程度[9, 17-18]。本研究显示高脂诱导小鼠白色脂肪组织Pgc-1a、Tfam和Nrf1的表达降低,MCP-1、F4/80以及TNF-α的表达增加,提示存在线粒体功能障碍和脂肪炎症,IF能改善上述基因的表达;然而尾静脉注射AAV-shSirt1敲低小鼠SIRT1表达后,IF对上述线粒体功能及炎症相关基因的作用被显著减弱,提示SIRT1可能通过改善线粒体功能障碍、减轻机体组织炎症程度而缓解机体代谢性疾病。
AMPK是机体的能量感受器,具有特异性调控线粒体生物过程的作用[19]。SIRT1是激活AMPK改善线粒体功能所必需的[8]。此外,SIRT1还通过上调FOXO1发挥抗自噬、抗氧化应激和抗炎等作用[10-20]。本研究显示,IF能上调HFD小鼠脂肪组织p-AMPK和FOXO1蛋白水平,但敲低SIRT1的表达后,IF上调p-AMPK、FOXO1表达的作用减弱,提示SIRT1通过激活AMPK和FOXO1参与IF改善肥胖脂肪组织线粒体功能和炎症的机制。
综上所述,IF可能通过调控脂肪组织线粒体功能和炎症状态从而改善肥胖,而SIRT1在其中起重要作用。本研究仅探讨了IF对白色脂肪组织的作用,需进一步检测其在组织代谢中的作用并通过体外实验更深入探讨SIRT1在其中的作用。
参 考 文 献
[1] Pan X F, Wang L, Pan A. Epidemiology and determinants of obesity in China. Lancet Diabetes Endocrinol, 2021, 9(6): 373-392.
[2] Ahmed B, Sultana R, Greene M W. Adipose tissue and insulin resistance in obese. Biomed Pharmacother, 2021, 137: 111315.
[3] Vasim I, Majeed C N, DeBoer M D. Intermittent fasting and metabolic health. Nutrients, 2022, 14(3): 631.
[4] Mitchell S J, Bernier M, Mattison J A, et al. Daily fasting improves health and survival in male mice independent of diet composition and calories. Cell Metab, 2019, 29(1): 221-228.e3.
[5] Chen C, Zhou M, Ge Y, et al. SIRT1 and aging related signaling pathways. Mech Ageing Dev, 2020, 187: 111215.
[6] Pardo R, Velilla M, Herrero L, et al. Calorie restriction and SIRT1 overexpression induce different gene expression profiles in white adipose tissue in association with metabolic improvement. Mol Nutr Food Res, 2021, 65(9): e2000672.
[7] Kong S, Cai B, Nie Q. PGC-1α affects skeletal muscle and adipose tissue development by regulating mitochondrial biogenesis. Mol Genet Genomics, 2022, 297(3): 621-633.
[8] Han W M, Chen X C, Li G R, et al. Acacetin protects against high glucose-induced endothelial cells injury by preserving mitochondrial function via activating Sirt1/Sirt3/AMPK signals. Front Pharmacol, 2020, 11: 607796.
[9] Lu C, Zhao H, Liu Y, et al. Novel role of the SIRT1 in endocrine and metabolic diseases. Int J Biol Sci, 2023, 19(2): 484-501.
[10] Wu Q J, Zhang T N, Chen H H, et al. The sirtuin family in health and disease. Signal Transduct Target Ther, 2022, 7(1): 402.
[11] Longo M, Zatterale F, Naderi J, et al. Adipose tissue dysfunction as determinant of obesity-associated metabolic complications. Int J Mol Sci, 2019, 20(9): 2358.
[12] Reyes-Farias M, Fos-Domenech J, Serra D, et al. White adipose tissue dysfunction in obesity and aging. Biochem Pharmacol, 2021, 192: 114723.
[13] Li G, Xie C, Lu S, et al. Intermittent fasting promotes white adipose browning and decreases obesity by shaping the Gut Microbiota. Cell Metab, 2017, 26(4): 672-685.e4.
[14] Liu B, Page A J, Hatzinikolas G, et al. Intermittent fasting improves glucose tolerance and promotes adipose tissue remodeling in male mice fed a high-fat diet. Endocrinology, 2019, 160(1): 169-180.
[15] 許晓, 陈芸芝, 徐芬, 等. 组蛋白乙酰化修饰调控NF-κB驱动的PNPLA3基因表达的机制初探. 新医学, 2021, 52(3): 187-191.
[16] Xu X, Deng X, Chen Y, et al. SIRT1 mediates nutritional regulation of SREBP-1c-driven hepatic PNPLA3 transcription via modulation of H3k9 acetylation. Genes Environ, 2022, 44(1): 18.
[17] Hang W, Shu H, Wen Z, et al. N-acetyl cysteine ameliorates high-fat diet-induced nonalcoholic fatty liver disease and intracellular triglyceride accumulation by preserving mitochondrial function. Front Pharmacol, 2021, 12: 636204.
[18] Li D, Xing Z, Yu T, et al. Pogostone attenuates adipose tissue inflammation by regulating the adipocyte–macrophage crosstalk via activating SIRT1. Food Funct, 2022, 13(22): 11853-11864.
[19] Herzig S, Shaw R J. AMPK: guardian of metabolism and mitochondrial homeostasis. Nat Rev Mol Cell Biol, 2018, 19(2): 121-135.
[20] Maissan P, Mooij E J, Barberis M. Sirtuins-mediated system-level regulation of mammalian tissues at the interface between metabolism and cell cycle: a systematic review. Biology, 2021, 10(3): 194.
(收稿日期:2022-11-01)
(本文编辑:洪悦民)

