肉制品中蛋白质、脂质及其相互作用吸附 挥发性风味物质机理研究进展
聂若彤,魏相茹,张德权,王振宇,刘 欢
(中国农业科学院农产品加工研究所,农业农村部农产品加工与贮藏重点实验室,北京 100193)
挥发性风味物质是评价肉制品品质优劣的关键指标[1]。 挥发性风味物质存在于肉制品中的主要原因是风味形成与风味吸附(保留)[2]。目前,已有大量学者对风味形成进行了系统研究与综述,明确了美拉德反应、脂质氧化、硫胺素降解及其相互作用是形成肉制品风味的关键,并揭示了其形成路径[3-4]。肉制品中风味吸附载体主要包括蛋白质、脂质及碳水化合物[5-6],其中蛋白质与脂质最为关键。本研究综述肉制品中蛋白质、脂质及其相互作用吸附挥发性风味物质的作用机理、检测方法及内外源影响因素,以期从风味保留的角度实现肉制品风味保真,为肉制品加工提供参考。
1 蛋白质吸附挥发性风味物质机理研究进展
风味保留与肉制品基质大分子密切相关,蛋白质是吸附挥发性风味物质的理想载体[7]。肌原纤维蛋白与胶原蛋白分别是肌肉与皮的主体蛋白质,血清蛋白是血液的重要蛋白质,研究表明,肌原纤维蛋白与血清蛋白可以显著保留醛类、醇类、酮类、含硫与含氮等挥发性风味物质[8-10]。内外源因素使蛋白质结构改变或变性,其羧基、胺基、硫醇等官能团等被激活,进而吸附挥发性风味物质[4,11]。蛋白质结合风味物质的作用力主要包括可逆与不可逆作用力,可逆结合化学作用力包括疏水和静电相互作用、氢键及范德华力,不可逆结合化学作用力包括氨基和巯基结合等[12-13]。以蛋白质吸附挥发性风味物质疏水作用为例(图1),蛋白质通过非共价作用力折叠成三维网状结构,氨基酸的疏水侧链主要在蛋白质内部,极性基团在外部,通过疏水作用力吸附挥发性风味物质[14]。
1.1 肌原纤维蛋白
肌原纤维蛋白是肉制品中的主要蛋白质,占总蛋白含量的50%以上,其主要包括肌球蛋白、肌动蛋白、肌原蛋白和肌动球蛋白等[15]。肌原纤维蛋白、肌球蛋白等吸附挥发性风味物质的作用机理包括:一是暴露更多的疏水作用位点与氢键结合风味化合物实现可逆结合[16];二是暴露色氨酸、赖氨酸、谷氨酸等氨基酸残基或巯基实现不可逆结合[17]。以肌球蛋白研究为例,外源条件使肌球蛋白二级结构由α-螺旋向β-折叠结构转变,从而暴露出更多的疏水结合位点与巯基结合戊醛、己醛、庚醛、辛醛与壬醛等醛类物质,结合作用位点主要包括苏氨酸残基、脯氨酸残基与色氨酸残基等[18]。然而,含硫与含氮类物质是肉制品中呈烤肉味与肉香味的关键物质,相关学者应进一步聚焦不同类型肌原纤维蛋白吸附含硫与含氮等关键挥发性风味物质的作用机理解析。肌原纤维蛋白吸附挥发性风味物质的作用机理如表1所示。

表1 肌原纤维蛋白吸附挥发性风味物质的作用机理Table 1 Binding mechanism between myofibrillar protein and volatile compounds
1.2 胶原蛋白
胶原蛋白是由3 条左手螺旋的多肽链通过范德华力、氢键与共价键相互缠绕形成右手超螺旋结构的高分子蛋白质,具有很高的机械强度[24]。胶原蛋白结构的稳定主要依赖于非共价作用力,如氢键、范德华力、静电和疏水相互作用。胶原蛋白分子的固有结构是由内力结合在一起的,其结构的变化与蛋白分子间共价交联的数量密不可分,在大多数情况下,随着温度的升高蛋白质发生“热变性”,氨基酸链展开,分子内部基团暴露在分子表面,改变了分子对其他分子的亲和性[25]。研究表明:猪皮胶原蛋白结合醛类、酮类及酯类等(己醛、 2-庚酮、2-戊基呋喃、丁酸乙酯)风味物质的能力随温度升高(75 ℃)显著增强,75~95 ℃又显著降低,原因可能是温度超过85 ℃,胶原蛋白结构被破坏,蛋白质-蛋白质相互作用(聚集)和沉积趋势增加;胶原蛋白吸附萜烯类风味物质的作用力主要为疏水相互作用与氢键,其中氢键是主要作用力,但萜烯类化合物良好的疏水特性导致胶原蛋白结合效果不明显[26]。
1.3 血清蛋白
血清蛋白是血清中的一种球状蛋白,包含3 个脂质结合域[11]。以牛血清蛋白为例,其通过氢键、范德华力等可逆作用力结合香草醛(图2),在Tyr 149、Arg 256和His 241氨基酸残基位点通过氢键结合香草醛,在Arg 198、Leu 237、Lys 221、Ala 290和Ser 286氨基酸残基位点通过疏水与静电相互作用结合香草醛[27];牛血清蛋白结合醛类、酮类、醇类风味物质的化学作用力为氢键与疏水相互作用,结合位点主要为色氨酸残基[28-29]; 另外,牛血清蛋白可通过疏水相互作用结合烷基吡嗪化合物[30-31]。
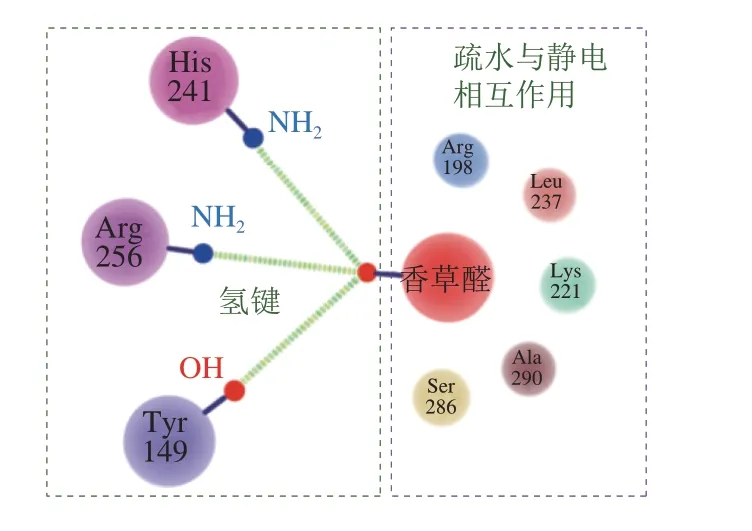
图2 牛血清蛋白吸附醛类风味物质(以香草醛为例)作用机理Fig. 2 Mechanism of bovine serum protein binding to aldehydes (vanillin)
1.4 检测方法
肉制品中蛋白质空间构象变化影响挥发性风味物质的结合程度,这些变化可以通过色谱、质谱与光谱等方法检测。本文从风味吸附程度、蛋白质结构变化、作用力与作用位点三方面综述蛋白质吸附挥发性风味物质机理(表2)。蛋白质吸附挥发性风味物质程度主要采用液相分析法与气相色谱-质谱联用(gas chromatography-mass spectrometry,GC-MS)法解析,2 种方法操作简单,可以反映蛋白质对风味物质的整体吸附能力,但液相分析法会隐藏部分结合位点,GC-MS法很难反映蛋白内部与风味物质的结合。蛋白质结构变化主要采用热力学方法与圆二色光谱法进行解析,热力学方法样品用量小,方法灵敏度高,但缺乏特异性,圆二色光谱法方法快速、简便、灵敏、可定量,但对溶液的澄清度、浓度要求高。蛋白质吸附挥发性风味物质的作用力与作用位点主要采用光谱法、核磁共振(nuclear magnetic resonance,NMR)与分子对接技术解析,荧光光谱法应用广泛并且精准,但对风味化合物浓度要求较高,测定值通常偏高,NMR可研究蛋白动态结构、功能及其动力学特性,无需结晶,但受相对分子质量限制,需要标记,分子对接模拟技术可在原子水平准确阐明相互作用。目前,诸多相关研究聚焦于荧光光谱、紫外-可见吸收光谱、圆二色光谱和分子对接等多种手段解析蛋白质吸附挥发性风味物质机理。

表2 蛋白质吸附挥发性风味物质机理解析方法Table 2 Analytical methods for binding mechanism between protein and volatile compounds
2 脂质吸附挥发性风味物质机理研究进展
脂质是肉制品中风味形成的重要底物,也是吸附挥发性风味物质的关键基质[42]。肉制品中的脂质包括中性脂质、磷脂、鞘脂、衍生脂质等[43]。醛类、醇类、酯类、含硫与含氮类等风味物质具有脂溶性特点,表现出疏水特性,对脂质有很大的亲和力[6]。脂质含量与脂质类型均显著影响挥发性风味物质的保留,含量对香气保留的影响大于类型[44]。中性脂质(甘油三酯)与磷脂对肉制品风味保持具有重要作用[45]。大多数风味物质(如醛类、醇类、脂类)具有疏水性,这些分子与脂质相似相溶,通过疏水相互作用被包裹在脂质分子内部。
脂质吸附挥发性风味化合物受物理化学作用的影响[46]。 在肉制品加工过程中甘油三酯对挥发性化合物的吸附作用随温度的升高而增强,而液态甘油三酯的吸附作用随温度的升高而减弱;甘油三酯中脂肪酸不饱和程度会显著影响与挥发性风味物质的结合能力[47]。相关学者采用脂质组学研究烤羊肉中的脂质,结果表明,烤羊肉中主要包括7 种脂质,如中性脂质、磷脂、鞘脂、脂肪酰基脂、糖甘油脂、衍生脂质等,并发现1,3-二油酸-2-棕榈酸甘油三酯与1,3-二硬脂酰-2-油酰甘油酯是吸附风味物质的关键脂质[48]。
因此,在研究脂质吸附风味物质作用时,以下几点需要注意[14]:1)脂质在研究体系中的分布形态。脂质是具有疏水性和非极性的物质,可在加热、超声和其他条件下在介质中形成乳浊液。风味化合物遵循物理定律,分布在脂质和水相之间,并在理想条件下达到真正的平衡,在各相间的分布主要取决于其分配系数;2)脂质在研究体系中的含量。在不同脂肪含量的复合食品中,风味化合物的阈值与脂肪含量成比例增加;3)风味化合物在脂质中阈值的确定。风味化合物在不同介质中的分配系数不同,导致其阈值也有所不同,这主要与化合物的分子结构有关。
目前主要采用脂质组学方法解析脂质含量与类型(表3),包括GC-MS、薄层色谱(thin-layer chromatography,TLC)、基质辅助激光解吸电离飞行时间MS(matrix-assisted laser desorption ionization time-of-flight MS,MALDI-TOF-MS)、电喷雾电离MS(electrospray ionization MS,ESI-MS)Q-Exactive高分辨MS和NMR等。单一技术并不能完全反映分子之间的相互作用,具有一定局限性,可以采用MS、多光谱、分子模拟等技术联合使用。
3 蛋白质与脂质相互作用吸附挥发性风味物质机理 研究进展
脂质氧化和蛋白质氧化密切相关,脂质氧化程度越高导致蛋白质的氧化反应越强,影响肉制品品质[52]。在肉制品的加工过程中,肌肉蛋白不可避免地受到活性氧基团攻击,使蛋白质的结构发生变化,并造成氧化 损伤[53]。蛋白质、脂质及二者的氧化分解产物也会在肉品加工过程中发生交互作用,显著影响食品的风味[54]。脂质氧化产生的自由基和过氧化物会促进蛋白质的氧化,二者的氧化产物所形成的自由基链相似,形成的氧化产物可以结合转化为烷基过氧化物,进而形成烷基自由基和羟基衍生物[55]。
脂质氧化会显著影响蛋白质吸附挥发性风味物质水平[8,55]。食品加工过程中,蛋白质通过疏水缔合和二硫键部分展开聚集,一些脂类(如棕榈酸酯)可以稳定蛋白质结构,减缓蛋白质去折叠和变性[56]。脂质与肌原纤维蛋白体外氧化研究表明,脂质和蛋白质氧化可发生耦合及相互作用[21],分子间的相互作用因蛋白质的构象状态和电荷而异,并通过界面作用调控稳定性[57]。叶黄素二棕榈酸酯通过氢键、范德华力和疏水作用自发地与牛血清白蛋白结合[5]。脂质与蛋白质结合机理见图3(以牛血清蛋白与叶黄素二棕榈酸酯为例)。胶原蛋白与表没食子儿茶素没食子酸酯结合的作用力包括静电相互作用、疏水相互作用,主要作用位点为丙氨酸(Ala 932、Ala 945)与赖氨酸残基(Lys 935)[58]。
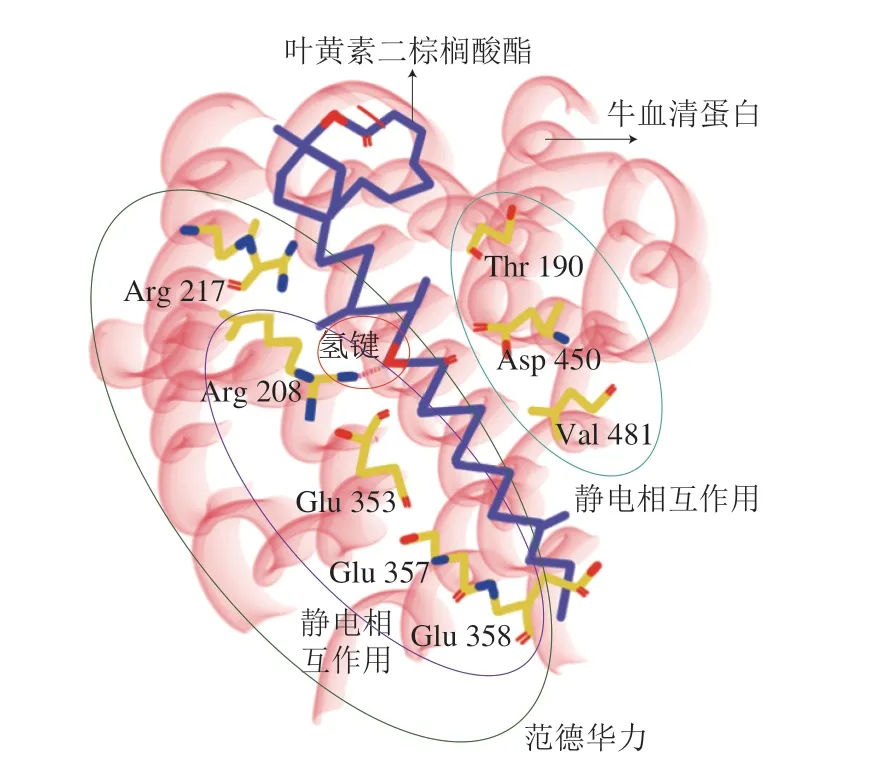
图3 脂质与蛋白质结合机理示意图(以牛血清蛋白与叶黄素 二棕榈酸酯为例)Fig. 3 Binding mechanism between lipid (lutein dipalmitate) and protein (bovine serum protein)
4 肉制品流变特性保留挥发性风味物质机理研究进展
食品基质流变性显著影响挥发性风味物质保留[59]。食品基质黏度越高,挥发性化合物吸附作用越强[60-62]。大分子溶液的表观黏度随着浓度的增大而显著增强,分子间/内部作用力的破坏和重组影响胶体稳定性,改变食品基质的流变学特性,导致食品基质的结合和风味物质释放程度不同[9,46,63],如适度加热使蛋白质变性,二级结构展开导致流变特性增强[9,64]。亲水胶体作为增稠剂可减少风味释放,这主要是由于介质中的扩散减少和风味化合物与基质成分之间的分子相互作用[60]。
食品基质中风味物质的保留平衡根据增稠剂的浓度而变化,并且取决于其他分子特性,如疏水性[65]。风味化合物的结构特征同样影响食品基质中的保留/释放行为,不饱和醇在水性介质中的保留作用比在乳制品凝胶中的保留更强,相反,醛、酮、酯类物质在乳制品凝胶中的保留程度高于在水性介质中的保留程度,并且基质组成强烈影响伯醇的保留,而对叔醇的保留影响较小[65]。
添加适量脂质可以改善冰淇淋的特性(黏度增加、类似泡沫的外观、防止乳清脱落和抗熔化性)。在冰淇淋搅打步骤中乳脂的部分不稳定导致形成稳定气室的脂肪网络,此外,乳制品甜点中乳脂的增加有助于减少摩擦,通过部分聚结机制促进对奶油油腻和黏性属性的更好感知[66]。肉制品加工过程可借助外界条件(加热、加压与搅拌等)改变调节食品基质的流变学特性,进而调控风味物质保留。
5 结 语
我国食品工业已进入“风味与健康”双导向的深度转型期,风味是实现食品高质量发展的重要抓手,风味形成与保持理论和技术的突破是实现该目标的重要途径。风味物质的形成已进行了相对系统的研究与综述,肉制品风味形成后如何保持以及如何保持更长久是当下食品风味研究的热点,意义重大。食品基质吸附挥发性风味物质的相关研究主要聚焦于蛋白质(如肌原纤维蛋白、胶原蛋白),阐明了蛋白质吸附醛类、醇类、酮类、呋喃类等挥发性风味物质的作用力与作用位点,如可逆相互作用(氢键、疏水作用等)与不可逆相互作用(共价结合等),初步解析了甘油三酯是吸附挥发性风味物质的重要脂质,明确了蛋白质、脂质等可以发生化学相互作用,进而影响风味吸附,并发现肉制品的流变特性也可以调控风味物质的吸附水平。
目前,由于肉制品体系的复杂性与技术的局限性,肉制品中蛋白质、脂质及其相互作用吸附风味物质作用机理解析任重道远。从现有理论突破与技术发展的趋势来分析,在可预见的未来,以下内容将有深入挖掘的空间:1)大多数研究是在离体模型中进行,肉制品是一个包含蛋白质、脂质、碳水化合物等物质的复杂体系,如何更加真实地解析肉制品基质中蛋白质吸附风味物质机理将是重要研究内容;2)蛋白质吸附风味物质作用位点验证与作用力决定风味保留系数计算需要理论突破; 3)蛋白质-蛋白质、蛋白质-脂质、蛋白质-脂质-碳水化合物及其共同形成的流变特性如何调控风味物质吸附是一个复杂且重要的课题;4)风味物质修饰肉制品基质进而如何影响风味物质吸附需要系统解析。

