白菜健康株与根肿病患病株的土壤微生物群落和功能差异*
张智浩,邓毅书,聂 强,解国玲,吴流通,邸雪嫣,石 浩,付克剑,张继来,林 春,张乃明,苏友波**
(1.云南农业大学资源与环境学院 昆明 650201; 2.云南农业大学建筑工程学院 昆明 650201; 3.红河恒林有限责任公司红河 652399; 4.云南农业大学农学与生物技术学院 昆明 650201)
土壤健康是土壤作为一个动态生命系统具有的维持其功能的持续能力[1]。伴随设施农业集约化水平不断提高、农业生产资料投入不断增加,在满足粮食需求的同时,也导致了土壤质量退化,土传病害加重等问题,并引发一系列环境生态问题,提升耕地土壤质量和维持耕地土壤健康已成为我国土壤科学研究的焦点和前沿。高强度集约化农业生产一定程度上破坏了土壤微生物群落结构的稳态平衡,削弱了土壤生态系统的功能,导致十字花科(Brassicaceae)作物根肿病[2]等土传病害频发,严重威胁作物生产。根肿病在云南发生流行已有近30年的历史,最早出现在昆明呈贡地区,现已扩散至楚雄、玉溪、曲靖、大理等地。云南根肿病病原菌比中国其他地区的更复杂,致病能力更强,防治难度更高[2],受根肿病影响造成的十字花科作物产量损失为20%~30%,严重时产量损失达70%,严重制约了十字花科蔬菜产业的健康可持续发展[3]。
白菜根肿病是由芸薹根肿菌(Plasmodiophora brassicae)侵染引起的土传植物病害,该病原菌属专性寄生,在无寄主植物存在时,其休眠孢子仍能在土壤中存活达15年之久,环境适宜时休眠孢子萌发释放初级游动孢子侵染根毛进而侵染根皮内部形成肿根,肿根的形成会阻碍白菜(Brassica rapa)水分和养分的吸收,从而导致植株萎蔫和发育不良,继而导致白菜产量和品质下降[4]。近年来,人们寄希望通过生物防治达到有效防控根肿病流行的目的,如Liu 等[5]从大白菜根际分离到的枯草芽孢杆菌(Bacillus subtilis) XF-1 菌株对根肿菌休眠孢子有较强的抑制作用。Fu 等[6]研究发现,溶杆菌(Lysobacter)粗提液中的抗真菌物质对根肿病及休眠孢子均有抑制作用。植物内生菌与根肿菌竞争营养和生态位,通过产生抗微生物化合物和诱导寄主防御来抵御根肿菌侵染[7]。Yang 等[8]研究发现,油菜(Brassica napus)与大豆(Glycine max)轮作显著提高了土壤中芽孢杆菌(Bacillus)、链霉菌(Streptomyces)、木霉菌(Trichodema)等能抑制油菜根肿病病原菌的微生物种群密度,而十字花科作物连作显著积累了油壶属(Olpidium)和炭疽菌属(Colletotrichum)等植物病原菌。此外,链孢粘帚霉(Gliocladium catenulatum)、哈茨木霉(Tharzianum)等木霉属真菌、内生子囊菌(Ascomycetes)一定程度上也可延缓根肿菌侵染十字花科作物,降低根肿病发病率并减轻根肿病严重程度[9]。目前,土壤微生态治理已成为防治十字花科作物根肿病的主要途径之一。
土壤微生物组是维持土壤健康的核心与关键,利用土壤微生物组来提高土壤健康水平对可持续农业发展及保护土壤生态环境具有重要意义[10]。土壤微生物可以提高植物抗病性和土壤抑病性,在植物生长和健康中有重要的作用[11]。植物土传病害的发生、发病严重程度一般与病原菌及植物所在土壤生态环境有密切的关系。例如Zhou 等[12]对健康香蕉(Musa nana)根际土壤和患枯萎病香蕉根际土壤微生物多样性进行分析,发现健康土壤与患枯萎病土壤中存在独特的细菌和真菌分布,且患枯萎病土壤中细菌和真菌的丰富度和多样性均高于健康土壤。Wei 等[3]对健康土壤和患锈腐病人参(Panax ginseng)根际土壤多样性进行研究,发现患病土壤中微生物群落失衡,真菌多样性降低,细菌多样性增加,而真菌则在健康土壤中富集。Qi 等[13]对健康土壤和患青枯病土壤理化性质和微生物网络进行研究发现,患病土壤速效氮、速效磷、速效钾和土壤pH 均低于健康土壤,健康土壤微生物网络较患病土壤更复杂、稳定。可见,许多工作已经在多种植物上证实了土传病害的发生与土壤微生物多样性及物种组成变化有密切的关系,但健康株与患病株的土壤微生物群落和功能差异尚不很清楚。本研究以健康白菜植株和患根肿病白菜植株根围土壤样品为研究对象,利用Illumina Miseq 高通量测序技术对16S rDNA 和ITS 片段进行测序,对比健康和患根肿病白菜根围土壤中微生物群落结构和功能的差异,同时测定健康和患根肿病白菜根围土壤理化性质,通过研究根围土壤微生物群落的结构差异,探究土壤中制约根肿病发生的关键因素,为揭示根肿病发生的微生态机制及研发根肿病绿色综合防控技术提供理论支撑。
1 材料与方法
1.1 研究区概况
研究区位于云南省大理白族自治州祥云县刘厂镇龙之源蔬菜有限责任公司蔬菜生产基地(25°28′37.34″N,100°45′15.84″E),年平均气温15.2 ℃,年均降水751 mm,年日照时数2327.05 h。土壤连作障碍发生严重,目前该基地通过与菊科(Compositae)作物轮作模式来防治根肿病,但效果不明显,白菜仍深受根肿病的影响且存在减产、品质下降等问题。
1.2 样品采集
2021年4月于祥云蔬菜基地随机选取5 块根肿病发病严重和5 块未发病的田块,各田块面积均为480 m2(80 m×6 m),田块间隔4~10 m。发病田块根肿病发病率为35%~80%。各田块内按S 型路线每隔90 m2(45 m×2 m)左右随机选择白菜健康株和患病株,将白菜连根拔起,采用抖根法收集白菜根围土壤,去除植物根系和石砾等杂物后装入15 mL 无菌离心管,每个田块采集5 个样点并将其混匀作为一个生物学重复。健康白菜根围土壤组(H)样品编号分别为H1、H2、H3、H4、H5,患根肿病白菜根围土壤组(D)样品编号分别为D1、D2、D3、D4 和D5。同时,用塑料袋收集抖落的多点土样,将其混为重1 kg左右的混合土样。无菌离心管采集的土样放入-80 ℃干冰保藏箱,迅速带回实验室后于-80 ℃超低温冰箱保存,并及时送至上海美吉生物医药科技有限公司进行微生物群落多样性测序及交互式分析,混合土样在实验室自然风干后用于部分土壤理化性质测定。
1.3 土壤理化性质的测定
土壤pH、有机质、全氮、碱解氮、速效磷、速效钾、交换性钙镁和阳离子交换量等理化性质参照鲍士旦[14]的《土壤农化分析》进行测定。
1.4 土壤总 DNA 提取、PCR 扩增和高通量测序
土壤DNA 采用Soil DNA Kit 试剂盒进行提取,提取完成后利用1%琼脂糖凝胶电泳检测提取基因组DNA 含量和纯度。检测合格后,使用338F (5′-ACTCCTACGGGAGGCAG CAG-3′)和 806R (5′-GGACTACHVGGGTWTCT AAT-3′)对16S rRNA 基因“V3+V4”区进行 PCR 扩增,使用ITS1F(5′-CTTGGTCATTTAGAGGAAG TAA-3′)和 ITS2R(5′-GCTGCGTTCTTCATCGA TGC-3′)对ITS1 区进行PCR 扩增,检测合格后利用Illumina 公司的MiSeq 进行测序。
1.5 数据处理
MiSeq 测序得到的PE reads 进行样本拆分后,根据测序质量对双端Reads 进行质控和过滤,然后使用DADA2 序列降噪方法处理优化数据,按最小样本序列数进行抽平,利用美吉生信云分析平台对抽平后的数据进行群落组成多样性、物种差异、相关性和功能预测分析。物种注释方法采用Naive Bayes,细菌注释数据库为silva138/16s_bacteria,真菌注释数据库为unite8.0/its_fungi,分类置信度为0.7。采用Excel 2016 软件对土壤理化、测序数据进行统计分析,采用SPSS 26.0 软件对土壤理化、alpha 多样性指数进行配对样本T检验,所有数据均用“平均值±标准误”表示,分析描述数据时分别将对应样品合并为H、D。
2 结果与分析
2.1 健康与患根肿病白菜根围土壤理化性质差异
测定健康白菜植株和患根肿病白菜植株根围土壤理化性质,结果显示健康白菜植株根围土壤pH、有机质、全氮、碱解氮、速效磷、速效钾和阳离子交换量均高于患根肿病植株土壤,但二者间差异不显著; 健康白菜植株根围土壤中交换性钙和交换性镁含量显著高于患根肿病白菜植株根围土壤(P<0.05)(表1)。
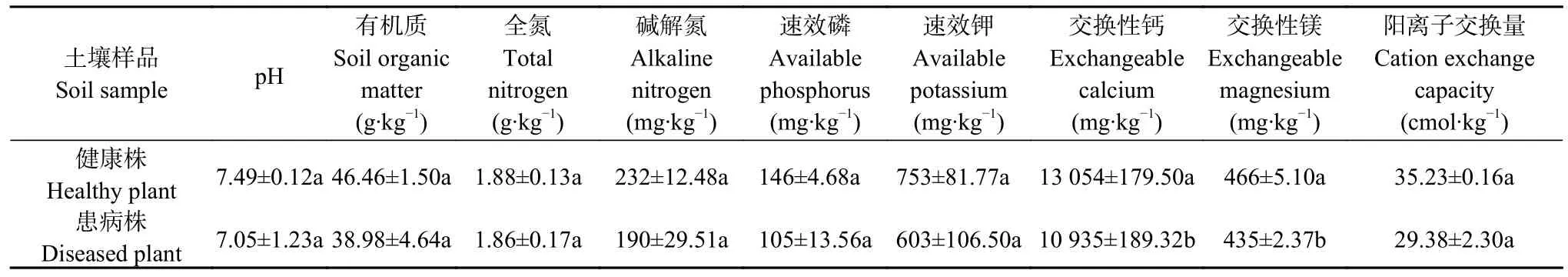
表1 健康与患根肿病白菜植株根围土壤理化性质Table 1 Physicochemical properties of bulk soil of healthy and clubroot infected Chinese cabbage plants
2.2 16S rDNA 和ITS 基因测序深度分析
当土壤样品在测序深度为20 000 时,土壤样品细菌稀释曲线趋于平缓(图1a); 在测序深度为40 000 时,土壤样品真菌稀释曲线趋于平缓(图1b)。即便再加大测序深度所观测到的细菌、真菌物种数已不会再增加,说明测序深度已经足够,本次测序结果能够满足后续样品间细菌、真菌群落结构的对比分析。
2.3 健康与患根肿病白菜根围土壤OTU 聚类分析
高通量测序结果显示芸薹根肿菌侵染白菜植株后细菌和真菌各分类学水平数量较健康白菜植株根围土壤均有所增加。其中,患根肿病白菜植株根围土壤细菌增加2 个门、5 个纲、14 个目、29 个科、72 个属、171 个种和581 个OTU; 患根肿病白菜植株根围土壤真菌增加1 个门、4 个目、12 个科、16个属、21 个种,而减少132 个OTU (表2)。健康白菜植株和患根肿病白菜植株根围土壤共有的细菌属为713 个,健康白菜植株根围土壤特有的细菌属为98 个,患根肿病白菜植株根围土壤特有的细菌属为171 个; 健康白菜植株和患根肿病白菜植株根围土壤共有的真菌属为325 个,健康白菜植株根围土壤特有的真菌属为88 个,患根肿病白菜植株根围土壤特有的真菌属为103 个(图2)。
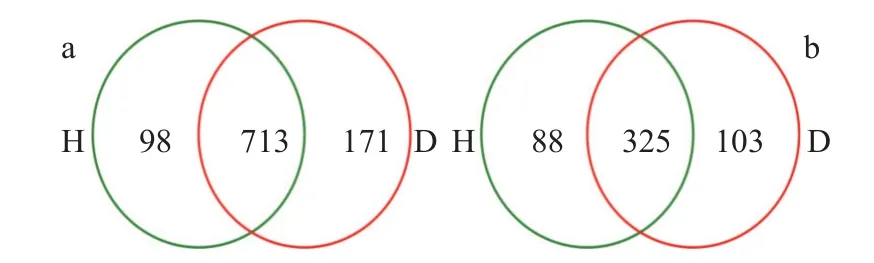
图2 健康(H)与患根肿病(D)白菜植株根围土壤细菌(a)和真菌(b)维恩图Fig.2 Venn diagram for bacterial (a) and fungal (b) communities in the bulk soil of healthy (H) and clubroot infected (D) Chinese cabbage plants
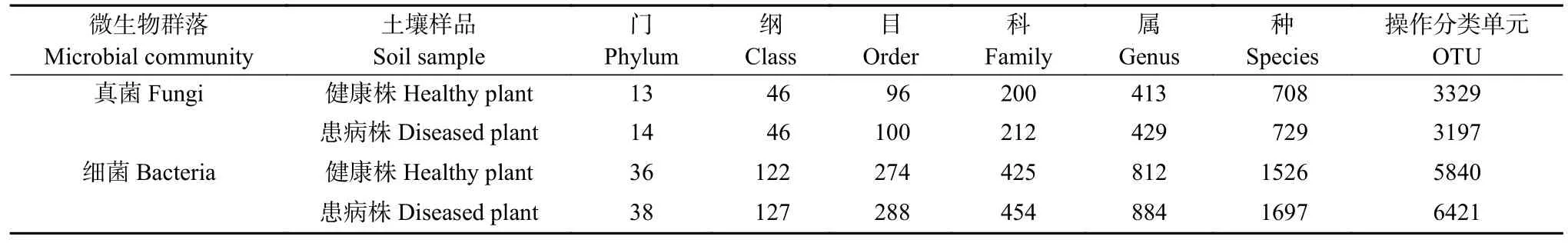
表2 健康与患根肿病白菜植株根围土壤不同分类水平微生物群落数Table 2 Number of microbial communities at different classification levels in the bulk soil of healthy and clubroot infected Chinese cabbage plants
2.4 健康与患根肿病白菜根围土壤微生物多样性指数
患根肿病白菜植株根围土壤真菌Chao 1 指数(417.96)和Shannon 指数(3.86)高于健康白菜植株根围土壤(412.20、3.84),但差异不显著。健康白菜植株根围土壤细菌Chao 1 指数(1018.24)和Shannon 指数(6.47)高于患根肿病白菜植株根围土壤(1011.91、6.43),但差异不显著(表3)。说明芸薹根肿菌侵染一定程度上使患根肿病植株根围土壤真菌多样性增加,细菌多样性减少。
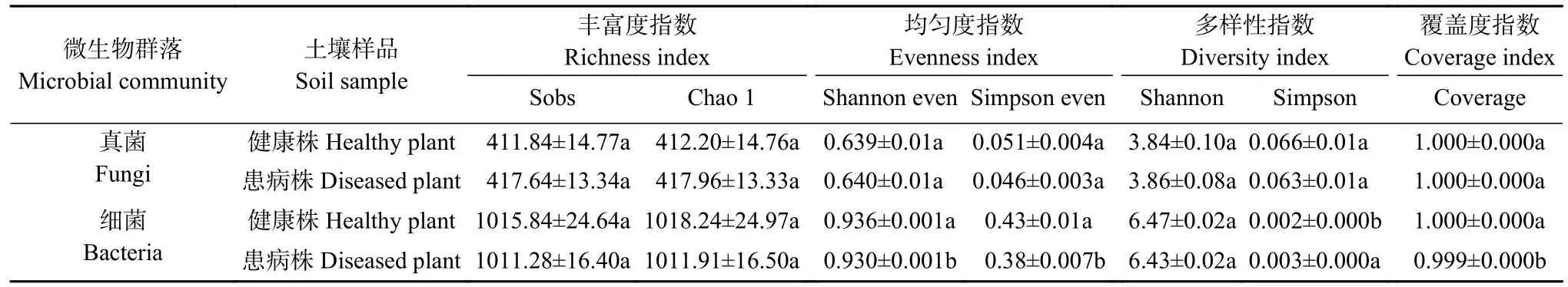
表3 健康与患根肿病白菜植株根围土壤微生物群落Alpha 多样性指数Table 3 Alpha diversity indices of bulk soil microbial communities of the healthy and clubroot infected Chinese cabbage plants
2.5 健康与患根肿病白菜根围土壤主坐标分析
健康白菜植株和患根肿病白菜植株根围土壤细菌、真菌群落组成具有显著差异(P<0.05),患根肿病根围土壤细菌、真菌群落组成趋于相似,健康白菜植株根围土壤细菌、真菌群落组成具有一定差异。基于weighted_unifrac 和bray_curtis 计算距离的PCoA分析在第1 主坐标和第2 主坐标上分别检测到所有土壤样本细菌群落差异的43.32%、24.33% (图3a),真菌群落差异的57.04%、22.83% (图3b)。

图3 健康与患根肿病白菜植株根围土壤细菌(a)和真菌(b)主坐标分析Fig.3 Principal coordinate analyses (PCoA) for bacteria (a) and fungi (b) in the bulk soil of healthy (H) and clubroot infected (D)Chinese cabbage plants
2.6 健康与患根肿病白菜根围土壤微生物群落组成
2.6.1 细菌群落组成
放线菌门(Actinobacteria)、变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、绿弯菌门(Chloroflexi)、酸杆菌门(Acidobacteria)和芽单胞菌门(Gemmatimonadetes)是细菌群落中的优势门(图4a),平均占比达90.59%。门分类学水平上,健康白菜植株根围土壤中的主要细菌门为放线菌门(31.22%)、变形菌门(20.71%)、厚壁菌门(13.57%)、绿弯菌门(12.07%),患根肿病白菜植株根围土壤中的主要细菌门为放线菌门(29.46%)、变形菌门(20.80%)、厚壁菌门(18.04%)、绿弯菌门(12.37%),可见健康白菜植株和患根肿病白菜植株根围土壤细菌的主要优势门组成一致,但各丰度稍有差异。健康白菜根围土壤中放线菌门、酸杆菌门、芽单胞菌门和硝化螺旋菌门(Nitrospirota)相对丰度较患根肿病白菜植株根围土壤高1.76%、2.04%、0.06%和0.21%,患根肿病白菜根围土壤变形菌门、厚壁菌门、绿弯菌门、Myxococcota 和拟杆菌门相对丰度较健康白菜植株根围土壤高0.09%、4.47%、0.30%、0.10%和0.03%。属分类学水平上(图4b),健康白菜植株根围土壤中的主要细菌属为芽孢杆菌属(Bacillus,5.62%)、Gaiella(3.93%)、Defluviicoccus(3.54%)、Clostridium_sensu_stricto_1(2.30%)和类诺卡氏属(Nocardioides,2.01%),患根肿病白菜植株根围土壤中的主要细菌属为芽孢杆菌属(4.74%)、Gaiella(3.41%)、Defluviicoccus(3.60%)、Clostridium_sensu_stricto_1(4.41%)和类诺卡氏属(2.25%),可见健康白菜植株和患根肿病白菜植株根围土壤细菌的主要优势属组成一致,但各丰度有所差异,健康白菜根围土壤中Solirubrobacter、硝化螺旋菌属(Nitrospira)相对丰度较患根肿病白菜植株根围土壤高0.05%和0.32%,患根肿病白菜根围土壤中链霉菌属(Streptomyces)、Romboutsia、鞘氨醇单胞菌属(Sphingomonas)、Turicibacter、小单胞菌属(Micromonospora)、斯克尔曼氏菌属(Skermanella)、Terrisporobacter分别较健康白菜植株根围土壤高0.16%、0.92%、0.20%、0.70%、0.11%、0.13%和0.92%。
2.6.2 真菌群落组成
门水平上(图5a),真菌群落中的子囊菌门(Ascomycota)在健康白菜植株和患根肿病白菜植株根围土壤中均是相对丰度最高的优势真菌门,平均占比达78.97%,且患根肿病白菜植株根围土壤中相对丰度(81.42%)高于健康白菜植株根围土壤(76.52%);被孢霉门(Mortierellomycota)相对丰度在所有样品中仅次于子囊菌门,其在健康和患根肿病白菜根围土壤中平均占比为11.63%,在健康白菜植株根围土壤中相对丰度(12.16%)高于患根肿病白菜植株根围土壤(11.10%); 此外,健康白菜植株根围土壤中壶菌门(Olpidiomycota)、担子菌门(Basidiomycota)相对丰度较患根肿病白菜根围土壤分别高3.81%和0.87%,而患根肿病白菜植株根围土壤中罗兹菌门(Rozellomycota)相对丰度较健康白菜植株根围土壤高0.12%。属水平上(图5b),相对丰度高于1%的属占76.98%~79.21%。健康白菜植株根围土壤中的优势真菌属分别为赤霉属(Gibberella,14.21%)、被孢霉属(Mortierella,12.69%)、梭孢壳属(Thielavia,10.14%)、油壶属(8.09%)、基孢霉属(Mortierella,6.66%),患根肿病白菜植株根围土壤中的优势真菌属依次为基孢霉属(17.53%)、梭孢壳属(12.67%)、被孢霉属(11.49%)、赤霉属(7.61%)、镰刀菌属(Fusarium,4.88%),可见健康株和患病株根围土壤的优势真菌属组成无较大差异,但相对丰度有所差异。此外,患根肿病白菜植株根围土壤中基孢霉属、梭孢壳属、丝壳属(Kernia)分别较健康白菜植株根围土壤高10.87%、2.53%和1.26%。因此,门水平上白菜根围土壤罗兹菌门相对丰度的变化及属水平上根围土壤中梭孢壳属、丝壳属两种真菌属相对丰度的变化可能与白菜根肿病的发生有较大关联。

图5 健康(H)与患根肿病(D)白菜植株根围土壤真菌群落在门水平(a)和属水平(b)的相对丰度Fig.5 Relative abundances at phylum (a) and genus (b) levels of fungi communities in the bulk soil of healthy (H) and clubroot infected (D) Chinese cabbage plants
2.7 健康与患根肿病白菜根围土壤微生物属水平LEfSe 物种差异分析
细菌群落(图6a)的LDA 分析(LDA>3,P<0.05 )表明: 门水平上,厚壁菌、Nitrospirota、Methymolirabilota、 unclassified_k_norank_d_Bacteria、 Entotheonellaeota 的相对丰度对健康白菜植株和患根肿病白菜植株根围土壤细菌群落差异效果影响最大; 属水平上,Clostridium_sensu_stricto_1、norank_f_Vicinamibacteraceae、norank_f_norank_o_Vicinamibacterales的相对丰度对健康白菜植株和患根肿病白菜植株根围土壤细菌群落差异效果影响最大。真菌群落(图6b)的 LDA 分析(LDA>3,P<0.05 )表明: 门水平上,Zoopagomycota、unclassified_k_Fungi 的相对丰度对健康白菜植株和患根肿病白菜植株根围土壤真菌群落差异效果影响最大; 属水平上,赤霉属、基孢霉属、丝壳属、尾孢属(Cercophora)、unclassified_k_Fungi的相对丰度对健康白菜植株和患根肿病白菜植株根围土壤真菌群落差异效果影响最大。其中,Nitrospirota、Methymolirabilota和赤霉属是健康白菜植株根围土壤中具有显著丰度差异特征的物种,Clostridium_sensu_stricto_1、厚壁菌、基孢霉属、Zoopago-mycota、丝壳属是患根肿病白菜植株根围土壤中具有显著丰度差异特征的物种。

图6 健康(H)与患根肿病(D)白菜植株根围土壤细菌(a)和真菌(b)属水平的LDA 判别结果图Fig.6 LDA discriminant result charts for genus level of bacteria (a) and fungi (b) in the bulk soil of healthy (H) and clubroot infected (D) Chinese cabbage plants
2.8 健康与患根肿病白菜根围土壤微生物功能预测
2.8.1 细菌群落功能预测
为探究健康白菜植株和患根肿病白菜植株根围土壤微生物群落在功能分布上的差异,利用PICRUSt2 对细菌群落进行功能预测,将预测结果与KEGG 数据库对比,并通过Wilcoxon 秩和检验对功能预测结果进行差异显著性分析。结果表明,新陈代谢、环境信息处理、细胞过程和有机系统是健康株与患病株根围土壤细菌群落具有显著差异的4 类细菌功能。其中,属于新陈代谢的细菌功能丰度占比最大,在健康土壤和患病土壤中的功能丰度分别达78.63%和78.38%。进一步分析代谢通路发现,新陈代谢以Global and overview maps 和Energy metabolism 为主,环境信息处理以Membrane transport 为主,细胞过程以Cellular community-prokaryotes 和Cell motility 为主,有机系统以Immune system 和Sensory system 为主(图7)。
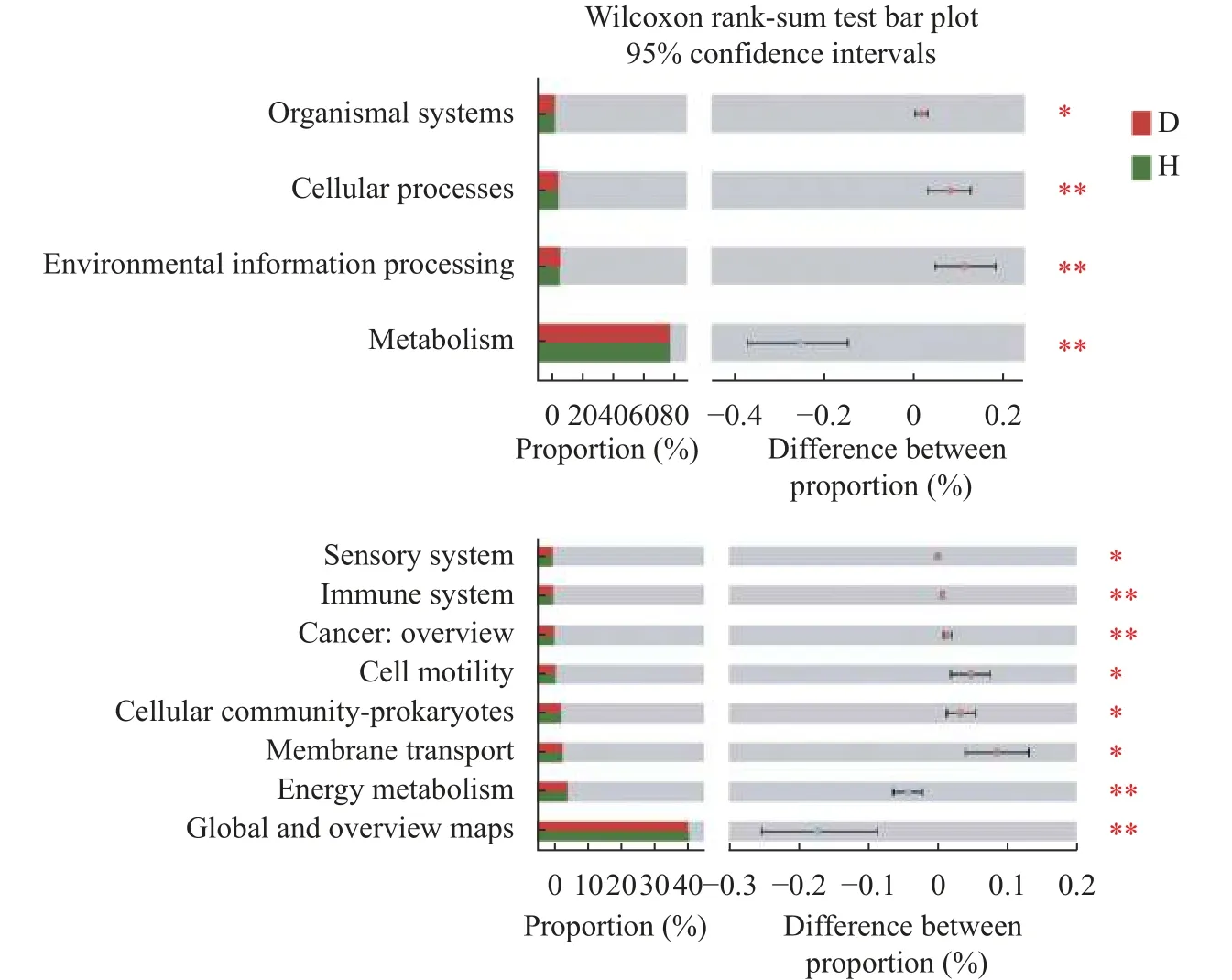
图7 健康(H)与患根肿病(D)白菜植株根围土壤细菌群落的功能预测Fig.7 Function prediction of bacteria community in bulk soil of the healthy (H) and clubroot infected (D) Chinese cabbage plants
2.8.2 真菌群落功能预测
FUNGuild 功能预测可根据真菌各功能在不同土壤样品中的丰度信息对真菌功能进行分类分析。通过分析,发现健康和患根肿病白菜根围土壤中病理营养性和腐生营养型2 个类群真菌相对丰度较高,其中Plant pathogen (病理营养型)对应的真菌有赤霉属、Plectosphaerella、Gibellulopsis,Endophyte-litter saprotroph-soil saprotroph-undefined saprotroph (腐生营养型)对应的真菌只有Mortierella,Dung saprotrophundefined saprotroph (腐生营养型)对应的真菌有梭孢壳属、丝壳属,Animal pathogen-endophyte-lichen parasite-plant pathogen-soil saprotroph-wood saprotroph 对应的真菌仅有镰刀菌属。Plant pathogen 在健康白菜植株根围土壤中的功能丰度为18.60%,在患根肿病白菜植株根围土壤中的功能丰度为10.70%;Dung saprotroph-undefined saprotroph 在健康白菜植株根围土壤中的功能丰度为9.49%,在患根肿病白菜植株根围土壤中的功能丰度为13.01%; Undefined saprotroph 在健康白菜根围土壤中的功能丰度为20.67%,在患根肿病白菜根围土壤中的功能丰度为30.78% (图8)。

图8 健康(H)与患根肿病(D)白菜植株根围土壤真菌群落的功能预测Fig.8 Function prediction of fungal community in the bulk soil of healthy (H) and clubroot infected (D) Chinese cabbage plants
2.9 微生物群落与土壤理化因子相关性分析
由于某些土壤因子间本身具有很强的相关性,会影响后续土壤因子相关性分析,因此,在进行土壤因子分析前,利用方差膨胀因子(variance inflation factor,VIF)对土壤理化因子进行筛选,删除VIF 值大于10 的无用土壤理化因子,保留相互作用较小的土壤因子进行后续分析。经VIF 筛选后,在健康白菜根围土壤和患根肿病白菜根围土壤中pH、全氮(TN)、碱解氮(AN)、速效钾(AK)、阳离子交换量(CEC)具有显著性差异,微生物群落数据为土壤样品中物种的相对丰度,然后基于冗余分析(RDA)描述环境因子与微生物群落结构关系。由表4 可知,pH、TN、AN、AK、CEC 是影响细菌群落和真菌群落的重要因子,其中pH、TN 与细菌群落结构存在显著相关性,pH、AN、AK 与真菌群落结构存在显著相关性。本研究基于VIF 的冗余分析结果如图9 所示,对于细菌群落而言,pH、TN、AN、AK、CEC 解释了44.01%的总特征值,并且这5 个环境因子解释了根围土壤真菌群落结构56.34%的总特征值,说明pH、TN、AN、AK 和CEC 对白菜植株根围土壤微生物有较大影响。进一步分析表明,pH、TN 是影响白菜根围土壤微生物群落改变的主要环境因子。
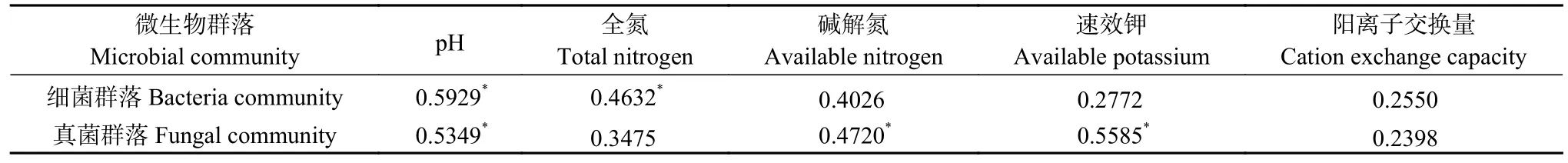
表4 土壤理化因子与细菌和真菌群落结构的相关性分析Table 4 Correlation analysis between the bacterial and fungal community structures with the different soil physical and chemical factors
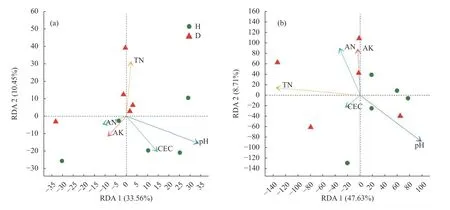
图9 经VIF 筛选后的土壤理化因子与健康(H)与患根肿病(D)白菜植株根围土壤细菌(a)和真菌(b)群落冗余分析Fig.9 Redundancy analysis on bacteria (a) and fungi (b) communities by properties of the bulk soil of healthy (H) and clubroot infected (D) Chinese cabbage plants after screening by variance inflation factor test
3 讨论
3.1 白菜健康株与根肿病患病株的土壤理化性状差异
土传病害日益给农业生产带来毁灭性的损失[15],详细了解土壤理化性质对解释根肿病的发生具有重要意义。本研究土壤理化性质测定结果显示,患根肿病白菜植株根围土壤pH、有机质、全氮、碱解氮、速效磷、速效钾、交换性钙、交换性镁和阳离子交换量均低于健康白菜植株根围土壤,这与孙战等[16]的研究结果一致。Pei 等[17]研究发现,根肿菌侵染发病与土壤pH、温度关系密切。本研究发现,在碱性条件芸薹根肿菌仍可侵染白菜根部导致根肿病发生流行,这与当地生产上采取大量施用硅钙肥(6.39 t·hm-2,硅钙总含量≥83%,CaO 含量≥47%,SiO2含量≥36%,pH 9~10)来防控根肿病的措施有关,大量施用硅钙肥导致土壤pH 升高,虽一定程度抑制了休眠孢子萌发,但再次种植十字花科作物依然发生根肿病危害。这与Knox 等[18]和Botero-Ramirez等[19]研究结果类似,即在感染根肿病的土壤中,pH、养分、水分与孢子含量间存在复杂的相互作用,仅提高土壤pH不足以控制根肿病的发生流行,即使在高pH 和高Ca 浓度的土壤中,根肿病的抑病机制也会受到水分、养分、温度、孢子数量等其他潜在因素的限制。闫玉芳等[20]对患根肿病的茎瘤芥(Brassica junceavar.tumida)土壤N、P、K 及有机质含量进行了分析,发现患根肿病土壤中N、K 含量较高,且病害随N、P含量的增加而加重,而患根肿病土壤有机质含量显著低于发病程度较轻的土壤。本研究也得出类似结果。班洁静等[21]研究发现,pH 与Ca2+浓度密切影响芸薹根肿菌的侵染与发病,酸性和中性高Ca2+浓度可抑制孢子萌发,降低病害严重程度,而碱性条件下Ca2+浓度作用不明显。土壤中高含量可交换性钙可一定程度减轻根肿病的危害,但本文研究发现,即便在较高的土壤交换性钙镁水平下,根肿病依然发生流行。
3.2 白菜健康株与根肿病患病株根围土壤微生物群落Alpha 多样性差异
土壤微生物是影响土壤健康和植物健康的关键因素,它以竞争营养生态位、分泌抑菌代谢物质和诱导植物抗性等机制抑制土壤中的病原体[22]。因此,土壤微生物经常被用作土壤健康的衡量指标[23]。当根际微生物区系结构合理,多样性程度越高、物种越丰富,作物抗病能力就越强[24]。本研究Alpha 多样性结果分析表明,白菜根围土壤中细菌种群数量高于真菌,健康白菜植株根围土壤细菌、真菌结构组成类似,患根肿病白菜植株根围土壤细菌结构组成趋于相似,而真菌结构组成差异较大。这与伍文宪等[24]在健康和患根肿病十字花科作物根际土壤微生物群落结构差异上的结果一致。细菌性土壤是土壤肥力的重要生物指标,其数量和多样性一定程度上反映了土壤的健康状况[25-27]。本研究发现,健康白菜植株根围土壤细菌均匀度和多样性指数均高于患根肿病植株根围土壤,这些更丰富的细菌类群可能与抑制疾病有关。根肿菌侵染导致土壤细菌群落多样性减少,使得土壤微生态发生变化[24]。而患根肿病白菜植株根围土壤真菌丰富度及多样性指数则高于健康白菜植株根围土壤,意味着根肿病的发生对土壤真菌群落组成影响较大。
3.3 白菜健康株与根肿病患病株根围土壤群落组成及优势菌群差异
芸薹根肿菌侵染十字花科作物时,根际土壤中的微生物群落结构会发生不同程度变化[28]。Saraiva等[29]在根肿病发病程度重和发病程度轻的土壤细菌群落组成上发现,发病程度较重和发病程度较轻的土壤细菌组成在门水平和属水平上存在差异。本研究发现,患根肿病白菜植株根围土壤中放线菌等有益微生物相对丰度明显低于健康白菜植株根围土壤。Hu 等[30]在白菜根际土壤微生物群落差异上的研究表明,细菌中放线菌、酸杆菌、变形杆菌、厚壁菌、拟杆菌、芽单胞菌是主要的优势菌群,真菌门水平上子囊菌门、担子菌门是主要优势菌群,本研究结果与其一致。变形杆菌和酸杆菌是土壤抑制植物病原菌的重要生物指标,本研究发现,健康白菜植株根围土壤放线菌、变形杆菌、酸杆菌、芽单胞菌相对丰度均高于患根肿病植株根围土壤,与Wang 等[31]、Wang 等[32]的研究结果一致。Saraiva 等[29]研究发现,根肿病发病较轻的土壤以硝化螺旋菌和芽孢杆菌为主,发育较好的根系更利于植株从土壤吸收营养物质,而这些营养物质也有益于芽孢杆菌、硝化螺旋菌的生长[29],本研究亦发现,健康白菜根围土壤芽孢杆菌、硝化螺旋菌和被孢霉菌相对丰度分别为5.62%、1.38%和12.69%,高于患根肿病植株根围土壤。患根肿病植株根围土壤Defluviicoccus、类诺卡氏属、基孢霉属、梭孢壳属、丝壳属相对丰度分别为3.60%、2.25%、17.53%、12.67%和3.32%,高于健康植株土壤。说明根肿病的发生影响了根围土壤微生物群落组成结构,导致健康株与患病株根围土壤中优势菌属占比不同。
3.4 白菜健康株与根肿病患病株根围土壤微生物功能预测
PICRUSt2 分析得到健康株与患病株根围土壤细菌群落中具有显著差异的新陈代谢、环境信息处理、细胞过程和有机系统4 大类功能以及8 个二级功能,其中新陈代谢类的功能丰度较大,这与杨盼等[33]对苜蓿(Medicago sativa)根际土壤细菌群落功能预测分析的研究结果一致,这可能与植株的分泌物有关。本研究在健康白菜植株根围土壤中检测到被孢霉[34]、鞘氨醇单胞菌[8]、 芽孢杆菌[5]、链霉菌[30]等有益微生物,且健康土壤中被孢霉和芽孢杆菌相对丰度明显高于患根肿病植株根围土壤,在患根肿病植株根围土壤中发现油壶菌[35]、镰刀菌[36]、丝壳菌[37]、梭状芽孢杆菌[38]和赤霉菌[39]等病原菌富集,这与Yang等[8]在不同轮作方式对根肿病发生及根际微生物多样性影响的研究结果一致。本研究还发现了一些仅存在于健康白菜植株根围土壤样本的未知细菌和真菌,这些微生物可能是防治根肿病潜在的生防资源;此外,在健康白菜植株根围土壤中也检测到了其他作物的多种病原菌,如镰刀菌、赤霉菌,这些病原菌对白菜等非寄主植物的影响还有待进一步的研究。本研究利用FUNGuild 预测真菌群落的功能,结果表明属于腐生营养型和植物病理性这两个类群的功能丰度较高,一些典型的腐生真菌或致病菌在患根肿病白菜植株根围土壤样本中检测到。因此,我们推测,根肿菌需要在腐生微生物的帮助下腐烂和分解寄主根,以便在白菜生长发育的后期将休眠孢子释放到土壤中[28]。说明根肿病的发生通过影响真菌群落组成结构,可能导致其功能改变,最终引起群落失衡。
4 结论
土壤理化因子与白菜根围土壤微生物群落密切相关,其中pH、全氮、碱解氮、速效钾和阳离子交换量是影响健康白菜植株和患根肿病白菜植株根围土壤微生物群落结构的主要环境因子。Nitrospirota、Methymolirabilota和赤霉属是健康白菜植株根围土壤中具有显著丰度差异特征的物种,Clostridium_sensu_stricto_1、厚壁菌门、基孢霉属、Zoopagomycota、丝壳属是患根肿病白菜植株根围土壤中具有显著丰度差异特征的物种。新陈代谢、环境信息处理、细胞过程和有机系统是健康株与根肿病患病株根围土壤中具有显著差异的细菌功能。
十字花科作物土壤优势微生物之间的相互作用和十字花科作物富集土壤微生物群落的机制及如何利用这些机制来提高作物质量还有待进一步研究,此外,研究还发现了非十字花科作物寄主的病原微生物,其与十字花科作物的作用机制还需进一步探究,以便更深入地了解与根肿病相关的微生物群落,防止土壤生物多样性的进一步丧失,并达到控制根肿病危害的目的。

