3%卵磷脂·维生素E 对草甘膦的增效作用及在植物体内吸收与传导的影响
相世刚, 强 胜, 夏爱萍, 李春林, 左 娇, 宋小玲*,, 张瑞萍*,,3
(1.南京农业大学 生命科学学院 杂草研究室,南京 210095;2.北京成禾佳信农资贸易有限公司,北京 100025;3.江苏爱佳福如土壤修复有限公司江苏省研究生工作站,江苏 南通 226300)
草甘膦 (glyphosate)是一种具有强内吸传导性的非选择性除草剂,广泛用于非耕地、园地、林地等,以及农田播种前除草、作物收获后倒茬期间除草。草甘膦因杀草活性高、杀草谱广、土壤残留期短、低毒等优异的特性使其成为世界上应用最广泛的除草剂[1]。尽管草甘膦能够被土壤中的无机和有机颗粒快速吸收和降解或固定在土壤中,对微生物和动物毒性低,但其在杂草管理中反复大规模使用可能会对土壤生物、水生生物和人类造成有害影响[2]。2015 年3 月,世界卫生组织(WHO) 的国际癌症研究机构根据流行病学研究,将草甘膦归类为“可能人类致癌物”(2A 类)[3]。因此应采取措施在不影响草甘膦药效的同时降低其使用量,从而减轻其对环境的影响。研究表明,喷雾时添加助剂可以提高除草剂药效,实现减量施用,减少对作物和环境的负面影响[4-5]。安融乐®是由南非西北大学开发的从大豆中提取的新型生物增效喷雾助剂,在1947 年的南非第36 号法案中作为农药助剂注册 (注册号:L9443),主要成分为卵磷脂和维生素E (www.AnnGro.com)。前期研究表明,安融乐®可通过泡囊包裹并携带肥料或农药,进入植物体内并上下传导,从而提高植物对肥料的吸收和利用,增加农药对病虫草害的防控效果[6-14]。
目前,有关安融乐®与除草剂混用增效机理方面的研究报道较少,本研究团队从安融乐®加速草甘膦靶标酶(EPSPS)的失活和莽草酸的积累方面做了初步研究[15],但有关其对草甘膦药液在植物体内的吸收和传导的影响尚未见报道。本研究以草甘膦异丙胺盐水剂为供试药剂,以空心莲子草为供试杂草,通过室内生物测定和同位素示踪技术等方法,研究安融乐®对草甘膦在植株表面的润湿展布能力和吸收与传导的影响,并探究安融乐®对除草剂的减量增效效果和作用机理,旨在为安融乐®作为除草剂的增效助剂进一步推广应用提供理论基础。
1 材料与方法
1.1 供试杂草、药剂和仪器
空心莲子草Alternanthera philoxeroides,采于南京市荒地,选取5 对叶期,茎长5 cm,须根位于倒五叶下侧,须根长1 cm 且长势一致的幼苗,移栽至装有普通黄土和腐殖质质量比为3 : 1 混合的土壤的塑料盆钵 (直径23 cm,高度20.3 cm)中,每盆均匀移栽5 株,待杂草生长至8~10 对叶期时用于生物测定。
供试药剂:4 1% 草甘膦异丙胺盐水剂(glyphosate-isopropylammonium 41% AS),分别为苏州佳辉化工有限公司(商品名为发达®,英文简称FD) 和美国孟山都公司(商品名为农达®,英文简称RD)生产的市售产品。供试增效助剂3% 卵磷脂 • 维生素E 悬浮剂 (商品名为安融乐®),由北京成禾佳信农资贸易有限公司提供,生产商为南非尼勒思科882 有限责任公司。供试药剂14C-草甘膦水剂,放射性活度为3.7 × 104Bq,由美国放射性标记化学品股份有限公司生产。
供试仪器:1.5 L SX-574 手持式喷雾器 (市下牌,市下控股有限公司);界面张力仪JZHY-180 型 (承德大华试验机有限公司);接触角测定的接触角测量仪JC2000C1B型 (上海中晨数字技术设备有限公司);放射性活度测定的液体闪烁计数仪(贝尔曼 LS6500)。
1.2 试验方法
1.2.1 安融乐®对草甘膦的增效作用测定 2 种41% 草甘膦异丙胺盐水剂发达®和农达®均设置7 个剂量:0 (CK)、375、750、1500、2250、3000和6000 mL/hm2;安融乐®以0.20 mL/L 的比例在喷药前桶混于供试药剂各剂量中。
选用适宜天气,在室外采用1.5 L 手持式喷雾器对整株杂草均匀喷雾,兑水量为45 mL/m2。不同药剂使用独立的喷雾器,避免相互影响。分别于用药后3、4、5 和7 d 观察并记录空心莲子草的中毒症状和死亡速度,进行中毒等级分级 (表1)。计算各药剂对空心莲子草的中毒综合指数。用Origin8.0 分析软件进行剂量和1 - 中毒综合指数的Logistic 剂量-反应曲线拟合,得出回归方程,计算ED50和ED90值及其置信区间。根据杂草的ED50及ED90值分析评估安融乐®分别与发达®和农达®混用后对杂草防除效果的影响。各指标按公式 (1)~(3) 计算。

表1 空心莲子草中毒症状分级标准[16]Table 1 Classification criteria for injury symptoms of Alternanthera philoxeroides[16]
式中:RI为中毒综合指数;N1为每盆各中毒级别株数;N2为每盆总株数;I1为中毒级别;R50为ED50值降低百分比;E1为除草剂单用杂草的ED50值;E2为除草剂与安融乐®混用杂草的ED50值;R90为ED90值降低百分比;E3为除草剂单用杂草的ED90值;E4为除草剂与安融乐®混用杂草的ED90值。
1.2.2 表面张力和接触角的测定
1.2.2.1 表面张力测定 发达®和农达®的供试剂量均为4.44 mL/L,它们分别与0.20 和0.40 mL/L 安融乐®混合均匀后用于试验。
按照国家标准GB 5549—1990《表面活性剂用拉起液膜法测定表面张力》进行测定。同一样品连续测量5 次,且5 次测得的表面张力值相差不超过0.2 mN/m,取其算数平均值后乘以校正因子获得实际表面张力值。试验时保持恒温(24 ±0.5) ℃。按公式 (4) 计算表面张力降低率。
式中:RS为表面张力降低率;S1为除草剂与安融乐®混合药液的表面张力,mN/m;S2为除草剂单用的表面张力,mN/m。
1.2.2.2 接触角测定 选取新鲜洁净的空心莲子草倒4 叶叶片,使叶面保持自然状态并平整地固定在接触角测量仪的载物台上,用微量注射器分别抽取出体积为5 μL 的药液滴在叶片上表皮上,用接触角测量仪上的CCD 摄像头摄下叶面上的液滴,每30 s 拍摄一次,连续拍摄10 次,用拟合分析法计算出药滴在空心莲子草叶面上的接触角。每个处理重复测定4 次。试验时温度为(28 ± 2) ℃。测定结果发现,在液滴滴下300 s 后,药液在叶表面的接触角达到最小接触角,且保持不变,由此根据液滴滴下300 s 后的接触角对安融乐®的增效机理进行分析。用相同方法测定供试药剂与叶片下表皮的接触角。按公式 (5) 计算接触角降低率。
式中:Rθ为接触角降低率;θ1为除草剂与安融乐®混合药液在叶片上的接触角;θ2为除草剂单用在叶片上的接触角。
1.2.314C-草甘膦在空心莲子草体内的吸收与传导测定
1.2.3.114C-草甘膦处理空心莲子草 试验共设两个处理:14C-草甘膦水剂 + 无菌水 (10.0 μL + 0.5 μL);14C-草甘膦水剂 + 安融乐®(10.0 μL + 0.5 μL)。每个处理重复16 株。
试验在南京农业大学高放射性同位素实验室进行。同位素样品的保存、使用操作规程、废物处理等严格遵照《南京农业大学放射性同位素管理条例》执行。选择健康的8~10 对叶龄且高度和根长一致的空心莲子草,以倒4 叶 (从植株顶部往下数至第4 对叶) 为处理叶,用微量注射器将10.5 μL 药液 (放射性活度为3.7 × 104Bq) 均匀点在上表皮叶脉两侧。待植株上药液自然铺展并完全蒸干后,将空心莲子草植株转移至高放射性植物培养室进行光照培养,培养温度为 (28 ± 2) ℃,光照/黑暗为14 h/10 h,光强为5000 lx。
1.2.3.2 自显影胶片成像 将培养2 和4 d 后的植株用10%的乙醇溶液10 mL 分4 次淋洗处理叶片表面,合并淋洗液待用。处理叶淋洗后,小心将植株从土壤中取出,将根部擦拭干净,切勿破坏根须,植株固定在标本夹中,压成标本杀青。采用接触曝光法于标本制作后10 d 进行自显影胶片制作。
1.2.3.314C-草甘膦闪烁计数测定 将1.2.3.2 节的淋洗液混匀后取出200 μL 作为样品测定。分别培养2 和4 d 后的植株采样自显影后,将植株分成处理叶以上茎叶、处理叶、处理叶以下茎叶、根状茎、根共5 部分,分别用液氮磨成细粉末称重,记为m1。将细粉末混匀取出0.05 g 左右,记为m2,作为样品测定。将上述淋洗液以及植株5 个部分的细粉末样品均分别加入闪烁液300 μL,混匀后用液体闪烁计数仪测量各样品的放射性活度。计数效率为95%。按公式 (6) 计算各部位的放射性活度。
式中:Bq为植株各部位的放射性活度;DPM为实际测量的各样品的放射性活度;m1为植株各部位分别用液氮磨成细粉末称重的质量,g;m2为测定时分别称取的植株各部位的实际质量,g。
1.3 数据处理
采用Excel 2010 和SPSS 21 软件对数据进行统计分析,并利用Origin8.0 分析软件作图。
2 结果与分析
2.1 空心莲子草中毒级别和死亡速度分析
药剂处理5 d 后,在相同剂量下,发达®或农达®与安融乐®混用处理的空心莲子草中毒症状和中毒等级均比发达®和农达®单用更为严重,中毒级别平均增加1 级 (表2),且杂草完全死亡的时间均提前1 d。说明安融乐®对2 种草甘膦异丙胺盐水剂均有明显的增效作用。

表2 发达® 和农达® 单用及其与安融乐® 混用下空心莲子草的中毒级别 (处理5 d 后)Table 2 Injury levels of A.philoxeroides treated with FD and RD alone and mixed with AnnGro® (5 days after application)
2.2 ED50 值及ED90 值的分析
生物测定试验结果表明,对空心莲子草,发达®和农达®分别与安融乐®混用与其单用处理出现不同的Logistic 剂量-反应曲线 (图1) 以及ED50和ED90值 (表3)。其中,发达®与安融乐®混用后,空心莲子草的ED50值和ED90值比其单用分别降低34.9%和21.4%;农达®与安融乐®混用后,空心莲子草的ED50值和ED90值分别降低35.9%和23.3%。说明,安融乐®对2 种41%草甘膦异丙胺盐水剂均有明显的减量增效作用。

图1 发达®和农达®单用及其与安融乐®混用下空心莲子草logistic 剂量-反应曲线方程Fig.1 Logistic dose-response curve equations of A.philoxeroides treated with FD and RD alone and mixed with AnnGro®

表3 发达®和农达®单用及其与安融乐®混用对空心莲子草的ED50 和ED90 值Table 3 ED50 and ED90 values of A.philoxeroides treated with FD and RD alone and mixed with AnnGro®
2.3 安融乐® 对草甘膦异丙胺盐药液表面张力的影响
发达®和农达®分别与0.20 和0.40 mL/L 的安融乐®混用,与其单用相比表面张力均呈现下降趋势。与发达®单用相比,药液表面张力降低率分别为12.70%和15.23%;与农达®单用相比,药液表面张力降低率分别为2.19%和5.29% (表4)。由此可知,安融乐®可以降低2 种41%草甘膦异丙胺盐水剂的表面张力,且随着安融乐®剂量增大,表面张力降低更明显,其中,安融乐®对发达®表面张力的影响更大。
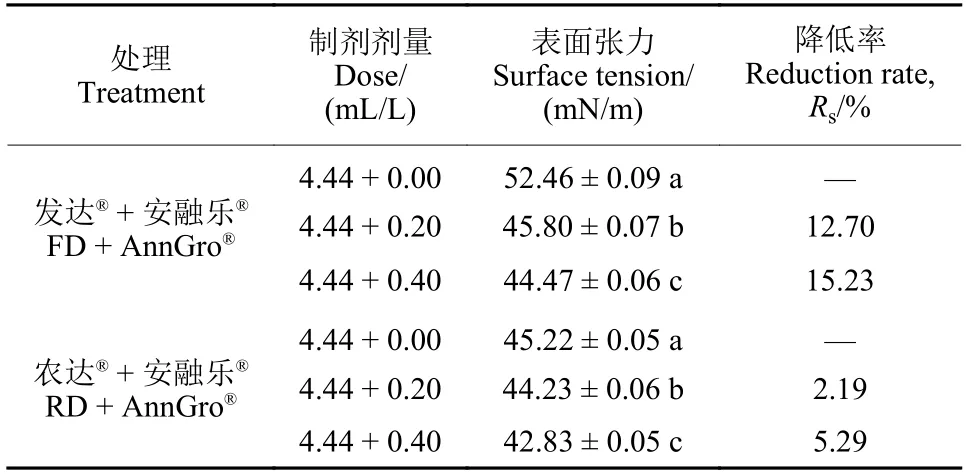
表4 安融乐®对41% 草甘膦异丙胺盐水剂药液表面张力的影响Table 4 Effect of AnnGro® on the surface tension of 41%glyphosate-isopropylammonium AS
2.4 安融乐® 对草甘膦异丙胺盐在空心莲子草叶片上的接触角影响
发达®和农达®分别与0.20 和0.40 mL/L 的安融乐®混用,与其单用相比,在空心莲子草叶片上、下表皮的接触角均明显变小 (表5)。其中与发达®混用上表皮接触角降低率分别为9.72% 和19.97%,下表皮接触角降低率分别为14.96%和32.44%;与农达®混合后,上表皮接触角降低率分别为11.81%和23.30%,下表皮接触角降低率分别为16.14%和23.21%。说明0.20 和0.40 mL/L安融乐®与41%草甘膦异丙胺盐水剂混用,可以降低药液在空心莲子草上下表皮的接触角。

表5 安融乐® 对41%草甘膦异丙胺盐水剂在空心莲子草叶片上接触角的影响Table 5 Effect of AnnGro® on contact angles of 41% glyphosate-isopropylammonium AS on the leaf of A.philoxeroides
2.5 14C-草甘膦在空心莲子草不同部位的吸收和传导
通过观察全植物放射自显影图像 (图2) 可知,在处理4 d 后,单用处理下,14C-草甘膦在空心莲子草体内的主要传导部位位于处理叶以上茎叶(图2 a-1),向下传导量较少 (图2 a-2,a-3)。与安融乐®混用处理下,14C-草甘膦向植株两端传导,在植株体内各部位的传导量均较高 (图2 b-1,b-2,b-3),尤其在根部传导量较单用14C-草甘膦有明显增加 (图2 b-2,b-3,a-2,a-3)。
液体闪烁计数测定结果 (表6) 表明,14C-草甘膦 + 安融乐®处理的空心莲子草各部位14C-草甘膦吸收和传导量显著高于单用14C-草甘膦处理。处理2 d 后,14C-草甘膦单用和14C-草甘膦 + 安融乐®处理的植株总吸收量分别为7.60%和10.67%,其中植株体内总传导量分别为2.69% 和3.92%,向下传导量 (处理叶以下地上部分茎叶、根状茎、根) 分别为2.31% 和3.07%。14C-草甘膦 + 安融乐®处理植株体内的14C-草甘膦总吸收量、总传导量和向下传导量是单用14C-草甘膦的1.14、1.46和1.33 倍。处理4 d 后,植株体内的14C-草甘膦的吸收传导量较2 d 明显增加。14C-草甘膦单用和14C-草甘膦 + 安融乐®处理的植株体内总吸收量分别为11.92%和27.80%,其中植株体内总传导量分别为11.81%和27.64%,向下传导量分别为11.13%和26.28%。14C-草甘膦 + 安融乐®处理植株体内14C-草甘膦总吸收量、总传导量和向下传导量是单用14C-草甘膦的2.33、2.34 和2.36 倍。综上所述,安融乐®对14C-草甘膦在空心莲子草体内的吸收和传导量有明显提高效果,尤其对向下传导量的促进作用更大。
3 讨论
在农业领域,卵磷脂的应用研究主要有两个方面:一是卵磷脂成分本身给植物体带来的生物学功能,例如促进种子萌发、抗冻、调节生长等[17];二是卵磷脂作为增效助剂 (例如安融乐®),是药物的运输载体,通过与肥料、农药混用起到对药肥减量增效的作用。相世刚等[18-19]研究表明,加入安融乐®可以使氰氟草酯对稻田稗草和千金子的防效提高19%~32%,并提高氯氟吡氧乙酸和2 甲4 氯对猪秧秧、大巢菜和野芥菜3 种杂草的防效。张瑞萍等[20]研究发现,安融乐®与2 种不同剂型的草铵膦混用,能有效增加草铵膦对野生芥菜的作用速度,并提升10.9%~44.8%的防除效果。宋喜娥等[21]研究发现,添加稀释倍数为2500 的安融乐®可以提高烯禾啶对牛筋草的防效。本研究结果显示,安融乐®与草甘膦异丙胺盐水剂混合后施用,能提高其对空心莲子草的防除效果,并促进杂草死亡。该结果与文献报道的研究结果一致。
相同剂量下,草甘膦的药效取决于植物的吸收和传导效率。吸收效率受雾滴大小、药液浓度、药液在植物叶片上润湿铺展能力、环境湿度等因素的影响[22]。喷雾助剂能够增加除草剂的药效,其主要原因是其降低药液液滴在植物表面的接触角和表面张力,改善了药液的润湿展布能力,从而提高了植物对除草剂的吸收和传导量[23]。本研究结果表明,0.20 和0.40 mL/L 的安融乐®分别与2 种41%草甘膦异丙胺盐水剂混用后,均能显著降低它们的表面张力和接触角,说明安融乐®能提高供试药剂的湿润性能。除药液润湿展布性能,除草剂能否通过角质层和质膜两道屏障也是影响茎叶除草剂药效的主要原因[24]。在药后分别2 d 和4 d,14C-草甘膦 + 安融乐®处理的吸收量分别是单用14C-草甘膦处理的1.14 和2.23 倍。安融乐®的主要成分卵磷脂属于两性离子表面活性剂,能够与角质层的蜡质和质膜紧密结合,从而可增加除草剂的穿透能力,加快除草剂进入细胞内部,达到靶标部位而实现防除效果。
传导是内吸传导型除草剂发挥药效最为重要的过程[25]。由于草甘膦的施用量被限制,导致除草剂在植物体内传导量不足,多年生杂草往往无法彻底死亡,出现反复再生的情况[26-27]。本研究发现,安融乐®提高了草甘膦在处理叶上部、处理叶、处理叶下地上部分和地下部分 (茎和根部) 的吸收和积累,从而促进了草甘膦在植物体内的双向传导。这对多年生难除杂草的有效防除有重要意义,因此建议将安融乐®作为除草剂的增效助剂进一步推广应用。

