血清胆红素与颅内动脉粥样硬化性狭窄的相关性


[摘要] 目的 探讨血清胆红素水平对颅内动脉粥样硬化性狭窄(ICAS)的影响。
方法 以接受磁共振血管成像(MRA)检查、年龄≥40岁非脑卒中病人以及健康查体者753例作为研究对象,其中无ICAS者601例(对照组),有ICAS者152例(病例组);年龄≤65岁331例,gt;65岁422例。对纳入人群采用多元回归模型分析胆红素与ICAS的关系。
结果 对照组的总胆红素(TBIL)、直接胆红素(DBIL)和间接胆红素(IBIL)的水平均显著高于病例组(H=4.867~5.669,Plt;0.05)。多元回归分析显示,TBIL(OR=0.93,95%CI=0.87~0.99,P=0.018)、DBIL(OR=0.66,95%CI=0.48~0.89,P=0.007)和IBIL(OR=0.92,95%CI=0.86~0.99,P=0.030)是非卒中情况下ICAS的独立保护因素。在总人群中,TBIL(OR=0.40,95%CI=0.23~0.79,P=0.001)、DBIL(OR=0.54,95%CI=0.30~0.96,P=0.037)和IBIL(OR=0.50,95%CI=0.28~0.86,P=0.013)的第四四分位数组发生ICAS的风险均较低。此外,gt;65岁的受试者TBIL(OR=0.92,95%CI=0.86~1.00,P=0.044)和DBIL(OR=0.65,95%CI=0.44~0.96,P=0.031)与ICAS显著相关,IBIL(OR=0.92,95%CI=0.83~1.00,P=0.058)可能对ICAS有保护作用。
结论 血清TBIL、DBIL和IBIL水平升高与ICAS风险降低相关,且对65岁以上的老年人保护作用更为显著。
[关键词] 胆红素;颅内动脉硬化;保护因素
[中图分类号] R743.1
[文献标志码] A
[文章编号] 2096-5532(2023)02-0274-04
doi:10.11712/jms.2096-5532.2023.59.009
[开放科学(资源服务)标识码(OSID)]
脑卒中事件是全球第二大致死原因。80%以上的急性卒中事件为缺血性卒中。动脉粥样硬化性狭窄是缺血性脑卒中的主要危险因素之一。年龄gt;65岁的老年人群中约80%存在颅内动脉粥样硬化的病理证据。众所周知,高龄、糖尿病、高血压及血脂异常是颅内动脉粥样硬化性狭窄(ICAS)的重要病因。研究表明,血清胆红素对人体血管可能具有保护作用。目前研究多认为升高血清胆红素可延缓动脉粥样硬化的进程,降低ICAS的风险。本文研究中国非卒中人群血清胆红素水平与ICAS之间的关系,以探究胆红素是否可以作为ICAS的保护因素。
1 资料和方法
1.1 研究对象
研究对象为2014年1月—2018年6月在青岛大学附属青岛市市立医院神经内科就诊的非脑卒中病人及健康体检中心查体者。入选标准:①年龄≥40岁;②完成颅脑磁共振成像和磁共振血管成像(MRA)及相关实验室检查。排除标准:①服用可能会影响胆红素水平的他汀类等降脂药物;②颅外动脉粥样硬化性狭窄;③有可能发生心房颤动等心源性脑卒中和心脏栓塞的证据;④由于非动脉粥样硬化性疾病,如夹层、动脉炎、烟雾病和肌纤维发育不良,导致颅内和(或)颅外动脉狭窄;⑤感染、肿瘤、慢性肝病及肾功能不全;⑥既往卒中史。最终,共纳入受试者753例,经颅脑MRA检查601例无ICAS,152例有ICAS。根据年龄分为2组,gt;65岁(老年组)422例,40~65岁(中年组)331例。
1.2 ICAS的评估和受试者分组
应用磁共振扫描仪(3.0 Tesla)进行颅脑磁共振平扫和MRA,磁共振扩散加权成像用于排除急性缺血性卒中,MRA对ICAS进行评估。行颈动脉超声、颈部MRA或计算机断层血管造影排除颅外动脉粥样硬化狭窄。由两名放射科医生分析图像,意见不同时由第三位放射科医生审查。评估以下动脉:颈内动脉和椎动脉的颅内段、基底动脉、大脑中动脉(M1、M2)、大脑前动脉(A1、A2)和大脑后动脉(P1、P2)。将ICAS定义为在上述动脉中存在一个或多个≥50%的动脉粥样硬化狭窄。根据影像学结果,将受试者分为ICAS组和非ICAS组。
1.3 数据采集
收集研究对象人口统计学(年龄、性别)和风险因素(吸烟、饮酒、高血压、糖尿病、冠心病和高脂血症等)数据。高血压:收缩压≥18.67 kPa和(或)舒张压≥12.00 kPa,正在服用降压药,或有自我报告的高血压史。糖尿病:空腹血糖≥7.0 mmoL/L,或糖化血红蛋白浓度≥6.5%,使用降糖药物或自我报告糖尿病史。中度至重度饮酒:每周乙醇摄入超过168 g。吸烟:每天至少吸1支烟。血脂异常:TC≥5.2 mmol/L,或TG≥1.7 mmol/L,或HDL-Clt;1.0 mmol/L,或LDL-C≥3.4 mmol/L,或正在服用降脂药物。
1.4 胆红素水平测定
采集所有研究对象的隔夜空腹外周静脉血,应用自动分析平台(BECKMAN COULTER au 5800: BECKMAN COULTER Inc. Brea,CA,USA)测定空腹血清胆红素、三酰甘油(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)水平。
1.5 统计学分析
应用R软件(4.0.2版)进行统计学处理。正态分布计量资料结果以±s表示,数据间比较采用Kruskal-Wallis方法;非正态分布计量资料结果以四分位数范围(M(IQR))表示,数据间比较采用Kruskal-Wallis方法。计数资料以频数和百分率表示,数据间比较采用卡方检验。采用多元Logistic回归分析胆红素水平或者其四分位数是否与ICAS存在独立相关性时,将所有的协变量(年龄、性别、收缩压、高血压、糖尿病、冠心病、吸烟、饮酒、TG、TC等)纳入回归模型中,以最低四分位数作为参考组。结果以95%置信区间 (95%CI)的比值比(OR)表示。所有数据差异的显著性水平设为Plt;0.05。
2 结 果
2.1 研究对象基线资料比较
ICAS组与非ICAS组性别、高血压、冠心病、吸烟、饮酒、HDL-C、LDL-C、TG、TC差异无显著性(Pgt;0.05);ICAS组年龄、收缩压及糖尿病占比显著高于非ICAS组(H=15.950、5.006,χ2=5.579,Plt;0.05);ICAS组的总胆红素(TBIL)、 直接胆红素(DBIL)和间接胆红素(IBIL)水平均显著低于非ICAS组(H=4.867~5.669,Plt;0.05)。见表1。
2.2 总人群中血清胆红素与ICAS的相关性
对ICAS组和非ICAS组进行多因素Logistic回归分析,结果显示,TBIL(OR=0.93,95%CI=0.87~0.99,P=0.018)、DBIL(OR=0.66,95%CI=0.48~0.89,P=0.007)以及IBIL(OR=0.92,95%CI=0.86~0.99,P=0.030)是非卒中情况下ICAS的独立保护因素。见表2。
2.3 不同年龄者血清胆红素与ICAS的相关性
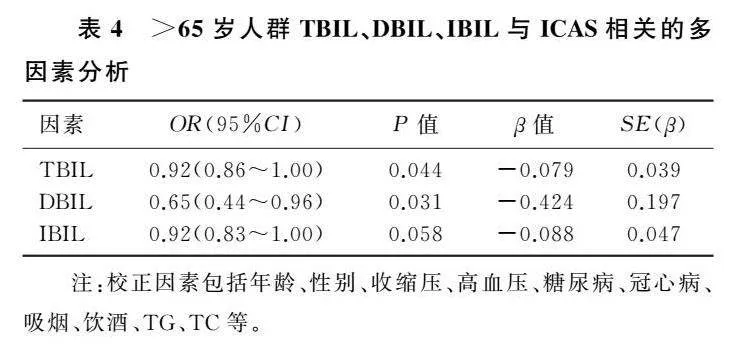
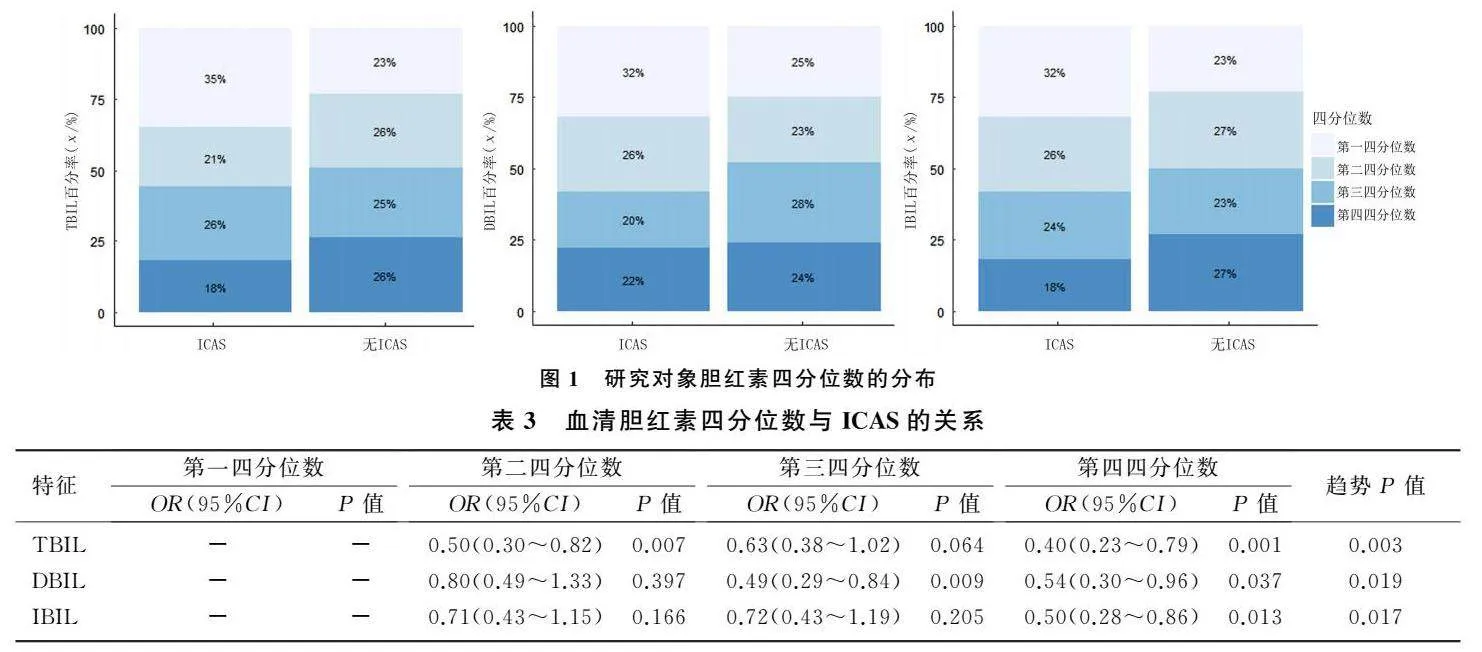
分别根据血清TBIL、DBIL和IBIL水平的四分位数(第一四分位数、第二四分位数、第三四分位数、第四四分位数)对所有研究
对象进行分组(图1),回归分析显示,三者的四分位数较高的研究对象发生ICAS的可能性小于第一四分位数者;趋势检验显示,TBIL、DBIL、IBIL与颅内动脉粥样硬化风险之间存在剂量-反应关系(Plt;0.05)。见表3。
收缩压数据为M(IQR)形式。与非ICAS组比较,*H=4.867~5.669,Plt;0.05;#H=15.950、5.006,Plt;0.05;amp;χ2=5.579,Plt;0.05。
对总人群进行年龄与胆红素影响ICAS的交互作用分析,未发现年龄与TBIL、DBIL、IBIL在影响ICAS方面存在交互作用(t=0.279~0.645,Pgt;0.05)。多因素Logistic回归分析结果显示,≤65岁的受试者TBIL、DBIL和IBIL与ICAS无相关性(Pgt;0.05),gt;65岁受试者TBIL(OR=0.92,95%CI=0.86~1.00,P=0.044)和DBIL(OR=0.65,95%CI=0.44~0.96,P=0.031)与ICAS有显著相关性,IBIL(OR=0.92,95%CI=0.83~1.00,P=0.058)对ICAS可能有保护作用。见表4。
3 讨 论
长期以来胆红素被认为是人体内含量较高的潜在毒物。但有研究显示,胆红素具有抗氧化、抗炎和细胞保护作用。动脉粥样硬化可导致血管狭窄甚至闭塞,最终导致缺血。动脉粥样硬化的早期特征之一是内皮功能紊乱,其在动脉粥样硬化过程中起着不可或缺的作用。内皮功能障碍的机制之一是氧化应激的增加。血清胆红素作为内源性抗氧化剂和自由基清除剂,被认为具有抗动脉粥样硬化作用,水平升高的血清胆红素可对抗动脉粥样硬化早期的氧化应激。促炎细胞因子的产生和募集可导致动脉粥样硬化,胆红素可通过抑制补体诱导反应、调节细胞毒性T淋巴细胞活性、抑制促炎细胞因子的产生影响炎性反应的进展。胆红素通过抑制动脉粥样硬化过程中LDL-C的氧化修饰作用影响动脉粥样硬化的形成和进程。在动脉粥样硬化过程中,内皮环境发生变化,导致黏附分子(促进细胞黏附和细胞间通讯的蛋白)表达增加,炎性细胞和免疫细胞向动脉壁迁移。胆红素通过抑制细胞间黏附分子-1和血管细胞黏附分子-1表达最终抑制炎性反应。
本文研究探讨了非卒中人群中胆红素和ICAS之间的关系,结果显示,ICAS组的TBIL、DBIL和IBIL水平均低于非ICAS组,胆红素水平的降低与ICAS风险增高有关。本文研究结果还显示,≤65岁年龄组胆红素水平与ICAS之间无显著相关性,而gt;65岁组胆红素水平下降与ICAS密切相关。提示不同年龄者胆红素与ICAS相关性程度不同,其对65岁以上的老年人保护作用更为显著。
本研究分析了TBIL、DBIL和IBIL与ICAS的关系,以更全面了解胆红素与ICAS及脑卒中的关系。值得一提的是,本研究中采用MRA评估血管狭窄,较经颅多普勒超声准确度更高。本文研究存在以下局限性:首先,这是一项横断面研究,这意味着我们无法获得该纳入人群中有关ICAS发展或预后的任何信息;其次,本研究只涵盖了居住在青岛的汉族人群,其结论可能不适用于其他地区、种族人群。尽管存在这些局限性,本研究对ICAS病人胆红素水平的研究仍具有重要意义。
综上所述,血清胆红素水平升高是ICAS的独立保护因素。在一定范围内,ICAS发生的风险随着血清胆红素水平的升高而降低。本文结果需要在更大的队列中进行重复研究,以阐明胆红素水平对于ICAS诊断的意义。
[参考文献]
FEIGIN V L, FOROUZANFAR M H, KRISHNAMURTHI R, et al. Global and regional burden of stroke during 1990—2010: findings from the Global Burden of Disease Study 2010. Lancet (London, England), 2014,383(9913):245-254.
KOSTAPANOS M S, CHRISTOGIANNIS L G, BIKA E, et al. Apolipoprotein B-to-A1 ratio as a predictor of acute ischemic nonembolic stroke in elderly subjects. Journal of Stroke and Cerebrovascular Diseases: the Official Journal of National Stroke Association, 2010,19(6):497-502.
PAN Y S, MENG X, JING J, et al. Association of multiple infarctions and ICAS with outcomes of minor stroke and TIA. Neurology, 2017,88(11):1081-1088.
QURESHI A I, CAPLAN L R. Intracranial atherosclerosis. Lancet (London, England), 2014,383(9921):984-998.
MA Y H, LENG X Y, DONG Y, et al. Risk factors for intracranial atherosclerosis: a systematic review and meta-analysis. Atherosclerosis, 2019,281:71-77.
WAGNER K H, WALLNER M, MLZER C, et al. Looking to the horizon: the role of bilirubin in the development and prevention of age-related chronic diseases. Clinical Science (London, England:1979), 2015,129(1):1-25.
THAKKAR M, EDELENBOS J, DOR S. Bilirubin and ischemic stroke: rendering the current paradigm to better understand the protective effects of bilirubin. Molecular Neuro-biology, 2019,56(8):5483-5496.
ZHONG K Y, WANG X, MA X T, et al. Association between serum bilirubin and asymptomatic intracranial atherosclerosis: results from a population-based study. Neurolo-gical Sciences, 2020,41(6):1531-1538.
KIM B S, JUNG H S, BANG O Y, et al. Elevated serum lipoprotein(a) as a potential predictor for combined intracranial and extracranial artery Stenosis in patients with ischemic stroke. Atherosclerosis, 2010,212(2):682-688.
SHAROBEEM K M, PATEL J V, RITCH A E, et al. Elevated lipoprotein (a) and apolipoprotein B to AI ratio in South Asian patients with ischaemic stroke. International Journal of Clinical Practice, 2007,61(11):1824-1828.
CASTELNUOVO A D, VERONESI G, COSTANZO S, et al. NT-proBNP (N-terminal pro-B-type natriuretic peptide) and the risk of stroke. Stroke, 2019,50(3):610-617.
PINEDA S, BANG O Y, SAVER J L, et al. Association of serum bilirubin with ischemic stroke outcomes. Journal of Stroke and Cerebrovascular Diseases, 2008,17(3):147-152.
SUH S, CHO Y R, PARK M K, et al. Relationship between serum bilirubin levels and cardiovascular disease. PLoS One, 2018,13(2):e0193041.
MARUHASHI T, KIHARA Y, HIGASHI Y. Bilirubin and endothelial function. Journal of Atherosclerosis and Thrombosis, 2019,26(8):688-696.
STOCKER R, YAMAMOTO Y, MCDONAGH A F, et al. Bilirubin is an antioxidant of possible physiological importance. Science (New York, N Y), 1987,235(4792):1043-1046.
(本文编辑 黄建乡)

