JWH133对右旋糖酐铁过载小鼠脾脏铁代谢影响
[摘要] 目的 探讨激活大麻素Ⅱ型受体(CB2受体)对右旋糖酐铁处理的铁过载模型小鼠脾脏铁代谢的影响。
方法 将18只9周龄雄性C57BL/6J小鼠随机分为对照组、右旋糖酐铁组、JWH133(CB2受体激动剂)+右旋糖酐铁组。应用铁检测试剂盒(比色法)检测各组小鼠脾脏铁水平,采用Western blot法检测脾脏转铁蛋白受体1(TFR1)和铁转运蛋白1(FPN1)的表达。
结果 与对照组相比,右旋糖酐铁组小鼠脾脏总铁含量和Fe3+含量明显升高(F=12.710、8.352,q=6.980、5.698,P<0.01),Fe2+含量有增高趋势,但差异无统计学意义;JWH133预处理抑制右旋糖酐铁造成的总铁含量和Fe3+含量的升高(q=4.747、3.687,P<0.05)。与对照组相比,右旋糖酐铁组小鼠脾脏TFR1表达显著升高(F=12.090,q=6.859,P<0.01);JWH133预处理抑制右旋糖酐铁引起的TFR1蛋白表达上调(q=4.419,P<0.05)。3组小鼠脾脏FPN1表达比较差异无显著性(F=1.152,P>0.05)。
结论 激活CB2受体可以抑制右旋糖酐铁引起的小鼠脾脏铁水平增高以及TFR1蛋白表达上调,CB2受体可能通过调节TFR1蛋白表达介导小鼠脾脏铁的聚集。
[关键词] 受体,大麻酚,CB2;铁右旋糖酐复合物;脾;受体,转铁蛋白;小鼠
[中图分类号] R338.2
[文献标志码] A
[文章编号] 2096-5532(2023)02-0199-04
doi:10.11712/jms.2096-5532.2023.59.033
[开放科学(资源服务)标识码(OSID)]
大麻素的生物学效应主要由G蛋白偶联受体家族的两个成员大麻素Ⅰ型受体(CB1受体)和大麻素Ⅱ型受体(CB2受体)介导。CB1受体在中枢神经系统中高度表达,参与各种脑功能的调节,包括执行力和记忆处理等,被称为“中枢型”大麻素受体。而CB2受体则被认为是“外周型”大麻素受体,主要分布在外周组织中,如脾脏边缘区、扁桃体、胸腺等。近年来的研究表明,CB2受体在中枢神经系统也广泛表达,并参与多巴胺相关的行为调节,包括抑郁症、焦虑和精神分裂症等。有研究表明,内源性大麻素系统参与了机体铁代谢相关疾病的发生。在HEK293T细胞中,CB2受体通过抑制二价金属离子转运体磷酸化来介导铁转运。本课题组的前期研究也证实,JWH133(CB2受体激动剂)激活CB2受体能够抑制1-甲基-4-苯基吡啶离子(MPP+)诱导的星形胶质细胞铁摄取。但大麻素系统对全身铁代谢的影响尚未见报道。本实验应用右旋糖酐铁建立铁过载小鼠模型,用JWH133进行预处理,观察小鼠脾脏铁水平以及铁代谢相关蛋白转铁蛋白受体1(TFR1)、铁转运蛋白1(FPN1)的表达,探讨JWH133激活CB2受体是否影响小鼠脾脏铁的聚集及其可能的机制。
1 材料与方法
1.1 实验材料
1.1.1 实验动物 SPF级9周龄雄性C57BL/6J小鼠购自北京维通利华实验动物公司。饲养条件:温度(21±1)℃,湿度(50±5)%,12 h昼夜循环光照,自由饮水进食。实验前适应实验室环境1周。
1.1.2 主要试剂 右旋糖酐铁购自美国Sigma-Aldrich公司;CB2受体激动剂JWH133购自美国APE×BIO公司;铁检测试剂盒购自英国Abcam公司;TFR1抗体购自中国正能生物公司;FPN1抗体购自以色列Alomone Labs公司;β-actin抗体购自美国Proteintech公司;HRP标记山羊抗兔IgG购自中国爱必信公司;ECL化学发光液购于中国雅酶公司。
1.2 实验方法
1.2.1 动物分组及处理 将18只小鼠随机分为对照组(A组)、右旋糖酐铁组(B组)和JWH133+右旋糖酐铁组(C组),每组6只。右旋糖酐铁组小鼠每天给予右旋糖酐铁100 mg/kg腹腔注射,构建铁过载小鼠模型;JWH133+右旋糖酐铁组小鼠每天先腹腔注射1 mg/kg的JWH133,4 h后再腹腔注射100 mg/kg的右旋糖酐铁;对照组小鼠腹腔注射等量的生理盐水。持续腹腔注射15 d后处死小鼠,取脾脏进行后续实验。
1.2.2 脾脏铁含量检测 使用铁检测试剂盒(比色法)测定小鼠脾脏铁含量。首先将脾脏用预冷的PBS洗涤,在铁检测缓冲液中匀浆,12 000 r/min离心10 min,取上清液于EP管中,将收集的上清液和铁还原剂混匀后加入96孔板中,37 ℃孵育30 min。最后,每孔分别加入铁探针,37 ℃孵育1 h,在比色酶标仪上测定吸光度(波长为593 nm)。
1.2.3 Western blot法检测脾脏TFR1和FPN1的表达 脾脏组织按每4 mg 100 μL加入裂解液,充分研磨后冰上裂解30 min,4 ℃下以12 000 r/min离心20 min,提取上清。用 BCA 蛋白测定试剂盒测定蛋白浓度。按1∶4比例加入Loading buffer,金属浴100 ℃煮5 min。蛋白经SDS-PAGE电泳(电压80~120 V)后湿转至PVDF膜上,用含有50 g/L脱脂奶粉的TBST溶液室温封闭2 h后,将PVDF膜分别放入TFR1(1∶1 000)、FPN1(1∶1 000) 和β-actin(1∶10 000)一抗溶液中,4 ℃摇床过夜孵育。加HRP偶联的二抗(用TBST稀释至1∶10 000),室温孵育1 h。用UVP Bio Doc-It成像系统(美国Upland)和ECL高灵敏化学发光液显影,采用Image J分析软件进行灰度值分析。
1.3 统计学处理
应用Prism 7软件进行统计学处理,实验所得数据以±s表示,多组比较采用单因素方差分析(one-way ANOVA检验),组间两两比较采用Turkey法,P<0.05表示差异有统计学意义。
2 结 果
2.1 JWH133对右旋糖酐铁处理小鼠脾脏铁水平的影响
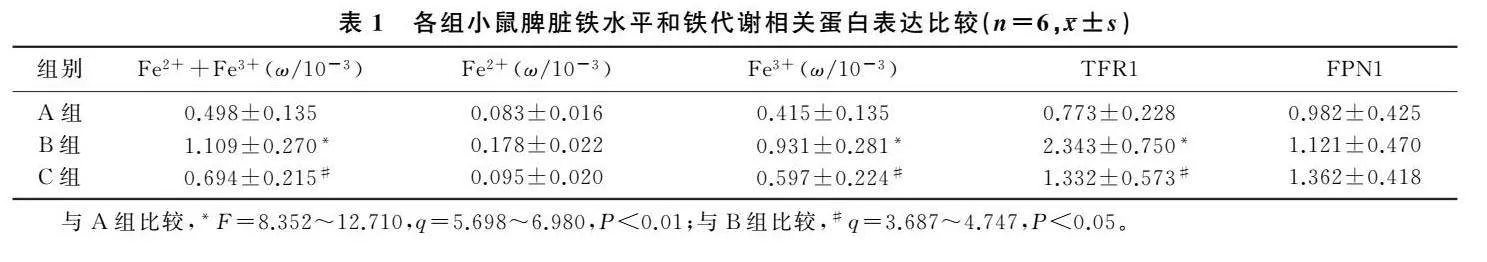
与对照组相比,右旋糖酐铁组总铁含量明显升高,Fe3+含量升高也较为明显,差异均有统计学意义(F=12.710、8.352,q=6.980、5.698,P<0.01);Fe2+含量有增高趋势,但差异无统计学意义(P>0.05)。与右旋糖酐铁组相比,JWH133+右旋糖酐铁组总铁含量和Fe3+含量明显降低,差异有统计学意义(q=4.747、3.687,P<0.05)。见表1。
2.2 JWH133对右旋糖酐铁处理小鼠脾脏TFR1和FPN1蛋白表达的影响
与对照组相比,右旋糖酐铁组小鼠脾脏TFR1蛋白的表达显著升高(F=12.090,q=6.859,P<0.01);与右旋糖酐铁组相比,JWH133+右旋糖酐铁组TFR1蛋白的表达显著降低(q=4.419,P<0.05)。3组小鼠脾脏FPN1蛋白表达比较差异无显著性(F=1.152,P>0.05)。见表1。
3 讨 论
内源性大麻素系统主要由内源性大麻素、大麻素受体以及负责生成、转运和水解大麻素的各种调节因子组成。大麻素受体与G蛋白偶联,通过抑制腺苷酸环化酶和电压门控钙通道(例如N型、P/Q型和L型钙电流)介导信号转导,激活丝裂原活化蛋白激酶和向内整流钾离子通道。目前临床上应用的大麻素受体激动剂如大麻醇、屈大麻酚、Δ9-四氢大麻酚和大麻二酚均为CB1受体/CB2受体的非选择性激动剂。已有研究表明,这些非选择性激动剂引起的不良反应大多来自CB1受体而不是CB2受体,因此CB2受体选择性激动剂在临床应用上会有许多优势。CB2受体作为7次跨膜的G蛋白偶联受体,主要存在于外周免疫器官和免疫组织中,如脾脏边缘区。激活CB2受体在心血管、胃肠道、肝脏、肾脏、肺相关疾病中发挥组织保护作用。此外,CB2受体在神经退行性疾病的动物模型中发挥抗炎和保护作用。CB2受体激活还可以抑制小胶质细胞的活化并改善神经退行性疾病中的神经功能缺陷和延缓疾病的进展。在1-甲基-4-苯基-1,2,3,6-四氢吡啶(MPTP)诱导损伤的模型小鼠中使用CB2受体激动剂AM1241,可以减轻MPTP对多巴胺能神经元的损伤作用。
铁作为人体内必需的微量元素之一,参与氧输送、线粒体呼吸以及DNA的合成,是神经递质及髓鞘蛋白合成重要酶的辅基,对能量代谢、氧化还原平衡、氧气运输以及炎症反应等基本生物学过程都具有重要的作用。生物体内存在许多生理过程来确保铁稳态。有研究报道,大麻素可以通过激活CB2受体抑制HEK293T细胞对铁的摄入,激活CB2受体也能够抑制MPP+诱导的星形胶质细胞铁摄取。本室前期研究表明,JWH133可以通过激活CB2受体来抑制MPP+诱导的SH-SY5Y细胞内的铁水平升高。铁稳态对维持人类机体正常代谢起着不可或缺的作用。本研究使用铁染色试剂盒采用比色法检测小鼠脾脏铁含量,结果表明,右旋糖酐铁引起脾脏总铁含量和Fe3+含量明显升高,使用JWH133预处理可明显抑制右旋糖酐铁引起的脾脏总铁含量和Fe3+含量升高,提示JWH133激活脾脏CB2受体可以减少右旋糖酐铁引起的脾脏铁聚集。摄入铁的膜蛋白TFR1是铁代谢所必需的,它可以将Fe3+转运至细胞核内体中,在核内体中Fe3+进一步被还原成为Fe2+。最终,在二价金属离子转运体的介导下,Fe2+从核内体释放到胞质内不稳定铁池中。一部分铁可以通过FPN1输出细胞,而多余的铁则以铁蛋白轻链和铁蛋白重链1的形式储存在细胞胞质中。这些铁代谢相关蛋白的异常表达或功能失调将会使细胞内铁离子浓度因代谢失衡而升高。本研究Western blot检测结果显示,使用CB2受体激动剂JWH133预处理激活CB2受体能够抑制右旋糖酐铁诱导的脾脏TFR1蛋白表达上调,提示TFR1参与脾脏的铁沉积过程,但激活CB2受体调控脾脏TFR1蛋白表达的机制仍不清楚,需要进一步研究。
综上所述,本研究用小鼠铁过载模型初步探讨了CB2受体在脾脏铁代谢中的作用,结果提示,激活CB2受体参与了右旋糖酐铁引起的小鼠脾脏铁过载,其可能的机制是通过抑制铁代谢相关蛋白TFR1的表达来减少铁的摄入。本文研究结果为治疗铁代谢相关疾病提供了新的方向,但还需要进一步研究其所涉及的机制。
[参考文献]
BUCKLEY N E. The peripheral cannabinoid receptor knockout mice: an update. British Journal of Pharmacology, 2008,153(2):309-318.
BUCKLEY N E, MCCOY K L, MEZEY E, et al. Immunomodulation by cannabinoids is absent in mice deficient for the cannabinoid CB(2) receptor. European Journal of Pharmacology, 2000,396(2-3):141-149.
MILLER L K, DEVI L A. The highs and lows of cannabinoid receptor expression in disease: mechanisms and their therapeutic implications. Pharmacological Reviews, 2011,63(3):461-470.
GALVE-ROPERH I, CHIURCHI V, DAZ-ALONSO J, et al. Cannabinoid receptor signaling in progenitor/stem cell proliferation and differentiation. Progress in Lipid Research, 2013,52(4):633-650.
ONAIVI E S, ISHIGURO H, GU S Z, et al. CNS effects of CB2 cannabinoid receptors: beyond neuro-immuno-cannabinoid activity. Journal of Psychopharmacology (Oxford, England), 2012,26(1):92-103.
MORCUENDE A, GARCA-GUTIRREZ M S, TAMBARO S, et al. Immunomodulatory role of CB2 receptors in emotional and cognitive disorders. Frontiers in Psychiatry, 2022,13:866052.
TORTORA C, DI PAOLA A, CREOLI M, et al. Effects of CB2 and TRPV1 stimulation on osteoclast overactivity induced by iron in pediatric inflammatory bowel disease. Inflamma-tory Bowel Diseases, 2022. doi:org/10.1093/ibd/izac073.
KIM B E, CHOI B, PARK W R, et al. Orphan nuclear receptor ERRγ is a transcriptional regulator of CB1 receptor-mediated TFR2 gene expression in hepatocytes. International Journal of Molecular Sciences, 2021,22(11):6021.
MALLAT A, TEIXEIRA-CLERC F, DEVEAUX V, et al. The endocannabinoid system as a key mediator during liver diseases: new insights and therapeutic openings. British Journal of Pharmacology, 2011,163(7):1432-1440.
SEO Y A, KUMARA R, WETLI H, et al. Regulation of divalent metal transporter-1 by serine phosphorylation. The Biochemical Journal, 2016,473(22):4243-4254.
万洪丽,马泽刚. CB2受体激活对MPP+致SH-SY5Y细胞损伤的保护作用. 精准医学杂志, 2019,34(3):240-244.
LU H C, MACKIE K. An introduction to the endogenous cannabinoid system. Biological Psychiatry, 2016,79(7):516-525.
PROCACCIA S, LEWITUS G M, LIPSON FEDER C, et al. Cannabis for medical use: versatile plant rather than a single drug. Frontiers in Pharmacology, 2022,13:894960.
PERTWEE R G. Targeting the endocannabinoid system with cannabinoid receptor agonists: pharmacological strategies and therapeutic possibilities. Philosophical Transactions of the Royal Society of London Series B, Biological Sciences, 2012,367(1607):3353-3363.
CHEN J C, WANG F X, ZHANG S, et al. Activation of CD4+ T cell-derived cannabinoid receptor 2 signaling exacerbates Sepsis via inhibiting IL-10. Journal of Immunology (Baltimore, Md: 1950), 2022,208(11):2515-2522.
ZHANG H, HE W, HU X F, et al. Electroacupuncture reduces visceral pain via cannabinoid CB2 receptors in a mouse model of inflammatory bowel disease. Frontiers in Pharmacology, 2022,13:861799.
DA SILVA V K, DE FREITAS B S, DORNELLES V C, et al. Novel insights into mitochondrial molecular targets of iron-induced neurodegeneration: reversal by cannabidiol. Brain Research Bulletin, 2018,139:1-8.
DA SILVA V K, DE FREITAS B S, GARCIA R C L, et al. Antiapoptotic effects of cannabidiol in an experimental model of cognitive decline induced by brain iron overload. Translational Psychiatry, 2018,8:176.
JAVED H, AZIMULLAH S, HAQUE M E, et al. Cannabinoid type 2 (CB2) receptors activation protects against oxidative stress and neuroinflammation associated dopaminergic neurodegeneration in rotenone model of Parkinson's disease. Frontiers in Neuroscience, 2016,10:321.
HE X L, YANG L, HUANG R Q, et al. Activation of CB2R with AM1241 ameliorates neurodegeneration via the Xist/miR-133b-3p/Pitx3 axis. Journal of Cellular Physiology, 2020,235(9):6032-6042.
BOGDAN A R, MIYAZAWA M, HASHIMOTO K, et al. Regulators of iron homeostasis: new players in metabolism, cell death, and disease. Trends in Biochemical Sciences, 2016,41(3):274-286.
WETLI H A, BUCKETT P D, WESSLING-RESNICK M. Small-molecule screening identifies the selanazal drug ebselen as a potent inhibitor of DMT1-mediated iron uptake. Che-mistry amp; Biology, 2006,13(9):965-972.
JIA Y, DENG H, QIN Q Y, et al. JWH133 inhibits MPP+-induced inflammatory response and iron influx in astrocytes. Neuroscience Letters, 2020,720:134779.
潘东,马泽刚. JWH133对MPP+诱导SH-SY5Y细胞铁水平和DMT1表达影响. 青岛大学学报(医学版), 2021,57(2):206-209.
AMEKA M, HASTY A H. Paying the iron price: liver iron homeostasis and metabolic disease." Comprehensive Physio-
logy, 2022,12(3):3641-3663.
ZHAO Y Q, DUAN J H, YU L, et al. Metabolic iron detection through divalent metal transporter 1 and ferroportin me-
diated cocktail fluorogenic probes." Chemical Communications (Cambridge, England), 2021,57(64):7902-7905.
SATO T, SHAPIRO J S, CHANG H C, et al. Aging is associated with increased brain iron through cortex-derived hepcidin expression." eLife, 2022,11:e73456.
PANTOPOULOS K, PORWAL S K, TARTAKOFF A, et al. Mechanisms of mammalian iron homeostasis. Bioche-
mistry, 2012,51(29):5705-5724.
GKOUVATSOS K, PAPANIKOLAOU G, PANTOPOULOS K. Regulation of iron transport and the role of transferrin." Biochimica et Biophysica Acta, 2012,1820(3):188-202.
FRAZER D M, ANDERSON G J. The regulation of iron transport." BioFactors (Oxford, England), 2014,40(2):206-214.
(本文编辑 马伟平)

