水稻分蘖期干物质积累对大气CO2浓度升高和氮素营养的综合响应差异及其生理机制
贺江,丁颖,娄向弟,姬东玲,张向向,王永慧,张伟杨,王志琴,王伟露3,杨建昌
水稻分蘖期干物质积累对大气CO2浓度升高和氮素营养的综合响应差异及其生理机制
贺江1,2,丁颖2,娄向弟2,姬东玲1,张向向2,王永慧2,张伟杨1,王志琴1,王伟露1,3,杨建昌1
1江苏省作物遗传生理重点实验室/江苏省作物栽培生理重点实验室/扬州大学农学院,江苏扬州 225009;2江苏沿海地区农业科学研究所,江苏盐城 224002;3教育部农业与农产品安全国际合作联合实验室/扬州大学农业科技发展研究院,江苏扬州 225009
【目的】探究不同类型水稻品种物质生产响应大气CO2浓度升高和氮素营养的综合响应差异及其生理机制。【方法】以产量和物质生产对CO2浓度升高响应有明显差异的水稻品种两优培九(LY)和南粳9108(NJ)为材料,在人工气候室进行水培试验。分别设置对照CO2浓度(A-CO2,400 μmol·mol-1)和CO2浓度升高(E-CO2,600 μmol·mol-1)两个CO2处理,高氮(HN,1.25 mmol·L-1NH4NO3)和低氮(LN,0.25 mmol·L-1NH4NO3)两个氮水平。分析CO2浓度升高对不同水稻品种根系形态与生理活性、叶片和根系中细胞分裂素(CTKs)含量、氮素同化酶活性、叶片生理特性、光合参数以及干物质积累的影响差异。【结果】(1)E-CO2显著增加了LY总冠根数、总根长(LN水平除外)、总根表面积和平均直径,提高其根系呼吸速率和维持较高的根系氧化力,而对NJ无显著影响或表现相反;(2)无论氮水平如何,E-CO2显著提高了LY叶片和根系CTKs含量,但显著降低了HN水平下NJ根系中玉米素核苷(ZR)含量;(3)在LN水平下,E-CO2显著提高了LY叶片GOGAT、GDH活性,显著降低了NJ叶片NR活性。在HN水平下,LY氮同化酶活性在E-CO2条件下都表现为提高,NJ仅NR活性提高;(4)在LN水平下,E-CO2使得LY和NJ净光合速率(n)分别提高了28.0%和29.4%。在HN水平下,两品种分别提高了41.0%和28.1%。LY光合响应大幅度提高归因于叶片最大羧化效率(V)、最大光合电子传递效率(J)、核酮糖-1,5-二磷酸羧化酶(Rubisco)含量、叶绿素含量、叶片氮含量等显著提高;(5)E-CO2显著增加了不同氮水平下LY单株叶面积,对NJ无显著影响;(6)E-CO2显著增加了LY各器官及总生物量,且HN水平增幅明显大于LN水平。E-CO2并未显著影响不同氮水平下NJ的总生物量,显著降低了HN水平下NJ地下部生物量(-16.7%)。【结论】无论在HN还是LN水平下,LY物质生产和生理特征对E-CO2的响应幅度与NJ相比更高。生育前期LY较优的根系形态性状和根系活力、较高的CTKs含量、较强的氮素同化能力、较大的绿叶面积以及光合响应能力是其干物质生产对E-CO2响应幅度较高的重要原因。
水稻;CO2浓度升高;根系形态;细胞分裂素;光合作用;干物质生产
0 引言
【研究意义】大气CO2浓度逐年升高,预计21世纪末将进一步增加到540—970 μmol·mol-1[1]。CO2是植物光合作用的底物,其浓度的增加有利于作物的光合碳同化,进而提高作物产量。水稻(L.)是世界上最重要的粮食作物之一[2]。到2050年,水稻产量需要增加约30%才能满足人口增长的需求[3]。CO2浓度升高对水稻产量的影响在品种间存在显著差异[4-6]。在自由大气CO2富集系统的研究结果表明,CO2浓度升高使得南粳9108、武香粳14和秋田小町等品种产量提高了12%—15%[5,7-8],而两优培九、扬稻6号和II优084等品种提高了30%—37%[9-10]。水稻产量形成与干物质生产、积累和分配密切相关。深入探究不同水稻品种物质生产对CO2浓度升高响应的差异及其生理机制,对于改善水稻品种产量的响应水平具有重要意义。【前人研究进展】植物干物质累积来源于叶片光合作用生产的光合产物。CO2浓度升高通过提高叶片净光合速率(n)[11],显著促进了不同水稻品种干物质积累,汕优63、两优培九等干物质积累平均增加20.0%—35.3%,秋田小町、五香粳14、南粳9108等干物质积累平均增加15.0%—18.6%[5,10,12-13]。随着生育期的推移,粳稻较籼稻更容易发生CO2适应现象,这与光合作用关键酶核酮糖-1,5-二磷酸加氧羧化酶(Rubisco)含量降低以及叶片衰老有关[11,14]。在高氮条件下,作物CO2适应现象得到适当缓解[15-16]。CO2浓度升高显著降低粳稻品种叶片氮含量,却未显著影响籼稻品种氮含量[14,17]。目前关于CO2浓度升高条件下水稻氮浓度降低的原因暂无定论,生物量的稀释作用被较多的研究所提及。近期有研究表明,在没有生物量的稀释作用下,氮浓度依然降低,认为氮浓度的降低与氮的吸收和利用密切相关[18]。根系作为养分吸收的直接器官,氮素的吸收同其形态结构、生理性状存在一定的内在联系[19-20]。CO2浓度升高提高了根系生物量和根表面积、体积、根长等形态性状[21-22]。但也有研究表明,CO2浓度升高并未显著影响根系生物量和根系形态性状,并且还会显著降低单位根干重或单茎根系活力[23]。此外,根系也是作为合成生理活性物质——细胞分裂素(CTKs)的主要场所,研究表明通过提高内源CTKs含量可以提高水稻氮素吸收同化能力,有效调控氮素的分布,促进氮素向叶绿素和Rubisco的合成与分配,延缓叶片的衰老[24-26]。这些结果表明,根系形态和生理特性可能是造成不同水稻品种干物质累积对CO2浓度升高响应差异的重要原因。【本研究切入点】尽管在CO2浓度升高条件下不同水稻品种干物质生产响应差异有较多研究,但其生理机制仍不清楚。【拟解决的关键问题】通过比较CO2浓度升高对两个不同类型水稻品种根系形态与活性、叶片和根系中CTKs含量、氮素吸收同化、叶片光合参数、干物质积累影响的差异,阐明不同水稻品种物质生产响应CO2浓度升高差异的生理机制,以期为改善水稻品种物质生产对CO2浓度升高的响应水平提供理论依据。
1 材料与方法
1.1 试验设计
试验于2019年6—8月在江苏省扬州大学农学院试验基地人工气候室内进行,方式为水培试验。首先将种子用浸种剂浸泡2 d,然后转移到育秧盘中,用0.5 mmol·L-1的CaCl2催根2 d后,将种子在培养液中育秧25 d后移栽。移栽时提前准备好装有20 L培养液的不透光周转箱(内径:28 cm×38 cm×22 cm,总容积约为22 L),每个周转箱的盖子上均匀分布6×7=42个孔。选取长势一致的幼苗2株移栽,并用海绵固定。除N元素外,培养液的组成如下:0.3 mmol·L-1KH2PO4,0.35 mmol·L-1K2SO4,1 mmol·L-1CaCl2·2H2O,1 mmol·L-1MgSO4·7H2O,0.5 mmol·L-1Na2SiO3·9H2O,9 μmol·L-1MnCl2·4H2O,0.39 μmol·L-1Na2MoO4·2H2O,20 μmol·L-1H3BO3,0.37 μmol·L-1ZnSO4·7H2O,0.32 μmol·L-1CuSO4·5H2O和20 μmol·L-1FeSO4·7H2O + Na2-EDTA。每天用稀NaOH或HCl调节培养液pH至5.5左右,培养液每5 d更换一次。水稻植株在以下控制条件下生长:光合有效辐射(PAR)300 μmol·m-2·s-1,相对湿度为60%,昼夜周期为14 h/10 h,昼夜温度分别设定为29℃和23℃[27]。
本研究选用了在自由大气CO2富集条件下多年种植,产量和生物量对CO2浓度升高响应差异明确的水稻品种两优培九(LY)和南粳9108(NJ)为供试材料。试验采用完全随机设计,水稻幼苗自移栽开始设置环境CO2浓度(400 μmol·mol-1,A-CO2)和CO2浓度升高(600 μmol·mol-1,E-CO2)2个CO2处理,设置高氮(1.25 mmol·L-1NH4NO3,HN)、低氮(0.25 mmol·L-1NH4NO3,LN)2个氮素水平,每个处理设置3个重复。
1.2 测定内容及方法
在处理30 d后取样测定。在该时期两水稻品种未出现CO2适应现象,并且干物质生产对CO2浓度升高的响应存在显著差异。取样前首先考察每盆分蘖数计算平均分蘖,根据平均分蘖数从每个周转箱中收获12穴长势一致的水稻植株。根系用去离子水冲洗3遍,以确保将残留的培养液冲洗干净。其中8穴用于干物质和氮含量的测定,其余4穴用于生理性状测定。
1.2.1 叶面积与干物质积累 水稻植株样品被分成叶片、茎鞘和根系三部分,同时用Li-Cor 3050型叶面积仪(LI-COR公司,美国)测量叶面积。然后用纸袋分装好于105 ℃烘箱中杀青30 min,再降温至75℃烘干至恒重,最后称量干物重。
1.2.2 叶片光合特性 采用Li-Cor 6400光合测定系统测定完全展开新叶的光合气体交换参数。测定时间为09:30—15:00,CO2浓度分别设定为400和600 μmol·mol-1,测定光强设定为1 800 μmol·m-2·s-1、流量设定为500 mL·s-1,叶室温度为(30±2)℃,相对湿度维持在60%左右。当叶片净光合速率分别在400和600 μmol·mol-1左右稳定时,开始测定-曲线,CO2浓度在环境条件下设置为400、200、100、50、400、600、1 000和1 500 μmol·mol-1(每步约5 min),在CO2浓度升高条件下设置为600、400、200、100、50、600、1 000和1 500 μmol·mol-1(每步约5 min)。参照SHARKEY等[28]的方法用非线性曲线拟合模型求解测定V、J等生化参数。
1.2.3 叶片氮含量 烘干称重后的样品粉碎后先过100目筛,然后称取0.5 g于消化管中,加入催化剂和浓H2SO4于消解炉420℃消解2 h。消解液变为绿色至澄清后,冷却至常温,用全自动凯氏定氮仪测定样品氮含量[27]。
1.2.4 叶绿素含量 采用热醇快速提取法提取叶片中叶绿素,根据Lichtenthaler等[29]修正的Arnon公式计算叶绿素含量。
1.2.5 Rubisco含量 参照MAKINO等[30-31]的方法测定Rubisco含量,称去叶脉的水稻叶片0.5 g,加5 mL缓冲液[含50 mmol·L-1pH=8.0的Tirs-HCl,5 mmol·L-1的巯基乙醇,12.5%的甘油(V/V)]充分研磨,匀浆液15 000×冷冻离心15 min,取上清液等体积溶于样品溶解液[含2% SDS(W/V),4%巯基乙醇(V/V),10%甘油(V/V)]在沸水中煮5 min后电泳分析。电泳分离胶浓度为12.5%(W/V),浓缩胶浓度为2.5%(W/V)。电泳时上样量10 μL,电流15 mA。电泳胶用0.25%(W/V)的考马斯亮蓝R250染色,脱色后将大小亚基条带切下放入1.5 mL甲酰胺中50℃恒温水浴洗脱5—9 h。洗脱液在595 nm波长下比色测定,用背景胶洗脱液作空白,用牛血清蛋白作标准蛋白。
1.2.6 氮同化关键酶活性 取上述用于测定生理指标植株样品,参照陈薇等[32]的方法测定硝酸还原酶(NR)活性,最后的结果以每克鲜重样品每分钟催化减少1 nmol NADH的量定义为一个NR活力单位。参照RHODES等[33]的方法测定谷氨酰胺合成酶(GS)活性,以每克样品鲜重在每毫升反应体系中每小时产生1 μmol γ-谷氨酰基异羟肟酸定义为一个GS活力单位。参照LIN等[34]的方法测定谷氨酸合酶(GOGAT)和谷氨酸脱氢酶(GDH)活性,最后以每分钟反应混合液减少1 nmol NADH定义为一个GOGAT酶活性单位,以每分钟每克鲜重样品中催化减少1 nmol NADH的量为一个GDH活力单位。
1.2.7 根系形态 从每个处理组中选择8穴长势一致的植株观察根系形态。将根系剪下,用去离子水冲洗附着在根系表面的培养液,再用吸水纸将水吸干,然后迅速用自封袋包好放入冰盒中,带回实验室进行分析。将根放在扫描仪(Epson Expression 1680 Scanner,Seiko Epson Corp,Tokyo,Japan)的透明托盘中,手动考察并记录总冠根数。然后在托盘中加入少量水,用扫描仪以600 dpi进行扫描,用WinRHIZO根系分析系统(Regent Instruments Inc.,Quebec,Canada)分析。计算水稻的总根长、总根表面积和平均直径。扫描后的根装在纸袋中,再于80℃烘箱烘干至恒重,称重并记录。
1.2.8 根系呼吸速率 本试验测定整株活体根系呼吸速率,利用Li-8100土壤呼吸仪测定,具体方法如下:处理30 d后,每个处理分别选取长势一致的水稻秧苗3穴,将根系表面培养液冲洗干净。用吸水纸擦干根系表面多余的水分后,放置于带孔塑料板上,用土壤环圈入,利用LI-8100A土壤呼吸仪装置测定活体根系呼吸速率。温度控制为25℃,测定时长6 min,记录活体根系呼吸作用的CO2释放量。测定结束将根系用纸袋装好,于80℃烘箱烘干至恒重,计算单位干重的根系呼吸速率。
1.2.9 根系氧化力 根系活力测定采用α-萘胺法,参照ANDO等[35]的方法,结果以每克鲜重每小时的α-萘胺生物氧化量(mg·g-1·h-1)表示。
1.2.10 激素含量 参照ZHANG等[36]的方法提取并测定根系和叶片中玉米素(Z)、玉米素核苷(ZR)、异戊烯基腺嘌呤(IP)和异戊烯基腺苷(IPA)含量。
1.3 计算方法与数据处理
本试验所有数据用Microsoft Excel 2016和SPSS 19.0软件进行数据整理与统计分析,采用最小显著差法(LSD)进行处理间的差异显著性分析,显著性水平设置为=0.05,用Sigma Plot 14.0绘图。
2 结果
2.1 水稻根系形态与生理活性对CO2浓度升高的响应
2.1.1 根系形态性状 除N、品种×CO2对平均根直径的影响未达显著水平外,N、品种和CO2及其之间的交互作用对总冠根数、总根长、总根表面积和平均根直径的影响都达到显著或极显著水平(表1)。低氮水平下,与环境CO2浓度相比,CO2浓度升高显著提高了LY总冠根数、总根表面积和平均根直径,分别提高了27.8%、21.6%和21.53%。CO2浓度升高仅使得NJ的平均根直径增加了32.4%,显著降低了总根长(表1)。在高氮水平下,CO2浓度升高使LY总冠根数(+50.1%)、总根长(+54.9%)、总根表面积(+87.3%)和平均根直径(+17.3%)显著提高。而CO2浓度升高使得NJ的总根表面积显著降低了14.5%(表1)。
2.1.2 根系生理活性 与环境CO2浓度相比,无论在低氮还是高氮水平下,CO2浓度升高未显著影响LY根系氧化力,而NJ根系氧化力随CO2浓度升高都显著降低,分别降低了27.1%和31.6%(图1-a)。CO2浓度升高显著提高LY根系呼吸速率,且在高氮水平下的提高幅度明显高于低氮水平。CO2浓度升高降低NJ根系呼吸速率,但未达显著水平(图1-b)。
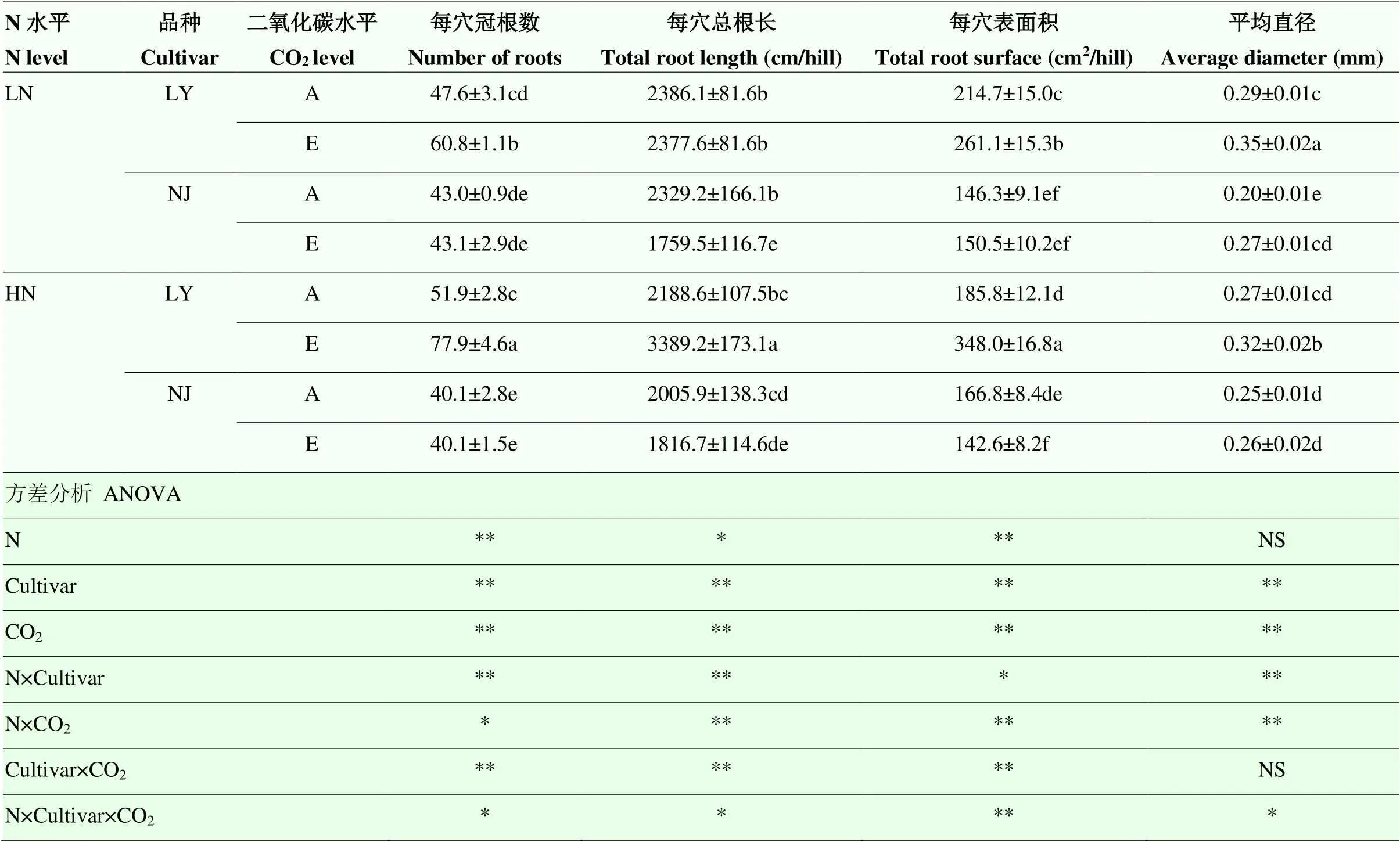
表1 CO2浓度升高对两优培九(LY)和南粳9108(NJ)根系形态的影响
LN:低氮水平;HN:高氮水平;A:对照CO2处理(400 μmol·mol-1);E:CO2浓度升高处理(600 μmol·mol-1);不同小写字母表示在=0.05水平上差异显著;数值为平均值±标准偏差(n=3);NS:>0.05;*:≤0.05;**:≤0.01。下同
LN: low nitrogen level; HN: high nitrogen level; A: Ambient CO2(400 μmol·mol-1); E: Elevated CO2(600 μmol·mol-1); Different lowercase letters indicate significant difference at 0.05 level; the value is mean ± standard deviation (n=3); NS:>0.05; *:≤0.05; **:≤0.01. The same as below

LN:低氮水平;HN:高氮水平;A:对照CO2处理(400 μmol·mol-1);E:CO2浓度升高处理(600 μmol·mol-1);不同小写字母表示在P=0.05水平上差异显著。下同
2.2 水稻叶片和根系细胞分裂素含量对CO2浓度升高的响应
在低氮水平下,与环境CO2浓度相比,CO2浓度升高显著提高了LY叶片中Z和ZR含量,仅使得NJ叶片ZR含量显著提高(图2-a、2-b)。在高氮水平下,CO2浓度升高显著提高了LY叶片Z、ZR和IP含量(图2-a—c),而CO2浓度升高仅提高了NJ叶片IPA含量,其余形态CTKs均未表现出显著差异(图2-a—d)。对于根系而言,在低氮水平下,与环境CO2浓度相比,CO2浓度升高仅显著提高了LY根系中Z和ZR含量,未显著影响NJ根系CTKs含量(图3-a—d)。在高氮水平下,CO2浓度升高显著提高了LY根系中Z和IPA含量,显著降低了NJ根系中ZR含量(图3-a—d)。
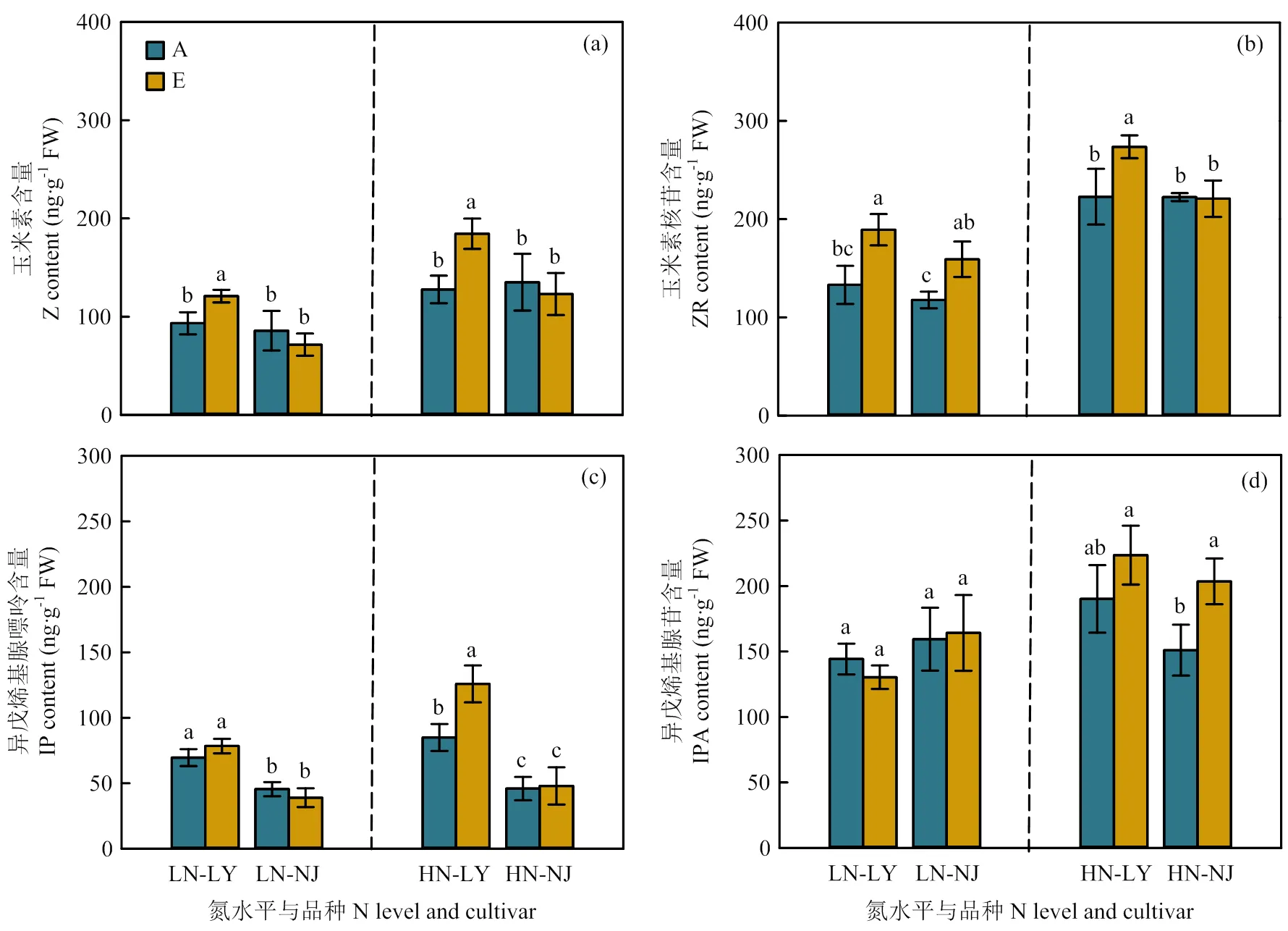
图2 CO2浓度升高对两优培九(LY)和南粳9108(NJ)叶片细胞分裂素含量的影响
2.3 水稻氮同化关键酶活性对CO2浓度升高的响应
在低氮水平下,与环境CO2浓度相比,CO2浓度升高显著提高了LY叶片GOGAT和GDH活性,而降低了NJ叶片NR活性(图4-a—d)。在高氮水平下,与环境CO2浓度相比,CO2浓度升高显著提高了LY叶片NR、GS、GOGAT以及GDH活性,仅使得NJ叶片NR活性显著提高(图4-a—d)。
2.4 水稻叶片光合与生理特性对CO2浓度升高的响应
2.4.1 光合参数 与环境CO2浓度相比,CO2浓度升高显著提高了两品种n(图5-a)。在低氮水平下LY和NJ分别提高了28.0%和29.4%,而在高氮水平下两品种分别提高了41.0%和28.1%。CO2浓度升高未显著影响低氮水平下LY气孔导度(s),但使得NJ叶片s显著提高了19.0%,高氮水平下表现相反,LY叶片s显著提高了13.9%,NJ未表现出显著差异(图5-b)。在低氮水平下,CO2浓度升高显著提高了LY和NJ的J ,分别提高了39.0%和20.9%。在高氮水平下,CO2浓度升高大幅度提高了LY叶片V和J ,仅显著提高了NJ叶片V(图5-c、5-d)。
2.4.2 单位叶面积叶片氮含量、叶绿素含量和Rubisco含量 在低氮水平下,与环境CO2浓度相比,CO2浓度升高降低了两品种单位叶面积Rubisco含量,但NJ未达显著水平(图6-c)。在高氮水平下,CO2浓度升高显著提高了LY单位叶面积叶片氮含量、总叶绿素含量和Rubisco含量,而对NJ单位叶面积叶片氮含量、总叶绿素含量和Rubisco含量无显著影响(图6-a—c)。

图3 CO2浓度升高对两优培九(LY)和南粳9108(NJ)根系细胞分裂素含量的影响

图4 CO2浓度升高对两优培九(LY)和南粳9108(NJ)氮同化酶活性的影响
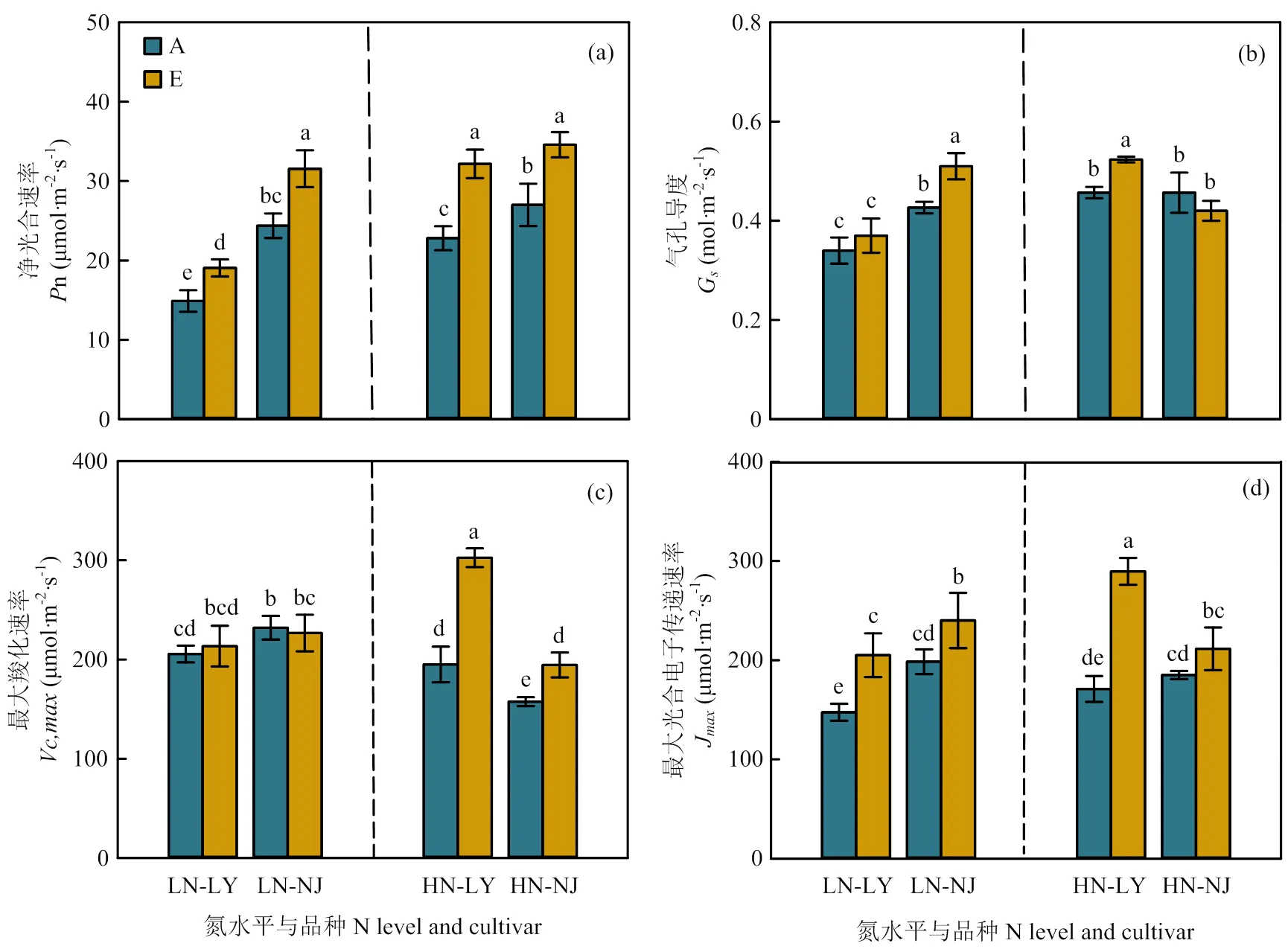
图5 CO2浓度升高对两优培九(LY)和南粳9108(NJ)叶片光合参数的影响

图6 CO2浓度升高对两优培九(LY)和南粳9108(NJ)叶片生理特性的影响
Fig. 6 Effect of elevated CO2concentration on physiological characteristics of leaves of Liangyoupeijiu (LY) and Nanjing 9108 (NJ)
2.5 水稻生长与物质生产对CO2浓度升高的响应
2.5.1 每穴分蘖数和叶面积 与环境CO2浓度相比,CO2浓度升高仅显著增加了高氮水平下LY的每穴分蘖数,增幅达44.8%(图7-a)。CO2浓度升高显著增加LY每穴叶面积,在低氮和高氮水平下分别显著增加了24.6%和51.9%。CO2浓度升高对NJ每穴分蘖数和叶面积均无显著影响(图7-b)。
2.5.2 各器官干物质积累 方差分析结果表明,除氮(N)×CO2,N×品种×CO2对根系干物质无显著影响外,N、品种、CO2及其之间的交互作用对各器官的干物质积累和总生物量均表现为极显著影响。在低氮水平下,与环境CO2浓度相比,CO2浓度升高能显著提高LY地上部(+49.27%)和地下部(+61.4%)干物质积累,并导致根冠比显著提高8.2%(表2)。在高氮水平下,地上部(+93.45%)和地下部(+102.93%)干物质积累响应CO2浓度升高的幅度较低氮水平更大。而对于NJ来说,在低氮水平下,CO2浓度升高未显著影响地上部和根系干物质积累;在高氮水平下,CO2浓度升高也未显著影响地上部干物质积累,却显著降低根系干物质积累(-16.36%),导致根冠比显著降低了18.1%。此外,与环境CO2浓度相比,CO2浓度升高显著提高了LY地上部单茎干重,其中低氮水平(+55.5%)下增幅较高氮水平(+34.1%)要大。无论氮水平如何,CO2浓度升高都没有显著影响NJ地上部单茎干重(表2)。
2.6 各指标间的相关性分析
图8相关性分析结果表明,叶片、茎鞘、根系以及总的生物量与单茎干重、每穴叶面积、根系形态指标(总冠根数、根长和根表面积)、根系生理指标(根系氧化力和根系呼吸速率)、叶片和根系总CTKs含量、GOGAT和GDH活性以及J呈显著或者极显著的正相关。叶片、茎鞘和总的生物量还与分蘖数、GS活性、V叶绿素和Rubisco含量呈显著或者极显著的正相关。根系形态指标(总冠根数、根长和根表面积)和根系呼吸速率与叶片和根系总的CTKs含量(总根长除外)、GS活性、GOGAT和GDH活性(总根长除外)、V、J叶绿素(总冠根数除外)和Rubisco含量呈显著或者极显著的正相关。根系氧化力与根系的CTKs含量、GOGAT和GDH活性、J呈显著或者极显著的正相关。n、V、叶绿素和Rubisco含量与单位叶面积氮含量呈显著或者极显著的正相关。V和J与叶绿素和Rubisco含量都呈显著或者极显著的正相关。
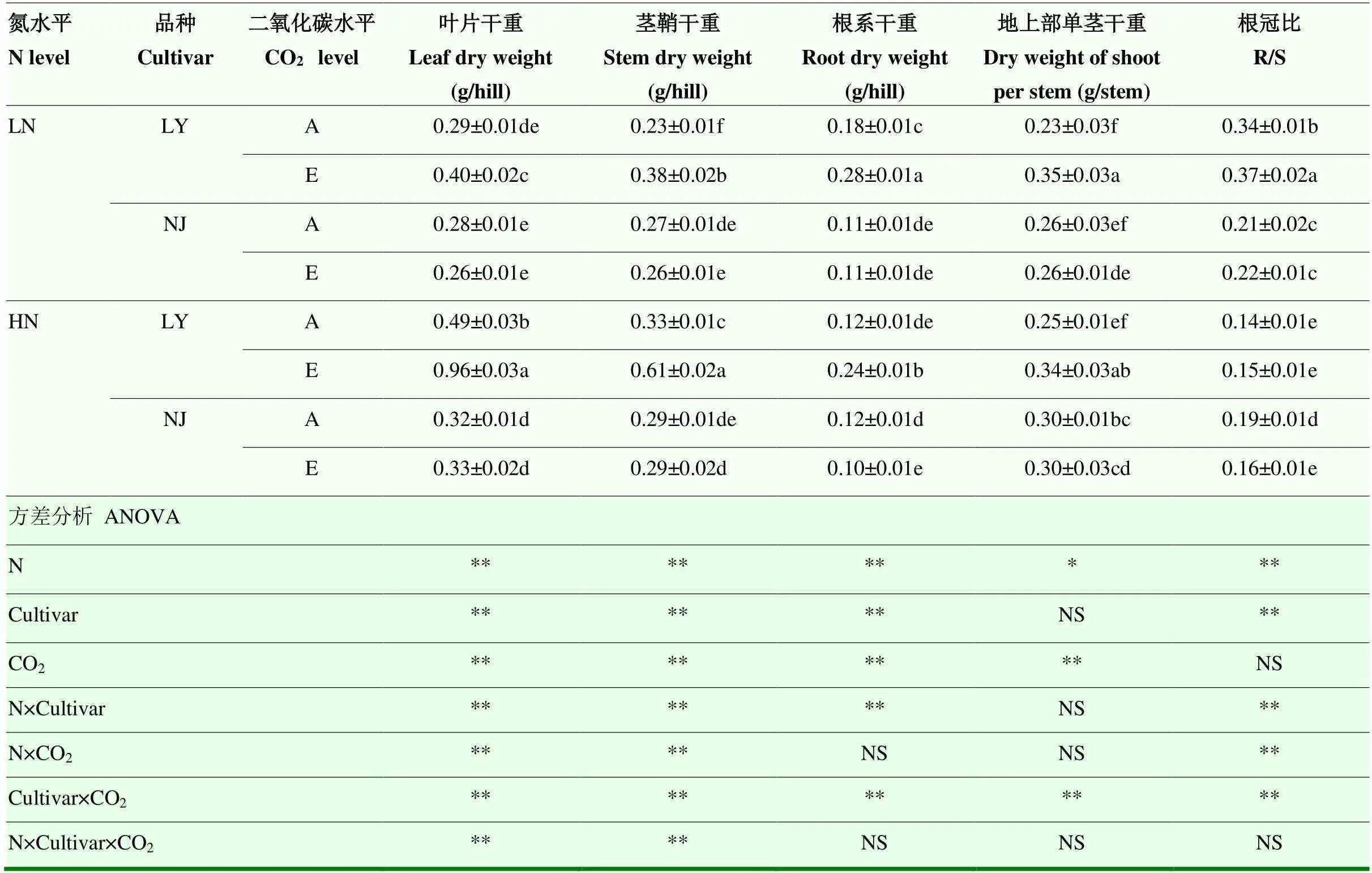
表2 CO2浓度升高对两优培九(LY)和南粳9108(NJ)干物质积累的影响
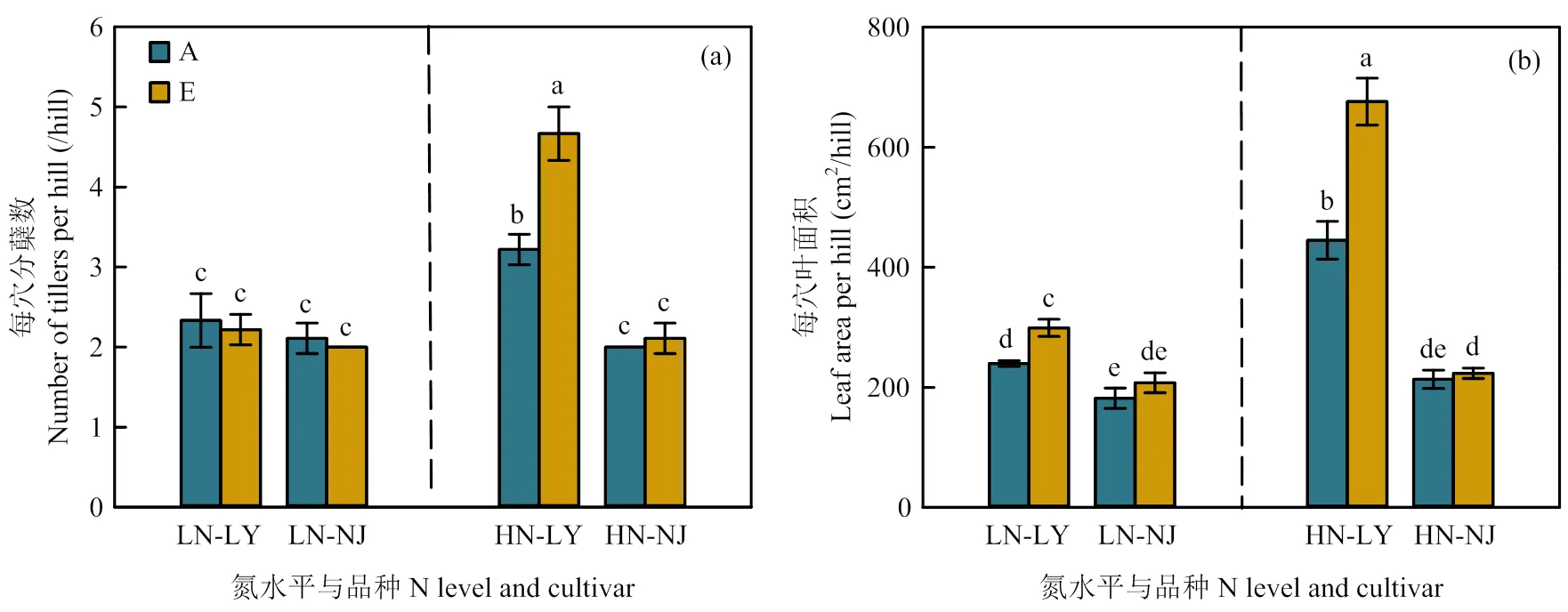
图7 CO2浓度升高对两优培九(LY)和南粳9108(NJ)每穴分蘖数和叶面积的影响
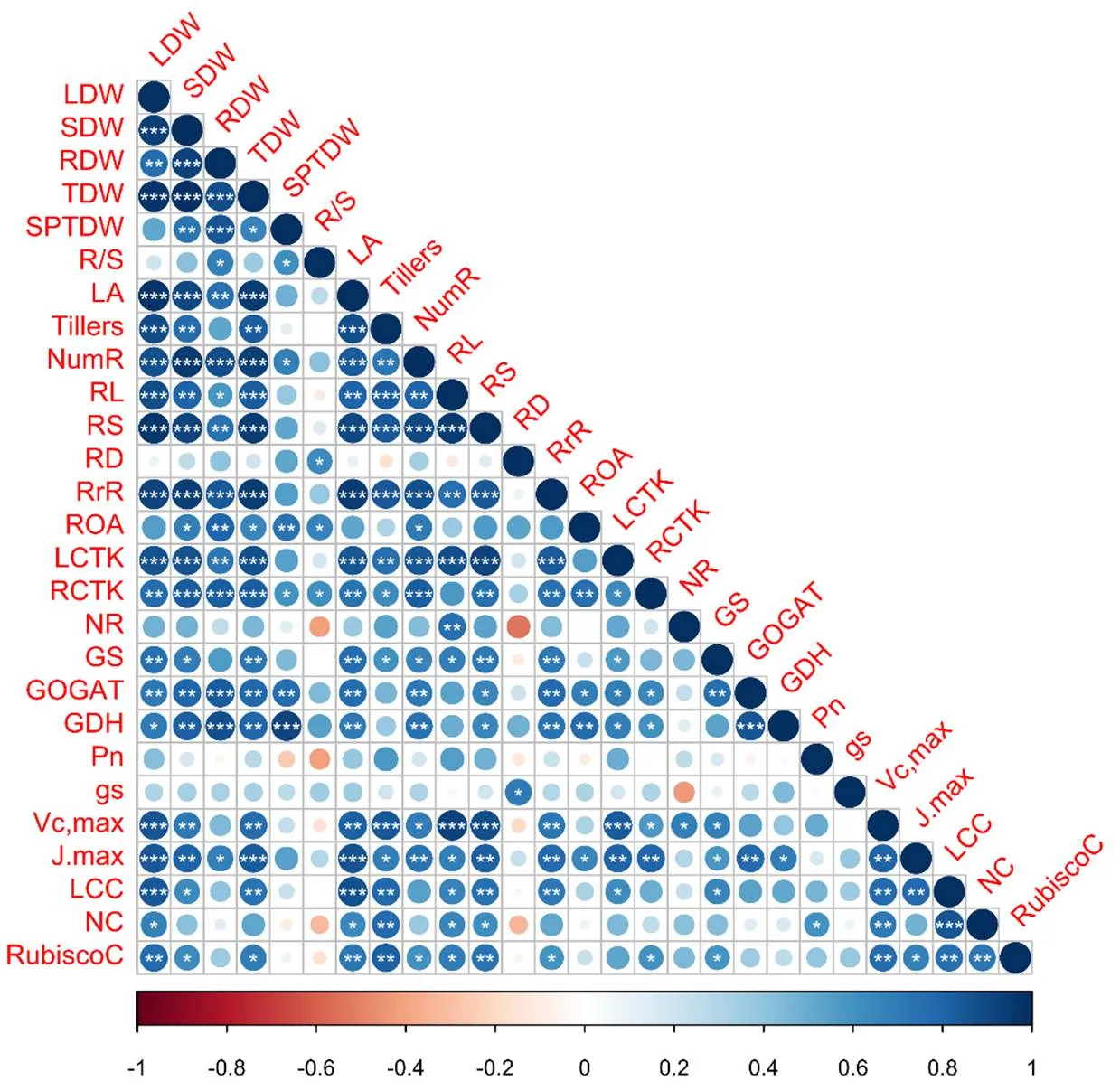
蓝色和红色分别表示显著正、负相关,白色表明无显著相关。*:P≤0.05;**:P≤0.01;***:P≤0.001。LDW,叶片干重;SDW,茎鞘干重;RDW:根系干重;TDW:总干重;SPTDW:单茎干重;R/S:根冠比;LA:叶面积;Tillers:分蘖数;NumR:总冠根数;RL:总根长;RS:总根表面积;RD:平均根径;RrR:根呼吸速率;ROA:根系氧化力;LCTK:叶片总细胞分裂素含量;RCTK:根系总细胞分裂素含量;NR:硝酸还原酶活性;GS:谷氨酰胺合成酶活性;GOGAT:谷氨酸合成酶活性;GDH:谷氨酸脱氢酶活性;Pn:叶片净光合速率;Gs:气孔导度;Vc,max:最大羧化效率;Jmax:最大光合电子传递效率;LCC:叶绿素含量;NC:叶片氮含量;RubiscoC:核酮糖-1,5-二磷酸羧化酶含量
3 讨论
3.1 CO2浓度升高对不同水稻品种根系形态、生理活性及氮素吸收的影响
水稻氮素营养来源于根系对土壤无机氮的吸收。氮素吸收能力强的水稻比氮素吸收能力弱的水稻具有更高的根长、根体积和有效吸收面积,根系氧化力等生理活性也更强[37]。武慧斌等[22]研究表明,CO2浓度升高不同程度地提高了威优644、金优207、湘晚12号和丰华占4个水稻品种根长密度(平均增幅分别为10%、10%、27%、24%),根表面积(24%、24%、21%、21%)、根体积(40%、25%、58%、20%)和根数(4%、8%、18%、11%)。YANG等[21]的研究也表明CO2浓度升高使得武香粳14不定根数量和不定根长度分别比环境条件下高25%—31%和25%—37%,并且在生长后期根系总吸收面积、活跃吸收面积和根系氧化力对CO2浓度升高的响应急剧下降。本研究结果表明,不管在何种氮水平下,CO2浓度升高对LY根系形态有显著的积极效应,其总冠根数、总根长(低氮水平除外)、总根表面积和平均根直径都显著地增加,并且增幅随氮水平的提高而提高。而NJ在CO2浓度升高条件下的冠根数、总根长和总根表面积都表现为降低或者无响应。对于根系生理活性而言,LY能在CO2浓度升高条件下维持较高的根系氧化力和提高根呼吸速率,而NJ表现为根系氧化力显著降低。说明LY与NJ相比根系形态和生理活性对CO2浓度升高的响应更强。
根系是作物CTKs合成的主要场所,其合成的CTKs可随着蒸腾流通过木质部转运至冠层,对氮代谢起着重要的调控作用[25,38]。前人研究表明其参与了氮素从根部向叶片分布的调节过程,在促进氮素向叶绿素和Rubisco的合成与分配,延缓叶片的衰老等方面起着至关重要的作用[24,26,39],并且认为CTKs的含量同水稻品种的氮素吸收能力呈正相关[40]。先前的研究表明,CO2浓度升高显著提高了烟草[41]、番茄[42]、油松[43]和兰花[44]等植物体内CTKs含量。YONG等[45]则认为CO2浓度升高对CTKs含量的影响受供氮水平的影响,低氮条件下棉花叶片CTKs含量显著增加,而高氮条件下棉花叶片CTKs含量与环境CO2下相比无显著差异。近期WANG等[46]研究表明,CO2浓度升高对扬稻6号和武运粳23号不同部位CTKs含量存在品种间的差异。并且认为扬稻6号与武运粳23号相比表现出更高的产量响应、源库比和光合速率,得益于CTKs的增加和旗叶衰老较慢[3]。本研究中叶片和根系中各形态CTKs含量响应CO2浓度升高的趋势不尽相同(图2、图3),但是品种间的差异表现明显,即无论在何种氮水平下,LY叶片和根系中CTKs含量对CO2浓度升高的响应都要大于NJ。综上所述,在CO2浓度升高条件下LY与NJ相比有更高的氮素吸收能力。
3.2 CO2浓度升高对不同水稻品种氮素同化的影响
水稻通过根系吸收的无机氮需要在NR、GS、GOGAT和GDH等氮同化关键酶的作用下,通过一系列的生理生化反应同化为自身所需的含氮化合物[47]。ROBREDO等[48]在大麦中的研究发现CO2浓度升高增强了NR、GS和GOGAT的活性。也有研究认为,CO2浓度升高使得小麦根部NR活性上升,叶片内NR活性有下降趋势[49-50]。WANG等[3,46]在水稻中的研究表明,CO2浓度升高对不同品种以及不同部位氮同化酶活性的影响都存在差异,其中CO2浓度升高显著提高扬稻6号叶片NR活性,却显著降低了武运粳23叶片GS、GOGAT活性。本研究中,两水稻品种叶片的氮同化酶活性对CO2浓度升高的响应也存在差异,并且此响应还受到供氮水平的影响。总的来说,不管氮水平如何,LY叶片氮同化酶活性对CO2浓度升高的响应能力相比于NJ更强,说明其具有更高的氮同化能力。
3.3 CO2浓度升高对不同水稻品种光合参数及理化特性的影响
干物质积累主要来源于光合作用固定的碳水化合物,叶片是进行光合作用、制造光合产物的主要器官,合理的绿叶面积和光合能力是提高光合产量的重要前提[51-52]。CO2浓度升高会增加生育前期的LAI,降低生育后期的LAI[53]。本研究中CO2浓度升高显著提高了不同氮水平下LY的单株叶面积,未显著影响NJ的叶面积。这主要是由于CO2浓度升高条件下NJ分蘖较少,表明LY的叶面积扩展能力对CO2浓度升高响应较NJ更强。CO2作为光合作用的底物,目前大气CO2含量对于C3作物生长并未达到饱和,其含量的上升势必会引起水稻光合速率的提高[54-55],而长期生长在CO2浓度升高条件下的水稻则会出现CO2适应现象[56]。但也有研究表明籼稻没有表现出明显的适应现象[11,14],认为粳稻适应现象可能是与V、Rubisco含量降低和叶片衰老等因素有关[11,57-58]。本研究结果显示,两水稻品种n在CO2浓度升高下都表现为显著提高,且在高氮水平下LY表现出更大的增幅,光合参数也未表明存在气孔限制。由于本研究处于水稻生长早期,所以并未观察到CO2浓度升高显著降低NJ叶片Vx、J、Rubisco以及叶绿素含量。但相比较于LY,NJ以上叶片生理指标对CO2浓度升高都无响应或响应较小,意味着LY光合作用对CO2浓度升高的响应能力较NJ更强。特别是在高氮水平下,这是由于氮素供应充足保证了较高的叶片氮含量。虽然低氮水平下LY叶片氮含量没有明显提高,但总的氮素累积量是显著提高的,这对CO2浓度升高条件下叶片Rubisco酶的合成和叶片的生长都有着积极作用[59]。以上结果表明,CO2浓度升高条件下LY叶面积扩展能力和光合响应能力都优于NJ,预示着其干物质生产能力对CO2浓度升高响应更高。
3.4 CO2浓度升高对不同水稻品种干物质积累的影响及其生理机制
不同生长阶段的干物质积累比例协调是作物高产的前提[60],CO2浓度升高下水稻产量的增加也与单位面积分蘖数和干物质产量的增加有关[61-62]。水稻干物质积累响应CO2浓度升高因品种不同存在差异,例如CO2浓度升高条件下汕优63地上部生物量平均增加33.0%[63],五香粳14和武运粳23地上部生物量分别增加16.0%和16.7%[64-65]。本研究仅观察到CO2浓度升高显著增加LY地上部生物量,且增幅随着施氮的增加而明显提高。而NJ地上部生物量无论在何种氮水平下对CO2浓度升高的响应都没有显著差异(表2)。进一步分析发现,在低氮水平下,LY地上部生物量显著增加主要是由于单茎干重(+55.5%)显著提高;高氮水平下单茎干重不仅提高了34.1%,高氮还促进了更多的分蘖产生。对于根系生物量而言,武慧斌等[22]发现CO2浓度升高显著提高两个杂交籼稻和两个常规籼稻根系生物量,平均增幅9.6%。陈改苹等[66]也发现CO2浓度升高显著提高常规粳稻五香粳14各个生育期根系干物质积累和根冠比。此外,张凤哲等[67]认为CO2浓度升高对根冠比的影响因时期而异,在抽穗期增加了25.6%,在分蘖期、拔节期和成熟期分别降低了3.2%、10.1%、4.9%。本研究观察到,LY在不同氮水平下根系生物量显著提高,但根冠比仅在低氮水平显著提高。而NJ根系的生物量在高氮水平下却表现为降低,导致了根冠比显著降低。说明水稻干物质积累对CO2浓度升高的响应不仅在品种之间存在差异,也与氮素供应密切相关。
WU等[68]研究表明,在不施氮条件下,水稻地上部生物量对CO2浓度升高响应差异形成在拔节期,而根系生物量响应差异在分蘖期,表明根系反应CO2浓度升高更快。而正常施氮条件下,地上部和根系差异响应同时出现在拔节期。在本研究中,两个品种响应CO2浓度升高存在差异,相比较于NJ,LY根系都能够快速反应。氮素匮乏时,LY优先将叶片生产的光合产物通过韧皮部转运到根系,根接收增加的碳水化合物后快速生长,显著提高了根冠比,获得了更大的根尺寸和生理活性。当氮素供应充足时,LY除了促进根系生长发育以外,还通过促进更多的分蘖产生来保证地上部的生长,维持较大的叶面积。良好的根系形态和生理活性可以促进根对氮的吸收,同时促进根系和叶片分泌CTKs,提高氮代谢酶活性与氮素同化能力。根系合成的CTKs通过木质部转运到地上部,促进氮素向叶绿素和Rubisco的合成与分配,从而提高光合响应能力,进而促进干物质的积累增加(图8)。说明促进根的生长是植株健康生长的先决条件,这对于有效应对CO2浓度升高至关重要。而对于NJ而言,无论供氮水平如何,其根系形态和生理活性对CO2浓度升高的响应都未明显提升,因此,其氮素吸收能力可能限制了C的同化与利用。这与WANG等[46]认为的CO2浓度升高导致武运粳23下调和转运蛋白基因的表达,从而导致对无机氮的吸收与转运减弱相一致。说明LY较NJ相比有更强的C、N协同能力,CO2浓度升高条件下其根系生长和氮素吸收利用响应较大是干物质积累显著提高的重要原因。
4 结论
本研究利用两个对CO2浓度升高响应差异明确的水稻品种LY和NJ,探究了物质生产对CO2浓度升高响应在品种间的差异及其生理原因。结果表明,不同水稻品种对CO2浓度升高响应受供氮水平的限制。在不同氮水平下,LY物质生产能力和生理特征对CO2浓度升高的响应幅度较NJ更大。与NJ相比,LY更能有效地利用CO2浓度升高来促进根系生长,生育前期LY较优的根系形态性状和根系活力保证了较高氮素吸收。同时CO2浓度升高提高根系和叶片CTKs含量,提高氮同化关键酶活性,促进氮素向叶绿素和Rubisco的合成与分配,维持较大的绿叶面积,从而提高光合响应能力,进而导致干物质的积累增加。鉴于不同水稻品种之间可能会存在较大的差异,今后仍需采用更多不同类型水稻品种,进一步明确在CO2浓度升高条件下制约水稻品种产量和物质生产的关键因素,探明改善水稻品种物质生产和产量响应水平的调控途径。
[1] IPCC. Climate change 2013: the physical science basis// working group I contribution to the fifth assessment report of the intergovernmental panel on climate change. Cambridge University Press, 2014.
[2] GAMAGE D, THOMPSON M, SUTHERLAND M, HIROTSU N, MAKINO A, SENEWEERA S. New insights into the cellular mechanisms of plant growth at elevated atmospheric carbon dioxide concentrations. Plant, Cell & Environment, 2018, 41(6): 1233-1246.
[3] WANG W L, HE J, WANG Z Q, GU J F, LIU L J, ZHANG W Y, ZISKA L H, ZHU J G. Leaf characteristics of rice cultivars with a stronger yield response to projected increases in CO2concentration. Physiologia Plantarum, 2021, 171(3): 416-423.
[4] WANG W L, CAI C, HE J, GU J F, ZHU G L, ZHANG W Y, ZHU J G, LIU G. Yield, dry matter distribution and photosynthetic characteristics of rice under elevated CO2and increased temperature conditions. Field Crops Research, 2020, 248: 107605.
[5] WANG W L, CAI C, LAM S K, LIU G, ZHU J G. Elevated CO2cannot compensate for japonica grain yield losses under increasing air temperature because of the decrease in spikelet density. European Journal of Agronomy, 2018, 99: 21-29.
[6] ZISKA L H, TOMECEK M B, GEALY D R. Assessment of cultivated and wild, weedy rice lines to concurrent changes in CO2concentration and air temperature: determining traits for enhanced seed yield with increasing atmospheric CO2. Functional Plant Biology, 2014, 41(3): 236.
[7] KIM H Y, LIEFFERING M, KOBAYASHI K, OKADA M, MITCHELL M W, GUMPERTZ M. Effects of free air CO2enrichment and nitrogen supply on the yield of temperate paddy rice crops. Field Crops Research, 2003, 83(3): 261-270.
[8] YANG L X, WANG Y L, DONG G C, GU H, HUANG J Y, ZHU J G, YANG H J, LIU G, HAN Y. The impact of free air CO2enrichment (FACE) and nitrogen supply on grain quality of rice. Field Crops Research, 2007, 102(2): 128-140.
[9] CHEN C, JIANG Q, ZISKA L H, ZHU J G, LIU G, ZHANG J S, NI K, SENEWEERA S, ZHU C W. Seed vigor of contrasting rice cultivars in response to elevated carbon dioxide. Field Crops Research, 2015, 178: 63-68.
[10] YANG L X, LIU H J, WANG Y X, ZHU J G, HUANG J Y, LIU G, DONG G C, WANG Y L. Yield formation of CO2enriched inter-subspecific hybrid rice cultivar Liangyoupeijiu under fully open-air field condition in a warm sub-tropical climate. Agriculture, Ecosystems & Environment, 2009, 129(1/3): 193-200.
[11] ZHU C W, ZHU J G, CAO J, JIANG Q, LIU G, ZISKA L H. Biochemical and molecular characteristics of leaf photosynthesis and relative seed yield of two contrasting rice cultivars in response to elevated CO2. Journal of Experimental Botany, 2014, 65(20): 6049-6056.
[12] YANG L X, LIU H J, WANG Y X, ZHU J G, HUANG J Y, GANG L, DONG G C, WANG Y L. Impact of elevated CO2concentration on inter-subspecific hybrid rice cultivar Liangyoupeijiu under fully open-air field conditions. Field Crops Research, 2009, 112(1): 7-15.
[13] 周娟, 舒小伟, 赖上坤, 许高平, 黄建晔, 姚友礼, 杨连新, 董桂春, 王余龙. 不同类型水稻品种产量和氮素吸收利用对大气CO2浓度升高响应的差异. 中国水稻科学, 2020, 34(6): 561-573.
ZHOU J, SHU X W, LAI S K, XU G P, HUANG J Y, YAO Y L, YANG L X, DONG G C, WANG Y L. Differences in response of grain yield, nitrogen absorption and utilization to elevated CO2concentration in different rice varieties. Chinese Journal of Rice Science, 2020, 34(6): 561-573. (in Chinese)
[14] CHEN C P, SAKAI H, TOKIDA T, USUI Y, NAKAMURA H, HASEGAWA T. Do the rich always become richer? Characterizing the leaf physiological response of the high-yielding rice cultivar takanari to free air CO2enrichment. Plant & Cell Physiology, 2014, 55(2): 381-391.
[15] DAEPP M, SUTER D, ALMEIDA J P F, ISOPP H, HARTWIG U A, FREHNER M, BLUM H, NÖSBERGER J, LÜSCHER A. Yield response ofswards to free air CO2enrichment increased over six years in a high N input system on fertile soil. Global Change Biology, 2000, 6(7): 805-816.
[16] STITT M, KRAPP A. The interaction between elevated carbon dioxide and nitrogen nutrition: the physiological and molecular background. Plant, Cell and Environment, 1999, 22: 583-621.
[17] TERASHIMA I, YANAGISAWA S, SAKAKIBARA H. Plant responses to CO2: background and perspectives. Plant & Cell Physiology, 2014, 55(2): 237-240.
[18] FENG Z Z, RÜTTING T, PLEIJEL H, WALLIN G, REICH P B, KAMMANN C I, NEWTON P C D, KOBAYASHI K, LUO Y J, UDDLING J. Constraints to nitrogen acquisition of terrestrial plants under elevated CO2. Global Change Biology, 2015, 21(8): 3152-3168.
[19] 戢林, 李廷轩, 张锡洲, 余海英. 氮高效利用基因型水稻根系形态和活力特征. 中国农业科学, 2012, 45(23): 4770-4781.
JI L, LI T X, ZHANG X Z, YU H Y. Root morphological and activity characteristics of rice genotype with high nitrogen utilization efficiency. Scientia Agricultura Sinica, 2012, 45(23): 4770-4781. (in Chinese)
[20] 杨建昌. 水稻根系形态生理与产量、品质形成及养分吸收利用的关系. 中国农业科学, 2011, 44(1): 36-46.
YANG J C. Relationships of rice root morphology and physiology with the formation of grain yield and quality and the nutrient absorption and utilization. Scientia Agricultura Sinica, 2011, 44(1): 36-46. (in Chinese)
[21] YANG L X, WANG Y L, KOBAYASHI K, ZHU J G, HUANG J Y, YANG H J, WANG Y X, DONG G C, LIU G, HAN Y, SHAN Y H, HU J, ZHOU J. Seasonal changes in the effects of free-air CO2enrichment (FACE) on growth, morphology and physiology of rice root at three levels of nitrogen fertilization. Global Change Biology, 2008, 14(8): 1844-1853.
[22] 武慧斌, 宋正国, 沈跃, 唐世荣, 刘仲齐. 水稻根系生长发育对CO2浓度升高的响应及其品种间的差异. 生态环境学报, 2014, 23(3): 439-443.
WU H B, SONG Z G, SHEN Y, TANG S R, LIU Z Q. Response of root development on elevated CO2and its variation among different rice varieties. Ecology and Environmental Sciences, 2014, 23(3): 439-443. (in Chinese)
[23] 庞静, 朱建国, 谢祖彬, 刘钢, 陈改苹, 张雅丽. 开放式空气二氧化碳浓度增高(FACE)条件下水稻的根系活力和氮同化能力. 应用生态学报, 2005, 16(8): 1482-1486.
PANG J, ZHU J G, XIE Z B, LIU G, CHEN G P, ZHANG Y L. Root activity and nitrogen assimilation of rice (L.) under free-air CO2enrichment. Chinese Journal of Applied Ecology, 2005, 16(8): 1482-1486. (in Chinese)
[24] OOKAWA T, NARUOKA Y, SAYAMA A, HIRASAWA T. Cytokinin effects on ribulose-1,5-bisphosphate carboxylase/oxygenase and nitrogen partitioning in rice during ripening. Crop Science, 2004, 44(6): 2107-2115.
[25] REGUERA M, PELEG Z, ABDEL-TAWAB Y M, TUMIMBANG E B, DELATORRE C A, BLUMWALD E. Stress-induced cytokinin synthesis increases drought tolerance through the coordinated regulation of carbon and nitrogen assimilation in rice. Plant Physiology, 2013, 163(4): 1609-1622.
[26] CRIADO M V, CAPUTO C, ROBERTS I N, CASTRO M A, BARNEIX A J. Cytokinin-induced changes of nitrogen remobilization and chloroplast ultrastructure in wheat (). Journal of Plant Physiology, 2009, 166(16): 1775-1785.
[27] HE J, ZHANG W Y, ZHU K Y, WANG Z Q, WANG W L, YANG J C. Advantages linked to root development enhance rice biomass accumulation under elevated carbon dioxide conditions. Agronomy Journal, 2020, 112(5): 4007-4017.
[28] SHARKEY T D, BERNACCHI C J, FARQUHAR G D, SINGSAAS E L. Fitting photosynthetic carbon dioxide response curves for C3leaves. Plant, Cell & Environment, 2007, 30(9): 1035-1040.
[29] LICHTENTHALER H K, WELLBURN A R. Determinations of total carotenoids and chlorophylls a and b of leaf extracts in different solvents. Biochemical Society Transactions, 1983, 11(5): 591-592.
[30] MAKINO A, OHIRA T M. Photosynthesis and ribulose-1,5- bisphosphate carboxylase/oxygenase in rice leaves from emergence through senescence. Planta, 1985, 166(3): 414-420.
[31] MAKINO A, MAE T, OHIRA K. Colorimetric measurement of protein stained with coomassie brilliant blue R on sodium dodecyl sulfate-polyacrylamide gel electrophoresis by eluting with formamide.Agricultural and Biological Chemistry, 1986, 50(7): 1911-1912.
[32] 陈薇, 张德颐. 植物组织中硝酸还原酶的提取、测定和纯化. 植物生理学通讯, 1980(4): 45-49.
CHEN W, ZHANG D Y. Extraction, determination and purification of nitrate reductase from Plant tissues. Plant Physiology Journal, 1980(4): 45-49. (in Chinese)
[33] RHODES D, RENDON G A, STEWART G R. The control of glutamine synthetase level inL. Planta, 1975, 125(3): 201-211.
[34] LIN C C, KAO C H. Disturbed ammonium assimilation is associated with growth inhibition of roots in rice seedlings caused by NaCl. Plant Growth Regulation, 1996, 18(3): 233-238.
[35] ANDO T, YOSHIDA S, NISHIYAMA I. Nature of oxidizing power of rice roots. Plant & Soil, 1983, 72(1): 57-71.
[36] ZHANG H, CHEN T T, WANG Z Q, YANG J C, ZHANG J H. Involvement of cytokinins in the grain filling of rice under alternate wetting and drying irrigation. Journal of Experimental Botany, 2010, 61(13): 3719-3733.
[37] YANG J C, ZHANG H, ZHANG J H. Root morphology and physiology in relation to the yield formation of rice. Journal of Integrative Agriculture, 2012, 11(6): 920-926.
[38] 李志康, 严冬, 薛张逸, 顾逸彪, 李思嘉, 刘立军, 张耗, 王志琴, 杨建昌, 顾骏飞. 细胞分裂素对植物生长发育的调控机理研究进展及其在水稻生产中的应用探讨. 中国水稻科学, 2018, 32(4): 311-324.
LI Z K, YAN D, XUE Z Y, GU Y B, LI S J, LIU L J, ZHANG H, WANG Z Q, YANG J C, GU J F. Regulations of plant growth and development by cytokinins and their applications in rice production. Chinese Journal of Rice Science, 2018, 32(4): 311-324. (in Chinese)
[39] KIBA T, KUDO T, KOJIMA M, SAKAKIBARA H. Hormonal control of nitrogen acquisition: roles of auxin, abscisic acid, and cytokinin. Journal of Experimental Botany, 2011, 62(4): 1399-1409.
[40] OOKAWA T, NARUOKA Y, YAMAZAKI T, SUGA J, HIRASAWA T. A comparison of the accumulation and partitioning of nitrogen in plants between two rice cultivars, akenohoshi and nipponbare, at the ripening stage. Plant Production Science, 2003, 6(3): 172-178.
[41] SCHAZ U, DÜLL B, REINBOTHE C, BECK E. Influence of root-bed size on the response of tobacco to elevated CO2as mediated by cytokinins. AoB Plants, 2014, 10(6): 490-552.
[42] WANG Y, DU S T, LI L L, HUANG L D, FANG P, LIN X Y, ZHANG Y S, WANG H L. Effect of CO2elevation on root growth and its relationship with indole acetic acid and ethylene in tomato seedlings. Pedosphere, 2009, 19(5): 570-576.
[43] LI X M, ZHANG L H, MA L J, LI Y Y. Elevated carbon dioxide and/or ozone concentrations induce hormonal changes inJournal of Chemical Ecology, 2011, 37(7): 779-784.
[44] LI C R, GAN L J, XIA K, ZHOU X, HEW C S. Responses of carboxylating enzymes, sucrose metabolizing enzymes and plant hormones in a tropical epiphytic CAM orchid to CO2enrichment. Plant, Cell & Environment, 2010, 25(3): 369-377.
[45] YONG J W H, WONG S C, LETHAM D S, HOCART C H, FARQUHAR G D. Effects of elevated CO2and nitrogen nutrition on cytokinins in the xylem sap and leaves of cotton. Plant Physiology, 2000, 124(2): 767-780.
[46] WANG W L, XU X, ZHU C W, GU J F, ZHANG W Y, LIU G, ZHU J G. Elevated CO2induced changes in cytokinin and nitrogen metabolism are associated with different responses in the panicle architecture of two contrasting rice genotypes. Plant Growth Regulation, 2019, 89(2): 119-129.
[47] XU G H, FAN X R, MILLER A J. Plant nitrogen assimilation and use efficiency. Annual review of plant biology, 2012, 63(1): 153-182.
[48] ROBREDO A, PÉREZ-LÓPEZ U, MIRANDA-APODACA J, LACUESTA M, MENA-PETITE A, MUÑOZ-RUEDA A. Elevated CO2reduces the drought effect on nitrogen metabolism in barley plants during drought and subsequent recovery. Environmental and Experimental Botany, 2011, 71(3): 399-408.
[49] 门中华, 李生秀. CO2浓度对冬小麦氮代谢的影响. 中国农业科学, 2005, 38(2): 320-326.
MEN Z H, LI S X. Effect of CO2concentration on nitrogen metabolism of winter wheat. Scientia Agricultura Sinica, 2005, 38(2): 320-326. (in Chinese)
[50] BLOOM A J, BURGER M, ASENSIO J S R, COUSINS A B. Carbon dioxide enrichment inhibits nitrate assimilation in wheat and. Science, 2010, 328(5980): 899-903.
[51] 赵黎明, 李明, 郑殿峰, 顾春梅, 那永光, 解保胜. 灌溉方式与种植密度对寒地水稻产量及光合物质生产特性的影响. 农业工程学报, 2015, 31(6): 159-169.
ZHAO L M, LI M, ZHENG D F, GU C M, NA Y G, XIE B S. Effects of irrigation methods and rice planting densities on yield and photosynthetic characteristics of matter production in cold area. Transactions of the Chinese Society of Agricultural Engineering, 2015, 31(6): 159-169. (in Chinese)
[52] WANG J Y, WANG C, CHEN N N, XIONG Z Q, WOLFE D, ZOU J W. Response of rice production to elevated CO2and its interaction with rising temperature or nitrogen supply: a meta-analysis. Climatic Change, 2015, 130(4): 529-543.
[53] 杨海龙, 蔡金洋. 大气CO2浓度和温度升高对水稻生长发育影响的研究进展. 安徽农业科学, 2020, 48(4): 24-27, 30.
YANG H L, CAI J Y. A review on the effects of increasing atmospheric CO2concentration and temperature on rice growth and development. Journal of Anhui Agricultural Sciences, 2020, 48(4): 24-27, 30. (in Chinese)
[54] 李彦生, 金剑, 刘晓冰. 作物对大气CO2浓度升高生理响应研究进展. 作物学报, 2020, 46(12): 1819-1830.
LI Y S, JIN J, LIU X B. Physiological response of crop to elevated atmospheric carbon dioxide concentration: a review. Acta Agronomica Sinica, 2020, 46(12): 1819-1830. (in Chinese)
[55] 谢立勇, 姜乐, 冯永祥, 赵洪亮, 王惠贞, 林而达. FACE条件下CO2浓度和温度增高对北方水稻光合作用与产量的影响研究. 中国农业大学学报, 2014, 19(3): 101-107.
XIE L Y, JIANG L, FENG Y X, ZHAO H L, WANG H Z, LIN E D. Impacts of elevated CO2and increasing temperature on rice photosynthesis and yield in North China under FACE system. Journal of China Agricultural University, 2014, 19(3): 101-107. (in Chinese)
[56] CAI C, YIN X Y, HE S Q, JIANG W Y, SI C F, STRUIK P C, LUO W H, LI G, XIE Y T, XIONG Y, PAN G X. Responses of wheat and rice to factorial combinations of ambient and elevated CO2and temperature in FACE experiments. Global Change Biology, 2016, 22(2): 856-874.
[57] ARANJUELO I, ERICE G, SANZ-SAEZ A, ABADIE C, GILARD F, GIL-QUINTANA E, AVICE J C, STAUDINGER C, WIENKOOP S, ARAUS J L, BOURGUIGNON J, IRIGOYEN J J, TCHERKEZ G. Differential CO2effect on primary carbon metabolism of flag leaves in durum wheat (Desf.). Plant, Cell & Environment, 2015, 38(12): 2780-2794.
[58] SENEWEERA S, MAKINO A, HIROTSU N, NORTON R, SUZUKI Y. New insight into photosynthetic acclimation to elevated CO2: The role of leaf nitrogen and ribulose-1,5-bisphosphate carboxylase/ oxygenase content in rice leaves. Environmental and Experimental Botany, 2011, 71(2): 128-136.
[59] LI Y, GAO Y X, XU X M, SHEN Q R, GUO S W. Light-saturated photosynthetic rate in high-nitrogen rice (L.) leaves is related to chloroplastic CO2concentration. Journal of Experimental Botany, 2009, 60(8): 2351-2360.
[60] 邹应斌, 黄见良, 屠乃美, 李合松, 黄升平, 张杨珠. "旺壮重"栽培对双季杂交稻产量形成及生理特性的影响. 作物学报, 2001, 27(3): 343-350.
ZOU Y B, HUANG J L, TU N M, LI H S, HUANG S P, ZHANG Y Z. Effects of the VSW cultural method on yield formation and physiological characteristics in double cropping hybrid rice. Acta Agronomica Sinica, 2001, 27(3): 343-350. (in Chinese)
[61] AINSWORTH E A, LONG S P. What have we learned from 15 years of free-air CO2enrichment (FACE)? A meta-analytic review of the responses of photosynthesis, canopy properties and plant production to rising CO2. New Phytologist, 2004, 165(2): 351-372.
[62] KIM H, SUNG N. The effect of ambient pressure on the evaporation of a single droplet and a spray. Combustion and Flame, 2003, 135(3): 261-270.
[63] 刘红江, 杨连新, 黄建晔, 董桂春, 朱建国, 刘钢, 王余龙. FACE对杂交籼稻汕优63干物质生产与分配的影响. 农业环境科学学报, 2009, 28(1): 8-14.
LIU H J, YANG L X, HUANG J Y, DONG G C, ZHU J G, LIU G, WANG Y L. Effect of free air CO2enrichment (FACE) on production and distribution of dry matter of three-line indica hybrid rice cultivar Shanyou 63. Journal of Agro-Environment Sciences, 2009, 28(1): 8-14. (in Chinese)
[64] YANG L X, HUANG J Y, YANG H J, DONG G C, LIU G, ZHU J G, WANG Y L. Seasonal changes in the effects of free-air CO2enrichment (FACE) on dry matter production and distribution of rice (L.). Field Crops Research, 2006, 98(1): 12-19.
[65] 李春华, 曾青, 沙霖楠, 张继双, 朱建国, 刘钢. 大气CO2浓度和温度升高对水稻地上部干物质积累和分配的影响. 生态环境学报, 2016, 25(8): 1336-1342.
LI C H, ZENG Q, SHA L N, ZHANG J S, ZHU J G, LIU G. Impacts of elevated atmospheric CO2and temperature on above-ground dry matter accumulation and distribution of rice (L.). Ecology and Environmental Sciences, 2016, 25(8): 1336-1342. (in Chinese)
[66] 陈改苹, 朱建国, 谢祖彬, 朱春梧, 程磊, 曾青, 庞静. 开放式空气CO2浓度升高对水稻根系形态的影响. 生态环境, 2005, 14(4): 503-507.
CHEN G P, ZHU J G, XIE Z B, ZHU C W, CHENG L, ZENG Q, PANG J. Effects of free air CO2enrichment on root morphology of rice. Ecology and Environment, 2005, 14(4): 503-507. (in Chinese)
[67] 张凤哲, 谢立勇, 赵洪亮, 金殿玉. 大气CO2浓度升高条件下施加生物炭对水稻生物量分配及产量的影响. 植物营养与肥料学报, 2021, 27(6): 929-937.
ZHANG F Z, XIE L Y, ZHAO H L, JIN D Y. Synergistic effects of biochar application and elevated atmospheric CO2concentration on rice biomass allocation and yield. Plant Nutrition and Fertilizer Science, 2021, 27(6): 929-937. (in Chinese)
[68] WU J J, KRONZUCKER H J, SHI W M. Dynamic analysis of the impact of free-air CO2enrichment (FACE) on biomass and N uptake in two contrasting genotypes of rice. Functional Plant Biology, 2018, 45(7): 696-704.
Difference in the comprehensive response of dry matter accumulation of rice at tillering stage to rising atmospheric CO2concentration and nitrogen nutrition and its physiological mechanism

1Jiangsu Key Laboratory of Crop Genetics and Physiology/Jiangsu Key Laboratory of Crop Cultivation and Physiology/Agricultural College of Yangzhou University, Yangzhou 225009, Jiangsu;2Jiangsu Coastal Agricultural Science Research Institute, Yancheng 224002, Jiangsu;3Joint International Research Laboratory of Agriculture and Agri-product Safety, Ministry of Education/Institutes of Agricultural Science and Technology Development of Yangzhou University, Yangzhou 225009, Jiangsu
【Objective】The aim of this study was to explore the comprehensive response difference and physiological mechanism of different rice cultivars in response to elevated atmospheric CO2concentration and nitrogen nutrition. 【Method】In this study, a rice cultivar Liangyoupeijiu (LY) with high response to CO2(high-response rice cultivar) and a rice cultivar Nanjing 9108 (NJ) with low response to CO2(low-response rice cultivar) were selected as materials. Hydroponic experiments were carried out in the climate chamber. Two CO2treatments and two nitrogen treatments were set up with ambient CO2concentration (A-CO2, 400 μmol·mol-1) and elevated CO2concentration (E-CO2, 600 μmol·mol-1), and high nitrogen (HN, 1.25 mmol·L-1NH4NO3) and low nitrogen (LN, 0.25 mmol·L-1NH4NO3), respectively. The effects of elevated CO2concentration on root morphology and physiological activity, cytokinin (CTKs) content in leaves and roots, nitrogen assimilation enzyme activity, physiological characteristics of leaves, photosynthetic parameters, and dry matter accumulation of different rice cultivars were analyzed.【Result】(1) E-CO2significantly increased the total crown root number, total root length (except LN level), total root surface area, and average diameter of LY, improved root respiration rate and maintained high root oxidation power, but had no significant or opposite effects on NJ. (2) Regardless of nitrogen level, E-CO2significantly increased CTKs content in LY leaves and roots, but significantly decreased zeatin nucleoside (ZR) content in NJ roots at HN level. (3) At LN level, E-CO2significantly increased GOGAT and GDH activities in LY leaves, but significantly decreased NR activities in NJ leaves. At HN level, the activity of LY nitrogen assimilation enzyme increased under E-CO2condition, but only NR activity increased in NJ. (4) At LN level, E-CO2increased the net photosynthetic rate (n) of LY and NJ by 28.0% and 29.4%, respectively. At HN level,nof the two cultivars increased by 41.0% and 28.1%, respectively. The significant increase in photosynthetic response of LY was attributed to the significant increase in leaf maximum carboxylation efficiency (V), maximum photosynthetic electron transport efficiency (J), ribulose-1, 5-bisphosphate carboxylase/oxygenase (Rubisco) content, chlorophyll content, and leaf nitrogen content. (5) E-CO2significantly increased the leaf area per plant of LY under different nitrogen levels, but had no significant effect on NJ. (6) E-CO2significantly increased the organs and total biomass of LY, and the increased level under HN was significantly higher than that under LN level. E-CO2did not significantly affect the total biomass of NJ under different nitrogen treatments, but significantly reduced the underground biomass of NJ under HN (-16.7%). 【Conclusion】No matter at the HN or LN treatment, the response of dry matter production and physiological characteristics of LY to E-CO2was higher than that of NJ. In the early growth stage, LY had better root morphological characters and root activity, higher CTKs content, stronger nitrogen assimilation ability, larger green leaf area and photosynthetic response capacity, which were important reasons accounting for the higher response of dry matter production under E-CO2conditions.
rice; elevated CO2concentration; root morphology; cytokinin; photosynthesis; dry matter production

10.3864/j.issn.0578-1752.2023.06.003
2022-06-28;
2022-08-02
江苏省自然科学青年基金(BK20200923)、国家自然科学基金(32201888,32071943)、国家重点研发计划(SQ2022YFD2300304,2018YFD0300801)、江苏高校优势学科建设工程资助项目(PAPD)、扬州市“绿杨金凤”人才引进计划
贺江,E-mail:hejiang0323@163.com。通信作者王伟露,E-mail:weiluwang868@yzu.edu.cn
(责任编辑 杨鑫浩,岳梅)

