不同土壤消毒方式对土壤真菌多样性和群落结构的影响
朱诗君,王丽丽,金树权,*,周金波,汪 峰,卢晓红
(1.宁波市农业科学研究院,浙江 宁波 315101; 2.中国农业科学院 植物保护研究所,北京 100193)
长期连作和不良的耕作措施容易导致土壤理化性质退化和土壤微生物区系恶化,从而产生土壤板结、酸化、盐渍化和土传病害等土壤连作障碍问题[1]。土传病害具有难防治、易复发、危害大等特点,严重影响作物产量和品质。土传病害的形成与土壤微生物群落失衡息息相关,常表现为土壤中有益菌群大量减少,而病原菌大量富集[2]。因此,重构土壤微生物群落,改善土壤微生态平衡,对防治连作作物的土传病害来说至关重要。目前,在生产实际中,土壤消毒技术是最为常见且有效的土传病害防控方法。该技术主要通过高效、快速杀灭土壤中的真菌、细菌、线虫等有害生物,达到防控效果[3-4]。
根据原理不同,土壤消毒大体分为物理消毒、化学消毒、生物熏蒸等方法[5-6]。其中,高温闷棚是生产中常用的物理消毒手段,主要通过将表层土壤温度提升到50 ℃以上,灭杀土壤中对温度较为敏感的微生物。生石灰、石灰氮、棉隆是生产中最常见的3种化学消毒剂,三者皆是通过与水反应从而实现土壤消毒的。生石灰遇水会产生热量提高土壤温度,通过高温杀灭土壤中的微生物;石灰氮与棉隆都是通过与水反应产生活性物质从而杀灭土壤中的病原体、有害昆虫、原生生物的,但两者产生的活性物质有所不同,石灰氮与水反应产生氰胺和双氰胺[7],棉隆则是产生异硫氰酸甲酯[8]。
本研究以重度连作障碍草莓大棚为研究对象,选择高温闷棚,以及生石灰、石灰氮和棉隆等进行土壤消毒,研究不同土壤消毒方式对土壤真菌多样性和土壤真菌群落结构的影响,从而明确其对土传病害的防治效果,以期为作物连作障碍防治提供技术指导和理论依据。
1 材料与方法
1.1 材料与试剂
生石灰由广西亿平化工有限公司生产,纯度≥90%;石灰氮由石嘴山市鹏盛化工有限公司生产,纯度≥60%;棉隆由南通施壮化工有限公司生产,纯度≥98%。
超强土壤基因组提取试剂盒,由北京聚合美生物科技有限公司生产;PCR试剂,由宝日医生物技术(北京)有限公司生产。
1.2 试验设计
试验于2020年6月—2021年5月在宁波市农业科学研究院新型农业技术集成示范基地(121°36′E,29°40′N)的一个单体棚内进行。试验前,大棚已经过7 a以上的草莓连作,有非常严重的连作障碍问题。土壤消毒前,按照5点法对试验前土壤取样,将取好的样品混合均匀装入取样袋中,-80 ℃保存,直至进行微生物分析。经测定,供试大棚土壤的基本理化性质如下:质地为砂壤土,pH值6.17,有机质含量46.40 g·kg-1,全氮含量2.32 g·kg-1,碱解氮含量182.36 mg·kg-1,速效磷含量111.25 mg·kg-1,速效钾含量452.16 mg·kg-1。
以消毒前的土壤作为对照(CK),另设置高温闷棚(T1)、生石灰消毒(T2)、石灰氮消毒(T3)、棉隆消毒(T4)4个处理。每个处理设3次重复,各小区面积为50 m2,小区之间间隔1 m,以防止氰胺、双氰胺和异硫氰酸甲酯等活性物质的交叉作用。
土壤消毒按照下述方法进行:清除上茬草莓残体后,充分翻耕,混合单体大棚的土壤。按照450 kg·hm-2的用量,按照对应处理,在试验小区内均匀撒施生石灰、石灰氮和棉隆,然后用旋耕机翻耕30~40 cm土壤,使消毒剂与土壤混合。随后,铺上滴灌管,并用厚度在0.8 mm以上的新膜对小区进行覆膜,确保小区的密封性后,使用滴灌管进行灌水,使土壤含水量达到50.0%~70.0%。覆膜40 d。消毒结束后揭去薄膜,随后同消毒前方法对消毒后的土壤进行取样,采集的土壤样品放置于通风橱中通风以去除熏蒸剂,然后将土样保存于-80 ℃直到进行测定分析。
1.3 土壤微生物多样性检测
称取混合均匀的土壤0.5 g,利用超强土壤基因组提取试剂盒提取并纯化土壤DNA,提取后的DNA经凝胶电泳检测后,使用NanoDrop 2000c型分光光度计(美国Thermo Scientific)测定提取的DNA浓度。用引物ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′)扩增ITS片段。反应体系(20 μL):DNA 100 ng,2×Taqmix 10 μL,ITS1和ITS4引物各0.2 μmol·L-1。反应程序:95 ℃ 5 min;95 ℃ 30 s,58 ℃ 30 s,72 ℃ 1 min, 30个循环;72 ℃ 10 min;10 ℃ 2 min。扩增好的片段经过凝胶电泳检测无误后,将所提取的土壤DNA送至上海欧易生物医学科技有限公司进行高通量测序和分析。
2 结果与分析
2.1 土壤样品测序深度评估
全部5个处理的土壤样品经过测序、Reads(读序)拼接、过滤后,共产生196 497个clean tags(即高质量的tags数据),聚类得到1 897个OTUs(分类操作单元)。随机抽取测序序列,在97%的相似度水平下,统计各样品代表物质的OTUs数目并进行注释,以抽取的序列数与物种数作为坐标轴绘制稀释曲线(图1),稀释曲线在序列数超过20 000之后趋于平缓,说明测序数据可以反映样品中真菌群落的实际情况。
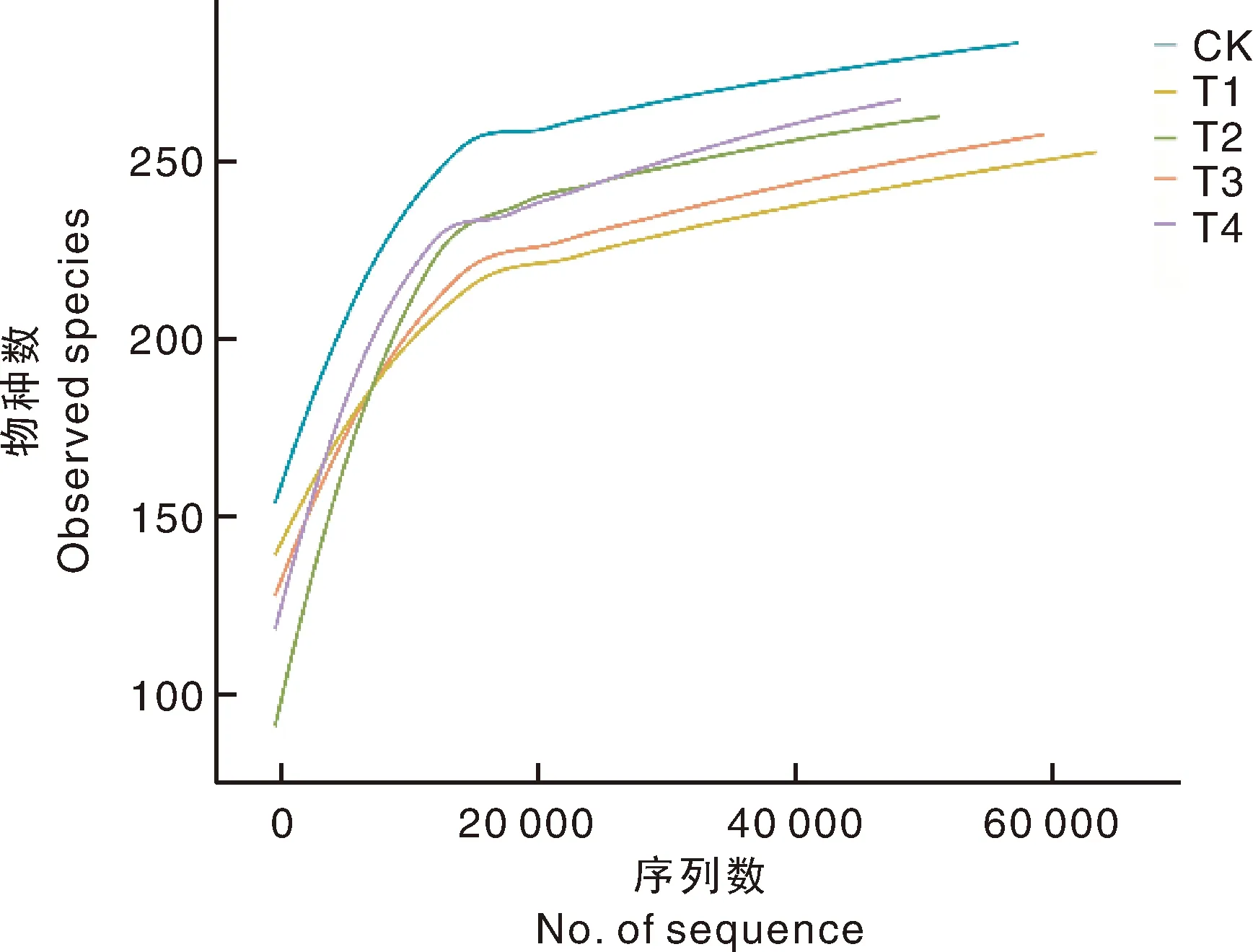
图1 不同土壤样品的真菌测序稀释曲线
2.2 土壤真菌群落的α多样性分析
Chao1指数和物种数反映群落的丰富度,其中前者对稀有物种敏感。相较于CK,各消毒处理土壤的真菌Chao1指数和物种数均有不同程度的降低(表1),其中,T4处理的降幅最大,较CK分别下降21.01%、18.91%。香农指数(Shannon index)和辛普森指数(Simpson index)综合反映物种的丰富度与均匀度。经过土壤消毒,各处理的香农指数和辛普森指数均较CK有不同程度的降低,同样以T4处理的降幅最大,分别较CK降低了8.97%和4.26%。通过对消毒前后土壤真菌多样性指标的分析可知,本试验所设置的4种土壤消毒方式均会不同程度地降低土壤真菌的物种多样性,降幅总体呈现为T4>T3>T2>T1。
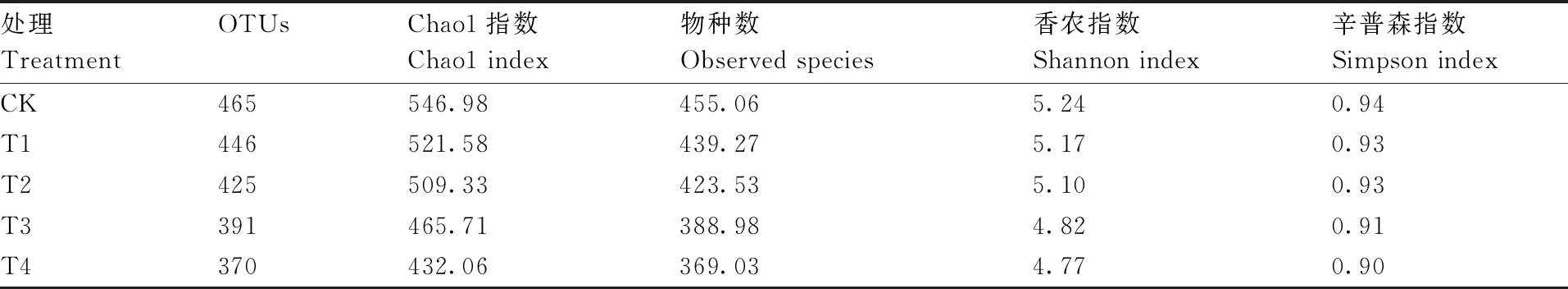
表1 不同土壤消毒处理的土壤真菌群落α多样性指数
2.3 土壤真菌门水平上的物种相对丰度分析
在所有样本中,在门水平上,最主要的土壤真菌主要是子囊菌门(Ascomycota)、接合菌门(Zygomycota)、担子菌门(Basidiomycota)、壶菌门(Chytridiomycota)、罗兹菌门(Rozellomycota)(图2),其中,相对丰度最高的为子囊菌门,在T1、T2、T3、T4处理中分别占比67.90%、63.76%、72.73%、74.60%。相对于CK,所有土壤消毒处理都明显减少了接合菌门的相对丰度,尤以T4处理的降幅最高。与CK相比,T1处理在降低接合菌门和罗兹菌门相对丰度的同时,增加了其他土壤真菌门的相对丰度;T2处理降低了子囊菌门、接合菌门、壶菌门、罗兹菌门的相对丰度,但增加了担子菌门的相对丰度;T3处理在降低接合菌门、壶菌门相对丰度的同时,增加了子囊菌门、担子菌门和罗兹菌门的相对丰度;T4处理在降低接合菌门、担子菌门相对丰度的同时,增加了壶菌门、子囊菌门的相对丰度。综上,经过土壤消毒后,土壤真菌门水平上各物种的相对丰度发生明显变化,且不同消毒方式下的变化趋势存在一定差异。
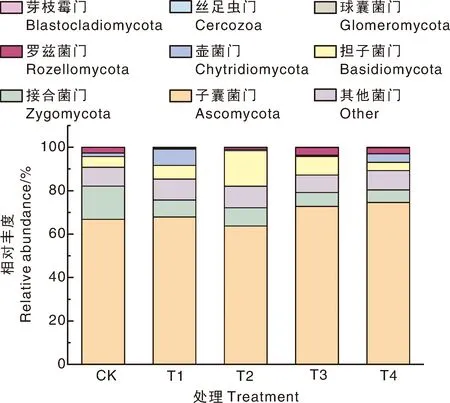
图2 不同处理对土壤真菌门水平上物种相对丰度的影响
2.4 土壤真菌属水平上的物种相对丰度分析
对确定分类地位至属的土壤真菌进行统计,在所有样本中共发现194个土壤真菌属,其中,相对丰度大于0.1%的土壤真菌属共62个(表2)。可以看出,各土壤消毒处理下所发现的土壤真菌多数属于子囊菌门,包含枝顶孢霉属(Acremonium)、镰刀菌属(Fusarium)、轮枝菌属(Verticillium)、毛壳菌属(Chaetomium)等,以及少量其他菌门真菌,如接合菌门(Zygomycota)的被孢霉属(Mortierella)。CK处理下,在子囊菌门内,属水平上相对丰度最高的土壤真菌为镰刀菌属。镰刀菌属是引发草莓枯萎病、根腐病等多种病害的病原菌,在CK下的相对丰度高达5.77%。这说明,在当地多年的草莓连作下,土壤的微生物群落结构已明显恶化。经过土壤消毒处理后,镰刀菌属的相对丰度降低,其中,T4处理的镰刀菌属相对丰度已低于0.5%。

表2 不同处理对土壤真菌属水平上物种相对丰度的影响
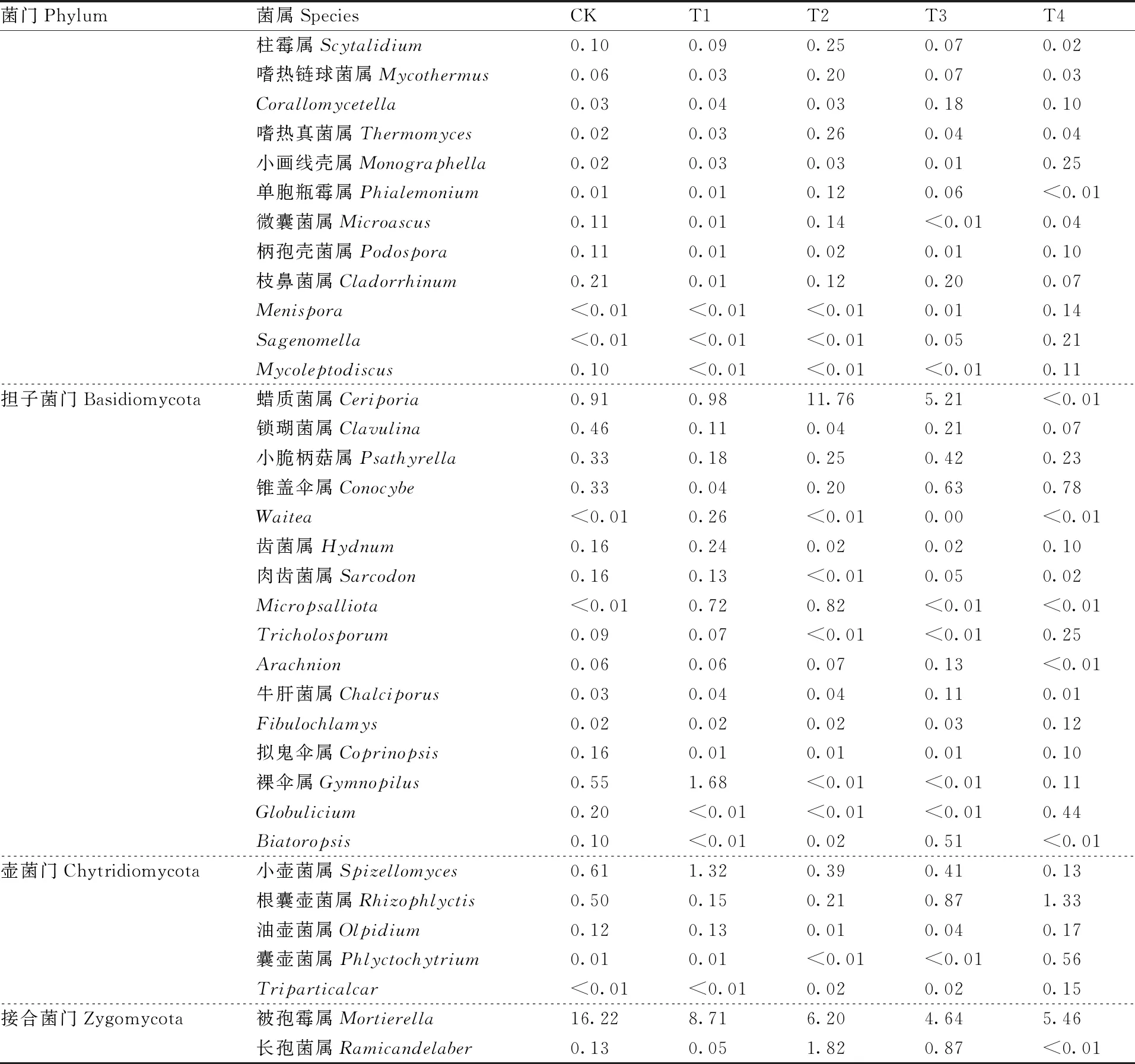
续表2 Continued Table 2
把相对丰度>1%的真菌属认定为优势真菌属,在属水平上,CK、T1、T2、T3和T4分别有9、13、10、8、11种。通过韦恩图(图3)分析可知,5个处理共同的优势真菌属有5种,分别是毛壳菌属、棒囊壳属(Corynascus)、被孢霉属、梭孢壳属(Thielavia)、脉孢菌属(Neurospora)。此外,CK、T1、T2、T3共有的1个优势真菌属为镰刀菌属,T1、T2、T3、T4共有的1个优势真菌属为青霉属(Penicillium),CK、T1、T4共有的1个优势真菌属为曲霉菌属(Aspergillus),CK与T1共有的1个优势真菌属为轮枝菌属,CK与T4共有的1个优势真菌属为枝顶孢霉属(Acremonium),T1与T2共有的1个优势真菌属为腐质霉属(Humicola),T2与T3共有的1个优势真菌属为蜡质菌属(Ceriporia)。另外,T1具有3个专属的优势真菌属,分别为Polyschema、裸伞属(Gymnopilus)和小壶菌属(Spizellomyces);T2专属的优势真菌属有1个,为长孢菌属(Ramicandelaber);T4专属的优势真菌属有3个,分别为节丛孢属(Arthrobotrys)、木霉属(Trichoderma)和根囊壶菌属(Rhizophlyctis)。
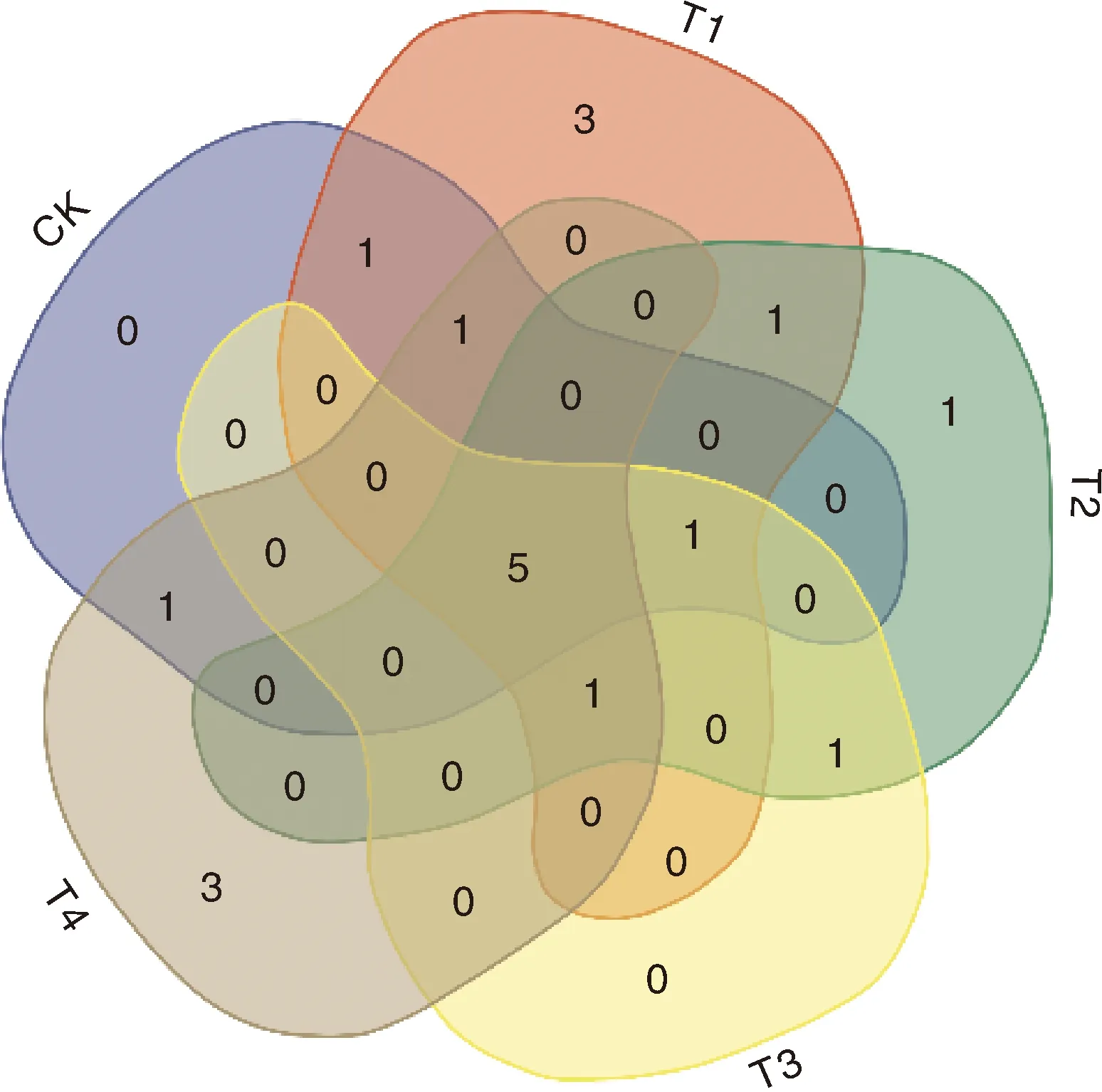
图3 不同处理土壤优势真菌属(相对丰度>1%)的韦恩图
对上述提及的19种优势真菌属在各处理下相对丰度的变化做进一步分析。结果显示,所有土壤消毒处理的镰刀菌属、梭孢壳属、轮枝菌属、被孢霉属、枝顶孢霉属的相对丰度下降,而毛壳菌属与青霉属的相对丰度均有所上升。此外,对变化幅度大于0.1百分点的总结如下:T1处理降低了棒囊壳属和根囊壶菌属的相对丰度,增加了腐质霉属、Polyschema、裸伞属和小壶菌属的相对丰度;T2处理降低了棒囊壳属、曲霉菌属、节丛孢属、祼伞属、小壶菌属、根囊壶菌属的相对丰度,增加了脉胞菌属、腐质霉属、木霉属、蜡质菌属与长孢菌属的相对丰度;T3处理降低了曲霉菌属、节丛孢属、裸伞属、小壶菌属的相对丰度,增加了棒囊壳属、脉孢菌属、腐质霉属、木霉属、蜡质菌属、根囊壶菌属和长孢菌属的相对丰度;T4处理降低了棒囊壳属、脉孢菌属、腐质霉属、蜡质菌属、裸伞属、小壶菌属、长孢菌属的相对丰度,增加了曲霉菌属、木霉属、节丛孢属和根囊壶菌属的相对丰度。
3 讨论
近年来,设施作物连作障碍问题频发且不断加剧,造成了严重的经济损失和环境问题,已经成为制约我国现代农业发展的一个重要问题。研究表明,作物连作障碍的发生、加剧与植物-土壤-微生物系统内多种因素的联合作用有关,其中,土壤微生态的失衡是导致土传病害频发和作物亚健康发育的重要原因之一[9]。土壤微生态失衡主要表现为有益微生物减少,病原菌大量富集,微生物区系特征由“细菌型”转化为“真菌型”[10-11]。
土壤消毒通过强有力的方式灭杀土壤中的靶标微生物,大幅减少土壤中的有害微生物群落,重构土壤微生物群落结构,可有效防控作物土传病害,缓解作物连作障碍[12]。因此,评估并明确各项土壤消毒技术对土壤中微生物群落的影响,对于连作障碍防治具有积极意义。
本研究分析了常见的几种消毒方式对土壤微生物群落的影响,结果发现,土壤消毒后,土壤真菌群落丰度和多样性均有不同程度的下降,群落组成也发生明显变化,各消毒处理下镰刀菌属的相对丰度均下降。镰刀菌属是常见的植物病原菌,该属的多个菌种与作物土传病害息息相关[13-14]。例如:禾谷镰孢菌(Fusariumgraminearum)与小麦、水稻等禾谷作物的茎基腐病、根腐病等病害有关[15]。尖孢镰刀菌(F.oxysporum)引发草莓、番茄等作物枯萎病、根腐病等病害[16]。轮枝菌属是导致草莓黄萎病的主要病原菌。被孢霉属也被报道可能与多种植物病害有关,如苹果的再植病[17]。但也有研究表明,被孢霉属的部分菌种,如细长被孢霉(Mortierellaelongata)在土壤碳储存、维持土壤健康和促进作物发育方面有积极作用[18-19]。
据报道,土壤消毒对非靶标生物同样存在影响。在本研究中,经过土壤消毒后,梭孢壳属等土壤真菌的相对丰度明显下降。梭孢壳属被报道含有丰富的酶资源,如漆酶、纤维素酶、角质酶等,在土壤物质代谢转化[20-21]和促进土壤健康上有一定的积极作用。这说明,试验中的土壤消毒方式具有广谱性,在杀灭病原真菌的同时,也会抑制部分有益真菌。但也有一些研究表明,土壤消毒后部分土壤真菌的相对丰度不仅没有降低,反而有所上升[22]。本研究中,各处理下毛壳菌属与青霉属的相对丰度均有不同程度的上升。青霉属真菌因其分泌的广谱抑菌素——青霉素而得到广泛研究[23]。毛壳菌属也被报道可以作为控制植物病害的广谱杀真菌剂[24]。在本研究中,棉隆消毒后,节丛孢属、木霉属的丰度有所上升。节丛孢属被报道为一类捕食线虫的寄生型真菌[25-26],而木霉属真菌则是生产中最常用的生防真菌。有研究报道,木霉属真菌对棉隆熏蒸具有非常高的抗性,在熏蒸土壤中能快速定殖,其相对丰度是未处理土壤的60倍[27]。这些有益微生物的富集,对于降低土壤病原菌的丰度或抑制其数量回升,以及稳定健康的土壤微生态等有重要意义。
从土壤真菌多样性和土壤真菌群落结构的角度出发,本试验的4种消毒方式中,棉隆的效果最佳。但是,棉隆的经济成本相对较高。相对而言,石灰氮是一个较为理想的替代方案,既具有较好的土壤微生态改良效果,还能带入部分氮素,可在一定程度上节省生产过程中的氮肥成本。另外要说明的是,仅靠土壤消毒并不能彻底防治土传病害复发,在没有结合其他生物手段的前提下,后茬草莓种植期间土壤中的有害微生物仍会迅速回升。结合土壤消毒、生防微生物或其他微生物的防治手段被证实是克服连作障碍的一项可行的方案。多项研究表明,通过土壤消毒大幅减少土壤致病真菌之后,再向土壤中添加生物菌肥,可以使根际微生物迅速恢复,且长久性增加有益菌群,减少有害真菌[28]。

