早期营养与康复训练在肺移植术后患者中的应用
郑赛华 杨带芹 殷远梅 谭彦珠
肺移植是治疗终末期肺病的重要手段,目前全世界每年约开展4000例,2020年我国29个肺移植中心开展超过500台肺移植手术[1]。术后康复是影响肺移植手术疗效与患者生存时间的关键因素[2]。已有研究指出,术后早期多学科康复训练能够改善肺功能,减少并发症[3]。肺移植患者大部分病程长、机体处于严重营养不良状态,据报道其营养不良发生率为20%~70%[4]。肺移植患者术后重症期给予早期肠内营养支持,可促进肠功能恢复,改善免疫和代谢功能,加速肺移植患者康复[5]。早期营养联合运动训练对于促进消化与代谢、提高免疫功能,改善机体有氧代谢能力具有重要意义[6],但目前临床缺乏标准化的早期营养支持与训练方案。本研究尝试在肺移植患者中实施早期营养与训练干预,为临床制订标准化肺移植患者早期营养支持和训练方案提供依据。
1 对象与方法
1.1 研究对象
选取2020年3月—2021年10月我院收治的肺移植患者80例作为研究对象,纳入条件:成功接受肺移植手术,术后生命体征稳定;年龄18~75岁;营养风险筛查2002(NRS2002)>3分。排除条件:合并严重心肝肾系统疾病;术后长时间无法脱机;发生急性排斥反应;合并急性胃肠功能损伤;合并肺栓塞、深静脉血栓等;合并甲状腺功能障碍等影响代谢的疾病。将80例患者按照组间基本特征具有可比性的原则分为对照组和观察组,各40例。观察组男31例,女9例;年龄47~69岁,平均54.23±2.21岁;疾病类型:肺纤维化22例,慢性阻塞性肺疾病(COPD)6例,支气管扩张3例,矽肺3例,其他6例;单肺移植27例,双肺移植13例;APACHEII评分20~27分,平均23.14±1.34分;NRS2002评分4~8分,平均5.11±0.88分。对照组男33例,女7例;年龄49~71岁,平均55.43±1.97岁;疾病类型:肺纤维化21例,COPD 5例,支气管扩张5例,矽肺4例,其他5例;单肺移植24例,双肺移植16例;APACHEII评分20~26分,平均23.46±1.15分;NRS2002评分4~9分,平均5.38±0.75分。两组患者一般资料比较差异无统计学意义(P>0.05)。本研究已获医院伦理委员会批准,患者均知情同意。
1.2 干预方法
1.2.1 对照组 术后入住ICU,按专科常规标准进行护理,即术后24~48 h患者血流动力学恢复稳定,采用百普力[肠内营养混悬液 (SP)],经鼻胃管输注;第1天输注速度为20~30 ml/h,给予供给量的1/3~1/2;术后第2天输注速度60 ml/h,给予1/2至全量,逐渐增加至全量。实施肠内营养支持时将床头抬高大约35°,氯己定口腔护理每天2次。同时监测白蛋白水平,静脉输注人血白蛋白10~20 g/d。每日2次协助患者进行床上运动锻炼,包括四肢大小关节的屈伸活动,臂关节和髋关节的内旋与外展等被动活动。
1.2.2 观察组 在对照组的基础上,实施基于多学科专业评估的个体化早期营养联合运动训练,具体措施按照《2016 年成人危重症患者营养支持治疗实施与评价指南》[7]及国外ICU患者早期运动方案为参考制订。
(1)早期营养方案:由ICU医生、责任护士、营养师、临床药师组成的多学科工作小组,每日联合查房,按照指南要求给予营养评估后制订相应干预方案。①鼻饲营养,NRS 2002评分超过3分、重症患者急性胃肠损伤分级(AGI分级)I~III级患者实施肠内营养,营养剂为百普力,初始剂量为41.84~85.68 kJ/h,每日最高剂量不超过2092 kJ,蛋白质摄入量1.2~2.0 g/(kg·d)。多学科工作小组按照指南相关肠内营养评估项目(有无呕吐、腹胀、腹泻、胃潴留、误吸、消化道出血等),每6h行肠内营养耐受评估,根据患者耐受状况,适当增加营养支持剂量。发现明显胃潴留立即给予胃肠动力药,可首选经空肠管喂养。胃残留量<500ml且无其他不耐受表现的患者可继续行肠内营养。②经口进食,撤机且血流动力学恢复稳定者,在拔除经口气管插管后2 h,开始适量饮水;经多学科联合查房,评估吞咽功能状况,如无障碍可给予流食后拔除胃管,由营养师负责个体化营养搭配及饮食调整,逐渐向普食过度。保证患者充足的热量125.52~146.44kJ/(kg·d)、蛋白质1.3~1.5 g/(kg·d)、维生素和微量元素,使体质量增加到正常范围。
(2)运动训练方案:按照国外ICU护理早期四步锻炼法,由专业康复师实施,一级活动,即意识昏迷或RASS镇静评分不超过-3分者,每2 h翻身拍背1次,并进行四肢关节被动活动与四肢肌肉按摩;二级活动,即意识清醒且肌力低于3级患者,在一级活动基础上,增加上肢运动(双手握拳10 s)与下肢运动(踝泵运动15 s),锻炼强度为每次20个,每天3次;三级活动,即意识清醒且肌力高于3级者,在上述基础上,增加抗阻力关节运动,包括上肢外展运动、扩胸运动、蹬腿运动,强度为每次30个,每天2次;四级活动,即意识清醒且下肢肌力高于3级者,在上述运动的基础上,每日在患者耐受情况下协助步行20 min。
1.3 观察指标
两组均干预1个月,在干预前与干预后收集患者的结局指标。
(1)ICU治疗指标:比较两组患者干预前后机械通气时间、ICU停留时间、谵妄发生率、胃管留置时间。
(2)营养指标:比较两组患者干预前后血清白蛋白、总蛋白水平。
(3)肺功能:比较两组患者干预前后肺功能指标。采用德国生产的MS-Scope肺功能仪在床边进行肺功能检测,记录用力肺活量占预计值比(FVC%)、1秒用力呼气量占预计值比(FEV1%)、FEV1/FVC。
(4)日常生活活动能力:采用改良 Barthel 指数评定量表(modified Barthel index,MBI)[8]评估患者干预前后日常生活活动能力,MBI内容包括修饰、进餐、淋浴、穿衣、转移、行走、上下楼梯、如厕、大便、小便共10项,按生活能力受限程度分为15分、10分、5分、0分4个等级,总分100分,得分越高表明生活自理能力越好。该量表在同一评定者及不同评定者间均有良好的信度(ICC=0.866~0.997)。
1.4 数据分析方法
采用 SPSS 19.0 统计学软件进行统计分析。采用K-S检验判断计量资料的分布形态,符合正态分布采用“均数±标准差”表示,组间均数比较采用独立样本t检验,方差不齐进行t’检验;计数资料计算百分率,组间率的比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者干预后ICU治疗指标比较
干预后,观察组机械通气时间、胃管留置时间、入住ICU时间短于对照组,谵妄发生率低于对照组,组间比较差异均具有统计学意义(P<0.05),见表1。
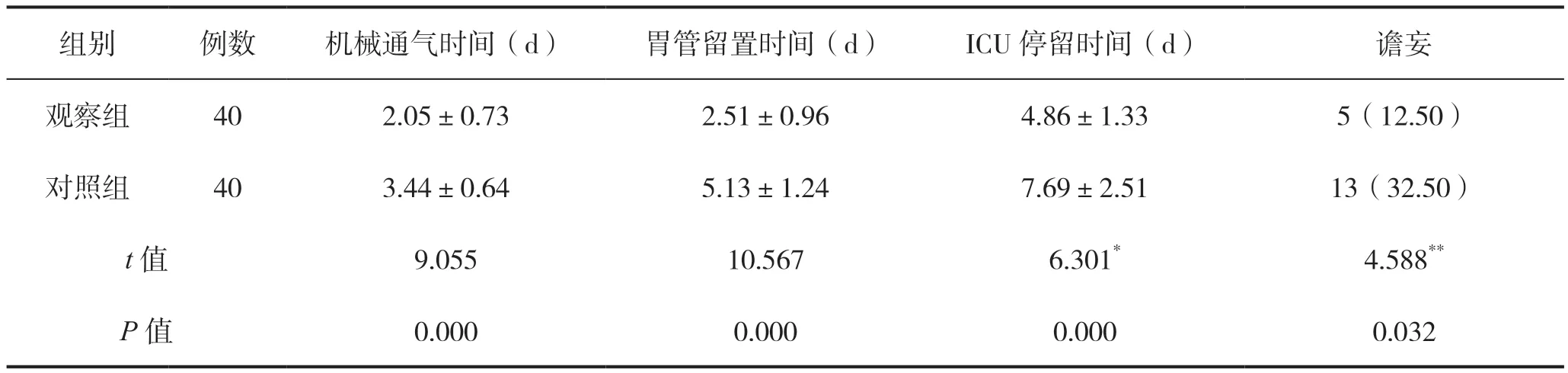
表1 两组患者干预后ICU治疗指标比较
2.2 两组患者干预前后营养指标比较
干预前,两组患者白蛋白、总蛋白水平比较差异均无统计学意义(P>0.05);干预后,观察组患者血清白蛋白、总蛋白高于对照组,组间比较差异具有统计学意义(P<0.05),见表2。
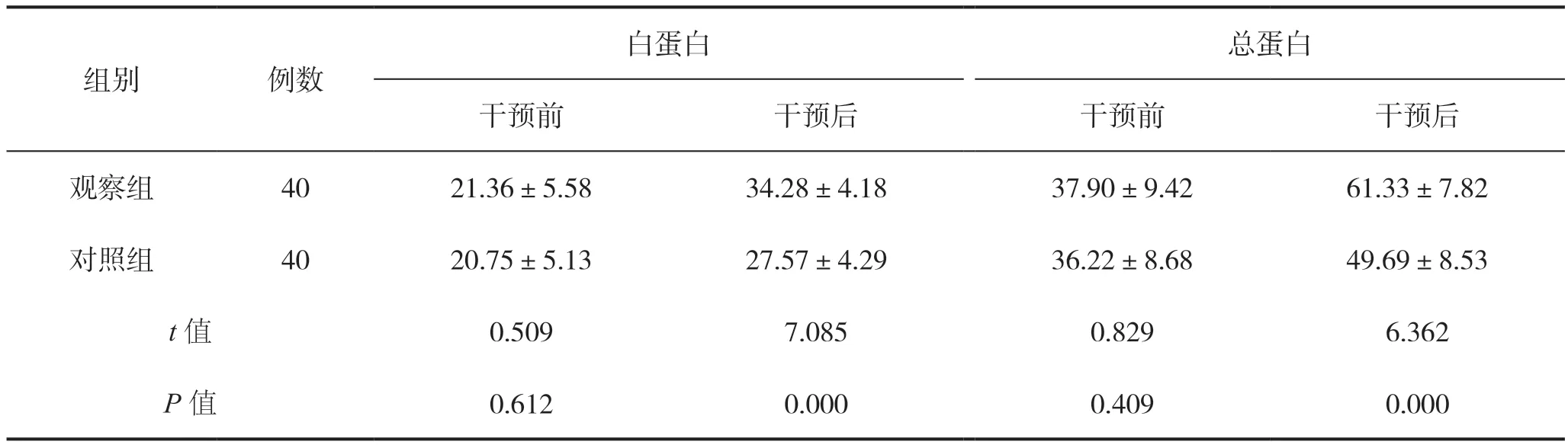
表2 两组患者干预前后营养指标比较(g/L)
2.3 两组患者干预前后肺功能与日常生活活动能力比较
干预前,两组患者肺功能与日常生活活动能力评分比较差异均无统计学意义(P>0.05);干预后,观察组患者肺功能指标均优于对照组,日常生活活动能力评分高于对照组,组间比较差异具有统计学意义(P<0.05),见表3。
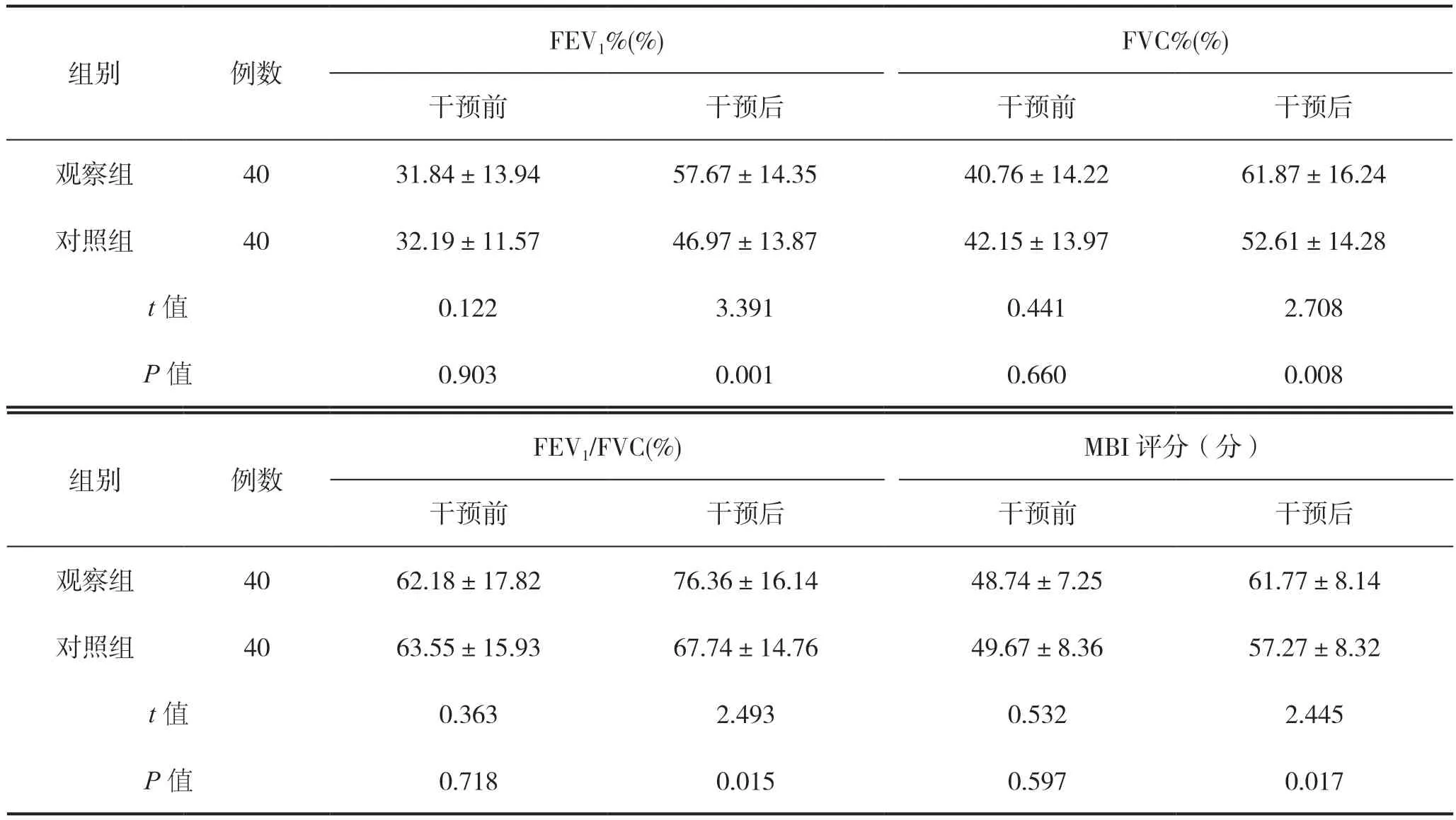
表3 两组患者干预前后肺功能与日常生活活动能力比较
3 讨论
肺移植患者术前患病时间长,营养状况差,运动功能受损,即使肺移植手术成功后,这些不利因素仍会继续影响患者的康复。加之手术过程中移植肺去神经支配、膈神经损伤、辅助肌肉力量减弱,术后需长期服用免疫抑制剂、置入各种管道等治疗措施,使患者机体功能进一步减弱[9],亟需营养与肺康复训练的介入。
本研究结果显示,干预后,观察组患者在ICU各项治疗指标均优于对照组,营养指标高于对照组,表明早期营养与训练可有效促进肺移植患者术后康复,改善患者营养状况,与已有研究结论一致[10]。肺移植患者由于使用体外膜肺氧合和肌松剂及镇痛镇静药等,易导致肌肉功能障碍而延长呼吸机使用时间[4]。营养不良则会降低呼吸肌耐力和强度,导致呼吸肌萎缩[11]。肠内营养是ICU患者营养供给的重要手段,可提供机体必需的热能,有效保护各系统脏器功能,改善氧化应激与炎症损伤,调节机体免疫[12]。研究证实,在患者耐受的情况下,早期拔出胃管对于促进术后康复具有积极意义[13]。在营养支持的同时,进行分级的科学运动训练,可通过增加机体早期活动,促进合成代谢,提高营养吸收,刺激呼吸肌与肢体肌力的恢复,改善术后整体生理功能,从而缩短ICU各项治疗时间,改善营养状况[14]。已有研究证实,营养不良是术后谵妄的独立危险因素,低蛋白血症、贫血可造成组织氧合障碍,影响机体对脑组织的供氧,进而影响大脑神经元的代谢功能,增加术后谵妄风险[15]。吴华炼等[16]研究指出,早期离床活动干预可有效降低ICU患者谵妄发生率。本研究中,在营养风险评估的基础上,给予个体化营养支持,并根据患者恢复情况,逐渐过渡至普食,加速消化系统功能的恢复,改善患者营养指标,降低术后营养不良风险,改善机体对脑组织的供氧,促进神经系统功能的改善;同时通过针对性的康复训练,鼓励患者在病情许可的情况下离床活动,从而有效降低谵妄发生率。
本研究结果显示,观察组干预后各项肺功能指标以及日常生活活动能力高于对照组,表明早期营养与训练可有效改善肺移植患者预后,与上述研究结论[14]基本一致。一方面是由于营养支持促进机体整体功能的恢复;另一方面,运动训炼可增加肌纤维的横截面积,加快肌肉细胞代谢,增加心输出量,改善肺循环及周围循环的供血,同时增加呼吸肌力量,从而改善呼吸功能与整体机体活动能力[17]。
综上所述,肺移植术后早期营养是改善患者营养状况的必要措施,在早期营养支持的同时,实施科学的运动训练,可有效改善患者肺功能,从而提升患者生活质量。本研究样本量较小,且为单中心试验,存在潜在的偏倚,后期还需继续进行大样本、多中心的研究,以进一步验证研究结果。

