基于缺氧诱导因子1α 探讨黄芪鳖甲丸治疗膝关节骨性关节炎的作用机制
谭志韵,罗汉文,彭 莎,赵新新,赖亦静
(1.佛山市中医院骨科,广东 佛山 528000;2.广州中医药大学第五临床医学院,广东 广州 510405)
骨性关节炎(osteoarthritis,OA)又称退行性关节病,首先出现关节软骨的变性,随后发生邻近软骨增生、继而骨化形成骨关节病变,其中以膝关节骨性关节炎(knee osteoarthritis,KOA)的发病率最高[1-2]。KOA 是以退行性病理改变为基础的疾病,多发于中老年人群,其症状多表现为膝盖红肿痛、上下楼梯时疼痛、坐起立行时膝部酸痛不适等。也会有患者表现膝盖节肿胀、弹响、积液等,如不及时治疗,则会引起关节畸形,甚至致残[3],其病变最主要为膝关节软骨的损伤,以及在软骨破损后引起的一系列广泛病理改变,后期甚至严重影响行走功能。因此,如何有效治疗KOA 是降低致残率、改善老年人生活质量的一个需要迫切解决的问题。
黄芪鳖甲丸为佛山市中医院的院内制剂(粤药制字Z20060051),用于医治退行性骨关节病、骨质疏松症等,以中医的“肾主骨”及“补肾”等作为理论基础,在医治肾精不足型KOA 上取得良好疗效[4]。本实验拟在前期研究的基础上,探讨黄芪鳖甲丸对缺氧诱导因子1α(HIF-1α)信号通路的影响,分析研究黄芪鳖甲丸治疗KOA的作用机制,为中医药治疗KOA 提供相应实验基础,现报道如下。
1 材料与方法
1.1 实验动物SPF 级SD 大鼠共60 只,雌性,购自广东省医学实验动物中心,实验动物生产许可证号SCXK(粤)2018-0002,动物实验环境:广东省中医药工程技术研究院SPF 级动物实验室,设施使用许可证号SYXK(粤)2020-0059。本研究经佛山市中医院实验动物伦理委员会批准。
1.2 试剂及仪器塞来昔布胶囊(辉瑞制药有限公司,国药准字J20140072,规格:0.2 g/粒);黄芪鳖甲丸(佛山市中医院,粤药制字Z20060051,规格:7.5 g/包)。碘乙酸钠(美国Sigma 公司,CAS 号:305-53-3,规格:5 g/瓶);雌二醇(E2)、白细胞介素-1β(IL-1β)、肿瘤坏死因子-α(TNF-α),酶联免疫吸附(ELISA)试剂盒购自天津安诺瑞康生物技术有限公司;HIF-1α[免疫印迹(WB)1∶1 000,免疫组化(IHC)1∶200]、基质金属蛋白酶-1(MMP-1,WB1∶1000,IHC1∶200)、葡萄糖载体-1(Glut-1,1∶1000)、血管内皮生长因子A(VEGFA,1∶1000)抗体(美国Proteintech 公司)。电子天平(德国Sartorius 公司,型号:BS224S),小型高速冷冻离心机(德国Eppendorf 公司,型号:5418),全波长多功能酶标仪(美国Thermo 公司,型号:Varioskan Flash),荧光显微镜(日本奥林巴斯株式会社,型号:BX51),核酸蛋白测定仪(美国Bio-Rad,型号:SmartSpec plus),电泳仪(美国Bio-Rad,型号:PowerPac Basic),多功能成像系统(上海Tanon,型号:5200 Multi)。
1.3 实验方法
1.3.1 实验动物分组、造模及给药 大鼠适应性喂养1周,按完全随机分组法分为假手术组(10 只)、造模组(50 只)。采用双侧卵巢切除及关节腔注射碘乙酸钠复制大鼠绝经后的KOA 模型。假手术组大鼠保留卵巢,仅切开表皮及进行相应缝合手术,造模组大鼠则在切除卵巢8周后进行关节腔注射碘乙酸钠1 次,然后将造模组分为模型组、塞来昔布组(0.018 g/kg)、黄芪鳖甲丸高剂量组(8.100 g/kg)、黄芪鳖甲丸中剂量组(4.050 g/kg)及黄芪鳖甲丸低剂量组(2.025 g/kg),每组10 只大鼠。对给药的组别每天灌胃相应种类和剂量的药物,假手术组和模型组给予等体积的生理盐水,1 次/d,连续4 周。
1.3.2 取材及指标检测 在最后一次给药1 h 后,将大鼠的双膝关节毛发剔除,在麻醉成功后抽取大鼠腹主动脉血3 mL;将大鼠膝关节屈曲90°,在股四头肌的最高点倾斜45°剪下缺口,露出髌韧带并使用镊子拉开,暴露关节腔的一部分。然后使用1 mL 注射器抽吸200 μL 生理盐水用于冲洗关节腔,反复3 次,得到膝关节灌洗液;接着解剖大鼠双膝关节,测量其横径;用刮匙及尖刀片小心剥离股骨髁部软骨,转移至EP 管后置于液氮中保存,胫骨平台软骨用甲醛固定。
1.3.3 大鼠膝关节横径测量 使用游标卡尺测量大鼠双侧膝关节的横径,然后计算其平均值。
1.3.4 ELISA 检测 采集大鼠腹主动脉血3 mL,以3 500 r/min 离心10 min,分离血清,使用ELISA 试剂盒检测大鼠血清E2。关节腔灌洗则采用ELISA 试剂盒检测大鼠膝关节灌洗液中的IL-1β、TNF-α。
1.3.5组织病理学观察 将大鼠双膝关节囊打开,观察其股骨髁部软骨的外观改变。然后切取大鼠关节胫骨平台软骨,使用甲醛固定,经过脱水脱钙、石蜡包埋及纵向连续切片系列操作,进行番红固绿染色,免疫组化法检测HIF-1α及MMP-1(稀释倍数1∶200)的表达和定位,显微镜下100 倍观察并拍摄。根据软骨形态变化及病理学染色结果,进行光镜软骨检测评价标准(Mankin’s)评分[5]。
1.3.6 使用蛋白免疫印迹法(Western blot)检测各组大鼠软骨HIF-1α、葡萄糖转运蛋白1(Glut-1)、血管内皮细胞生长因子(VEGF)、MMP-1 蛋白的表达 利用蛋白提取试剂盒提取大鼠膝关节软骨组织的总蛋白,检测浓度后进行聚丙烯酰胺凝胶电泳,再经过转膜,牛奶封闭,蛋白一抗孵育(稀释倍数1∶1 000)及相应的辣根过氧化物酶标记二抗孵育,最后采用增强型化学发光液显色,运用多功能成像系统拍照和分析条带灰度值,选用β-actin 作为内参蛋白,计算蛋白表达量。
1.4 统计学分析采用SPSS 26.0 统计学软件处理数据。计数资料以[例(%)]表示,组间比较采用χ2检验。计量资料以±s表示,多组间比较采用单因素方差分析,先行Levene Statistic 方差齐性检验,方差齐时,采用SNK 检验进行组间均值的两两比较;方差不齐时,采用Dunnett T3 检验进行组间均值的两两比较。以P<0.05 为差异有统计学意义。
2 结果
2.1 6组大鼠膝关节横径比较模型组大鼠膝关节横径明显大于假手术组,差异有统计学意义(P<0.05)。塞来昔布组、黄芪鳖甲丸高、中、低剂量组大鼠膝关节横径均小于模型组,差异有统计学意义(P<0.05),见表1。

表1 6组大鼠膝关节横径比较(mm,x)
2.2 6组大鼠血清E2 水平及膝关节灌洗液炎症因子水平比较模型组大鼠的血清E2水平显著低于假手术组,差异有统计学意义(P<0.05),黄芪鳖甲丸高、中剂量组大鼠的血清E2水平均高于模型组,差异有统计学意义(P<0.05)。模型组大鼠膝关节灌洗液IL-1β、TNF-α水平显著高于假手术组,差异有统计学意义(P<0.01),黄芪鳖甲丸高、中、低剂量组大鼠关节灌洗液IL-1β、TNF-α水平低于模型组,差异有统计学意义(P<0.05),见表2。

表2 6组大鼠血清E2 水平及膝关节灌洗液炎症因子水平比较(pg/mL,x)
2.3 6组大鼠膝关节软骨病理学观察及免疫组化分析假手术组大鼠膝关节软骨完整,表面无损伤且色泽光滑,无血管增生;模型组大鼠膝关节软骨光泽发暗,软骨表面有较为明显的缺损,可见血管增生;塞来昔布组大鼠膝关节软骨较模型组大鼠软骨有光泽,软骨表面存在部分缺损,存在血管增生;黄芪鳖甲丸高剂量组大鼠膝关节软骨表面与模型组相比,软骨光滑而富有光泽,缺损不明显;黄芪鳖甲丸中剂量组大鼠膝关节软骨中部稍有损伤,伴有血管增生;黄芪鳖甲丸低剂量组大鼠膝关节软骨表面有缺损,可见血管增生,见图1。

图1 大鼠膝关节软骨大体观察
大鼠膝关节经番红固绿染色后软骨及软骨下骨层次清晰,假手术组大鼠膝关节软骨表层光滑,软骨细胞数量及形态正常,潮线完整无紊乱,染色正常;模型组大鼠膝关节软骨表层缺损明显,软骨细胞排列不规整,潮线紊乱,炎症细胞浸润明显;塞来昔布组大鼠关节软骨表层有部分缺损,软骨细胞排列不规整,潮线不完整,有炎症细胞浸润;黄芪鳖甲丸高、中剂量组大鼠膝关节软骨表层光滑,软骨细胞排列规整,细胞形态正常,潮线完整;黄芪鳖甲丸低剂量组大鼠膝关节软骨表层部分缺损,软骨细胞排列还算整齐,潮线欠规整,见图2。
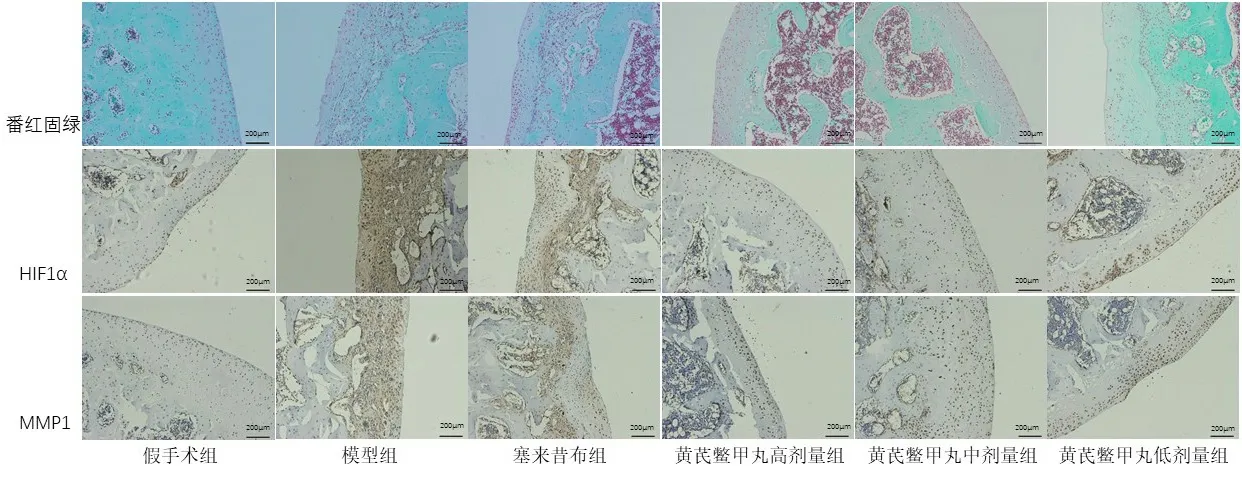
图2 大鼠膝关节软骨病理学检查(番红固绿染色及免疫组化,100×)
结合大鼠膝关节软骨大体观察及染色检查,根据Mankin’s 评分标准,模型组大鼠软骨Mankin’s 评分明显高于假手术组,差异有统计学意义(P<0.05)。黄芪鳖甲丸各剂量组和塞来昔布组大鼠软骨Mankin’s 评分明显低于模型组,差异有统计学意义(P<0.05)。根据图3 免疫组化染色结果,使用专业图像分析软件(IPP6)读取黄染颗粒光密度值(IOD),模型组大鼠软骨HIF-1α及MMP-1 黄染颗粒IOD 值高于假手术组,差异有统计学意义(P<0.05)。黄芪鳖甲丸各剂量组和塞来昔布组大鼠软骨HIF-1α及MMP-1 黄染颗粒IOD 值明显低于模型组,差异有统计学意义(P<0.05),见表3。
表3 6组大鼠膝关节软骨Mankin’s 评分及免疫组化IOD 值比较(±s)
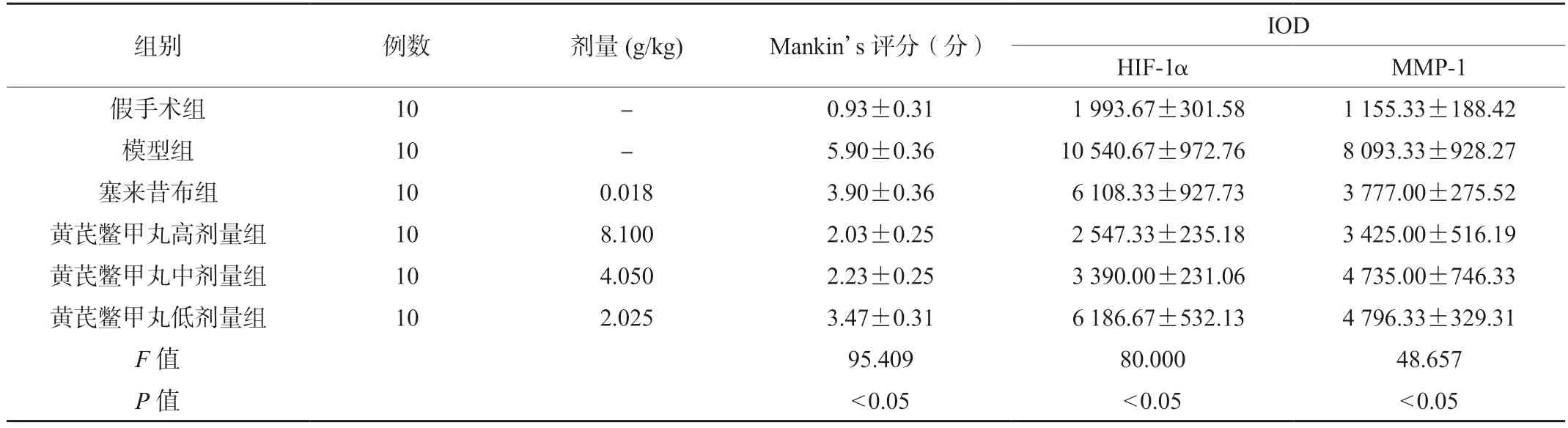
表3 6组大鼠膝关节软骨Mankin’s 评分及免疫组化IOD 值比较(±s)
注:Mankin’s:光镜软骨检测评价标准;IOD:光密度值;HIF-1α:低氧诱导因子-1α;MMP-1:基质金属蛋白酶-1。
组别 例数 剂量(g/kg) Mankin’s 评分(分) IOD HIF-1α MMP-1假手术组 10 - 0.93±0.31 1 993.67±301.58 1 155.33±188.42模型组 10 - 5.90±0.36 10 540.67±972.76 8 093.33±928.27塞来昔布组 10 0.018 3.90±0.36 6 108.33±927.73 3 777.00±275.52黄芪鳖甲丸高剂量组 10 8.100 2.03±0.25 2 547.33±235.18 3 425.00±516.19黄芪鳖甲丸中剂量组 10 4.050 2.23±0.25 3 390.00±231.06 4 735.00±746.33黄芪鳖甲丸低剂量组 10 2.025 3.47±0.31 6 186.67±532.13 4 796.33±329.31 F 值 95.409 80.000 48.657 P 值 <0.05 <0.05 <0.05
2.4 6组大鼠膝关节软骨蛋白表达水平比较模型组大鼠软骨中的HIF-1α、Glut-1、VEGF、MMP-1 蛋白表达量显著高于假手术组,差异有统计学意义(P<0.05)。黄芪鳖甲丸各剂量组和塞来昔布组大鼠软骨中HIF-1α及Glut-1 蛋白表达量显著低于模型组,黄芪鳖甲丸各剂量组大鼠软骨中VEGF 蛋白表达量显著低于模型组,差异有统计学意义(P<0.05),黄芪鳖甲丸高、低剂量组和塞来昔布组大鼠软骨中MMP-1 蛋白表达量显著低于模型组,差异有统计学意义(P<0.05),见图3、图4。

图3 6组大鼠软骨HIF-1α、Glut-1、VEGF 及MMP-1 蛋白表达量比较

图4 6组大鼠软骨HIF-1α、MMP-1、Glut-1 及VEGF 蛋白表达条带
3 讨论
成年人骨性关节炎的发病风险与年龄成正比,特别是在50岁以后,关节软骨细胞会出现明显的退变过程。Loeser等[6]证实软骨细胞的增殖及合成能力与年龄成反比,同时还会分泌亲炎症介质和基质降解酶,此外,细胞外基质也会随年龄的增长而逐步出现退变性损伤,进而加速OA 的病理发展。内源性雌激素减少亦可能导致OA 的发生[7],关节软骨中的雌激素受体对软骨细胞的生长、抑制软骨细胞炎症因子表达及缓解关节不稳定等起重要作用。本实验采用摘除卵巢并进行膝关节腔注射碘乙酸钠复制绝经期后KOA 模型,模型组大鼠血清E2水平显著降低,肿胀度明显,关节软骨受损严重,Mankin’s 评分显著升高,而黄芪鳖甲丸高、中剂量组大鼠血清E2水平高于模型组,关节肿胀及软骨损伤程度明显减轻,Mankin’s 评分低于模型组,说明该药滋阴补肾的功能对雌激素水平有一定调控作用,能减缓膝关节软骨的损伤。
目前已发现多种基因与骨性关节炎有关,其中包括编码细胞外基质蛋白的基因、一些转录因子和生长因子,如HIF-1α、白细胞介素-1(IL-1)、白细胞介素-6(IL-6)、TNF-α及VEGF 等。IL-1β 通过刺激软骨细胞合成基质金属蛋白酶,使软骨基质内溶解蛋白分子的酶增多,继而导致软骨细胞遭受破坏[8]。TNF-α则可作用于软骨细胞,阻止基质大分子的生成,刺激软骨降解酶的生成与分泌,增加软骨聚蛋白多糖的分解,继而破坏关节软骨[9]。IL-1β与TNF-α相互协同导致关节炎症反应的加重[10]。本实验中模型组大鼠膝关节洗液IL-1β 与TNF-α水平高于假手术组,而在给予黄芪鳖甲丸干预后,其膝关节洗液IL-1β与TNF-α含量显著降低,提示黄芪鳖甲丸高、中剂量可阻止关节软骨的进一步损伤。
HIF-1 是维持细胞内氧态平衡的一个重要因子,其通过控制血管生成来调动调节运氧能力,并通过调控糖酵解作用来增强机体的耐低氧能力,其生理活性主要由HIF-1α亚基的活性和表达决定。HIF-1α对保护软骨的完整性具有重要作用,其活性降低是导致软骨损伤的一个启动因素[11],因此了解软骨细胞凋亡过程中HIF-1α的变化对延缓OA 的发生具有极其重要的意义。处于低氧环境中的OA 软骨,软骨细胞主要的代谢途径是糖酵解。Glut-1 是HIF-1α的靶基因,是糖酵解过程中的重要物质。OA 中HIF-1α和Glut-1 的阳性程度随着软骨的破坏程度加重而增加[12]。有研究证实,HIF-1α对软骨细胞低氧状态下的糖酵解水平起到促进作用[13]。Glut-1 表达的增加表明KOA 时软骨细胞的糖酵解得到增强,这可能是HIF-1α转录活性增强的结果所起到的调节作用。VEGF是目前公认的一种促血管生成因子,是HIF-1α的一个靶基因,HIF-1α于低氧下促进VEGF 的表达,VEGF 及其受体在OA 中的表达随着软骨破坏程度加重而增高[14]。正常状态下,软骨细胞在细胞因子和生长因子的双重作用下,通过蛋白酶和蛋白酶抑制剂的含量调节来保持内环境的稳定,并通过分泌软骨相关细胞外基质来保持软骨结构和功能上的完整性。KOA 时,关节软骨细胞分泌过量的基质金属蛋白酶(MMPs),破坏了软骨基质合成和降解的平衡关系,导致软骨被过度降解,引起软骨退变[15]。在软骨基质合成与降解中,MMP-1 可以直接降解细胞外基质中的胶原纤维和明胶,使细胞外基质遭受破坏,同时还可介导其他 MMPs 蛋白破坏软骨的合成,使损伤细胞难以修复[16-17]。MMP-1 通过诱导IL-1β、TNF-α等炎症因子介导细胞外基质的过度降解,导致软骨细胞受损、坏死,软骨层变薄,因此导致关节缓冲不足,出现硬性摩擦导致疼痛、肿胀、活动受限等一系列临床症状,其与软骨破坏严重程度正相关[18]。本实验通过免疫组化及Western blot 方法观察KOA 大鼠膝关节软骨,发现软骨损伤程度与HIF-1α、Glut-1、VEGF、MMP-1 的表达量密切相关,经黄芪鳖甲丸治疗4 周后,HIF-1α和VEGF 表达显著降低,Glut-1 及MMP-1 表达亦有一定程度的下降,说明黄芪鳖甲丸可能是通过HIF-1α,调控VEGF 控制血管生成,通过Glut-1 调控糖酵解,及减缓基质蛋白酶对软骨降解[19-20]。但KOA 是一个复杂的病理变化过程,其中包含关节软骨和关节滑膜的病变。本实验目前仅针对KOA 关节软骨进行研究,其对关节滑膜的影响及作用机制需进一步探索研究。
综上所述,黄芪鳖甲丸可以改善KOA 大鼠模型膝骨性关节炎的肿胀度,降低Mankin’s 评分及关节腔内TNF-α、IL-1β 的水平,降低大鼠膝关节软骨组织中HIF-1α、Glut-1、VEGF、MMP-1 的表达量,其作用机制可能与抑制HIF-1α表达,调控Glut-1、VEGF,减缓亲炎症因子的表达相关。

