免疫检查点抑制剂相关内分泌不良反应的发生及处理:一项单中心真实世界研究
常俊佩,陈露,吴通,赵晓丽,段方方,刘丹娜,孔天东*
随着ICIs上市时间的延长以及使用患者的增多,发现其对各系统均可能产生影响,导致免疫相关性不良反应(irAEs)[8]。irAEs与化疗产生的毒副作用不同,其通常需要及时发现和处理,否则易导致严重不良事件。而内分泌系统irAEs则较为常见,主要包括甲状腺功能异常(甲状腺功能减退、甲状腺功能亢进、甲状腺炎等)、垂体功能障碍(中枢性甲状腺功能减退、中枢性肾上腺功能减退、低促性腺激素引起的性腺功能减退等);而原发性肾上腺功能减退、高钙血症、1型糖尿病和甲状旁腺功能减退等则比较罕见[9-10]。截至目前,CTLA-4单抗国内仅有一种产品上市,为百时美施贵宝公司的伊匹木单抗;PD-L1单抗已上市的有3种,阿特珠单抗、度伐利尤单抗和恩沃利单抗;而PD-1单抗国内上市较多,包括帕博利珠单抗和纳武利尤单抗、信迪利单抗等。虽然上市品种及厂家较多,但内分泌系统irAEs的发病机制相同,均为自身反应性T细胞、自身抗体和细胞因子等多种途径共同导致[11],而内分泌腺体血供丰富,能增加上述机制的敏感性,从而成为较常受累的靶点之一[12]。基于既往随机对照试验(RCT)研究的ICIs相关内分泌不良反应文献报道差异较大,为1%~20%[13-18],且有些不良反应不易确诊,但后果严重。为了观察真实世界中ICIs相关内分泌不良反应的发生情况及处理措施和流程,本研究回顾性分析了郑州市第三人民医院近3年进行ICIs治疗的患者免疫相关内分泌不良反应的发生及处理,为临床提供借鉴。
1 资料与方法
1.1 资料来源 回顾性分析2019年1月至2022年3月在郑州市第三人民医院使用ICIs治疗的204例实体瘤患者的临床资料。纳入标准:(1)均有明确的组织学或细胞学结果;(2)病例资料完整或可电话(微信)随访到;(3)免疫治疗前均无内分泌系统疾病(包括甲状腺功能亢进、甲状腺功能减退、糖尿病、垂体炎等);(4)基线血常规、肝肾功能、甲状腺功能、血糖水平均在参考范围内;(5)首次免疫治疗前无副瘤综合征;(6)至少行1周期免疫治疗。本研究已通过郑州市第三人民医院伦理委员会批准(2022-06-013-A05)。
1.2 体力状况评估 本研究采用美国东部肿瘤协作组(ECOG)制订的简化活动状态评分表(PS)评价患者体力状况[19]。将肿瘤患者活动状态分为0~5分,0分:活动能力完全正常,与起病前活动能力无任何差异;1分:能自由走动及从事轻体力活动,但不能从事较重的体力活动;2分:能自由走动及生活自理,但已丧失工作能力,日间不少于一半时间可以起床活动;3分:生活仅能部分自理,日间一半以上时间卧床或坐轮椅;4分:卧床不起,生活不能自理;5分:死亡。
1.3 ICIs相关内分泌不良反应的诊断及分级标准 ICIs相关内分泌不良反应包括甲状腺功能异常(甲状腺功能亢进、甲状腺功能减退、甲状腺炎等)、急性垂体炎(可导致垂体功能减退)、原发性肾上腺皮质功能减退、1型糖尿病、甲状旁腺功能亢进和甲状旁腺功能减退等[8-9]。不良反应诊断及分级标准依据美国国家癌症研究所(NCI)建立的不良事件通用评价标准(CTCAE 5.0)[20]和中国临床肿瘤学会(CSCO)发布的《CSCO免疫检查点抑制剂相关的毒性管理指南-2021》[21]。ICIs相关内分泌不良反应分级标准见表1。

表1 ICIs相关内分泌不良反应分级标准Table 1 Grading criteria for ICIs-related endocrinologic adverse reactions
1.3.1 甲状腺功能亢进 甲状腺功能亢进由体内甲状腺激素水平过高所致[22]。ICIs治疗期间,如果出现无法解释的心悸、出汗、进食增多,体质量减少等症状,血清游离甲状腺素(FT4)或总三碘甲状腺原氨酸(TT3)升高,合并促甲状腺激素(TSH)正常或降低可确诊;同时需要完善基线检查包括:TSH、FT4、TT3和总甲状腺素(TTs)[21-22]。
1.3.2 甲状腺功能减退 甲状腺功能减退因甲状腺产生甲状腺激素过少所致[22]。ICIs治疗期间,如果出现无法解释的乏力、体质量增加、毛发脱落、畏寒、便秘、抑郁等,合并TSH增高、FT4降低可确诊;同时需要完善基线检查包括:TSH、FT4、TT3和 TTs[21-22]。
1.3.3 垂体炎 ICIs治疗期间,如果患者出现无法解释的持续头痛、视觉障碍,需立即评估是否合并垂体炎[21]。颅脑磁共振成像(MRI),主要表现为垂体肿胀或增大、垂体柄增厚、鞍区上凸或腺体信号不均匀强化等;同时需要完善基线检查,包括促肾上腺皮质激素(ACTH)、TSH、FT4、游离三碘甲状腺原氨酸(FT3)、TTs、促黄体生成素(LH)、促卵泡激素(FSH)、睾酮、泌乳素等[22]。
1.3.4 1型糖尿病 1型糖尿病又称自身免疫性糖尿病,是由自身反应性T细胞介导的胰腺β细胞破坏引起的。表现为多尿、多饮、体质量减轻、恶心或呕吐的发生,血糖升高,部分人以酮症酸中毒就诊[22]。如果患者既往无糖尿病病史,在ICIs治疗期间,出现前述症状,且空腹血糖≥7.0 mmol/L或随机血糖≥11.1 mmol/L,则可确诊。
关停井复产或是长停井恢复,对老油田并非全新话题,但在新时期应该有全新的考虑。关停井的生产恢复,不应仅仅局限在一两口井的重新开井上,而应立足于某个区块、某个油藏的角度,以大修、压裂、补孔等油藏治理手段以及产能建设,带动长停井恢复,实现老油田局部富集区域的二次开发。也就是说,停井复产要作为一场大兵团协同作战的战役去打,才能发挥事半功倍的效果。
1.3.5 原发性肾上腺皮质功能减退 在ICIs治疗期间,如果患者出现无法解释的虚弱、疲乏、厌食、恶心、腹泻或肌肉关节痛等症状,则考虑原发性肾上腺皮质功能减退可能,进一步检查皮质醇、ACTH等可确诊。
1.3.6 甲状旁腺功能减退 甲状旁腺激素(PTH)分泌减少和/或效应不足所致的一组临床症候群,常表现为肌肉痉挛、手足搐搦的反复发作,Trousseau征和Chovstek征阳性[22]。在ICIs治疗期间,如果患者出现无法解释的上述症状,则考虑甲状旁腺功能减退可能,进一步检查若血清PTH下降、血钙下降、血磷上升则可确诊。
1.3.7 甲状旁腺功能亢进 甲状旁腺功能亢进指PTH产生过多,可导致高钙血症[22]。患者在ICIs治疗期间出现高钙血症相关临床表现,排除骨转移引起,同时血清PTH升高,血钙升高可确诊。
1.4 随访 随访截至2022-03-01,以门诊复查或住院的形式随访相关实验室检查指标及影像学检查,随访率100%。
1.5 统计学方法 本研究采用Excel表统计各项指标,非正态分布的计量资料以M(P25,P75)表示,计数资料以相对数表示。
2 结果
2.1 临床病理特征 204例实体瘤患者中男139例、女65例,中位年龄65.4(8.0,88.4)岁。PS评分以1分为主(46.1%);实体瘤种类以非小细胞肺癌为主(43.1%);治疗药物以信迪利单抗为主(47.1%),其次为卡瑞利珠单抗(42.6%)。治疗模式:单药使用20例(9.8%),免疫联合化疗67例(32.8%),免疫联合靶向药物117例(57.4%);靶向药物均为抗血管生成药物,包括安罗替尼、仑伐替尼、贝伐珠单抗、阿昔替尼等,见表2。
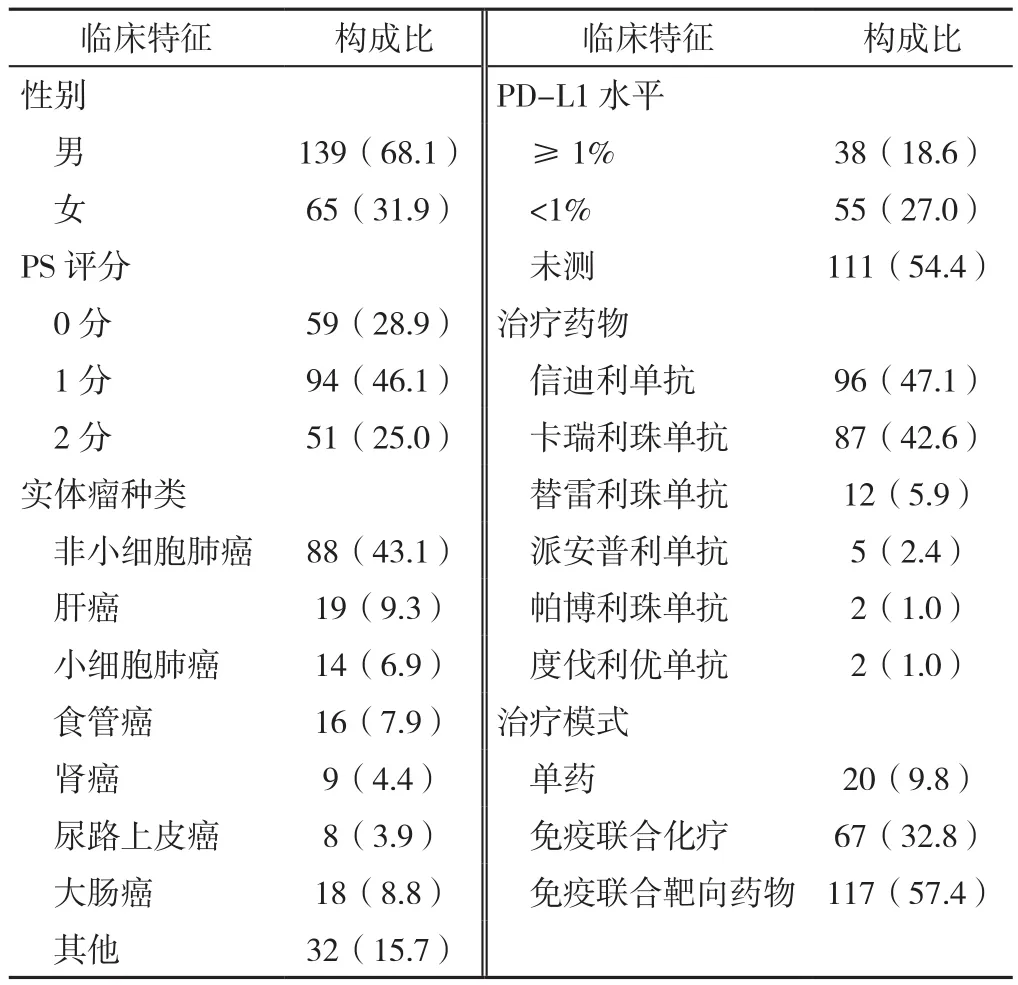
表2 204例患者临床病理特征〔n(%)〕Table 2 Clinicopathological features of 204 patients
2.2 ICIs相关内分泌不良反应发生情况 在204例患者用药过程中,共12例患者出现ICIs相关内分泌不良反应。其中9例(4.4%)为甲状腺功能减退(1例Ⅰ级,7例Ⅱ级,1例Ⅲ级),1例(0.5%)为甲状腺功能亢进(Ⅰ级),1例(0.5%)为1型糖尿病(Ⅳ级),1例(0.5%)为肾上腺皮质功能减退(Ⅲ级)。9例甲状腺功能减退均与PD-1单抗使用有关,包括联合化疗3例,联合靶向药物4例,单药使用2例,中位发生时间为自第1次免疫药物治疗后7(6,10)周;甲状腺功能亢进为PD-1单抗单药使用,发生时间为自免疫治疗后9周;1型糖尿病为PD-1单抗联合化疗,发生时间为自免疫治疗后6周;肾上腺皮质功能减退为PD-1单抗联合靶向药物,发生时间为自免疫治疗后7周,见表3。
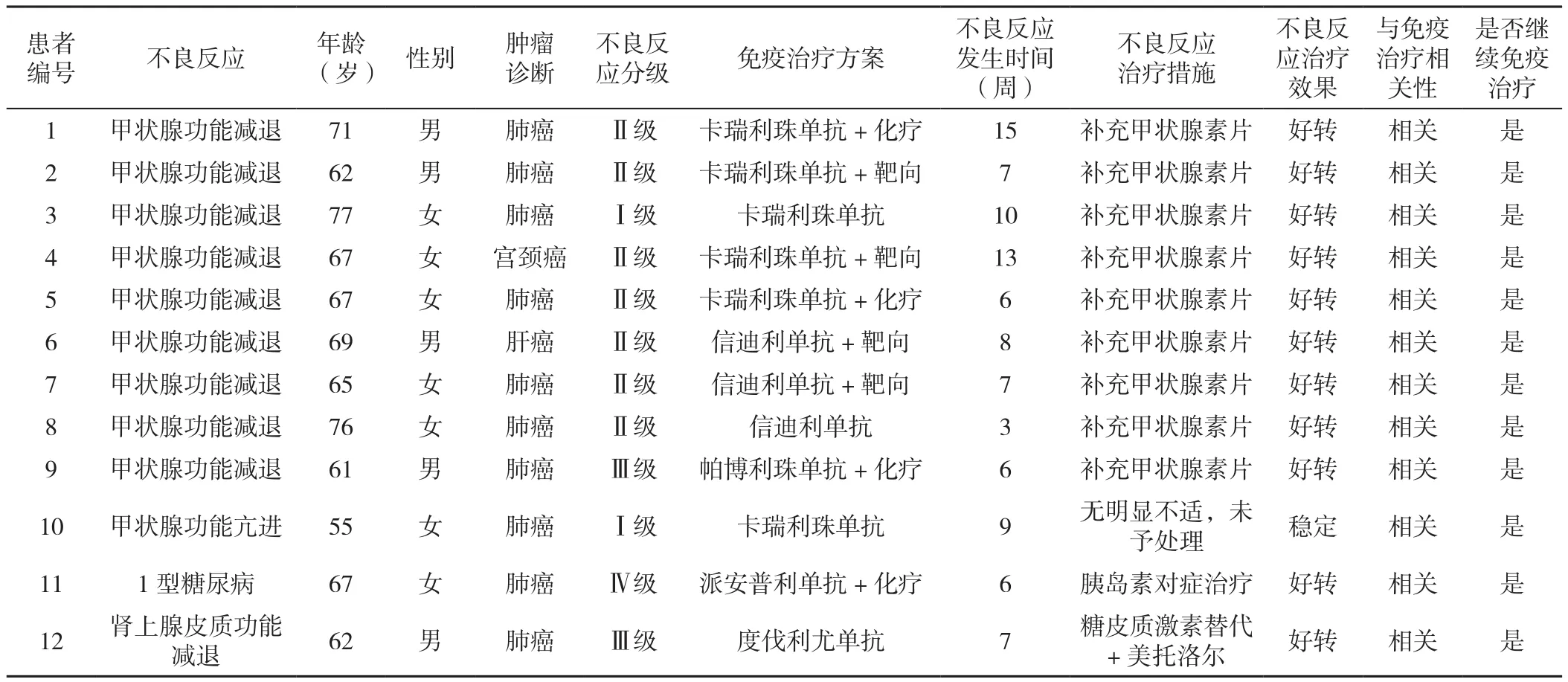
表3 12例ICIs相关内分泌不良反应患者临床资料Table 3 Clinical Information of the 12 cases of ICIs-related endocrinologic adverse reactions
2.3 ICIs相关内分泌不良反应症状及处理措施 9例甲状腺功能减退患者主要症状为:疲乏、食欲减退、恶心、活动减少等。所有甲状腺功能减退患者经过补充甲状腺激素替代治疗后,症状均有不同程度改善,FT3、FT4均恢复正常,不影响后续继续使用ICIs治疗。1例甲状腺功能亢进患者无明显症状,未给予抗甲状腺药物,继续后续ICIs治疗。
11号患者(ICIs相关1型糖尿病),女,67岁,于2021-09-22确诊左肺小细胞肺癌肝转移、多发椎体转移、脑转移广泛期,初始给予依托泊苷+顺铂(EP)+安罗替尼+派安普利单抗治疗,2周期后(第6周)达部分缓解(PR)。于首次免疫治疗第6周出现无诱因恶心、呕吐、乏力、间断意识不清等症状,经完善检查,空腹血糖 31.50 mmol/L(参考范围:3.89~6.11 mmol/L),尿酮体3+,糖化血红蛋白6.3%(4.0%~6.0%),抗胰岛素抗体(AIA)、胰岛细胞抗体(ICA)、谷氨酸脱羧酶抗体(GAD antibody)均阴性。患者既往无糖尿病病史,经多学科会诊,确诊为ICIs相关糖尿病酮症酸中毒(DKA)。在内分泌科医生指导下,规律使用胰岛素及对症处理后症状好转。目前降糖药为30R胰岛素,继续原方案及免疫治疗药物,病情稳定。
12号患者(ICIs相关肾上腺皮质功能减退),男,62岁,于2020年7月确诊左肺鳞癌晚期,驱动基因阴性,经放化疗后给予度伐利尤单抗维持治疗3周期后(第7周)出现疲乏明显、倦怠、无力、心律失常,进一步检查甲状腺功能正常,晨起皮质醇为0.866 μg/dl、下午皮质醇为 0.627 μg/dl(参考范围:7~9 μg/dl),经多学科会诊,诊断为继发性肾上腺皮质功能减退症,排除其他因素,与ICIs相关。给予泼尼松+美托洛尔纠正后缓解,后续继续使用ICIs。
2.4 ICIs相关内分泌不良反应处理流程 ICIs治疗期间,如果出现了相应内分泌系统或器官症状表现,需要引起重视,进一步评估是否是ICIs相关性不良反应,因其初始症状并无特异性,尤其是垂体炎、肾上腺功能减退等很难早期确诊,必要时要及时进行多学科会诊,并由内分泌科医生参与。其详细的评估及处理流程见图1。
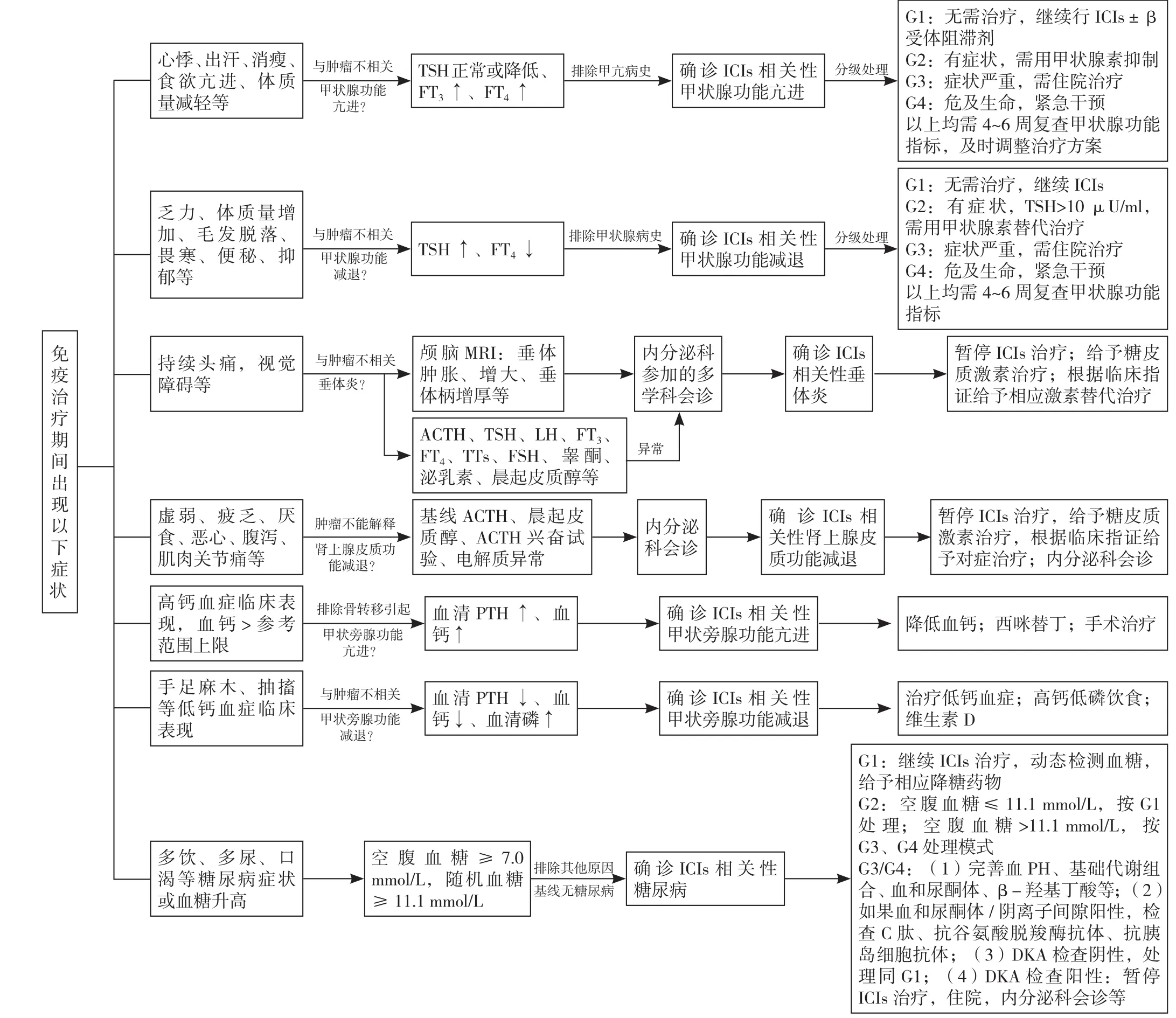
图1 ICIs相关内分泌不良反应处理流程图Figure 1 Management flow chart of ICIs-related endocrinologic adverse reactions
3 讨论
近年来,ICIs已成为治疗肿瘤的重要手段。免疫检查点是表达于T淋巴细胞表面的小分子,在维持免疫稳态和自我耐受以及调节免疫反应的持续时间和幅度方面发挥着重要作用[23]。ICIs是针对免疫检查点开发的抑制性药物,能阻断免疫检查点,激活T细胞功能来杀灭肿瘤细胞[24]。然而,ICIs由于其作用机制,在控制肿瘤生长的同时,还能改变免疫耐受,增加自身抗原介导的不良反应发生[25]。这些不良反应被称为irAEs。除皮肤和消化系统外,内分泌系统也是容易受影响的系统之一。内分泌系统irAEs包括垂体炎、甲状腺功能障碍、甲状旁腺功能障碍、1型糖尿病和原发性肾上腺皮质功能减退等[26]。如果不能及时发现和治疗,内分泌系统irAEs可能会危及生命。
一项大型荟萃分析显示ICIs相关甲状腺功能减退的预测发生率为6.6%,而甲状腺功能亢进为2.9%,甲状腺功能减退发生率明显高于甲状腺功能亢进[26]。既往研究显示双免(PD-1+伊匹木单抗)联合使用导致的甲状腺功能紊乱发生率(13.2%)明显高于单药方案[15,26],而单药PD-1单抗、PD-L1单抗以及伊匹木单抗之间甲状腺功能紊乱发生率相似,为3%~9%,无明显差异[27]。本研究回顾分析了ICIs相关内分泌不良反应的发生情况,结果显示最常见的不良反应为甲状腺功能异常,共10例,总发生率为4.9%。其中甲状腺功能减退占比最高,为9例,总发生率为4.4%;甲状腺功能亢进仅1例(0.5%),与上述研究相似。本研究结果显示,ICIs相关甲状腺功能紊乱包括联合化疗3例,联合靶向药物4例,单药使用3例,由于发生率太低,相互之间并未观察到明显差异。本研究还观察到甲状腺功能异常的患者多为Ⅰ~Ⅱ级,在充分补充甲状腺素或调整甲状腺激素水平后,不影响后续ICIs治疗。
本研究还发现个别患者出现少见的ICIs相关内分泌不良反应,包括1型糖尿病、肾上腺皮质功能减退各1例(0.5%)。ICIs相关糖尿病很少见,缺乏大规模队列研究,多为个案报道,目前回顾性分析显示ICIs相关糖尿病发生率为0.9%~1.9%[28-29]。几乎所有的ICIs相关糖尿病与PD-1单抗相关[30],CTLA-4引起仅有2例报道[31],其中位发生时间为药物治疗后13~504 d,以前6个月最易发生[32]。本研究1例患者PD-1单抗治疗后第6周(2周期后)开始出现严重的DKA后急诊入院,与既往文献报道76%的ICIs相关糖尿病会出现DKA或以DKA为主要表现的结论一致[28,33]。ICIs相关糖尿病多为永久性,不能通过使用糖皮质激素逆转破坏的胰岛细胞[34],因此不建议使用糖皮质激素[35],大多数患者需要终身使用胰岛素替代治疗。至于积极治疗后好转的情况下,是否能重启免疫治疗,目前尚有争议[36]。本研究该例患者为肿瘤晚期,经多学科评估后,认为在胰岛素支持下再发生DKA风险不大,免疫治疗仍能受益,后重启免疫治疗至今,未再发生严重irAEs,目前肿瘤稳定。
ICIs相关肾上腺皮质功能减退是罕见的irAEs,目前报道的发生率为0.8%~2.0%[37],是药物诱发自身免疫性肾上腺炎导致。由于发病率很低及随访时间短,尚无明确高危因素及流行病学特征。ICIs单药治疗可能发生在几个月后,联合治疗可能提前出现[38]。本例患者为使用PD-1单抗联合靶向药物治疗后7周出现Ⅲ级肾上腺皮质功能减退,经糖皮质激素替代治疗后皮质醇正常,继续给予ICIs治疗。
综上,本研究回顾了ICIs相关内分泌不良反应的发生情况及治疗过程,并结合文献总结了各不良反应的处理流程,为临床提供参考。ICIs相关内分泌不良反应发生率很低,难以进行大规模的队列研究,尤其是糖尿病、肾上腺皮质功能减退等文献来源多为个案报道。但随着ICIs类药物在肿瘤治疗中的大量广泛使用,ICIs相关内分泌不良反应需要肿瘤科医生、内分泌科医生以及临床药师的广泛参与,而随着临床和研究数据的不断累积,对ICIs相关内分泌不良反应的处理和管理流程也会不断优化。
作者贡献:常俊佩负责文章撰写;陈露、赵晓丽、段方方负责收集临床资料;吴通负责统计学指导;刘丹娜负责药学指导;孔天东负责肿瘤相关问题指导及研究协调,并对论文负责。
本文无利益冲突。

