CBL互作蛋白激酶GmCIPK10增强大豆耐盐性
李 慧 路依萍 汪小凯 王璐瑶 邱婷婷 张雪婷 黄海燕 崔晓玉,*
CBL互作蛋白激酶GmCIPK10增强大豆耐盐性
李 慧1,2路依萍1汪小凯1王璐瑶1邱婷婷1张雪婷1黄海燕1崔晓玉1,*
1临沂大学农林科学学院, 中国山东临沂 276000;2菲律宾克里斯汀大学国际学院, 菲律宾 1004
盐胁迫严重威胁大豆产量和品质。类钙调磷酸酶B亚基互作蛋白激酶(CIPKs)在植物应对环境胁迫过程中发挥重要作用。但是, 目前对大豆CIPKs的生物学功能知之甚少。本研究从大豆基因组克隆到。生物信息学分析结果表明,属于不含内含子型CIPKs, 包含一个丝氨酸(Ser)/苏氨酸(Thr)蛋白激酶结构域和NAF/FISL基序。表达模式分析结果表明, 在盐(NaCl)、甲基紫精(MV)和过氧化氢(H2O2)处理下,的转录水平升高。在拟南芥和大豆毛状根中过表达能够提高转基因植株的抗盐性。进一步的生理指标测定发现, 在盐胁迫下, 过表达能够降低转基因植株中丙二醛(MDA)和H2O2积累, 增强抗氧化酶活性以及降低钠离子(Na+)/钾离子(K+)比值。此外, qRT-PCR分析发现促进抗氧化和耐盐相关基因表达响应盐胁迫。酵母双杂交、Pull-down和双分子荧光互补试验结果证明GmCIPK10与钙离子(Ca2+)感应器GmCBL4相互作用。这些结果为解析CBL-CIPK信号通路在大豆盐胁迫应答的作用提供了参考。
; 耐盐性; ROS清除; Na+/K+稳态; 大豆
陆生植物是固着生物, 经常遇到各种逆境, 包括盐、干旱和极端温度等。在进化过程中, 植物进化出复杂的策略以适应不利的环境条件[1]。钙离子(calcium, Ca2+)是植物体内一种普遍存在的次级信使,参与调节植物的生长发育、营养吸收和胁迫响应等诸多生理过程[2]。不良环境刺激触发胞质Ca2+浓度的时空变化[3]。Ca2+依赖蛋白激酶、类钙调磷酸酶B亚基(calcineurin B subunits, CBLs)和钙调素等Ca2+传感器感知Ca2+浓度变化, 随后与其下游靶蛋白相互作用, 引发植物一系列生理代谢变化, 应对外界环境的改变[1-4]。
CBLs本身没有激酶活性, 通过特异性的与其互作蛋白激酶(CBL-interacting protein kinases, CIPKs)结合, 形成一套植物特有的Ca2+信号转导系统[2-3]。CIPKs编码丝氨酸(serine, Ser)/苏氨酸(threonine, Thr)蛋白激酶, 与蔗糖非酵解型蛋白激酶3亚族成员结构和功能高度相似[5]。CIPKs的激酶催化结构域位于N端, 具有一个激活环和一个ATP结合位点。毗邻连接域, 在CIPKs的C端鉴定到一个NAF/FISL基序, 该基序与CBLs结合时不可或缺[3-4]。CBL-CIPK信号通路在筛选拟南芥盐敏感突变体过程中初次被发现[6]。AtCBL4与AtCIPK24互作, 激活钠离子(sodium, Na+)/氢离子(hydrogen, H+)转运蛋白AtNHX7, 维持拟南芥根部组织的Na+稳态, 而AtCBL10-AtCIPK24复合物主要提高茎部组织的耐盐性[6-8]。AtCBL2和AtCBL3与AtCIPK21互作, 增强拟南芥对盐胁迫和渗透胁迫的耐受性[9]。在低钾(K+, potassium)胁迫下, AtCBL1/9-AtCIPK23复合物激活K+通道蛋白AKT1, 促进植物吸收K+[10]。AtCIPK1分别与AtCBL1和AtCBL9结合, 通过ABA依赖途径和ABA非依赖途径响应干旱胁迫[11]。已被证明正向调控拟南芥的耐盐性和氮元素的吸收[12-13]。
随后的基因组学和生物信息学研究陆续在水稻()[14]、辣椒()[15]、烟草()[16]、油菜()[17]和小麦()[18]等植物基因组中鉴定到CIPKs的同源基因。Ma等[19]研究发现, CaCBL2与CaCIPK3互作, 调节茉莉酸信号传递和抗氧化系统在辣椒应答干旱胁迫过程中发挥重要作用。在烟草应对干旱和盐胁迫中发挥关键作用, 能够调控脯氨酸合成响应干旱和盐胁迫[20]。参与调节野生大麦对干旱、盐和ABA胁迫的响应,过表达可以抑制拟南芥的盐敏感表型[21]。低温胁迫促使的转录水平增加, 水稻植株过表达表现出耐寒表型[14]。研究表明通过调节气孔运动和增强抗氧化酶活性参与小麦干旱胁迫应答[22]。GmCBL1与GmCIPK2互作, 通过调节气孔开闭和渗透物质合成, 降低干旱对大豆植株的损伤[23]。BnCBL1-BnCIPK6复合体在调节油菜高盐、低磷和ABA应答反应中发挥重要作用[17]。
大豆是一种重要的经济作物, 也是食用油、优质蛋白质和工业产品的重要来源[24]。盐胁迫严重限制了全球大豆的产量提高和品质改善[25]。众多研究表明, CIPKs在增强植物环境胁迫的耐受性方面具有重要作用[1-4], 但其在大豆适应盐胁迫中的生物学作用尚不清楚。本研究在大豆基因组鉴定到盐胁迫诱导基因。转基因植株抗盐鉴定和生理指标测结果表明,过表达增强了拟南芥和大豆毛状根的耐盐性, 并且在盐处理条件下具有清除活性氧(reactive oxygen species, ROS)和降低Na+/K+比值的积极作用。综上所述,具有在大豆对盐胁迫的响应中具有调节ROS稳态和Na+/K+平衡的作用。
1 材料与方法
1.1 植物材料和生长条件
本研究以大豆品种Williams 82为研究材料。将10粒大小一致的大豆种子均匀播种在湿润的蛭石中, 并放置于光照16 h/黑暗8 h、25℃、相对湿度70%的人工智能培养箱中培养。14 d后, 选取相同大小的大豆植株分别转入含有200 mmol L–1NaCl、20 µmol L–1甲基紫精(methyl viologen, MV)和10 mmol L–1过氧化氢(hydrogen peroxide, H2O2)的1/2 Hoagland溶液中进行胁迫处理。在0、1、3、6、12和24 h分别采集大豆叶片, 用于提取大豆总RNA。
本研究使用的拟南芥材料为Col-0。种皮表面杀菌后的拟南芥种子播种在1/2 MS培养基上, 4℃黑暗春化3 d。然后, 将这些种子放置于在光照16 h/黑暗8 h、23℃、相对湿度70%的人工智能培养箱内培养。
1.2 实时定量
利用植物总RNA提取试剂盒(Zomanbio)提取采集的植物材料总RNA。然后, 以这些RNA为模板合成后续实时定量(quantative real time-PCR, qRT-PCR)分析所需的cDNA。qRT-PCR反应按照SYBR Premix ExRT-PCR试剂盒(TaKaRa)的使用方法, 在7500 Real-time PCR System (Applied Biosystems)上进行, 引物见表1。qRT-PCR试验反应程序为94℃预变性3 min; 94℃变性5 s, 58℃退火15 s, 72℃延伸10 s, 共计42个循环。以大豆(Glyma. 08G014200)作为内参, 参照2–ΔΔCt法计算目的基因的表达水平。

表1 本研究所使用的引物
1.3 转基因材料构建
转基因拟南芥采用农杆菌浸染拟南芥花序的方法。参照Wang等[24]报道的方法, 利用农杆菌介导的大豆发状根构建系统构建转基因大豆株系, 将基因编码区序列插入pCAMBIA3301大豆遗传转化载体, 转入根癌农杆菌, 用于侵染大豆下胚轴。待下胚轴生出发状根, 去除原生根, 采集发状根检测基因表达量, 完成- overexpression(OE)过表达大豆植株制作。
1.4 耐盐鉴定
T3代-OE拟南芥的种子用于研究响应盐胁迫的功能。消毒杀菌后的拟南芥种子播种在1/2 MS培养基上。正常生长7 d后, 将大小一致的幼苗转移到含有75 mmol L–1NaCl的1/2 MS培养基继续培养。10 d后测定主根长、H2O2含量以及丙二醛(malondialdehyde, MDA)含量。用游标卡尺测定主根长。使用MDA含量检测试剂盒(BC0025, Solarbio)测定MDA含量, 参照说明书进行试验。使用H2O2含量检测试剂盒(BC3595, Solarbio)测定H2O2含量。在大豆植株耐盐鉴定试验中, 大豆种子播种在装有营养土壤和蛭石(1∶1)的花盆中, 每盆10棵, 设置3个重复。在大豆正常生长2周后, 将200 mmol L–1NaCl溶液浇灌到托盘底部, 对大豆进行盐胁迫处理。处理10 d后, 过表达和对照植株的萎蔫程度出现明显差异, 统计存活率。MDA含量、H2O2含量、抗氧化酶活性、Na+含量和K+含量测定使用盐处理7 d后的大豆发状根。使用CAT活性检测试剂盒(BC0205, Solarbio)测定CAT活性。使用电感耦合等离子体发射光谱仪法[32]测定Na+含量和K+含量。
1.5 酵母双杂交
利用Matchmaker酵母双杂交系统, 按照醋酸锂介导的酵母转化方法将pGADT7 (AD)、pGBKT7 (BD)、-AD和-BD质粒分别组合, 然后转入酵母感受态细胞中进行培养。将转化后的酵母菌株涂抹先后涂抹在二缺(-Leu/-Trp)培养基和四缺培养基(-Ade/-His/-Leu/-Trp), 在30℃生化培养箱培养, 最后用X-α-gal检测报告基因活性。
1.6 Pull-down试验
将pCold-和pGEX-4T-1-分别转化到大肠杆菌感受态中, 诱导表达GmCIPK10-His和GmCBL4-GST融合蛋白。然后使用Ni-NTA树脂纯化GmCIPK10-His融合蛋白, 然后使用200 mmol L-1的咪唑缓冲液进行洗脱, 获得可溶性的GmCIPK10-His融合蛋白。GST树脂纯化GmCBL4-GST融合蛋白和GST对照蛋白, 分别与可溶性的GmCIPK10-His融合蛋白进行结合试验。最后通过聚丙烯酰胺凝胶电泳、转膜以及免疫印迹试验检测GmCIPK10是否能结合GmCBL4。
1.7 双分子荧光互补试验
采用PEG介导的原生质体转化方法, 分别将-pSPYCE(cYFP) + pSPYNE (nYFP)、cYFP +-nYFP和-cYFP +- nYFP转化到同一个原生质体细胞中共表达, 进行双分子荧光互补(bimolecular fluorescence complementation,BiFC)试验。转化后原生质体在23℃的黑暗环境中培养12 h, 然后在激光共聚焦显微镜(LSM700)下观察黄色荧光蛋白(yellow fluorescent protein, YFP)信号。
1.8 统计分析
每个试验设3个重复, 使用SPSS数据分析软件,采用单因素方差分析(ANOVA)分析不同基因型植株间的差异。
2 结果与分析
2.1 GmCIPK10基因序列和蛋白结构
CIPKs在植物逆境适应过程中起着至关重要的作用。迄今为止, 已经从大豆基因组中鉴定到52个基因, 但它们在盐胁迫应答中的功能仍在很大程度上未知。在大豆的这些基因中, Glyma.
18G055000编码一个Ser/Thr蛋白激酶, 在其C端含有一个NAF/FISL基序, 属于CIPK家族蛋白激酶(图1-A)。BLASTP和多序列比对分析表明, Glyma. 18G055000编码的氨基酸序列与AtCIPK10、VvCIPK10和OsCIPK10有很高的序列相似性, 因此将该基因命名为(图1-A)。此外, 系统发育树分析GmCIPK10和26个AtCIPKs的结果表明, GmCIPK10和AtCIPK10亲缘关系最近, 属于不含内含子型CIPK蛋白激酶(图1-B)。
2.2 GmCIPK10基因响应盐和氧化胁迫的表达模式
鉴于CIPKs在植物逆境应答中的重要作用, 本研究采用qRT-PCR的方法测定在盐胁迫和氧化胁迫处理下的表达特征进行检测。当大豆植株经受盐胁迫时,基因转录本增加, 在3 h积累量达到最高值, 随后逐渐恢复至正常水平(图2-A)。此外,对氧化胁迫有响应。MV和H2O2均能提高的转录水平, 分别在3 h和6 h达到最大值(图2-B, C)。
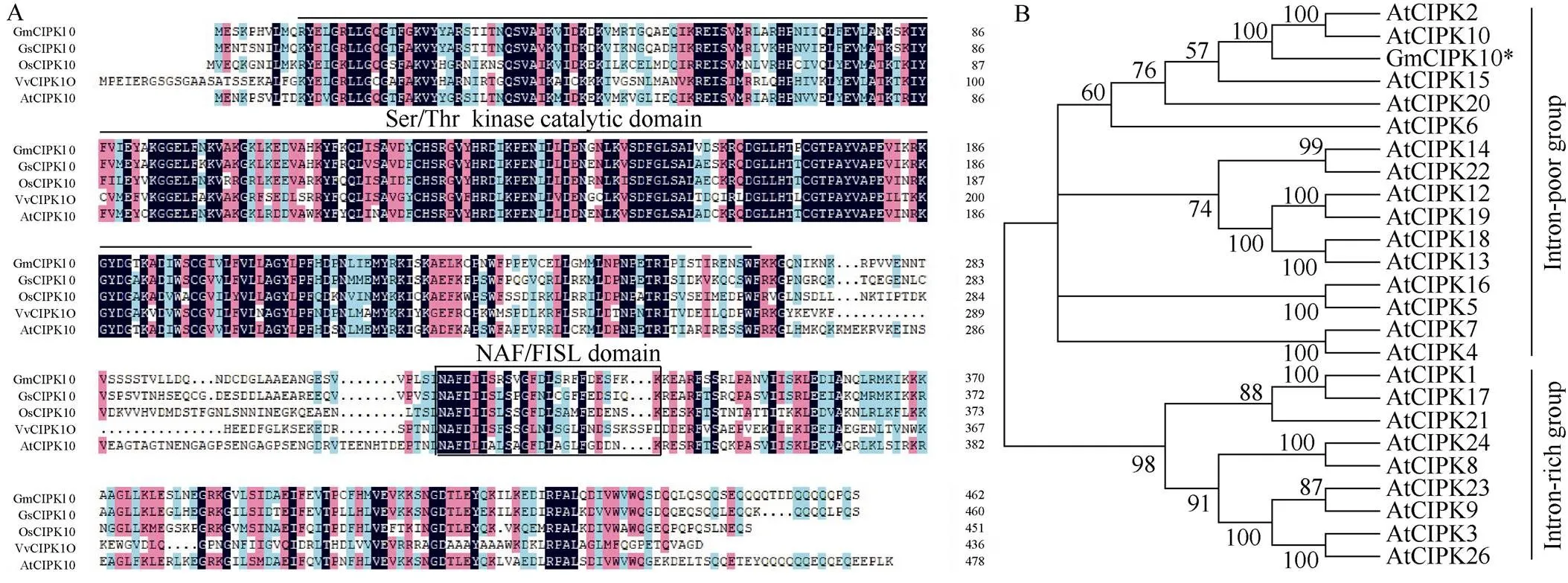
图1 GmCIPK10的蛋白结构和进化关系分析
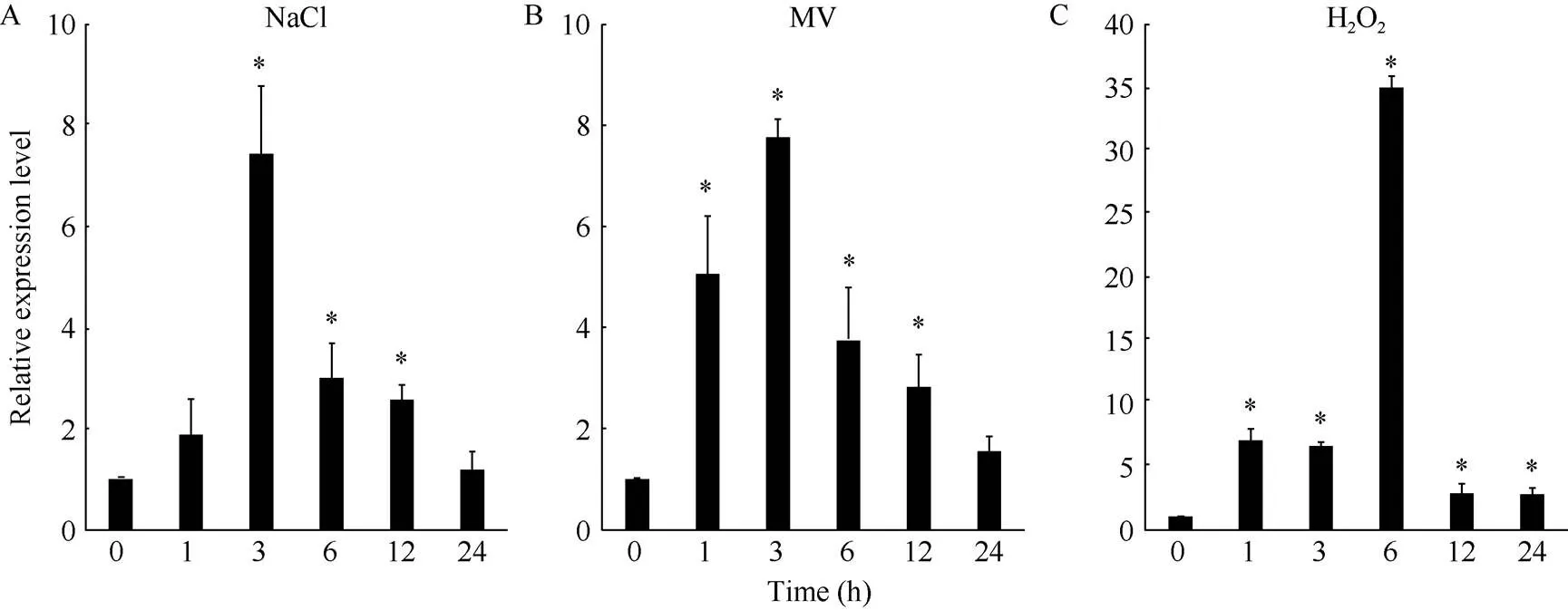
图2 GmCIPK10响应盐胁迫和氧化胁迫的表达模式
以为内参基因, 每组3棵, 3次生物学重复。MV: 甲基紫精。*:< 0.05。
is used as an internal control; each group contains three seedlings for three biological replicates. MV: methyl viologen. *:< 0.05.
2.3 GmCIPK10过表达提高转基因拟南芥的耐盐性
为探究在盐胁迫应答反应中的作用, 采用农杆菌浸染花序的方法构建了过表达的转基因拟南芥(OE2、OE3和OE7), 并且通过RT-PCR的方法对阳性拟南芥植株进行鉴定(图3-C)。在正常生长条件下,-OE和野生型(wild-type, WT)拟南芥植株生长状况类似。然而, 在盐处理条件下,-OE和WT的植株表型和生理性状存在显著差异。与WT相比,- OE拟南芥植株耐盐性更好, 主根长明显增加(图3-A, B)。盐胁迫促进丙二醛(malondialdenhyde, MDA)和H2O2的过量积累, 对细胞膜造成氧化胁迫[18-19]。在本研究中, 盐处理-OE植株的MDA和H2O2积累量显著低于对照植株(图3-D, E)。
2.4 GmCIPK10过表达促进转基因大豆发状根的耐盐性
为进一步验证在增强大豆耐盐性方面的作用, 通过农杆菌介导的大豆发状根转化系统, 本研究构建了-OE大豆发状根。qRT-PCR检测结果显示, 与载体对照(vector control, VC)相比,-OE大豆发状根中的转录水平显著提高(图4-C)。在正常情况下,-OE和VC幼苗在表型和生理代谢上均无差异。经过盐胁迫处理后,-OE幼苗在盐胁迫下表现明显优于对照植株, 存活率显著提高(图4-A, B)。此外, 盐胁迫增加了MDA和H2O2在大豆发状根的积累, 但盐处理的-OE发状根中累积的MDA和H2O2水平低于VC发状根(图4-D, E)。抗氧化酶担负着清除ROS, 维持细胞氧化还原平衡的关键作用[19]。定量检测抗氧化酶活性发现, 与VC相比, 盐胁迫处理的-OE发根中的过氧化氢酶(catalase, CAT)活性和过氧化物酶活性(peroxidase, POD)活性显著增强(图4-F, G)。此外, Na+/K+比值与植物的耐盐性呈正负关。在盐胁迫处理条件下,- OE发状根中的K+含量高于VC发状根(图4-H)。盐胁迫处理的-OE发状根中的Na+含量低于VC发状根(图4-I)。因此, 在盐胁迫处理条件下,-OE发状根的Na+/K+比率低于VC发状根(图4-J)。
2.5 GmCIPK10激活盐胁迫和氧化胁迫相关基因的表达响应盐胁迫
为阐明介导的盐胁迫适应机制, 采用qRT-PCR方法测定了正常和盐胁迫处理后毛-OE和VC大豆发状根中胁迫应答基因的转录水平。在正常环境条件下,-OE和VC发状根中的胁迫应答基因表达水平没有显著差异。然而, 盐处理显著促进盐胁迫和氧化胁迫相关基因的表达。在盐胁迫处理条件下,-OE发状根中的氧化胁迫应答基因(和)和盐胁迫响应基因(、、、、和)的转录水平均高于对照发状根(图5)。

图3 过表达GmCIPK10提高转基因拟南芥的耐盐性
A和B:-OE和WT拟南芥植株经盐胁迫(75 mmol L-1NaCl)处理10 d后的表型和主根长; C:基因表达量; D: MDA含量; E: H2O2含量; 每组4棵, 3次生物学重复; WT: 野生型; OE: 过表达。*:< 0.05。
A, B: the phenotypes and primary root length of-OE and WTplants with salt treatment (75 mmol L-1NaCl) for 10 days; C: the expression level ofgenes; D: MDA content; E: H2O2content; Each group contained four seedlings for three biological replicates; WT: wild type; OE: overexpression. *:< 0.05.

图4 过表达GmCIPK10提高转基因大豆发状根的耐盐性
A和B:-OE和VC大豆植株的表型经盐胁迫(200 mmol L–1NaCl)处理10 d后的表型和成活率; C:基因表达量;-OE和VC大豆植株经盐胁迫处理7 d后的; D: MDA含量; E: H2O2含量; F: CAT活性; G: POD活性; H: K+离子含量; I: Na+离子含量; J: Na+/K+比值; 每组10 棵, 3次生物学重复; VC: 载体对照; OE: 过表达; FW: 鲜重; DW: 干重。*:< 0.05。
A, B: the phenotype and survival rate of-OE and VC soybean plants with salt treatment (200 mmol L–1NaCl) for 10 days; C: the expression level ofgenes; D: MDA content; E: H2O2content; F: CAT activity; G: POD activity; H: K+content; I: Na+content; J: Na+/K+ratio of-OE and VC soybean plants with salt treatment for 7 days; VC: vector control; OE: overexpression; FW: fresh weight; DW: drought weight. *:< 0.05.
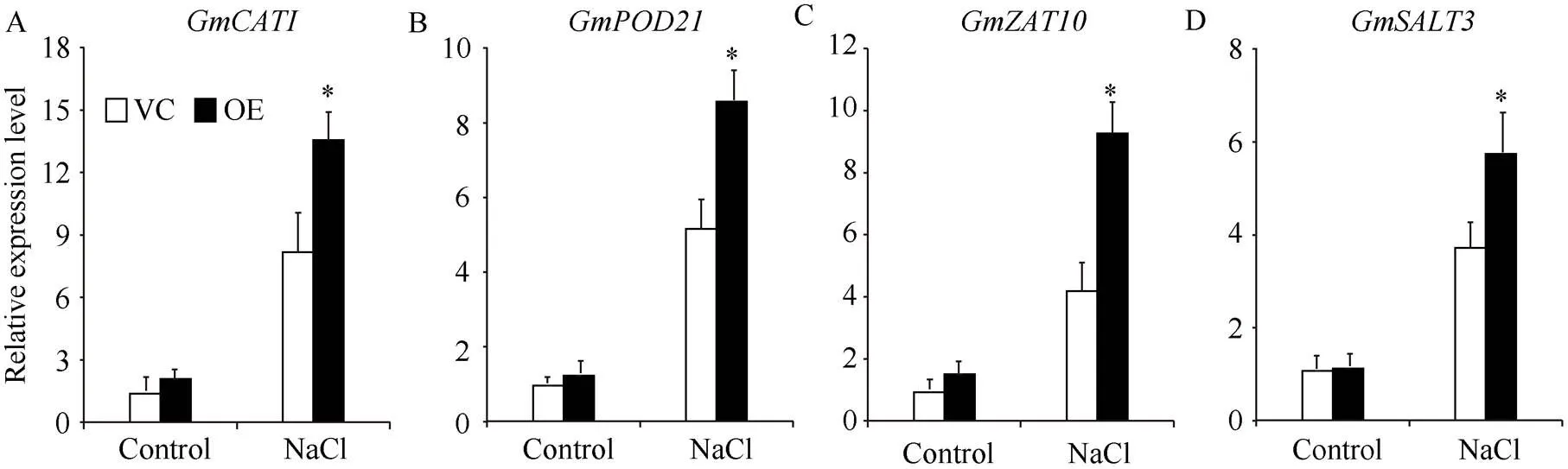
(图5)
每组3棵, 3次生物学重复。VC: 载体对照; OE: 过表达。*:< 0.05。
Each group contained four seedlings for three biological replicates. VC: vector control; OE: overexpression. *:< 0.05.
2.6 GmCBL4是GmCIPK10的互作蛋白
CBLs通常与特定的CIPKs结合形成复合体, 影响植物对逆境环境的耐受性。本研究使用酵母双杂交系统, 鉴定与GmCIPK10相互作用的候选CBL蛋白。当对照载体AD和BD、-AD和BD、AD和-BD在酵母菌株中共表达时, 报告基因未被激活。而当-AD和-BD载体共表达, 能够激活报告基因(图6-A)。因此, 初步断定GmCBL4是GmCIPK10候选互作蛋白。
接下来, 本研究采用Pull-down系统确定GmCBL4和GmCIPK10之间的互作关系, 在大肠杆菌中诱导表达GmCBL4-GST和GmCIPK10- His融合蛋白, 分别用Ni-NTA树脂和GST树脂进行纯化。在结合反应实验中, 分别使用吸附在树脂上的GmCBL4-GST和对照GST蛋白去吸附可溶性的CIPK10-His蛋白。然后收集和清洗反应后的蛋白复合物进行聚丙烯酰胺凝胶电泳和转膜, 并使用His抗体进行免疫印迹实验。结果表明, GmCBL4-GST能够结合GmCIPK10-His融合蛋白, 而GST对照蛋白则不能(图6-B)。此结果证明GmCIPK10能够特异性结合GmCBL4。
为进一步确定GmCBL4和GmCIPK10之间的互作关系, 本研究进行了BiFC试验。采用PEG介导的转化方法, 分别将-cYFP + nYFP、cYFP +-nYFP和-cYFP +- nYFP质粒转化到同一个原生质体细胞中共表达。结果表明, 当-cYFP +-nYFP在原生质体中共表达时, 能够在原生质体中观察到YFP信号。然而, 共表达-cYFP + nYFP或者cYFP +-nYFP的原生质体无法观察到YFP信号(图6-C)。此结果进一步证实明GmCIPK10能够与GmCBL4特异性结合。
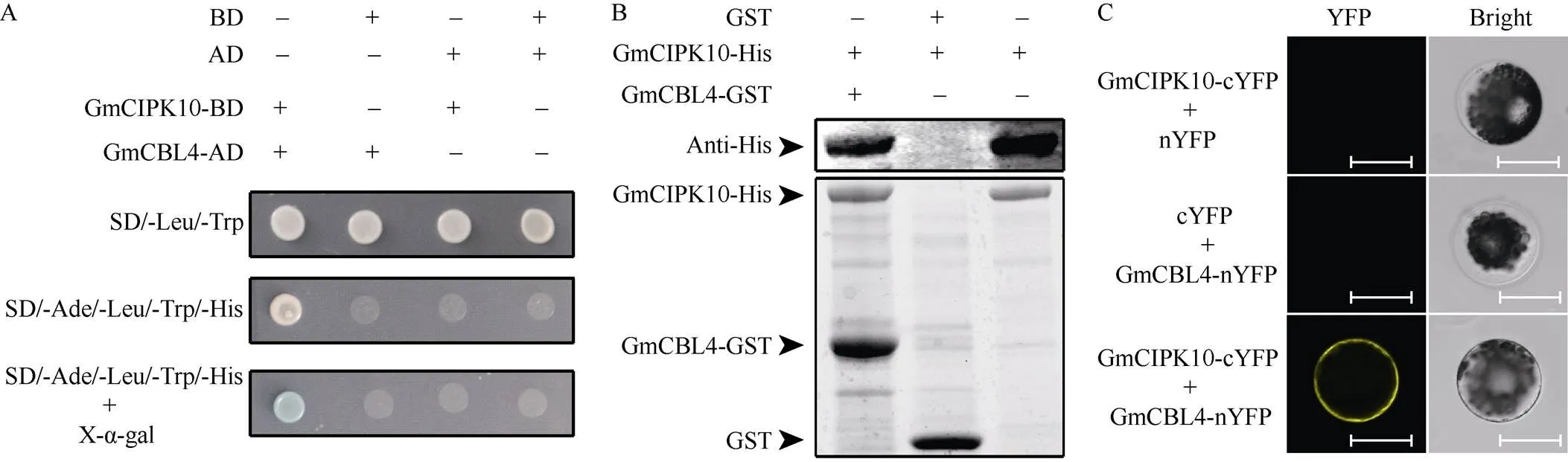
图6 GmCBL4与GmCIPK10互作
A: 酵母双杂交检测GmCBL4和GmCIPK10互作; B: Pull-down检测GmCBL4和GmCIPK10互作; C: BiFC检测GmCBL4和GmCIPK10互作。BiFC: 双分子荧光互补; YFP: 黄色荧光蛋白。标尺为12 µm。
A: yeast two-hybrid analysis of GmCBL4 interaction with GmCIPK10; B:pull-down assays of the interaction of GmCBL4 with GmCIPK10; C:BiFC assays of the interaction of GmCBL4 with GmCIPK10. BiFC: bimolecular fluorescence complementation; YFP: yellow fluorescent protein. Bar: 12 µm.
3 讨论
众多研究表明CIPKs在植物适应盐胁迫的过程中发挥了关键作用[26-27]。近年来, 大豆全基因组已经完成测序, 但是关于大豆基因在盐胁迫反应中的作用仍不清楚[28]。在试验中, 分离到了盐诱导基因(图2-A), 其编码蛋白包含一个NAF/FISL结构域, 属于不含内含子型CIPK蛋白激酶(图1)。转基因植株耐盐鉴定试验进一步证实, 在盐胁迫处理下,过表达能够促进拟南芥主根伸长和提高发状根大豆植株的存活率(图3和图4)。因此,是缓解大豆盐胁迫的正向调控因子。
盐胁迫等逆境因素会激发ROS过度积累, 导致细胞氧化损伤, 甚造成细胞死亡[29-30]。H2O2是一种公认的中等活性的ROS, 可诱发氧化应激反应[27]。有研究表明CIPKs参与调节ROS清除缓解盐诱导的氧化胁迫。和具有降低盐诱导ROS积累的作用[29-30]。MDA含量通常用于反映ROS在应激条件下对细胞膜的破坏作用[30]。在本研究中, MV和H2O2处理促进了表达。进一步的生理性状分析发现, 盐处理-OE拟南芥和发状根的H2O2和MDA含量均显著低于对照(图3和图4)。因此,参与减轻大豆氧化损伤以增强其耐盐性的过程。
抗氧化酶是抗氧化防御系统的重要组成部分, 在维持ROS稳态中发挥重要作用[30-31]。CIPKs已经被证明可以调节抗氧化酶的活性以应对盐胁迫。例如, Sun等[27]报道可以增强SOD、CAT和POD抗氧化酶的活性来清除盐诱导的H2O2积累。过表达能够提高转基因植株中SOD和POD抗氧化酶活性, 以促进盐诱导的H2O2清除[31]。在本研究中, 过表达增加了抗氧化相关基因和表达量(图5-A, B)。进一步的抗氧化酶活性分析结果表明, 在盐处理条件下, 与对照相比,-OE发状根具有更强的POD和CAT抗氧化酶活性(图4-F, G)。综上所述,参与增强抗氧化酶活性, 促进清除盐诱导的ROS。
K+是植物正常生长发育所必需的常量营养元素,参与调节酶促反应和渗透调节等生理过程[32-33]。在盐胁迫条件下, 植物细胞内过量积累的Na+会阻碍K+吸收, 破坏Na+/K+平衡, 引发细胞代谢紊乱[32-33]。研究表明CIPKs参与调节植物体内Na+/K+平衡。通过激活转基因烟草中和等基因表达, 降低细胞内Na+的累积, 增加K+含量, 增强植株耐盐性[16]。过表达能够提高转基因植株中、和表达, 提高细胞K+/Na+比值, 减少盐胁迫对细胞的损伤[26]。编码Na+/H+逆向转运蛋白,通过将胞内的Na+外排到胞外或将Na+区隔化到液泡中,来提高植株的抗盐性[34]。能够降低盐处理的大豆茎叶内的Na+积累量, 提高大豆幼苗的耐盐性[35]。本研究发现, 在盐胁迫处理条件下,能够增加大豆植株根部和茎部组织K+含量, 降低Na+含量和Na+/K+比值(图4-H~J)。与此结果相对应, 盐胁迫处理的大豆发状根中的、和的表达量高于对照发状根(图5-D, G, H)。因此能够增强Na+/K+稳态, 提高大豆的耐盐性。
诸多研究表明CBLs与特定的CIPKs结合, 调控植物对环境刺激的适应[1-3]。例如, TaCBL1和TaCIPK23相互作用, 增加渗透物质积累和干旱应答基因表达来缓解干旱胁迫[18]; CaCBL1/6/7/8与CaCIPK13结合, 通过增加花青素积累和提高抗氧化酶活性来提高番茄的耐寒性[15]; 此外, GhCBL2与GhCIPK6在液泡膜结合, 激活糖转运蛋白GhTST2表达, 进而调节棉花体内糖代谢平衡[36]。在本研究中通过酵母双杂交系统鉴定到GmCIPK10互作Ca2+感受器GmCBL4(图6-A)。通过Pull-down技术和BiFC试验进一步确认GmCIPK10与GmCBL4特异性结合(图6-B, C)。表明, GmCIPK10可能通过与GmCBL4形成复合物, 影响生理代谢过程, 从而调节大豆的盐胁迫应答反应。
4 结论
GmCIPK10是大豆盐胁迫应答的正向调节因子。进一步的生理指标测定结果表明参与调控大豆抗氧化酶系统和Na+/K+稳态提高大豆耐盐性。此外, GmCIPK10与Ca2+信号感受器GmCBL4互作。这些结果为探究CBL-CIPK信号通路在大豆盐胁迫应答中的作用提供了参考。
[1] Tang R J, Wang C, Li K, Luan S. The CBL-CIPK calcium signaling network: unified paradigm from 20 years of discoveries., 2020, 25: 604–617.
[2] Yu Q, An L, Li W. The CBL-CIPK network mediates different signaling pathways in plants., 2014, 33: 203–214.
[3] Ma X, Li Q H, Yu Y N, Qiao Y M, Haq S U, Gong Z H. The CBL-CIPK pathway in plant response to stress signals., 2020, 21: 5668.
[4] Luan S. The CBL-CIPK network in plant calcium signaling., 2009, 14: 37–42.
[5] Albrecht V, Ritz O, Linder S, Harter K, Kudla J. The NAF domain defines a novel protein-protein interaction module conserved in Ca2+-regulated kinases., 2001, 20: 1051–1063.
[6] Kudla J, Xu Q, Harter K, Gruissem W, Luan S. Genes for calcineurin B-like proteins inare differentially regulated by stress signals., 1999, 96: 4718–4723.
[7] Kudla J, Batistic O, Hashimoto K. Calcium signals: the lead currency of plant information processing., 2010, 22: 541–563.
[8] Quan R, Lin H, Mendoza I, Zhang Y, Cao W, Yang Y, Shang M, Chen S, Pardo J M, Guo Y. SCABP8/CBL10, a putative calcium sensor, interacts with the protein kinase SOS2 to protectshoots from salt stress., 2007, 19: 1415–1431.
[9] Pandey G K, Kanwar P, Singh A, Steinhorst L, Pandey A, Yadav A K, Tokas I, Sanyal S K, Kim B G, Lee S C, Cheong Y H, Kudla J, Luan S. Calcineurin B-like protein-interacting protein kinase CIPK21 regulates osmotic and salt stress responses in., 2015, 169: 780–792.
[10] Cheong Y H, Pandey G K, Grant J J, Batistic O, Li L, Kim B G, Lee S C, Kudla J, Luan S. Two calcineurin B-like calcium sensors, interacting with protein kinase CIPK23, regulate leaf transpiration and root potassium uptake in., 2007, 52: 223–239.
[11] D’Angelo C, Weinl S, Batistic O, Pandey G K, Cheong Y H, Schültke S, Albrecht V, Ehlert B, Schulz B, Harter K, Luan S, Bock R, Kudla J. Alternative complex formation of the Ca2+- regulated protein kinase CIPK1 controls abscisic acid dependent and independent stress responses in., 2006, 48: 857–872.
[12] Yin X, Xia Y, Xie Q, Cao Y, Wang Z, Hao G, Song J, Zhou Y, Jiang X. The protein kinase complex CBL10-CIPK8-SOS1 functions into regulate salt tolerance., 2020, 71: 1801–1814.
[13] Yasuda S, Aoyama S, Hasegawa Y, Sato T, Yamaguchi J.CBL-interacting protein kinases regulate carbon/nitrogen- nutrient response by phosphorylating ubiquitin ligase ATL31., 2017, 10: 605–618.
[14] Xiang Y, Huang Y, Xiong L. Characterization of stress-responsive CIPK genes in rice for stress tolerance improvement., 2007, 144: 1416–1428.
[15] M, X, Gai W X, Li Y, Yu Y N, Ali M, Gong Z H. The CBL-interacting protein kinase CaCIPK13 positively regulates defense mechanisms against cold stress in pepper., 2022, 73: 1655–1667.
[16] Lu L, Chen X, Zhu L, Li M, Zhang J, Yang X, Wang P, Lu Y, Cheng T, Shi J, Yi Y, Chen J. NtCIPK9: a calcineurin B-like protein-interacting protein kinase from the halophyte, enhancessalt tolerance., 2020, 11: 1112.
[17] Chen L, Ren F, Zhou L, Wang Q Q, Zhong H, Li X B. Thecalcineurin B-like 1/CBL-interacting protein kinase 6 (CBL1/CIPK6) component is involved in the plant response to abiotic stress and ABA signaling., 2012, 63: 6211–6222.
[18] Cui X Y, Du Y T, Fu J D, Yu T F, Wang C T, Chen M, Chen J, Ma Y Z, Xu Z S. Wheat CBL-interacting protein kinase 23 positively regulates drought stress and ABA responses., 2018, 18: 93.
[19] Ma X, Li Y, Gai W X, Li C, Gong Z H. Thegene positively regulates drought tolerance in pepper., 2021, 8: 216.
[20] Lu L, Chen X, Wang P, Lu Y, Zhang J, Yang X, Cheng T, Shi J, Chen J. CIPK11: a calcineurin B-like protein-interacting protein kinase from, confers tolerance to salt and drought in., 2021, 21: 123.
[21] Li R, Zhang J, Wu G, Wang H, Chen Y, Wei J. HbCIPK2, a novel CBL-interacting protein kinase from halophyte, confers salt and osmotic stress tolerance., 2012, 35: 1582–1600.
[22] Wang Y, Li T, John S J, Chen M, Chang J, Yang G, He G. A CBL-interacting protein kinase TaCIPK27 confers drought tolerance and exogenous ABA sensitivity in transgenic., 2018, 123: 103–113.
[23] Xu M, Li H, Liu Z N, Wang X H, Xu P, Dai S J, Cao X, Cui X Y. The soybean CBL-interacting protein kinase, GmCIPK2, positively regulates drought tolerance and ABA signaling., 2021, 167: 980–989.
[24] Wang F, Chen H W, Li Q T, Wei W, Li W, Zhang W K, Ma B, Bi Y D, Lai Y C, Liu X L, Man W Q, Zhang J S, Chen S Y. GmWRKY27 interacts with GmMYB174 to reduce expression of GmNAC29 for stress tolerance in soybean plants., 2015, 83: 224–236.
[25] Yu T F, Liu Y, Fu J D, Ma J, Fang Z W, Chen J, Zheng L, Lu Z W, Zhou Y B, Chen M, Xu Z S, Ma Y Z. The NF-Y-PYR module integrates the abscisic acid signal pathway to regulate plant stress tolerance., 2021, 19: 2589–2605.
[26] Deng X, Hu W, Wei S, Zhou S, Zhang F, Han J, Chen L, Li Y, Feng J, Fang B, Luo Q, Li S, Liu Y, Yang G, He G., a CBL-interacting protein kinase gene from wheat, confers salt stress tolerance in transgenic tobacco., 2013, 8: e69881.
[27] Sun T, Wang Y, Wang M, Li T, Zhou Y, Wang X, Wei S, He G, Yang G. Identification and comprehensive analyses of the CBL and CIPK gene families in wheat (L)., 2015, 15: 269.
[28] Zhu K, Chen F, Liu J, Chen X, He T, Cheng Z M. Evolution of an intron-poor cluster of the CIPK gene family and expression in response to drought stress in soybean., 2016, 6: 28225.
[29] Luo Q, Wei Q, Wang R, Zhang Y, Zhang F, He Y, Zhou S, Feng J, Yang G, He G. BdCIPK31, a calcineurin B-like protein- interacting protein kinase, regulates plant response to drought and salt stress.,2017, 8: 1184.
[30] Chen X, Huang Q, Zhang F, Wang B, Wang J, Zheng J. ZmCIPK21, a maize CBL-interacting kinase, enhances salt stress tolerance in., 2014, 15: 14819–14834.
[31] Su Y, Guo A, Huang Y, Wang Y, Hua J. GhCIPK6a increases salt tolerance in transgenic upland cotton by involving in ROS scavenging and MAPK signaling pathways., 2020, 20: 421.
[32] Li M, Chen R, Jiang Q, Sun X, Zhang H, Hu Z. GmNAC06, a NAC domain transcription factor enhances salt stress tolerance in soybean., 2021, 105: 333–345.
[33] Chen Y, Han Y, Kong X, Kang H, Ren Y, Wang W. Ectopic expression of wheat expansin gene TaEXPA2 improved the salt tolerance of transgenic tobacco by regulating Na+/K+and antioxidant competence., 2017, 159: 161–177.
[34] Yang L, Han Y, Wu D, Yong W, Liu M, Wang S, Liu W, Lu M, Wei Y, Sun J. Salt and cadmium stress tolerance caused by overexpression of theNa+/H+antiporter (GmNHX1) gene in duckweed (5511)., 2017, 192, 127–135.
[35] Qu Y, Guan R, Bose J, Henderson S W, Wege S, Qiu L, Gilliham M. Soybean CHX-type ion transport protein GmSALT3 confers leaf Na+exclusiona root derived mechanism, and Cl–exclusion via a shoot derived process., 2021, 44: 856–869.
[36] Deng J, Yang X, Sun W, Miao Y, He L, Zhang X. The calcium sensor CBL2 and its interacting kinase CIPK6 are involved in plant sugar homeostasisinteracting with tonoplast sugar transporter TST2., 2020, 183: 236–249.
GmCIPK10, a CBL-interacting protein kinase promotes salt tolerance in soybean
LI Hui1,2, LU Yi-Ping1, WANG Xiao-Kai1, WANG Lu-Yao1, QIU Ting-Ting1, ZHANG Xue-Ting1, HUANG Hai-Yan1, and CUI Xiao-Yu1,*
1College of Agriculture and Forestry Sciences, Linyi University, Linyi 276000, Shandong, China;2Center for International Education, Philippine Christian University, 1004, the Philippines
Salt stress seriously restricts the yield and quality of soybean. Calcineurin B subunit-interacting protein kinases (CIPKs) play a vital role in response to environmental stresses in plant. However, few study is known about the biological function of soybean CIPKs. In this study,was cloned from soybean genome. Bioinformatics analysis exhibited thatencoded an intron-poor type CIPKs with a serine (Ser)/threonine (Thr) protein kinase domain and a NAF/FISL motif. The relative expression pattern levels showed that the transcript level ofwas increased under NaCl, MV, and H2O2treatments. Overexpression ofinand soybean hairy roots improved salt tolerance of transgenic plants. Further physiological indicator assays demonstrated thatoverexpression could decrease the accumulation of MDA and H2O2, enhance the activity of antioxidant enzymes, and reduce sodium (Na+)/potassium (K+) in transgenic plants under salt stress. In addition, qRT-PCR illustrated thatpromoted the relative expression level of antioxidant- and salt tolerance-related gene in salt stress. The yeast two-hybrid, pull-down, and bimolecular fluorescence complementation experiments confirmed that GmCIPK10 interacts with the Ca2+sensor GmCBL4. These results provide a reference for investigating the role of the CBL-CIPK signaling pathway in response to salt stress in soybean.
; salt tolerance; ROS scavenging; Na+/K+homeostasis; soybean
10.3724/SP.J.1006.2023.24070
本研究由国家自然科学基金项目(32001459)和山东省自然科学基金项目(ZR2020QC123)资助。
This study was supported by the National Natural Science Foundation of China (32001459) and the Natural Science Foundation of Shandong Province (ZR2020QC123).
崔晓玉, E-mail: cuixiaoyu@lyu.edu.cn
E-mail: lihuiqau@163.com
2022-03-29;
2022-07-21;
2022-08-18.
URL: https://kns.cnki.net/kcms/detail/11.1809.S.20220817.1454.002.html
This is an open access article under the CC BY-NC-ND license (http://creativecommons.org/licenses/by-nc-nd/4.0/).

