系统性红斑狼疮继发肠系膜血管炎患病率及临床分析
蒙剑芬 骆爱姝 高其琛 陈蔚雯 刘 颖 马中双 龚 文 陈 宁 周芳芳 卞月存 马龙新*
(1 盐城市第一人民医院风湿免疫科,江苏 盐城 224006;2 响水县人民医院呼吸内科,江苏 盐城 224600)
系统性红斑狼疮(systemic lupus erythematosus,SLE)是一种多系统受累的自身免疫病,其中狼疮性肠系膜血管炎(lupus mesenteric vasculitis,LMV)是其并发症之一。LMV无特异的临床表现及辅检,易被误诊或漏诊,尤其是当LMV为SLE首发表现时,误诊率更高。临床上需及早对LMV进行正确的诊断和治疗,方能改善此类患者预后。本研究回顾性分析本中心LMV的患病率,临床特征及辅助检查,以加强临床医师对LMV的认识,提高诊治水平。
1 资料与方法
1.1 一般资料 回顾性分析2012年1月至2019年8月在盐城市第一人民医院住院SLE患者。患者符合1997年ACR和(或)2012年SLICC的SLE分类标准。LMV的诊断需在满足SLE诊断标准基础上,存在腹痛,腹泻,恶性呕吐等消化道症状,且符合下述条件:①经激素和(或)免疫抑制剂治疗后上述患者消化道症状可缓解。②腹部CT具备肠壁增厚或合并靶征、肠管节段性扩张、肠系膜血管影增粗等其中之一征象。③影像学检查排除如胃肠本身病变、急性胰腺炎、肿瘤等疾病[1-2]。
1.2 研究方法 回顾性收集LMV患者相关资料,描述患者相应的临床表现、辅助检查、治疗方案等。采用SLEDAI-2000评估系统性红斑狼疮的疾病活动度。
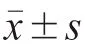
2 结果
2.1 SLE合并LMV患者的资料 具体见表1。此期我院首次住院SLE患者523例,并发LMV 8例(发生率为1.53%)。8例LMV患者均是女性,年龄25~48岁。SLE的中位病程6(1~25)个月。3例以LMV为SLE的首发表现,出现LMV至确诊SLE的中位时间为1(1~6)个月。5例在确诊SLE后发生LMV,其中2例为第2次发生LMV。
2.2 SLE合并LMV患者临床表现 具体见表1。100%患者表现为不同程度的腹痛,3例有腹泻,7例患者有恶心呕吐,1例有肛门停止排气排便,1例有里急后重。3例有发热,1例有头痛,1例关节肿痛。LMV患者SLEDAI-2000为2~12分,平均为(7±4)分。5例确诊SLE后出现LMV患者中,有2例是停药后发生,2例是服强的松10 mg qd时发生,1例是服强的松2.5 mg qd时发生。所有患者在激素加量和(或)环磷酰胺治疗后,病情得到改善。
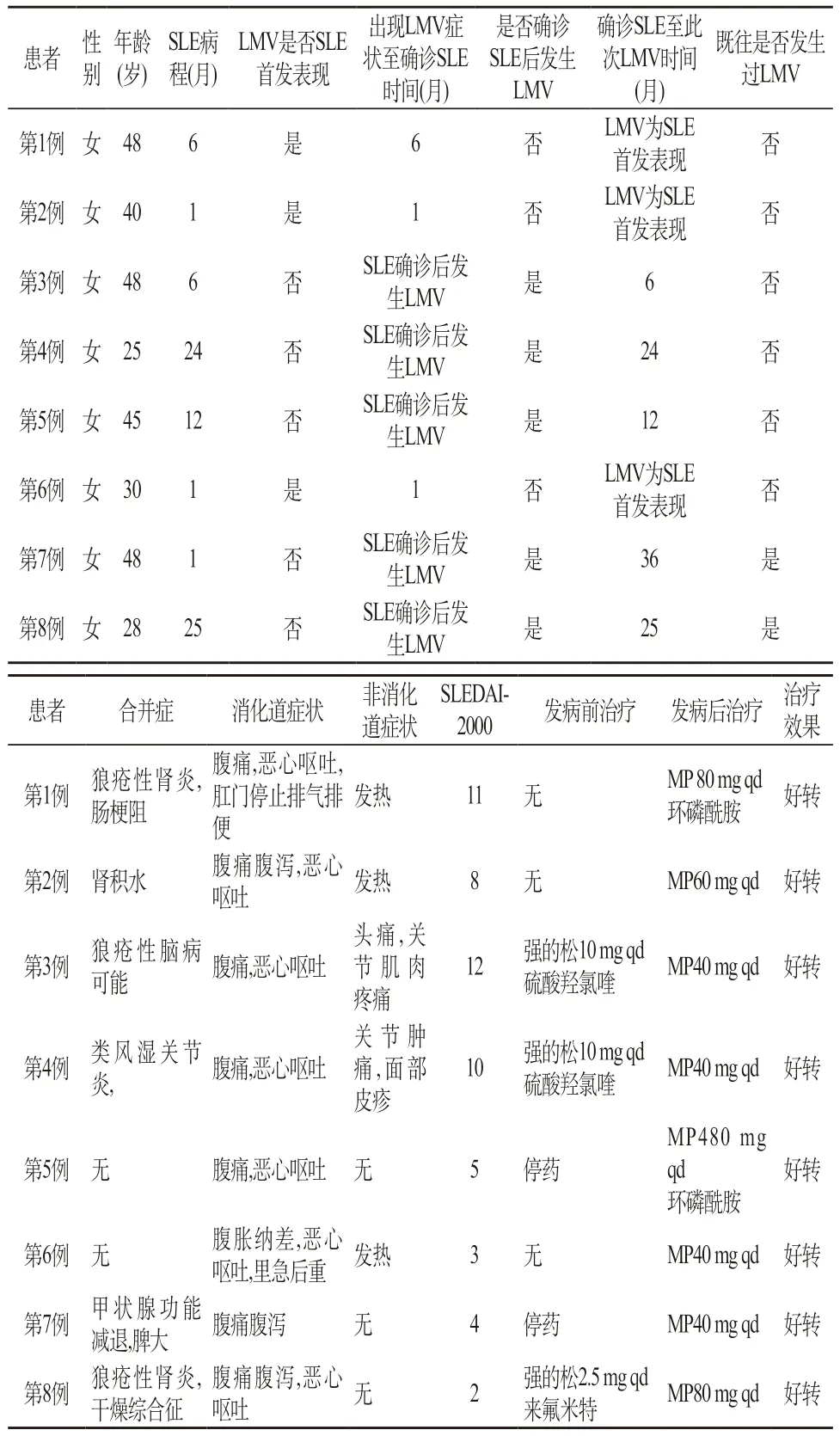
表1 SLE合并LMV患者一般资料、临床表现、病情活动度以及治疗预后
2.3 实验室辅助检查及腹部影像学检查 具体见表2。①血常规:4例白细胞下降,1例血小板减少。②24 h尿蛋白:3例≥0.5 g,5例正常。③粪隐血试验:3例阳性。④血沉及CRP:血沉增快7例,CRP升高3例。⑤补体及免疫球蛋白:8例C3和或C4下降,6例可见IgG不同程度升高。⑥免疫学检查:抗核抗体均阳性,患者的ENA及dsDNA等表现各异。⑦腹部超声:1例见双肾轻度积水,2例见腹腔积液,1例见脾大伴门静脉增宽。⑧腹部立位平片:2例有小气液平,1例见明显肠梗阻表现。⑨胃肠镜:2例进行此项检查,1例正常,1例见全结肠黏膜高度充血水肿。⑩腹部CT:8例有肠壁增厚水肿,部分患者可见“靶征”,节段性肠管扩张等表现。3例有腹膜后肿大淋巴结。4例有腹腔和盆腔积液。

表2 SLE合并LMV患者辅助检查
3 讨论
SLE临床表现多样。30%~50%SLE患者合并胃肠道症状[3],但SLE本身引起胃肠道症状极少见,其中LMV为SLE本身所致急性腹痛的最常见原因[4]。四川华西医院统计数据显示,其LMV患病率为1.2%[5],中山大学第一附属医院为2.5%[6],而南京医科大学第一附属医院统计的患病率高于二者,为4.67%[7],接近于另一亚洲国家韩国的SLE并发LMV5.8%的患病率[8]。本研究中SLE并发LMV发病率为1.5%,与华西医院报道相似。严重的LMV发生时可出现假性肠梗阻(IPO),常易伴发肾盂输尿管积水和(或)间质性膀胱炎[9]。
LMV可能的触发因素包括感染,非甾体消炎药的使用等[4]。SLE的血管病变的机制主要为两类:免疫复合物沉积在血管壁引起的经典的白细胞破碎性的炎症型和继发于循环中抗磷脂抗体介导的血栓型,上述两种机制协同参与LMV的发病[4,10]。免疫复合物沉积引起的炎症性血管炎的过程中,补体活化是其中的关键环节[11]。抗磷脂抗体如抗心磷脂抗体和抗β2-糖蛋白抗体,可通过活化内皮细胞,发挥促凝作用。当内皮细胞受损暴露抗原,刺激机体产生抗内皮细胞抗体。SLE并发LMV患者体内抗内皮细胞抗体IgG血清浓度显著高于无LMV的SLE患者或健康对照组[8],提示血管内皮受损在LMV的发病机制中发挥重要作用。SLE并发假性肠梗阻的机制亦尚不明确,目前认为血管炎所致肠道慢性缺血致平滑肌损害,肠道蠕动功能减弱为其可能的机制之一。鉴于假性肠梗阻常伴肾盂输尿管积水的发生,有观点提出可能是原发性肌病或神经方面疾病,或是继发于免疫复合物介导的血管炎或抗平滑肌细胞抗体导致肠道及泌尿道平滑肌出现蠕动功能降低所致。组织病理活检可见肌层萎缩及纤维化,平滑肌细胞减少,炎性细胞浸润,纤维蛋白样沉积以及血管炎表现。
普通CT可见节段性肠道扩张,局部或弥漫性肠壁增厚,腹水,后腹膜淋巴结肿大等表现。在增强扫描时,肿胀的肠壁呈“靶征”改变;肠系膜血管充血,呈“梳状征”或“栅栏征”[4]。腹部超声可见小肠壁水肿,增厚。胃镜和肠镜检查可以显示缺血和溃疡,但无法观察到肠系膜血管,故无法明确诊断LMV。
早期及时和准确的诊断LMV,使用有效的免疫抑制治疗,可避免病情恶化所致的需手术干预的梗死或肠穿孔。LMV的发病机制之一为炎性缺血性血管炎,因此在LMV诊断确立后需迅速大剂量激素以及完全胃肠休息治疗。对于复发性LMV和对类固醇激素反应不佳患者,使用磷酰胺可改善预后,降低复发[8]。若免疫抑制治疗未达到预期疗效时,需考虑患者是否发生肠穿孔或坏死,以便及时手术干预治疗。
综上所述,系统性红斑狼疮表现复杂,当有腹部症状,需排除可引起相似症状的疾病,临床医师需警惕肠系膜血管炎,尽早进行相关实验室器械检查,早期诊断和及时治疗,必要时手术干预,可显著改善患者的预后。

