槟榔蒂水提物对3种食用菌菌丝体品质及抗氧化活性的影响
包怡红 赖章飞 马银鹏 贾雨彤 潘飞兵 匡凤娇
(1.东北林业大学林学院,黑龙江 哈尔滨 150040;2.黑龙江省森林食品资源利用重点实验室,黑龙江 哈尔滨 150040;3.海南华创槟榔研究院,海南 海口 570100;4.海南口味王科技发展有限公司,海南 万宁 571501)
平菇、榆黄蘑、金针菇是消费者比较认可的食用菌,在中国栽培历史悠久[1-2],是公认的健康食品[3]。食用菌制种主要有固体培养和液体发酵两种,其中液体发酵具有生长周期短、菌丝活力旺盛等优点[4-5],是获得大量菌丝体和活性物质的常用方法[6]。
目前,利用中药残渣或林业废弃资源提取物进行液体发酵以改善食药用真菌的品质,成为该领域研究热点[7]。研究发现在发酵体系中添加外源物质如天麻提取物[8]、玉米油[9]等,能促进食药用菌的菌丝生长和多糖等代谢产物的产量。周丽思等[10]在培养基中添加不同浓度的忍冬茎水提物,研究其对茶藨子叶状层菌发酵菌丝体生长和代谢产物的影响,结果表明忍冬茎水提物可显著提高菌丝体中麦角甾醇、总多糖等成分的含量。潘琴等[11]研究了麻栎木醋液(主要成分为有机酸类、醛类、酮类、酚类等)对8种食用菌菌丝体生长的影响,发现适宜浓度的麻栎木醋液对食用菌菌丝体生长有明显的促进作用,而浓度过高时则抑制其生长。
槟榔(ArecacatechuL.)是棕榈科植物槟榔的成熟果实,主产于中国海南、台湾、云南,在广西、广东、湖南及福建等省也有少量分布[12]。槟榔含有多种氨基酸、矿物质、粗纤维、生物碱和酚类物质,具有很高药用和经济价值[13-14]。作为中国著名四大南药(槟榔、益智、砂仁、巴戟)之首,槟榔具有抗炎、抗抑郁、抑菌等作用,同时由于酚类化合物的存在而具有较高的抗氧化性能[15-16]。槟榔蒂是槟榔果实加工后的副产物,现多数企业直接废弃,不但造成资源浪费,更因腐烂霉变造成环境污染。研究通过在平菇、榆黄蘑、金针菇液体发酵培养基中添加不同浓度槟榔蒂水提物,探讨发酵过程中这3种食用菌菌丝体品质、抗氧化活性以及关键酶活性等指标的变化,旨在研究槟榔蒂水提物对3种食用菌菌丝体生长的影响,为进一步开发新的食用菌栽培基质提供理论依据。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
平菇、榆黄蘑、金针菇菌种:黑龙江省科学院微生物研究所;
槟榔蒂:海南华创槟榔研究中心;
芦丁、没食子酸、齐墩果酸、3,5-二硝基水杨酸、硝酸铝、硝酸钠、氢氧化钠、福林酚、碳酸钠、苯酚、H2SO4、无水乙醇、葡萄糖、琼脂粉、磷酸二氢钾、硫酸镁:分析纯,上海源叶生物科技公司;
试验用水:蒸馏水,市售;
马铃薯:市售。
1.1.2 主要仪器设备
电子分析天平:YP2002型,上海佑科仪器仪表有限公司;
酶标仪:RT-6000型,上海一恒科学仪器有限公司;
电热恒温水浴锅:DK-98-ⅡA型,天津市泰斯特仪器有限公司;
振荡培养箱:HZQ-X100型,哈尔滨市东明医疗仪器厂;
立式压力蒸汽灭菌器锅:DY04-13-44-00型,上海东亚压力容器制造有限公司;
离心机:TD5A型,湖南凯达科学仪器有限公司。
1.2 方法
1.2.1 槟榔蒂水提物制备
(1)槟榔蒂原料预处理:将槟榔蒂中杂质挑除,晒干后粉碎过60目筛,干燥器中存放备用。
(2)水提物制备:准确称取槟榔蒂粉末20 g,按料液比1∶20(g/mL)加水浸泡1 h后,在超声功率300 W、温度100 ℃条件下提取30 min,10 000 r/min离心10 min取上清液,提取2次合并上清液,将上清液浓缩至100 mL以下,真空冷冻干燥(压力20 Pa,冷阱温度-40 ℃,时间24 h)得到槟榔蒂水提物干粉,备用。
1.2.2 槟榔蒂水提物主要成分测定
(1)溶液配制:取2.5 g槟榔蒂水提物干粉,用蒸馏水溶解定容至25 mL,得质量浓度为0.1 g/mL的水提物待测样液。
(2)多糖含量测定:采用苯酚—硫酸法[17]。
(3)多酚含量测定:采用Folin-酚法[18]。
(4)黄酮含量测定:采用NaNO2-Al(NO3)3比色法[19]。
(5)槟榔碱含量测定:参照刘文杰[20]的方法。
1.2.3 培养基制作
(1)PDA培养基:去皮马铃薯200 g,切成小块放入烧杯中,加水1 000 mL煮沸30 min,用4层纱布过滤,滤液补充水分到1 000 mL,加入20 g葡萄糖、20 g琼脂、1 g KH2PO4、0.5 g MgSO4·7H2O,加热溶解,分装于试管,121 ℃灭菌30 min。
(2)液体培养基:去皮马铃薯200 g,切成小块放入烧杯中,加水1 000 mL煮沸30 min,用4层纱布过滤,滤液补充水分到1 000 mL,加入20 g葡萄糖、1 g KH2PO4、0.5 g MgSO4·7H2O,加热溶解,分装于250 mL三角瓶中,装液量100 mL,121 ℃灭菌30 min。
1.2.4 菌种制备
(1)斜面菌种活化:用接种铲取菌块(d=4 mm)接入PDA培养基中27 ℃恒温培养7 d,备用。
(2)液体菌种制备:已活化的斜面菌丝体,接种到装有100 mL液体培养基的250 mL三角瓶中,27 ℃恒温振荡培养7 d得液体菌种。
1.2.5 菌丝体长速测定 参照卢朝亮等[21]的方法,槟榔蒂水提物添加量分别为1.6,3.2,4.8,6.4,8.0 mg/mL,制作PDA试管斜面培养基,以未添加槟榔蒂水提物的培养基为对照,取菌块(d=4 mm)接入培养基中,于培养箱中27 ℃恒温培养。待菌种萌发,每日在菌丝前端对应位置的试管壁上划线,测其长速,求10 d长速平均值。
1.2.6 发酵培养 取250 mL三角瓶,配制液体培养基,槟榔蒂水提添加量分别为1.6,3.2,4.8,6.4,8.0 mg/mL,以不加槟榔蒂水提物为空白对照,按接种量5%将液体菌种接种到发酵培养基中,在温度27 ℃,转速150 r/min的恒温振荡培养箱中培养7 d。
1.2.7 菌丝体生物量测定 采用干重法测定。发酵液以4 000 r/min离心5 min得菌丝球,用无菌水反复漂洗,于60 ℃烘干至恒重后用分析天平称菌丝体干质量,菌丝体粉碎过60目筛,备用。
1.2.8 菌丝体提取物制备及相关指标测定
(1)水提液:称取菌丝体粉末0.4 g,按料液比1∶35(g/mL)加入蒸馏水,超声功率300 W、70 ℃下提取2 h,5 000 r/min离心10 min,收集上清液定容至20 mL得菌丝体水提液,4 ℃下保存备用。
(2)醇提液:称取菌丝体粉末0.4 g,按料液比1∶35(g/mL)加入70%的乙醇溶液,超声功率300 W、70 ℃下提取2 h,5 000 r/min离心10 min,收集上清液定容至20 mL得菌丝体醇提液,4 ℃下保存备用。
(3)胞内多糖测定:精确称取菌丝体粉末1 g,与蒸馏水以料液比1∶10(g/mL)混合,90 ℃下热水浸提2 h,4 000 r/min离心15 min取上清液,加入3倍体积99.7%的乙醇,4 ℃沉淀24 h,4 000 r/min离心15 min,沉淀用95%乙醇洗涤,然后用蒸馏水复溶,定容至50 mL备用。胞内多糖测定方法同1.2.2(2)。
(4)菌丝体多酚和黄酮含量测定:分别取1 mL菌丝体乙醇提取液,测定多酚和黄酮含量,测定方法同1.2.2(3)和1.2.2(4)。
(5)三萜含量测定:采用香草醛—冰醋酸法[22]。
1.2.9 抗氧化活性测定
(1)DPPH自由基清除率:参照范俐等[23]的方法略做修改,用无水乙醇配制0.2 mmol/L的DPPH溶液,于试管中依次加入1 mL DPPH溶液、2 mL蒸馏水以及1 mL 菌丝体水提液和醇提液,混匀,于25 ℃水浴锅中避光反应20 min,517 nm下测定吸光值。按式(1)计算DPPH自由基清除率。
Q1=[1-(A1-A2)/A0]×100%,
(1)
式中:
Q1——DPPH自由基清除率,%;
A1——样品吸光值;
A2——未添加DPPH溶液的样品吸光值;
A0——空白吸光值。
(2)还原力:采用铁氰化钾显色法[24]。10 mL离心管中分别加入菌丝体水提物和醇提物0.5 mL,加入2.5 mL 磷酸盐缓冲液(0.2 mol/L,pH 6.6)和1%的铁氰化钾溶液1 mL,混匀,于50 ℃水浴锅反应30 min,反应完快速冷却,加入10%的三氯乙酸2.5 mL,混匀,3 000 r/min离心10 min,取2.5 mL上清液,加入2.5 mL蒸馏水和0.1%的三氯化铁溶液0.5 mL,混匀静置10 min,于700 nm下测定吸光值。按式(2)计算菌丝体的还原力。
H=A1-A2,
(2)
式中:
H——还原力;
A1——样品吸光值;
A2——空白吸光值。
(3)ABTS自由基清除率:取5 mL 7 mmol/L的ABTS溶液,加入到100 μL过硫酸钾溶液中,混匀,于25 ℃ 下避光反应12 h,用pH 7.4的磷酸盐缓冲液稀释ABTS自由基溶液使其在734 nm下的吸光值为0.7,取1 mL菌丝体水提液和醇提液,加入2 mL ABTS溶液混匀,于25 ℃水浴锅中避光反应20 min,734 nm下测定吸光值。按式(3)计算ABTS自由基清除率。
Q2=[1-(A1-A2)/A0]×100%,
(3)
式中:
Q2——ABTS自由基清除率,%;
A1——样品吸光值;
A2——未添加ABTS溶液的样品吸光值;
A0——空白吸光值。
1.2.10 胞外酶活性测定
(1)粗酶液制备:液体发酵培养接种后每隔24 h吸取发酵液5 mL,4 000 r/min离心5 min,取上清液即为粗酶液,连续测定7 d。
(2)淀粉酶活性测定:参照徐秀红等[25]的方法,根据葡萄糖标准曲线计算还原糖含量,以在沸水浴中灭活的酶液为对照。酶活力定义:1 mL发酵液中酶量与底物作用30 min释放出1 mg葡萄糖为一个活力单位。
(3)纤维素酶活性测定:用pH 4.6、0.1 mol/L的醋酸盐缓冲液配制0.5%的CMC-Na溶液,取25 mL试管,加入1.5 mL CMC-Na溶液和0.5 mL粗酶液,混匀后,于45 ℃恒温水浴中反应30 min,其后操作同淀粉酶活性测定,于520 nm处测定吸光值,根据葡萄糖标准曲线计算还原糖含量,以在沸水浴中灭活的酶液为对照。酶活力定义:1 mL发酵液中酶量与底物作用30 min释放出1 mg 葡萄糖为一个活力单位。
(4)木聚糖酶活性测定:用pH 4.6、0.1 mol/L的醋酸盐缓冲液配制0.5%的木聚糖溶液,取25 mL试管,加入1.5 mL木聚糖溶液和0.5 mL粗酶液,混匀后,于50 ℃ 恒温水浴中反应30 min,其后操作同淀粉酶活性测定,于520 nm处测定吸光值,根据木糖标准曲线计算还原糖含量,以在沸水浴中灭活的酶液为对照。酶活力定义:1 mL发酵液中酶量与底物作用30 min释放出1 mg木糖为一个活力单位。
(5)漆酶活性测定:参照Li等[26]的方法略做修改,配制0.5 mmol/L的ABTS溶液,酶活反应体系包含ABTS溶液0.5 mL、0.1 mol/L的醋酸盐缓冲液(pH 4.6)1 mL,加入酶液0.5 mL启动反应,在反应的前5 min内每隔30 s记录一次OD420 nm值变化,以在沸水浴中灭活的酶液为对照。酶活力定义:1 mL发酵液中酶量与底物(ABTS)作用每分钟使OD420 nm值改变0.01为一个活力单位。
1.2.11 数据处理 每组试验重复3次,采用Excel对原始数据进行统计,数据分析和作图分别采用IBM SPSS Statistics 22.0和Origin 2021。
2 结果与分析
2.1 槟榔蒂水提物主要成分
槟榔蒂经粉碎提取后得到水提物,主要成分含量测定结果见表1。水提物中丰富的活性成分可促进真菌菌丝体分泌胞外酶,还可能通过增加真菌细胞壁的通透性,从而有利于营养物质的摄取和活性物质的生物合成积累[27]。
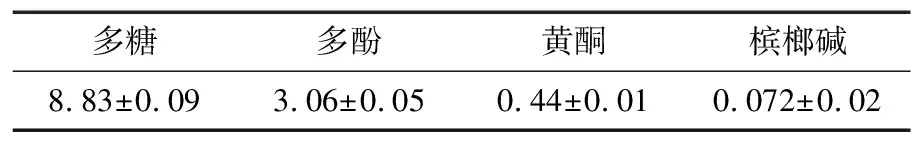
表1 槟榔蒂水提物主要成分
2.2 槟榔蒂水提物对菌丝长速的影响
由表2可知,随着槟榔蒂水提物添加量的增加,3种菌种的菌丝长速先呈上升趋势,与对照组相比较,平菇、榆黄蘑的菌丝长速有显著提高,金针菇菌丝长速差异不显著,槟榔蒂水提物添加量为6.4,4.8,3.2 mg/mL时,平菇、榆黄蘑、金针菇的菌丝长速分别达到最高,之后呈下降趋势,但均高于对照组。这表明3种菌种均可在添加槟榔蒂水提物的培养基中生长,且根据试验观察,槟榔蒂水提物可有效缩短3种菌种的菌丝萌发时间。
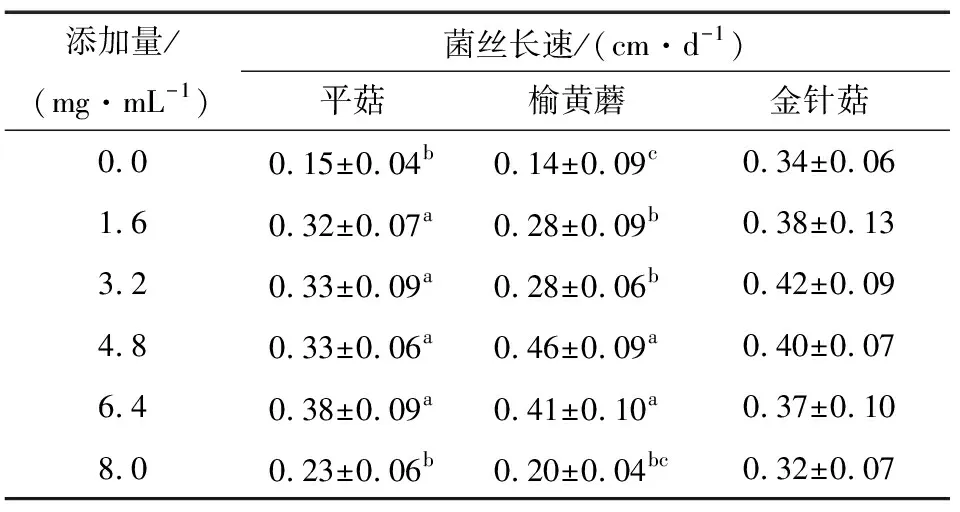
表2 槟榔蒂水提物添加量对菌丝长速的影响†
2.3 槟榔蒂水提物对菌丝体生物量的影响
由表3可知,与对照组相比,槟榔蒂水提物对3种菌种生物量的影响均表现为先上升趋势,槟榔蒂水提物添加量为6.4 mg/mL时,平菇菌丝生物量达到最高值,与对照组相比提高了46.25%,添加量为4.8 mg/mL时,榆黄蘑、金针菇生物量达到最高值,与对照组相比分别提高了14.77%,26.83%,之后生物量开始下降,但仍高于对照组,原因可能是添加少量的槟榔蒂水提物时,其中的糖类、酚类等活性物质对菌丝生长有一定促进作用,而过高的添加量会造成液体培养基黏度增加和溶氧量降低,不利于菌丝体生长[28]。此外,还考虑到槟榔蒂水提物中残留的微小颗粒会富集在菌丝表面,对菌丝生长也有一定抑制作用。
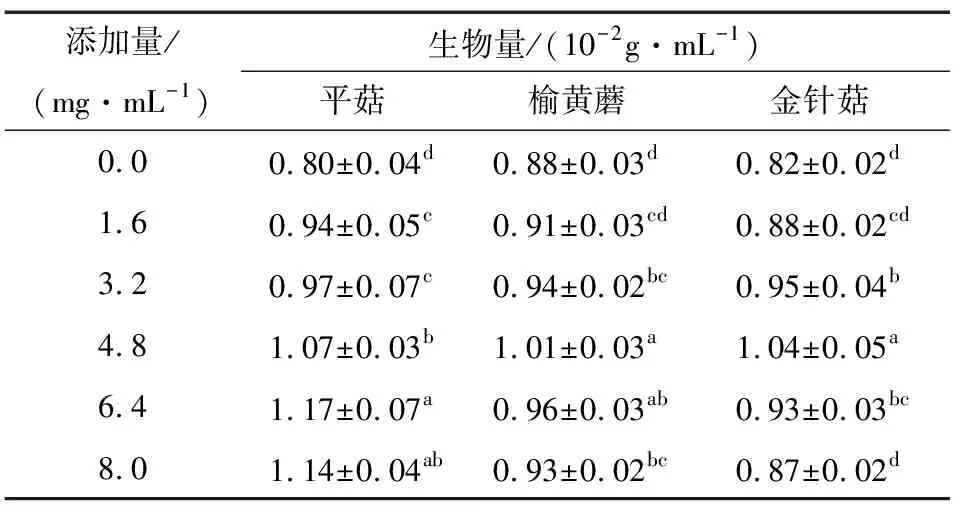
表3 槟榔蒂水提物添加量对菌丝体生物量的影响†
2.4 槟榔蒂水提物对菌丝体多糖、三萜含量的影响
由图1可知,随着培养基中槟榔蒂水提物添加量逐渐增高,菌丝体多糖和三萜含量呈先升后降趋势,槟榔蒂水提物添加量为6.4 mg/mL时,平菇菌丝体多糖达到最高值,与对照组相比提高了27.40%,添加量为4.8 mg/mL时,榆黄蘑、金针菇胞内多糖与对照组相比分别提高了22.20%,8.71%;菌丝体三萜含量均在槟榔蒂水提物添加量为4.8 mg/mL时最高,与对照组分别提高了95.24%,70.91%,75.00%;说明槟榔蒂水提物的添加对3种食用菌菌丝体多糖和三萜的合成有促进作用,并且与生物量的变化趋势一致;这是由于菌丝体在快速生长时期,细胞代谢旺盛,相关酶系活跃,生物量增加的同时,活性物质的合成速率加快,含量也随之增加,与赵小瑞等[29]以当归、党参、甘草、黄芪提取物作为激发因子,研究灵芝液态发酵过程中菌丝生长和产三萜的研究结果相似。

小写字母不同表示差异显著(P<0.05)
2.5 槟榔蒂水提物对菌丝体多酚、黄酮含量的影响
由图2可知,随着培养基中槟榔蒂水提物添加量的逐渐增高,多酚和黄酮含量呈先升后降趋势,槟榔蒂水提物添加量为6.4 mg/mL时,平菇菌丝体多酚和黄酮达到最高值,与对照组相比分别提高了72.99%,34.48%,添加量为4.8 mg/mL时,榆黄蘑、金针菇菌丝体多酚与对照组相比提高了33.74%,46.37%,黄酮与对照组相比分别提高了53.30%,37.04%。槟榔蒂水提物中含有丰富的水溶性酚类物质,添加不同量的槟榔蒂水提物作为菌丝生长外源代谢前体,有利于菌丝体对酚类物质的代谢和转化,与吴俐等[30]考察的油茶枝浸提液对茶薪菇菌丝酚类代谢影响的结果相似。

小写字母不同表示差异显著(P<0.05)
2.6 抗氧化活性评价
2.6.1 DPPH自由基清除能力 由图3可知,平菇、榆黄蘑、金针菇菌丝体的水提物和醇提物对DPPH自由基均有一定的清除作用,随着培养基中槟榔蒂水提物添加量的逐渐增高,菌丝体水提物和醇提物对DPPH自由基的清除能力呈先升后降趋势,槟榔蒂水提物添加量为6.4 mg/mL时,平菇菌丝体水提物和醇提物DPPH自由基清除率分别为55.76% 和65.33%,与对照组相比提高了24.77%和17.27%,槟榔蒂水提物添加量为4.8 mg/mL时,榆黄蘑、金针菇菌丝体清除DPPH能力达到最大;不同提取物对DPPH自由基的清除率大小差异显著,依次为榆黄蘑醇提物>金针菇醇提物>平菇醇提物>榆黄蘑水提物>金针菇水提物>平菇水提物。
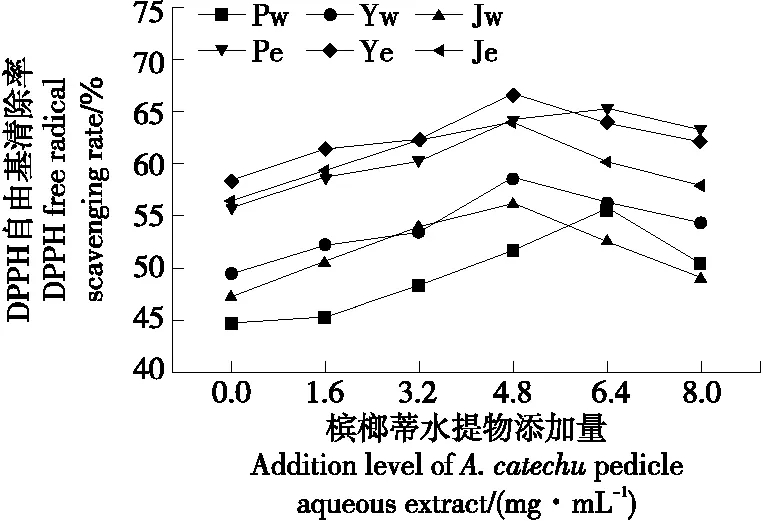
Pw.平菇菌丝体水提物 Yw.榆黄蘑菌丝体水提物 Jw.金针菇菌丝体水提物 Pe.平菇菌丝体醇提物 Ye.榆黄蘑菌丝体醇提物 Je.金针菇菌丝体醇提物
2.6.2 还原力 由图4可知,平菇、榆黄蘑、金针菇菌丝体的水提物和醇提物对Fe3+具有不同程度的还原能力,随着培养基中槟榔蒂水提物添加量的逐渐增高,菌丝体水提物和醇提物对Fe3+的还原能力呈先升后降趋势,槟榔蒂水提物添加量为6.4 mg/mL时,平菇菌丝体水提物和醇提物对Fe3+的还原能力达到最大,添加量为4.8 mg/mL时,榆黄蘑、金针菇菌丝体对Fe3+的还原能力达到最大;各提取物对Fe3+的还原能力大小依次为榆黄蘑醇提物>金针菇醇提物>平菇醇提物>榆黄蘑水提物>金针菇水提物>平菇水提物。
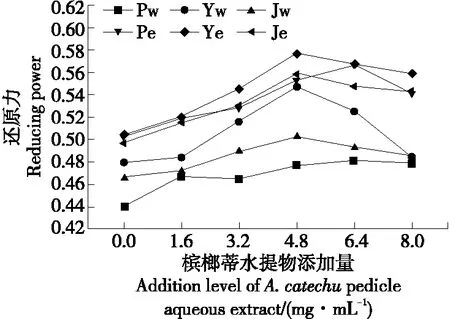
Pw.平菇菌丝体水提物 Yw.榆黄蘑菌丝体水提物 Jw.金针菇菌丝体水提物 Pe.平菇菌丝体醇提物 Ye.榆黄蘑菌丝体醇提物 Je.金针菇菌丝体醇提物
2.6.3 ABTS自由基清除能力 由图5可知,平菇、榆黄蘑、金针菇菌丝体的水提物和醇提物对ABTS自由基均有一定的清除作用,随着培养基中槟榔蒂水提物添加量的逐渐增高,菌丝体水提物和醇提物对ABTS自由基的清除能力呈先升后降趋势,槟榔蒂水提物添加量为6.4 mg/mL时,平菇菌丝体水提物和醇提物ABTS自由基清除率达到最大,与对照组相比提高了51.34%和39.74%,添加量为4.8 mg/mL 时,榆黄蘑、金针菇菌丝体清除ABTS自由基能力达到最大;不同提取物对ABTS自由基的清除率大小差异显著,依次为榆黄蘑醇提物>榆黄蘑水提物>金针菇醇提物>平菇醇提物>平菇水提物>金针菇水提物。

Pw.平菇菌丝体水提物 Yw.榆黄蘑菌丝体水提物 Jw.金针菇菌丝体水提物 Pe.平菇菌丝体醇提物 Ye.榆黄蘑菌丝体醇提物 Je.金针菇菌丝体醇提物
2.7 槟榔蒂水提物对酶活性的影响
随着液体发酵进程的推进,菌丝分泌胞外酶,培养基中的营养物质不断被菌丝营养代谢转化利用,促进菌丝生长。根据3种菌种菌丝生物量、活性成分含量以及抗氧化活性的结果,平菇选择添加6.4 mg/mL的槟榔蒂水提物、榆黄蘑和金针菇选择添加4.8 mg/mL的槟榔蒂水提物,分别测定3种菌种液态发酵过程中淀粉酶、纤维素酶、木聚糖酶和漆酶的活性变化。
2.7.1 淀粉酶活性变化 由图6可知,3种菌种的淀粉酶活性变化规律基本一致,初始1~3 d时,淀粉酶活性升高,菌种颗粒周围开始长出白色菌丝,在培养第3天酶活性达到最高,随着培养基中营养物质慢慢被利用,酶活性开始下降,培养4~5 d时,菌丝长至一定时期断落至菌液中形成新的萌发点,此时酶活又有所上升,达到另一个高点,随着营养物质彻底被吸收利用,酶活性开始下降。

小写字母不同表示差异显著(P<0.05)
2.7.2 纤维素酶活性变化 由图7可知,培养1~3 d时,3种菌种纤维素酶活性呈上升趋势,第3天达到最高,之后酶活性开始下降,培养至第6天达到另一个高点,变化规律与淀粉酶基本一致;3种菌种相比,酶活性差异不显著,金针菇的纤维素酶活性从第3天后一直呈下降趋势,未出现第二个高点,可能与不同菌种自身特性有关。
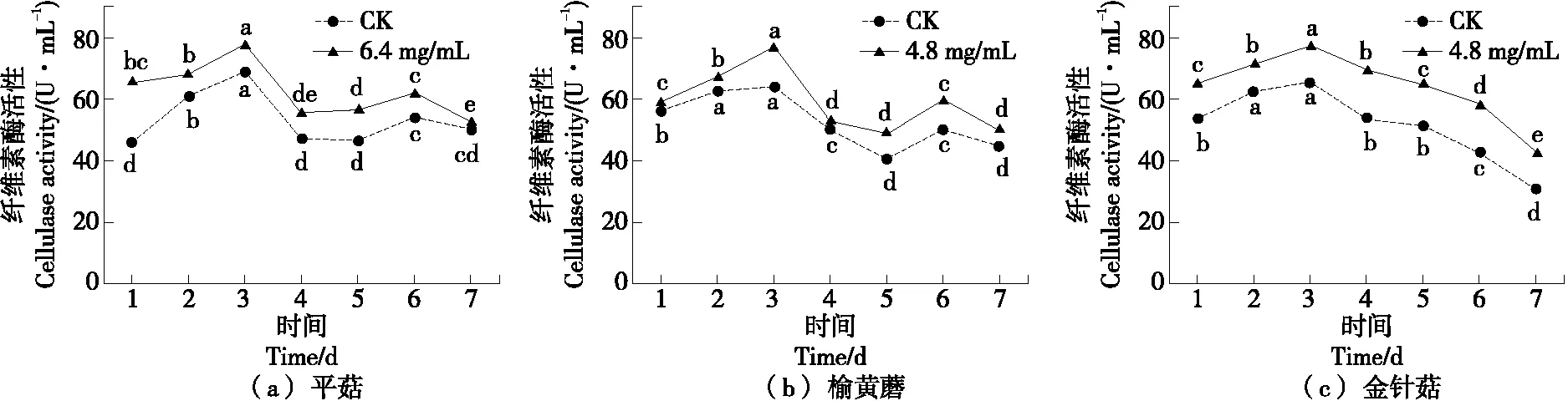
小写字母不同表示差异显著(P<0.05)
2.7.3 木聚糖酶活性变化 由图8可知,培养1~3 d时,3种菌种木聚糖酶活性呈上升趋势,第3天达到最高,之后酶活性开始下降,培养至第6天达到另一个高点,变化规律与淀粉酶基本一致。3种菌种相比,酶活性差异不显著,金针菇的纤维素酶活性从第3天后一直呈下降趋势,未出现第二个高点。

小写字母不同表示差异显著(P<0.05)
2.7.4 漆酶活性变化 由图9可知,3种菌种漆酶初始活性偏低,随着培养时间的增加,漆酶活性开始上升,第3天达到最大活性,之后漆酶活性开始下降,平菇和榆黄蘑在培养第6天漆酶活性再次上升,之后随着培养的进行,开始呈下降趋势,槟榔蒂水提物的添加只改变了3种菌种的酶活性大小,对酶活性变化趋势影响不大。
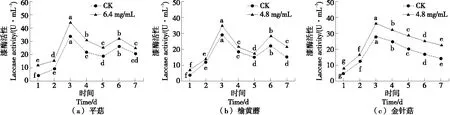
小写字母不同表示差异显著(P<0.05)
3 结论
在一定浓度范围内,槟榔蒂水提物能促进平菇、榆黄蘑、金针菇菌丝体生长,添加过量的槟榔蒂水提物对菌丝体生长有抑制作用。在最适添加浓度下,3种菌丝体的多糖、三萜、多酚、黄酮含量与对照组相比有显著提高(P<0.05)。随着槟榔蒂水提物添加量的增加,3种菌丝体的水提物和醇提物抗氧化活性均有显著提高(P<0.05),其活性大小依次为榆黄蘑>金针菇>平菇;槟榔蒂水提物能在一定程度上提高3种食用菌生长代谢相关酶的活性,但对酶活性变化趋势的影响不显著。
槟榔蒂水提物添加到食用菌液体培养体系中,可以提高菌丝体的生物量、活性成分含量以及抗氧化能力,但槟榔蒂水提物促进菌丝体生长的具体成分尚不明确,还需进一步研究。

