长链非编码RNA BC015134调控胃癌细胞侵袭与迁移的研究
邬仲鑫 蔡炜龙 尹磊
胃癌是我国最常见的恶性肿瘤之一,发病率和病死率位居所有消化系统恶性肿瘤首位[1]。胃癌年病死率为25.2/10万人,占同期所有恶性肿瘤死亡的23.3%[2-4]。早期胃癌的预后较好,但是临床上约90%胃癌患者就诊时已处于进展期,转移率高,根治性切除率低,术后5年局部复发及转移的发生率高达60%~70%,预后较差[5]。因此,探究促进胃癌转移的分子机制,寻找胃癌转移的关键分子,可为胃癌治疗提供潜在的靶点,对提高患者预后具有重要意义。近年来,高通量测序技术和计算机平台的发展为非编码RNA的发现和分类发挥了关键作用[6]。在这些非编码RNA中,有一类长度大于200核苷酸的不具备蛋白编码能力的RNA,称之为长链非编码RNA(long noncoding RNA,lncRNA)。研究发现,lncRNA在调节基因表达的过程中发挥了非常重要的作用,其几乎可以参与基因表达的各个阶段,从而调控机体的各项生命活动[7-9]。
肿瘤的发生和进展是一个多因素、多步骤的复杂过程[10]。研究表明,lncRNA在肿瘤的生物学过程中扮演了重要角色,促进了多种肿瘤的发生、发展[11-13]。笔者通过对GEO数据库中10对胃癌和癌旁组织RNA芯片结果进行分析以及临床样本验证,筛选出胃癌转移相关lncRNA BC015134,探究BC015134在胃癌发生、发展尤其是转移方面的功能,为胃癌患者的治疗提供潜在靶点,进而改善预后。
1 材料和方法
1.1 材料 人胃癌MGC-803细胞购自中国科学院细胞库;Trizol试剂、RNA逆转录试剂盒、qRT-PCR试剂盒均购自日本Takara公司;蛋白提取试剂盒、ECL发光试剂盒均购自上海碧云天生物技术有限公司;Transwell小室购自美国BD公司;RNA pulldown试剂盒购自美国Thermo fisher scientific公司;Lipofectamine 2000试剂购自美国Invitrogen公司;β-连环蛋白(β-Catenin)、神经型钙黏蛋白(N-cadherin)、上皮型钙黏蛋白(E-cadherin)抗体均购自美国Cell Signaling Technology公司;BC015134-shRNA质粒、pcDNA3.1-BC015134过表达质粒、pcDNA3.1-β-Catenin过表达质粒、pBluescriptⅡSK-BC015134质粒购自上海吉玛制药技术有限公司。人胃癌及癌旁组织取自2015年1月至2020年12月湖州市中心医院行胃癌根治术患者80例,男49例,女31例,年龄40~78岁;病理检查结果均为胃腺癌。本研究经湖州市中心医院医学伦理委员会批准,所有患者均签署知情同意书。
1.2 方法
1.2.1 细胞培养及转染 MGC-803细胞置于含有10%FBS的RPMI 1640培养基中,放置在含5%CO2的37℃细胞培养箱中培养。取对数生长期细胞,接种至6孔板,第2天按照Lipofectamine 2000试剂的转染步骤转染细胞,6 h后换液,48 h后用遗传霉素(G418)2 mg/ml筛选4周。qRT-PCR检测转染效果后,得到稳定敲减及过表达BC015134的感染细胞株。细胞株分为敲减对照组(sh-CTRL)、敲减BC015134组(sh-BC015134)、质粒对照组(pcDNA3.1-CTRL)和质粒过表达BC015134组(pcDNA3.1-BC015134)。
1.2.2 BC015134表达水平的检测 采用Trizol试剂提取组织及细胞RNA,cDNA用PrimeScript™RT reagent Kit试剂盒反转录,采用qRT-PCR检测,使用SYBR®Premix Ex Taq™II试剂盒,GAPDH作为内参。所有实验均按照试剂盒说明书步骤进行操作。选用GAPDH作为BC015134的对照基因。GAPDH引物序列:上游:5'-AGAAGGCTGGGGCTCATTTG-3';下游:5'-AGGGGCCATCCACAGTCTTC-3'。BC015134 引物序列:上游:5'-AGGCCCAAGTGTACCAATAAGC-3';下游:5'-TGTTTAATAGACCTCAAAGCCAGAC-3'。采用 2-ΔΔCt定量计算基因表达水平。每组设3个副孔,结果取平均值。
1.2.3 MGC-803细胞侵袭及迁移能力的检测 采用Transwell实验。取1.2.1中各组对数生长期的的MGC-803 细胞,2×104个/孔接种到上层 8 μm Transwell小室中,下层孔板中加入700 μl完全培养基,放入细胞培养箱中培养18 h,取出上层小室用PBS冲洗3遍,4%多聚甲醛固定20 min,结晶紫染液染色15 min,PBS冲洗3遍,小室网筛上面残留的细胞用棉棒擦除,置于显微镜下观察计数穿透至小室筛网下面的细胞数。
1.2.4 富集蛋白的检测及验证 采用RNA pulldown实验。BC015134的正义链和反义链RNA以pBluescriptⅡSK-BC015134质粒为模版进行体外转录,同时进行生物素标记。用RNeasy Mini Kit纯化RNA,定量后-80℃冰箱保存备用。按照Pierce™Magnetic RNAProtein Pulldown Kit试剂盒的步骤进行RNA pulldown实验。对富集蛋白进行凝胶电泳并银染,观察正义链及反义链RNA富集蛋白条带的差异。采用Western blot法对富集蛋白进行验证。
1.2.5 MGC-803细胞中 β-Catenin、N-cadherin、E-cadherin的表达测定 采用Western blot法。MGC-803细胞用PBS漂洗2遍,6孔板每孔加入200 μl RIPA细胞裂解液置冰上裂解30 min,放入低温高速离心机中,8 000 r/min,4℃离心10 min,将蛋白上清液转移至新的离心管中,进行蛋白定量后加入相应体积的蛋白上样缓冲液变性。配置电泳胶,上样后电泳。根据蛋白分子量大小100 V恒压转膜。转膜完毕后放入5%脱脂奶粉中封闭2 h,用PBST冲洗1遍。分别孵育1∶10 000稀释的一抗(β-Catenin、N-cadherin、E-cadherin抗体,兔源)及1∶5 000稀释的二抗(羊抗兔)。将孵育好抗体的膜放入显影托盘中,滴加上适量的ECL显影液,放入化学发光仪中显影,曝光完成后选取最佳曝光时间的图片进行保存,观察不同处理的细胞相关蛋白的表达差异。
1.3 统计学处理 采用GraphPad Prism统计软件。计量资料以表示,多组间比较采用单因素方差分析,两两比较采用LSD-t检验;预后分析采用Pearson χ2检验。采用Kaplan-Meier法绘制生存曲线,生存率的比较采用log-rank检验。P<0.05为差异有统计学意义。
2 结果
2.1 BC015134在胃癌组织中的表达情况 通过GEO数据检索发现编号为GSE50710的芯片数据,该芯片最终筛选得到8条在胃癌和癌旁组织中差异表达的lncRNA。通过临床样本检测发现BC015134在伴有远处转移的胃癌原发灶中表达水平高于不伴有远处转移的表达水平(图1A)。进一步在80对本院标本库中的临床样本上验证发现,高BC015134表达患者预后较差(图1B)。BC015134全长1 142个核苷酸(图1C),通过美国国家生物技术信息中心中的开放阅读框分析,确定了BC015134不具备蛋白编码功能(图1D)。
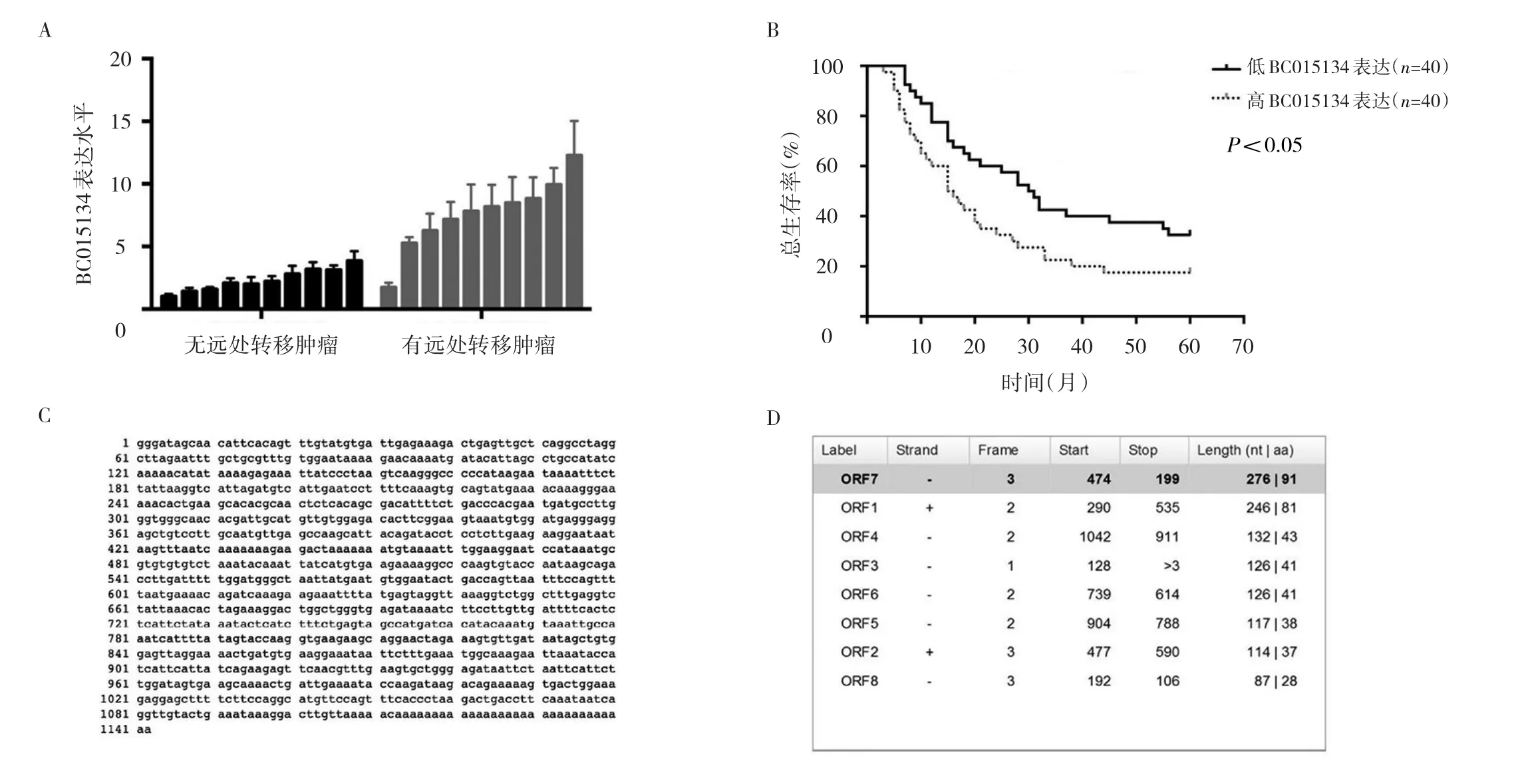
图1 BC015134在胃癌组织中的表达情况(A:BC015134在胃癌原发灶有无远处转移患者中的表达水平;B:高BC015134表达组及低BC015134表达组患者的生存曲线;C:BC015134的全长序列;D:BC015134的开放阅读框分析)
2.2 转染不同质粒后MGC-803细胞BC015134的表达及侵袭迁移能力 敲减BC015134组MGC-803细胞BC015134表达水平较敲减对照组明显较少,质粒过表达BC015134组表达水平较质粒对照组明显增多,差异均有统计学意义(均P<0.01),见图2A(插页)。Transwell实验发现过表达BC015134能够促进MGC-803细胞侵袭及迁移(见图2B,插页),而敲减BC015134能够抑制MGC-803细胞侵袭及迁移(图2C,见插页)。
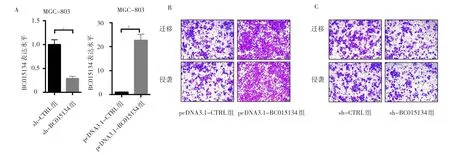
图2 BC015134表达及细胞侵袭迁移图(A:MGC-803细胞中敲减及过表达BC015134后表达水平的比较,aP<0.01,bP<0.001;B:过表达BC015134促进MGC-803细胞侵袭迁移,结晶紫染色,×200;C:敲减BC015134抑制MGC-803细胞侵袭迁移,结晶紫染色,×200)
2.3 富集蛋白的检测及验证 RNA pulldown实验将与BC015134结合的蛋白进行富集(图3A,见插页),发现其潜在结合蛋白β-Catenin。Western blot进一步验证BC015134能够与β-Catenin相互结合(图3B,见插页)。在MGC-803细胞中过表达BC015134,发现β-Catenin的表达水平也相应增加(图3C,见插页),因此证明BC015134通过与β-Catenin相互结合促进其表达。

图3 RNA pulldown及Western blot结果图(A:RNA pulldown实验后蛋白电泳胶进行银染实验结果;B:BC015134与β-Catenin相互结合图;C:过表达BC015134后β-Catenin电泳图)
2.4 MGC-803细胞中β-Catenin、N-cadherin、E-cadherin的表达 Western blot实验发现,MGC-803细胞中过表达β-Catenin后,N-cadherin表达上调,而E-cadherin表达下调,见图4。
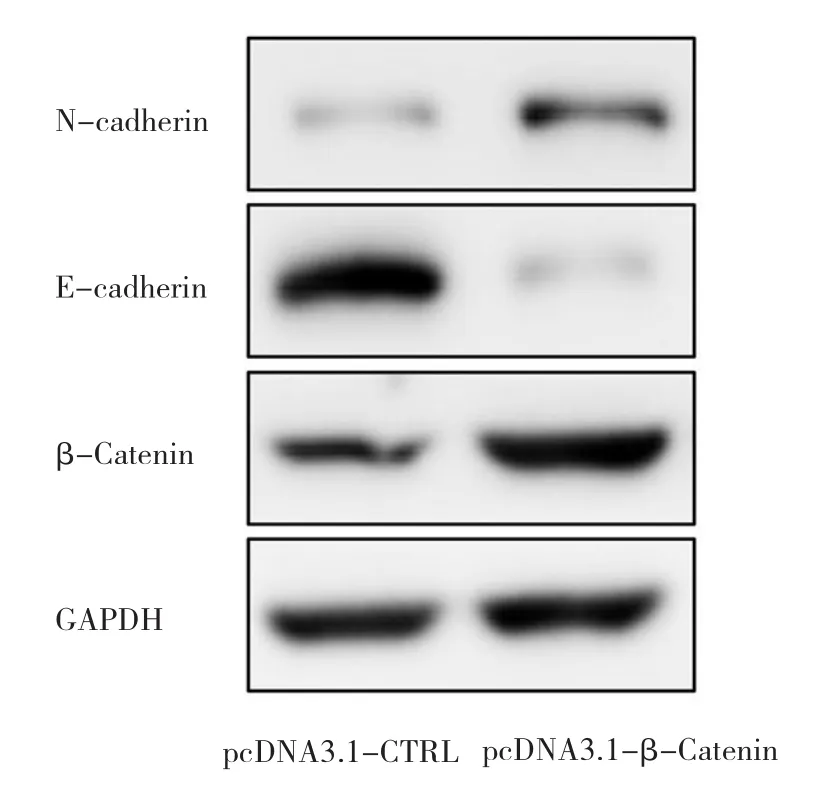
图4 MGC-803细胞中过表达β-Catenin、N-cadherin及E-cadherin的电泳图
3 讨论
胃癌是消化系统最常见的恶性肿瘤,早期发现率低,患者就诊时往往合并淋巴结甚至远处转移,可手术的患者术后也容易发生远处转移[5]。因此寻找调控胃癌转移的分子靶点,探索其中的调控通路是亟需解决的问题。lncRNA在肿瘤发生、发展中的调控作用越来越受到重视,笔者通过检索GEO数据库,筛选出BC015134可能促进胃癌转移的lncRNA。通过临床样本验证,结果发现BC015134在伴有远处转移的胃癌原发灶中表达水平高于不伴有远处转移的胃癌原发灶中表达水平,且高BC015134表达的患者预后较差,这提示BC015134可能具有促进胃癌细胞转移的作用。进一步研究发现,BC015134能够促进胃癌细胞的侵袭迁移。以往的研究表明,lncRNA能够与蛋白、mRNA、microRNA等相互作用发挥调节功能,而其中最重要的就是与蛋白相互作用[9]。那么BC015134是否能与蛋白相互作用促进胃癌细胞转移呢?有研究发现β-Catenin在促进肿瘤转移方面发挥了非常重要的作用[14-16]。主要因为β-Catenin能够通过调节上皮间质转化促进肿瘤细胞转移[17]。因此笔者推测BC015134是否能够与β-Catenin相互结合促进胃癌转移,通过RNA pulldown实验结合Western blot实验,笔者发现BC015134确实能够与β-Catenin相互结合并进一步促进β-Catenin的表达。以往的研究表明,β-Catenin通过调节N-cadherin及E-cadherin的表达调控细胞的上皮间质转化过程,从而促进肿瘤细胞转移[14]。因此笔者在胃癌细胞中过表达β-Catenin后发现其确实发生了上皮间质转化。笔者考虑BC015134通过与β-Catenin相互结合促进β-Catenin入核,进而调控N-cadherin及E-cadherin的表达从而促进胃癌细胞发生上皮间质转化,最终促进胃癌细胞转移。那么BC015134是否能促进β-Catenin入核以及具体是如何促进β-Catenin入核的问题需要进一步探讨,笔者在后续的实验中将会进行深入的研究。
综上所述,BC015134在胃癌中高表达,其高表达提示患者预后较差。BC015134通过与β-Catenin相互结合诱导胃癌细胞发生上皮间质转化,从而促进胃癌细胞转移。BC015134有望成为胃癌诊断和治疗的新靶点。

