可降解甲壳素/壳聚糖支架联合GMSCs来源外泌体对大鼠坐骨神经损伤的修复作用研究
郑佳欣 李晓飞
坐骨神经损伤多见于患者受到直接暴力,是临床上常见的周围神经损伤。此类患者往往因缺乏有效治疗导致残疾,给家庭和社会带来沉重负担[1]。目前对于坐骨神经损伤主要采用手术治疗。修复周围神经损伤的手术方法很多,大面积损伤常采用端对端吻合,但是外伤造成的长时间周围神经缺损,通常需要移植物来填补缺口[2]。尽管自体神经移植仍然是周围神经损伤的首选治疗策略,但也存在各种问题,比如神经供体组织的来源、神经是否可以存活。周围神经损伤的修复是一个非常复杂的病理过程,由于神经再生缓慢、沃勒变性、组织粘连、肌肉和运动终板萎缩等原因,很难取得满意的效果[3]。所以,开发新的治疗策略来加速神经突起的生长是非常重要的。既往研究表明,间充质干细胞(mesenchymal stem cells,MSCs)多用于治疗组织再生和自身免疫性疾病,细胞生长因子可以作为旁分泌或自分泌介质来调节免疫反应和组织再生[4]。外泌体是由活细胞分泌的细胞外囊泡,通过多泡体和细胞质膜的融合释放到细胞外空间,直径为30~150 nm,与病毒大小相似。牙龈间充质干细胞(gingival mesenchymal stem cells,GMSCs)是可从牙龈组织中分离的干细胞特异性前体细胞,具有自我更新、多向分化和免疫调节能力。与骨髓来源的MSCs相比,GMSCs易于分离、同质化,增殖速度更快,形态稳定,并且在长期培养后也能保持正常的核型和MSCs特征[5-6]。然而,GMSCs来源的外泌体是否能够促进周围神经再生的相关报道较少。笔者采用可降解甲壳素/壳聚糖支架联合GMSCs来源外泌体,观察其对坐骨神经损伤的修复作用,以期为临床上周围神经损伤患者的康复提供依据。
1 材料和方法
1.1 GMSCs
1.1.1 来源 选取2020年1月至2021年12月收治金华市中心医院4名健康志愿者,其中男2例,女2例,年龄22~32岁。在拔除智齿过程中收集1 mg牙龈组织进行实验。纳入标准:(1)没有牙周病史;(2)无出血性疾病;(3)签署知情同意书。排除标准:(1)牙龈发炎或者感染的患者;(2)不同意手术方案的患者。本研究经本院医学伦理委员会批准[(研)2020-121-09]。
1.1.2 GMSCs收集和培养 收集的牙龈组织进行无菌处理,用PBS清洗3次,并在含有2 mg/ml胰蛋白酶的培养基中培养2 h。终止消化后,分离上皮层和固有层,收集固有层并切碎,在37℃下用胶原酶消化1 h,1 000 r/min离心10 min,离心半径为10 cm,取上清液备用;加入含有10%FBS和100 U/ml青霉素+链霉素的DMEM培养基将沉淀物制备成细胞悬液,然后接种培养在细胞培养皿中,于37℃、5%CO2的增湿细胞培养箱中培养24 h。弃原始培养基,去除漂浮细胞。加入含10%FBS的DMEM培养基,每2 d更换1次培养基。当细胞融合率达到80%时,用胰蛋白酶消化细胞进行连续传代。第3~5代细胞用于实验。
1.1.3 GMSCs鉴定 采用流式细胞仪鉴定原代GM-SCs,将2×105个/ml的GMSCs与异硫氰酸荧光素(fluorescein isothiocyanate,FITC)或藻红蛋白(phycoerythrin,PE)的特异性单克隆抗体相结合,在4℃避光培养箱中孵育30 min。采用流式细胞仪分析目的细胞表面抗原,其中抗CD34(PE)抗体、CD45(PE)抗体、CD73(FITC)抗体、CD90(FITC)和CD146(FITC)作为阳性检测组,小鼠单克隆IgG1同型作为对照组。通过观察CD34、CD45、CD73、CD90和CD146的阳性率来确定细胞类型。
1.2 实验动物和材料 选择24只SPF级SD大鼠,鼠龄4~6(5.22±1.34)周,体重287~399(343±56)g,购自浙江省中医药大学实验动物中心[许可证号:SCXK(浙)2021-1009];饲养于金华市实验动物中心[使用许可证号:SYXK(浙)2021-0024]。饲养环境为(22±2)℃、50%~60%湿度、12 h明暗交替的环境中适应性饲养1周,期间自由饮水进食。DMEM培养液(批号:10829018,500 ml)购自美国Gibco公司;Trizol试剂(批号:10296028,100 ml)和荧光定量PCR试剂盒(批号:KK4611,10 ml)均购自日本TaKaRa公司;CD34(PE)抗体、CD45(PE)抗体、CD73(FITC)抗体、CD90(FITC)和CD146(FITC)(批号:ab187284、ab134202、ab239246、ab124527、ab78451,100 μl)均购自美国 Abcam 公司。科赛格外泌体试剂盒(批号:CSB-EI0110,10T)购自武汉华美生物工程有限公司。兔抗鼠CD63、CD9、CD81和GAPDH一抗(批号:10628D、10626D、MA5-32333、MA5-15738,100 μl)、辣根过氧化物酶标记的山羊抗鼠IgG二抗(批号:MA5-42729,100μl)购自北京赛默飞公司。马尔文Nanosight纳米颗粒追踪分析仪购自英国马尔文帕钠科公司,型号为NanoSight LM10;流式细胞仪购自德国Partec公司,型号为CyFlow®Cube 6;CatWalk XT 9.0步态分析仪购自诺达思(北京)信息技术有限责任公司。
1.3 GMSCs来源外泌体提取和鉴定
1.3.1 外泌体提取 利用CUSABIO外泌体试剂盒提取GMSCs细胞上清液中的外泌体。取1.1.2中的上清液,超速离心,去除杂质。按照说明书的要求,加入试剂A和试剂B,850 r/min离心1 min,离心半径为10 cm,加入1 000 μl试剂 E,850 r/min离心 1 min,离心半径为10 cm,吸去液体,保留沉淀物;重复此步骤2次,加入400 μl试剂F,水平混合仪室温洗脱10 min,同上法离心得到沉淀物即为提取外泌体样本,于-80℃冰箱中保存备用。
1.3.2 外泌体囊泡观察 采用透射电子显微镜(transmission electron microscope,TEM)观察。在外泌体样本中加入100 μl PBS重新悬浮外泌体,取30 μl外泌体悬液,置于载样铜网上,室温下静置3 min,加入3%磷钨酸溶液30 μl进行染色,5 min后弃去染色液,室温下静置于铜网干燥,采用TEM观察外泌体囊泡结构,并采用马尔文Nanosight纳米颗粒追踪分析仪分析外泌体囊泡直径分布。
1.3.3 外泌体标志蛋白CD63、CD9、CD81检测 采用Western blot法。取100 μl外泌体悬液于EP管,置于冰上预冷,采用RIPA裂解液提取总蛋白。采用BCA蛋白浓度测定试剂盒测定蛋白浓度,调整蛋白上样量为30 μg,采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)分离蛋白。电泳结束后,采用电转移的方式将凝胶上的蛋白转到聚偏氟乙烯膜。将膜浸入封闭液中,在室温下放置在摇床上封闭2 h;加入兔抗鼠CD63、CD9、CD81和GAPDH一抗,抗体稀释比例为1∶10 000,4℃过夜孵育;用TBST缓冲液洗膜3次,5 min/次;加入辣根过氧化物酶标记的山羊抗鼠IgG二抗,抗体稀释比例为1∶2 000,室温避光孵育10 min;用TBST缓冲液洗膜3次,5 min/次;加入Supersignal west femto最大灵敏度底物,于凝胶成像分析系统显影并拍照。
1.4 可降解甲壳素/壳聚糖支架制备 委托江西中洪博元生物试剂有限公司制备可降解甲壳素/壳聚糖支架,购买制备专利(专利号:ZL01136314)后,按照说明书制备。将虾蟹壳50 g置于2 000 ml的烧瓶中,然后加入盐酸1 000 ml,水浴锅中40℃浸泡,直至无气泡产生,收集虾蟹壳后,中性水冲洗,直至pH值为中性;然后将虾蟹壳置于2 000 ml的烧瓶中,加入50%氢氧化钠1 000 ml,水浴锅中加热4 h,温度控制在90℃,收集虾蟹壳后,中性水冲洗,直至pH值为中性,随后加入5%高锰酸钾浸泡30 min脱色,脱色后中性水冲洗,直至pH值为中性,沉淀物为甲壳素。称取5 g甲壳素置于烧瓶中,再加入50%氢氧化钠500 ml,烧瓶中110℃回流1 h后即可脱乙酰基,然后中性水冲洗,直至pH值为中性,烘干后可得壳聚糖,根据说明书制备可降解甲壳素/壳聚糖支架凝胶以备用,用于后续实验。
1.5 动物模型构建和分组
1.5.1 动物模型构建 24只SD大鼠均构建动物模型,腹腔注射戊巴比妥钠30 mg/kg麻醉,然后右后肢备皮,钝性分离股二头肌和半腱肌、半膜肌,暴露坐骨神经,用4.0铬制羊肠线结扎4道,每道间距1 mm,松紧度以结扎线恰可上下活动为准。坐骨神经损伤模型制备完成,用于后续实验。
1.5.2 分组 将24只坐骨神经损伤模型大鼠采用随机数字表法分为支架组、支架+外泌体组、自体移植组3组,每组各8只。支架组在坐骨神经损伤部分加入单纯甲壳素/壳聚糖支架凝胶,铺满切口为止,然后逐层缝合;支架+外泌体组在坐骨神经损伤部分加入可降解甲壳素/壳聚糖支架+外泌体凝胶复合物,铺满切口为止,然后逐层缝合;自体移植组采用自体移植的坐骨神经组织进行治疗,具体操作:将切除的自体坐骨神经在手术显微镜下翻转,以9-0缝合线缝合神经外膜两断端,每端各缝合8针,逐层缝合肌肉和皮肤,手术区置入少量青霉素粉,然后待大鼠自然苏醒。手术后,所有大鼠均存活,切口均在术后6~9 d愈合。
1.6 运动功能评估 采用CatWalk XT 9.0步态分析系统评估大鼠术后1、4和8周的运动功能恢复情况,采用坐骨神经功能指数(sciatic nerve function index,SFI)定量测定坐骨神经功能,其中SFI=0为正常,-100为完全损伤。
1.7 组织学评估 术后8周评估运动功能后采用脊椎脱臼法处死各组大鼠,然后收集大鼠的神经组织样本以及双侧腓肠肌进行以下实验。
1.7.1 大体组织和再生神经组织样本观察 处死大鼠后取出再生神经组织样本,大体组织在直视下观察。将大鼠的再生神经组织用2.5%戊二醛固定2 h,1%锇酸染色,丙酮梯度脱水,制备石蜡组织块,切成700 nm厚的半薄切片和70 nm厚的超薄切片。700 nm厚的半薄切片用1%甲苯胺蓝染色,避光孵育20 min,用光镜观察;70 nm厚的超薄切片用醋酸铀酰和柠檬酸铅进行染色并用TEM观察。使用Image Pro Plus软件测量有髓轴突密度、有髓轴突直径和髓鞘厚度。
1.7.2 坐骨神经支配的肌肉重量和肌纤维重塑评估处死大鼠后取双侧腓肠肌,称重并用主要含有甲醛、冰醋酸和无水乙醇的肌肉组织固定剂固定24 h。石蜡包埋切片(厚7 mm),Masson三色染色。光学显微镜下用Image Pro Plus软件进行定量分析。计算腓肠肌湿重比,腓肠肌湿重比=手术侧/正常侧×100%。肌纤维横截面积计算采用坐标格的描纸法。
1.8 统计学处理 采用SPSS 16.0统计软件。计量资料以表示,多组间比较采用单因素方差分析,两两比较采用SNK-q检验;计数资料以例(%)表示,组间比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 GMSCs的培养和鉴定 流式细胞仪测定GMSCs细胞标志物包括CD73(87.2%)、CD90(98.2%)和CD146(63.0%)呈阳性,而CD34(1.8%)和CD45(3.0%)呈阴性,见图1。
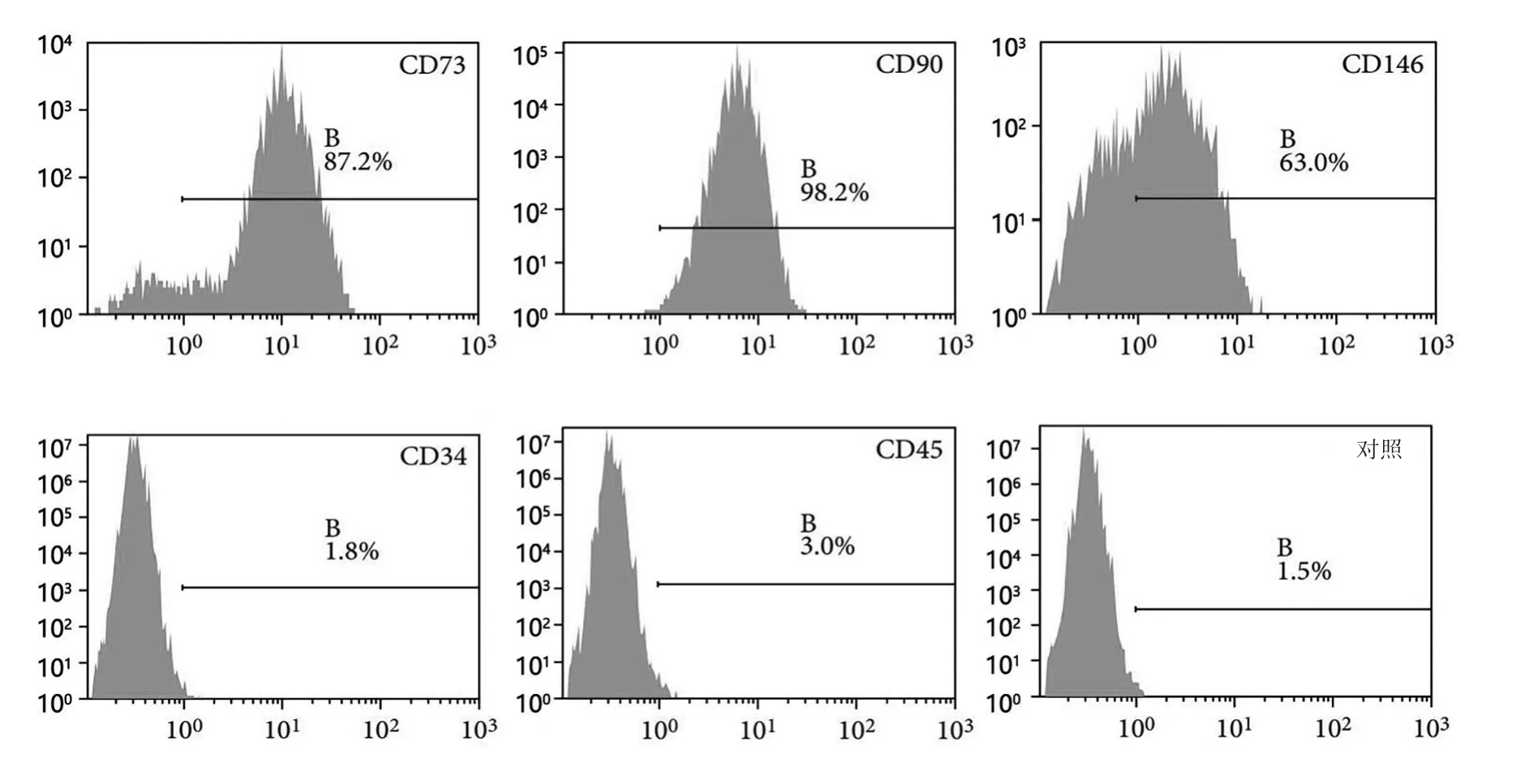
图1 GMSCs鉴定的流式细胞图
2.2 GMSCs来源外泌体收集和鉴定 TEM检查显示外泌体囊泡结构呈圆形结构。马尔文Nanosight纳米颗粒追踪分析仪测量外泌体囊泡直径峰值为102 nm。Western blot法分析显示,外泌体标志蛋白CD9和CD63呈阳性。见图2。
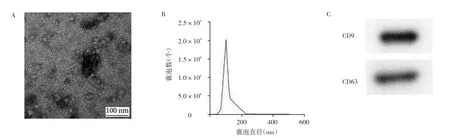
图2 GMSCs来源外泌体收集和鉴定结果(A:外泌体囊泡结构的TEM图,×600;B:外泌体囊泡直径分布图;C:外泌体标志蛋白的电泳图)
2.3 3组大鼠术后1、4、8周SFI的比较 3组大鼠术后1周SFI比较差异无统计学意义(F=2.784,P>0.05),但术后4、8周SFI比较差异均有统计学意义(F=18.904、19.237,均P<0.05);进一步比较发现,术后4、8周支架+外泌体组的SFI明显高于支架组(q=3.278、3.291,均P<0.05),而自体移植组术后4、8周SFI明显高于支架+外泌体组和支架组(q=3.074、2.971、3.209、2.943,均P<0.05)。见表1。
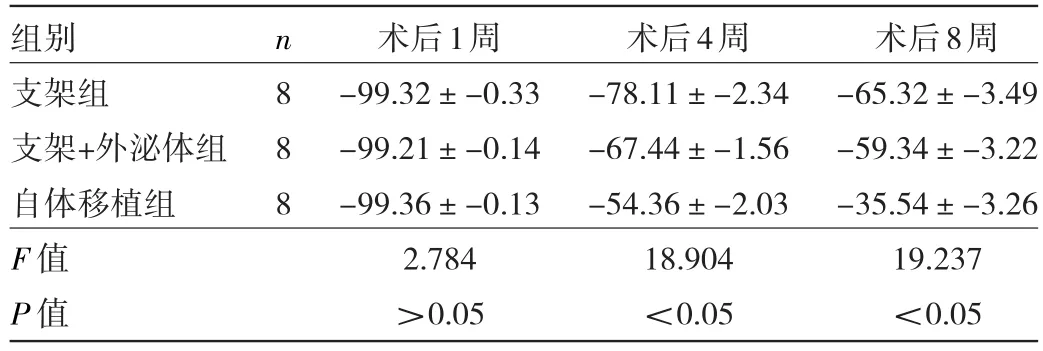
表1 3组大鼠术后1、4、8周SFI的比较
2.4 对再生坐骨神经的组织学评估结果 与支架组比较,自体移植组和支架+外泌体组的再生神经组织较为粗大,有髓神经纤维形成明显规则,且数量多,有髓轴突密度、有髓轴突直径和髓鞘厚度均明显增高,差异均有统计学意义(F=16.027、15.584、12.507,均P<0.05)。此外,支架+外泌体组有髓轴突密度、有髓轴突直径和髓鞘厚度均明显高于支架组(q=3.944、4.332、4.905,均P<0.05)。而支架组和支架+外泌体组的有髓轴突密度、有髓轴突直径和髓鞘厚度均明显低于自体移植组(q=3.094、2.884,3.904、3.224、3.981、3.004,均P<0.05)。见图3(插页)、表2。
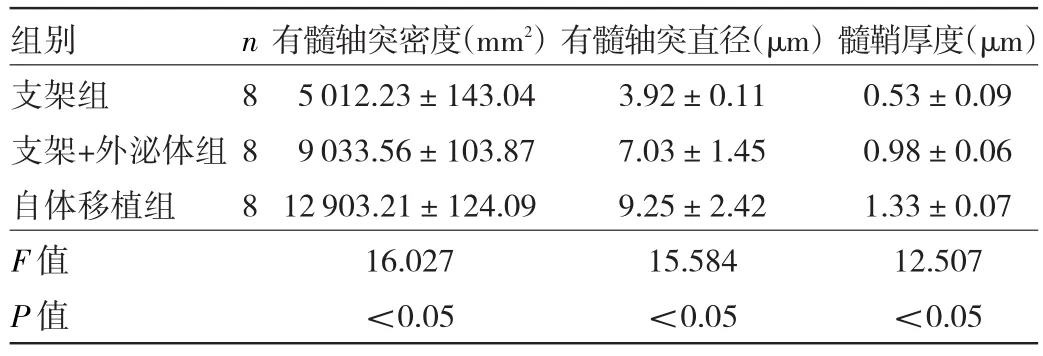
表2 3组大鼠有髓轴突密度、有髓轴突直径和髓鞘厚度的比较
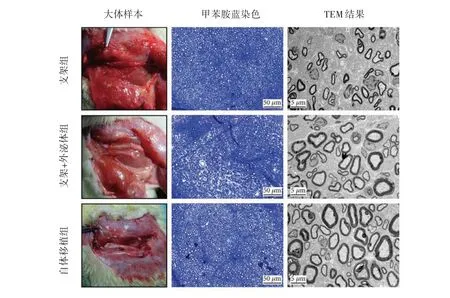
图3 再生坐骨神经的大体样本(×10)、甲苯胺蓝染色(×100)和TEM(×600)所见
2.5 腓肠肌的组织学检测结果 Masson染色结果显示,相较于支架组,支架+外泌体组的腓肠肌组织更紧密,自体移植组腓肠肌组织肌间隙明显。支架+外泌体组的腓肠肌湿重比和肌纤维横截面积明显高于支架组(q=3.902、3.228,均P<0.05),自体移植组的腓肠肌湿重比和肌纤维横截面积明显高于支架组和支架+外泌体组(q=5.413、4.149、3.227、3.278,均 P<0.05)。见图4(插页)、表3。

表3 3组大鼠腓肠肌湿重比和肌纤维横截面积的比较
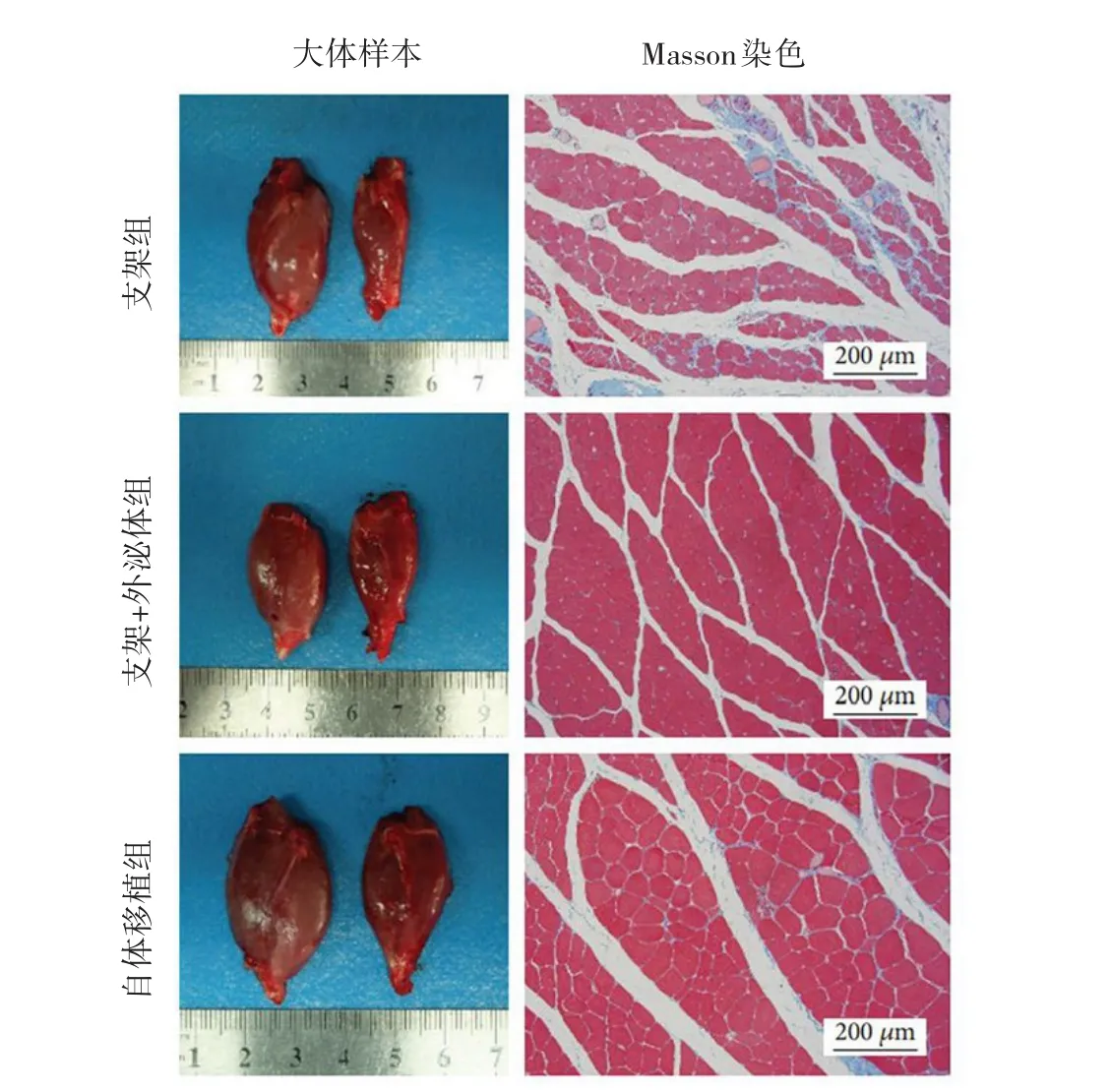
图4 腓肠肌的大体样本和Masson 染色所见
3 讨论
既往研究表明,自体神经移植仍是修复周围神经缺损的最佳方案,然而,神经供体来源有限以及手术技术的限制,所以有必要找到替代这种技术的方法。局部植入干细胞治疗周围神经损伤可促进轴突再生和髓鞘形成。在修复过程中,干细胞分泌多种因子,如成纤维细胞生长因子、神经生长因子、睫状神经营养因子和脑源性神经营养因子,对神经细胞存活和神经再生具有积极作用[7]。既往研究表明,干细胞介导组织修复的主要机制是旁分泌,而不是干细胞的分化[8]。并且,干细胞的旁分泌功能可以通过外泌体介导,作为一种新的替代方法,外泌体具有替代全细胞治疗的巨大潜力。干细胞分泌的外泌体传递各种分子,包括细胞因子、生长因子、信号脂质、mRNA和微小RNA。外泌体作为细胞间通讯介质,传递蛋白质、脂质和RNA以调节各种生理和病理过程。此外,外泌体的应用被证明比干细胞给药更安全,干细胞给药可以克服细胞免疫排斥和致癌突变。众所周知,牙龈组织在受伤后会很快愈合,而由于GMSCs的功能,瘢痕很少。这些细胞有许多优点,包括均质、非肿瘤、易于分离和表型稳定[9-10]。在本研究中,笔者成功地从人牙龈组织中分离出GMSCs,可以表达特异性表面抗原,包括CD73、CD90和CD146,但不表达造血干细胞的表面抗原,如CD34和CD45。既往研究表明,GMSCs移植可以用于周围神经损伤后再生。Lai等[11]和Court等[12]提出,外泌体可能调节中枢神经系统中的神经轴突生长。然而,GMSCs衍生的外泌体被研究用于周围神经缺损的报道较少。本研究还成功地从GMSCs中分离和鉴定了外泌体。
在既往研究中,有学者探究可降解甲壳素/壳聚糖支架对周围神经缺损的修复效果,结果发现对于10 mm神经缺损的修复中,可降解甲壳素/壳聚糖支架的修复效果很差[13-14]。本研究在此基础上,使用可降解甲壳素/壳聚糖支架结合来源于GMSCs的外体修复大鼠10 mm周围神经缺损。具体支架性状如下:可降解甲壳素/壳聚糖支架为凝胶状态,可以吸附外泌体,吸附效率可达90%以上,支架与外泌体结合后,可以缓慢释放外泌体,支架本身属于可降解材料,不会阻碍神经断端的修复,生物兼容性好,不会产生排斥反应。本研究结果表明,术后8周,GMSCs分泌的外泌体不仅增加了再生轴突的有髓轴突密度和直径,而且增加了再生轴突的髓鞘厚度,这与体外研究结果一致。同时,步态分析也用于评估大鼠神经肌肉功能的恢复。本研究术后4周和8周,与支架组相比,外泌体+支架组的SFI有所改善。在本研究中,术后8周,肌肉组织学数据显示,与支架组相比,外泌体+支架组的腓肠肌湿重比和肌纤维横截面积增加,表明神经肌肉功能的恢复有所改善,间接验证了步态分析的结果。
综上所述,可降解甲壳素/壳聚糖支架联合GMSCs来源外泌体可以对鼠坐骨神经损伤模型起到一定的修复效果。但是,本研究尚存在一定的局限性,即牙龈干细胞分泌的外泌体如何发挥作用。Kou等[15]发现,GMSCs分泌的外泌体具有更多的蛋白质含量,包括可抑制IL-1RA功能的细胞因子,该研究认为外泌体中IL-1RA起到重要作用。因此,后续的研究也会对GMSCs分泌的外泌体成分进行深入探讨。

