甜瓜果实发育相关SWEET糖转运蛋白基因的鉴定与功能初步分析
李苹芳,姚协丰,徐锦华,朱凌丽,羊杏平
(1.浙江开放大学 教学中心农学教研部, 浙江 杭州 310012; 2.江苏省高效园艺作物遗传改良重点实验室,江苏省农业科学院 蔬菜研究所, 江苏 南京 210014)
碳水化合物是植物光合作用的主要产物,也是植物生命活动包括果实生长发育的基础物质,其运输关系到光合产物在植物不同器官之间的分配与转运。在果实发育过程中,蔗糖等同化物在源叶中合成,经韧皮部运输,以共质体或质外体途径转运到果实中。与共质体途径不同的是,在糖的质外体装载及卸载过程中,需要依靠特定糖转运蛋白,通过膜的主动运输进出细胞,如单糖转运蛋白(monosaccharide transporters, MST)、蔗糖转运蛋白(sucrose transporters, SUT),以及最新发现的糖外排转运蛋白(sugars will eventually be exported transporters,SWEET)等[1-3]。已有对番茄、葡萄、枣、苹果、黄瓜和西瓜等作物的研究表明,果实发育时期部分或全程采用质外体途径进行糖分卸载[4-8],即糖转运蛋白在果实内糖分卸载与积累中发挥重要作用,然而目前对于果实发育过程中糖转运蛋白基因的鉴定及如何参与其中发挥转运作用还知之甚少。
SWEET糖转运蛋白是2010年Chen等[1]运用荧光共振能量转移传器技术(fluorescence resonance energy transfer, FRET sensor)从拟南芥(Arabidopsisthaliana)中鉴定出的一类新的运输葡萄糖和其他寡糖的蛋白。不同于蔗糖转运子这类蛋白,SWEET糖转运蛋白利用细胞内外糖浓度梯度进行跨膜转运,它不依赖于细胞膜上的质子梯度,其糖转运活性也不依赖于环境pH值; 且具有双向转运糖类功能,即顺浓度梯度从胞内向胞外运输糖分或将糖分从胞外运输到胞内[1]。在结构上,SWEET糖转运蛋白属于MtN3/saliva蛋白家族,大多数预测MtN3/saliva蛋白由7个跨膜螺旋组成,包含2个MtN3/saliva结构域[1,9]。自Chen等[1]报道拟南芥AtSWEET11、AtSWEET12 蛋白的蔗糖输出作用以来, 已从水稻、番茄和葡萄等多种植物中鉴定发现众多SWEET蛋白具有糖转运功能[4,10-11]。虽然SWEET发现并不久,但已发现其参与了配子体育性、植株发育、衰老、耐性胁迫、植物-病原菌互作、果实发育等多个植物生理过程[12-20]。
甜瓜是一种重要的夏令水果,目前甜瓜中SWEET的研究鲜有报道。为探究甜瓜果实发育过程中SWEET糖转运蛋白的作用,本研究从甜瓜基因组中鉴定获得18个SWEETs糖转运蛋白基因,进一步筛选在果实发育全程或某个时期表达量较高的基因。然后通过构建携带GFP载体的融合基因,运用激光共聚焦观察,获得这些基因的定位。并通过酵母表达研究这些基因在体外是否具有转运葡萄糖和果糖的功能,以期为揭示SWEET糖转运蛋白在甜瓜果实发育过程的调控作用奠定基础,从分子水平上探明果实糖分、风味等甜瓜品质形成的内在机理。
1 材料与方法
1.1 试验材料
植物材料选用甜瓜Vedrantais品种。甜瓜生长条件为白天25~28 ℃,晚上18~20 ℃。先在穴盘内播种,10 d后移栽到体积为65 L,直径为55 cm,高度为34 cm的盆内,每3株种在一个盆内。基质为草炭∶沙∶火山岩=6∶3∶1(体积比)。
1.2 试验方法
1.2.1 甜瓜SWEETs基因家族生物信息学分析
以拟南芥SWEETs氨基酸序列作为种子序列在甜瓜基因组数据库中搜索得到同源序列21条,根据拟南芥名字进行命名。利用软件TMHMM(http://www.cbs.dtu.dk/services/TMHMM/)对甜瓜21条SWEETs序列进行跨膜结构预测,并在DNASTAR中进行氨基酸、分子量、等电点的预测。利用Mega6.0对甜瓜、拟南芥、水稻SWEET氨基酸序列采用邻接法(NJ, Neighbor-Jointing)构建系统进化树,Bootstrap设置为1 000次。
1.2.2 RNA提取和RT-PCR
选取甜瓜根、茎、叶、花、不同发育阶段(0、5、10、20、30、40 d)果实进行RNA提取,RNA的提取使用TRIZOL试剂(Invitrogen公司,Carlsbad, CA, USA)。提取后,总RNA溶解在经焦碳酸二乙酯处理的水中。采用相同量的RNA进行反转录,反转录使用RevertAidTM第一链cDNA合成试剂盒(Fermentas, USA)进行PCR,所用引物见表1。
1.2.3 实时荧光定量(quantitative real-time PCR,qPCR)
选取授粉0、5、10、20、30、40 d的果实维管束部位进行总RNA提取,并进行反转录合成cDNA,采用qPCR对CmSWEET3,CmSWEET7a和CmSWEET17c进行扩增,以3个不同果实样品作为3次生物学重复。每个反应(总容积20 μL)由10 μL iQ SYBR Green Supermix、1 μL稀释cDNA、0.1 μmol·L-1正向和反向引物组成。PCR循环条件如下:95 ℃循环3 min,40个循环,95 ℃循环10 s,58 ℃循环45 s。甜瓜Actin7(XM_008442791)作为内参基因。基因表达的计算采用2-ΔΔCT[21]。
1.2.4CmSWEET3,CmSWEET7a,CmSWEET17c开放阅读框的克隆
根据甜瓜基因组数据库或EST库查找CmSWEET3、CmSWEET7a、CmSWEET17c的序列,分别使用引物TOPO-SWEET3-F/R、TOPO-SWEET7a-F/R、TOPO-SWEET17c-F/R进行克隆入pENTRTM/D-TOPO载体(Invitrogen)(引物序列见表1)。获得序列正确的pENTRTM/D-TOPO克隆后用Gateway®LR ClonaseTMⅡ enzyme mix(Invitrogen)克隆入终载体pMDC83和pMDC43,分别获得GFP在C末端和N末端的蛋白。LR反应体系为:150 ng入门克隆(entry clone),150 ng目的载体(destination vector),LR酶混合液0.5 μL,总体积2.5 μL。
1.2.5 本氏烟浸润法表达重组蛋白
用无菌牙签挑取含目的基因的农杆菌克隆和沉默抑制子P19分别置入2 mL的含有抗生素的YEP液体培养基(25 μg·mL-1Rif,50 μg·mL-1Amp,50 μg·mL-1Strep,50 μg·mL-1Km)中,30 ℃,振荡培养过夜;将过夜培养物加入50 mL 含有抗生素的YEP液体培养基中(Rif 25 μg·mL-1,Amp 50 μg·mL-1,Strep50 μg·mL-1,Km 50 μg·mL-1),30 ℃,过夜振荡培养;20 ℃,4 000 r·min-1,离心15 min,收集菌体;将菌体用转化缓冲液(10 mmol·L-1MES,10 mmol·L-1MgCl2,200 μmol·L-1乙酰丁香酮)混匀,调整D600,含目的基因的农杆菌调至0.3~0.5,P19调至0.8~1.0,室温静置3 h,然后将两种菌液按1∶1混合,用1 mL注射器注射入一个月大小的本氏烟叶片背面。72 h后采用激光共聚焦观察GFP。
1.2.6 酵母表达实验
将CmSWEET3和CmSWEET7aCDS 分别利用引物NEV-SWEET7a-F/R、NEV-SWEET3-F/R(引物序列见表1)克隆到酵母表达载体NEV-N载体中,再转化入己糖与转化酶缺失突变酵母CSY4000菌株中。挑取包含目的基因的酵母菌落,于CAA培养基中过夜培养至D值为2.0,并按照8倍的浓度依次稀释,各浓度取2 μL,点于以葡萄糖(glucose)、果糖(fructose)、麦芽糖(maltose)、蔗糖(sucrose)为糖原的CAA培养基上于29 ℃进行培养,3 d后拍照。
2 结果与分析
2.1 甜瓜SWEETs家族基因的生物信息学分析
进入http://pfam.xfam.org/网站搜索SWEETs家族基因的hmmer文件,对甜瓜基因组数据库(CucumismeloL. cv. DHL92 v3.6.1)进行搜索,本试验共得到21条蛋白序列。经过SMART和NCBI-CD 人工筛选删除了3条过短的蛋白序列,得到18条符合条件的序列。以拟南芥同源序列名字进行命名为CmSWEET1~CmSWEET17(表2),并用ExPASy (http://web.expasy.org/protparam/) 进行蛋白分子量分析,以及用SMART(http://smart.embl.de/)进行蛋白结构预测和跨膜区域预测。如表2所示,18条基因所表达的蛋白序列长度在151~297个氨基酸,分子量在19.5~33.3 ku,等电点在6.44~9.66。经软件预测,绝大部分甜瓜SWEET家族成员N端包含5~7个跨膜结构域,个别可能由于拼接问题,序列不完整,含有2个或4个跨膜结构域,如CmSWEET17d。
2.2 甜瓜SWEETs家族基因的进化树分析
为研究甜瓜SWEETs家族基因与水稻、黄瓜、番茄之间的进化关系,用ClustalW对甜瓜、水稻、黄瓜、番茄5个作物的SWEETs家族基因蛋白质序列进行多序列比对,并使用Neighbor-Joining方法建树(图1)。根据Anjali等[22]最新综述,将SWEETs分为3个类型,甜瓜SWEETs序列中属于类型Ⅰ有2个,包括CmSWEET1、CmSWEET3;类型Ⅱ有6个,包括CmSWEET5a、CmSWEET5b、CmSWEET5c、CmSWEET7a、CmSWEET7b、CmSWEET17d;类型Ⅲ有10个,包括CmSWEET9a、CmSWEET9b、CmSWEET10、CmSWEET12a、CmSWEET12b、CmSWEET12c、CmSWEET15、CmSWEET17a、CmSWEET17b、CmSWEET17c。
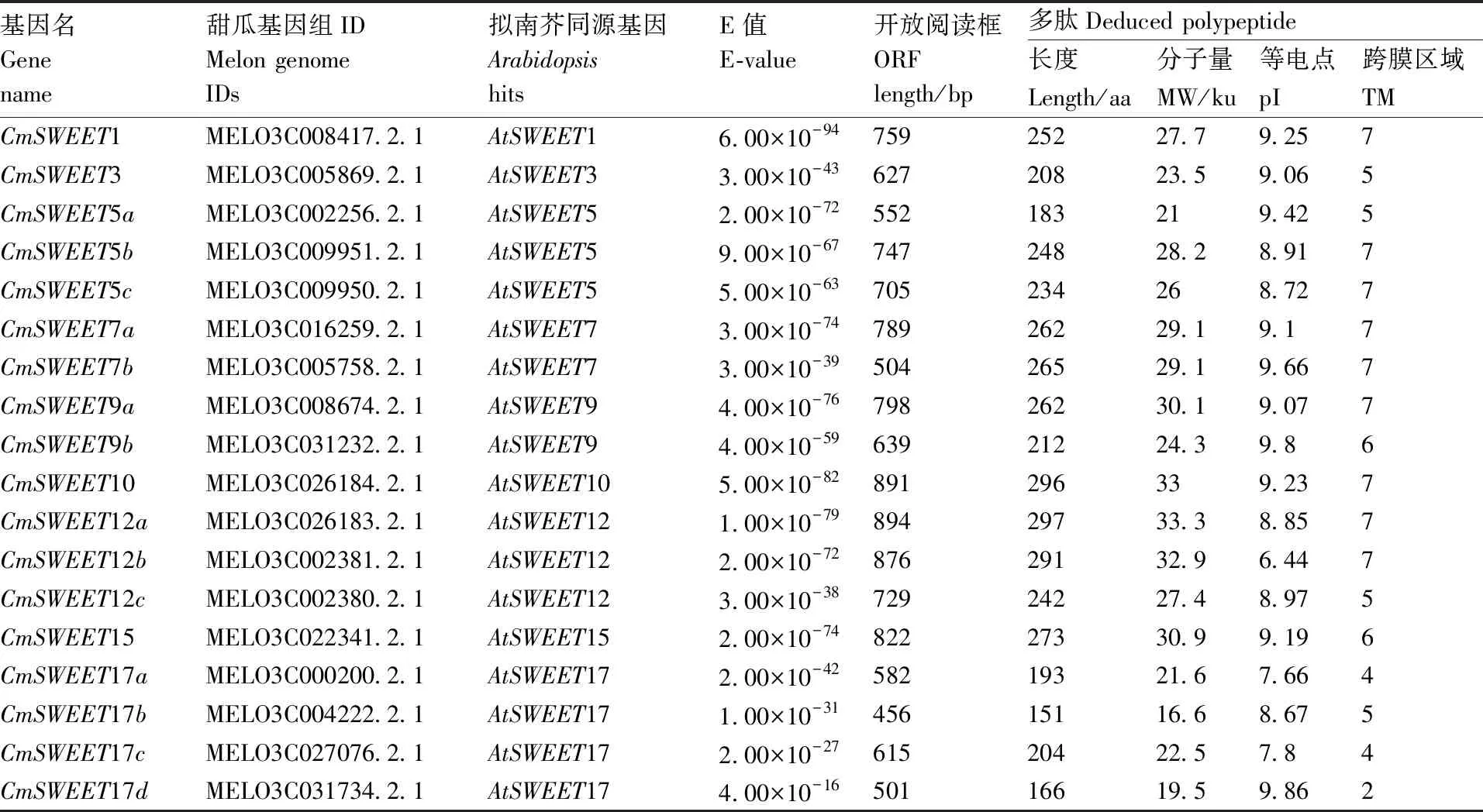
表2 甜瓜SWEETs家族基因的生物信息学分析
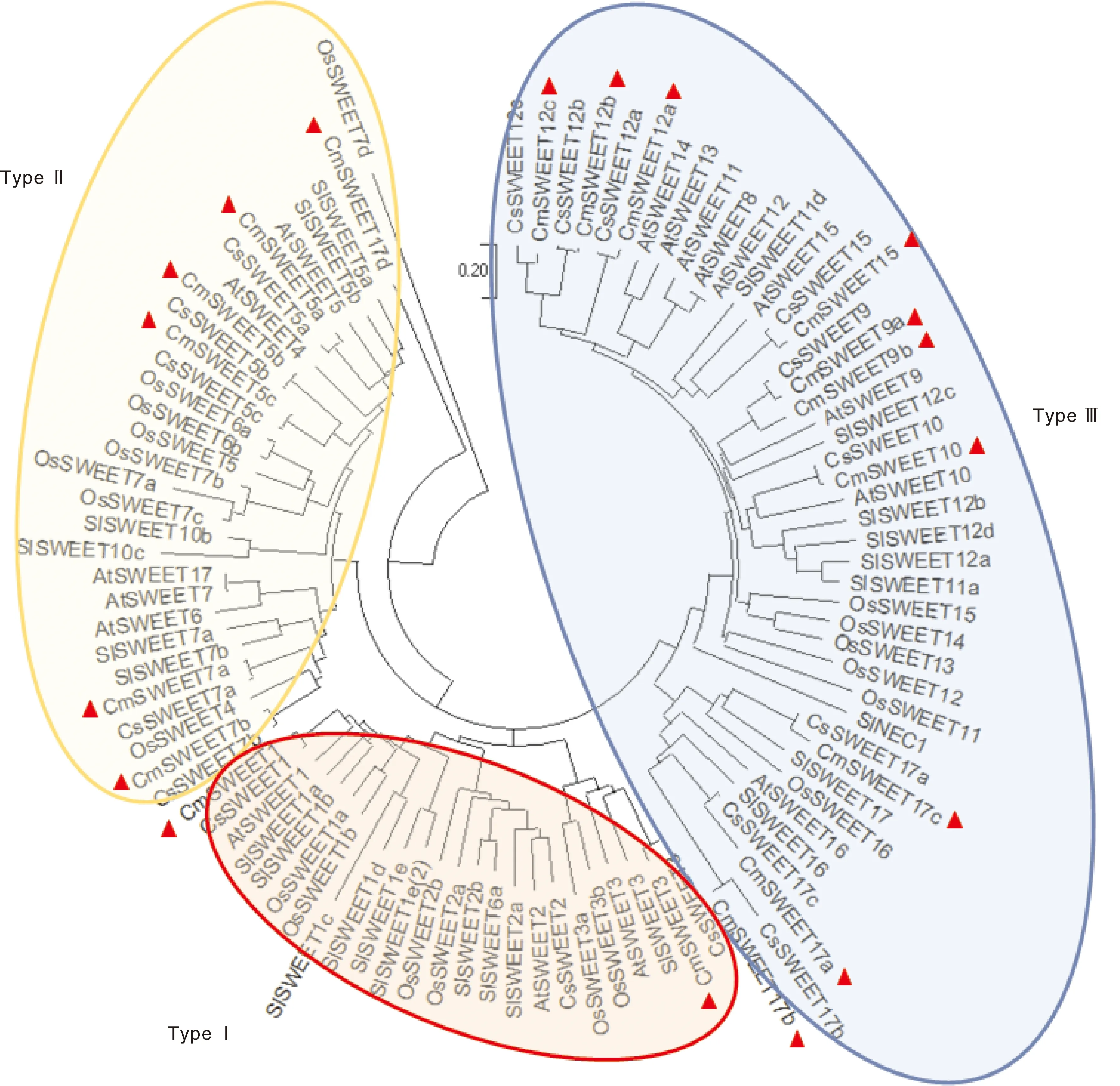
图1 甜瓜SWEETs家族基因氨基酸序列与其他物种的进化树分析Fig.1 Phylogenetic analysis of melon SWEETs family amino acid sequences with other plant species
2.3 甜瓜SWEETs家族基因的染色体定位分析
根据甜瓜DHL92基因组的注释信息将甜瓜18个SWEETs家族基因进行染色体定位(图2),其中16条成功定位于1~12号染色体,而CmSWEET17a、CmSWEET17c定位于chr00, 该版本基因组未能将正确拼接的碎片一并归为chr00。16个甜瓜SWEETs基因在12条染色体的分布不均匀,1、8、10号染色体上无SWEETs基因,3、6、7、11号染色体上分别有1个SWEETs基因,2、4、9号染色体有2个SWEETs基因,5、10号染色体分布有3个SWEETs基因。
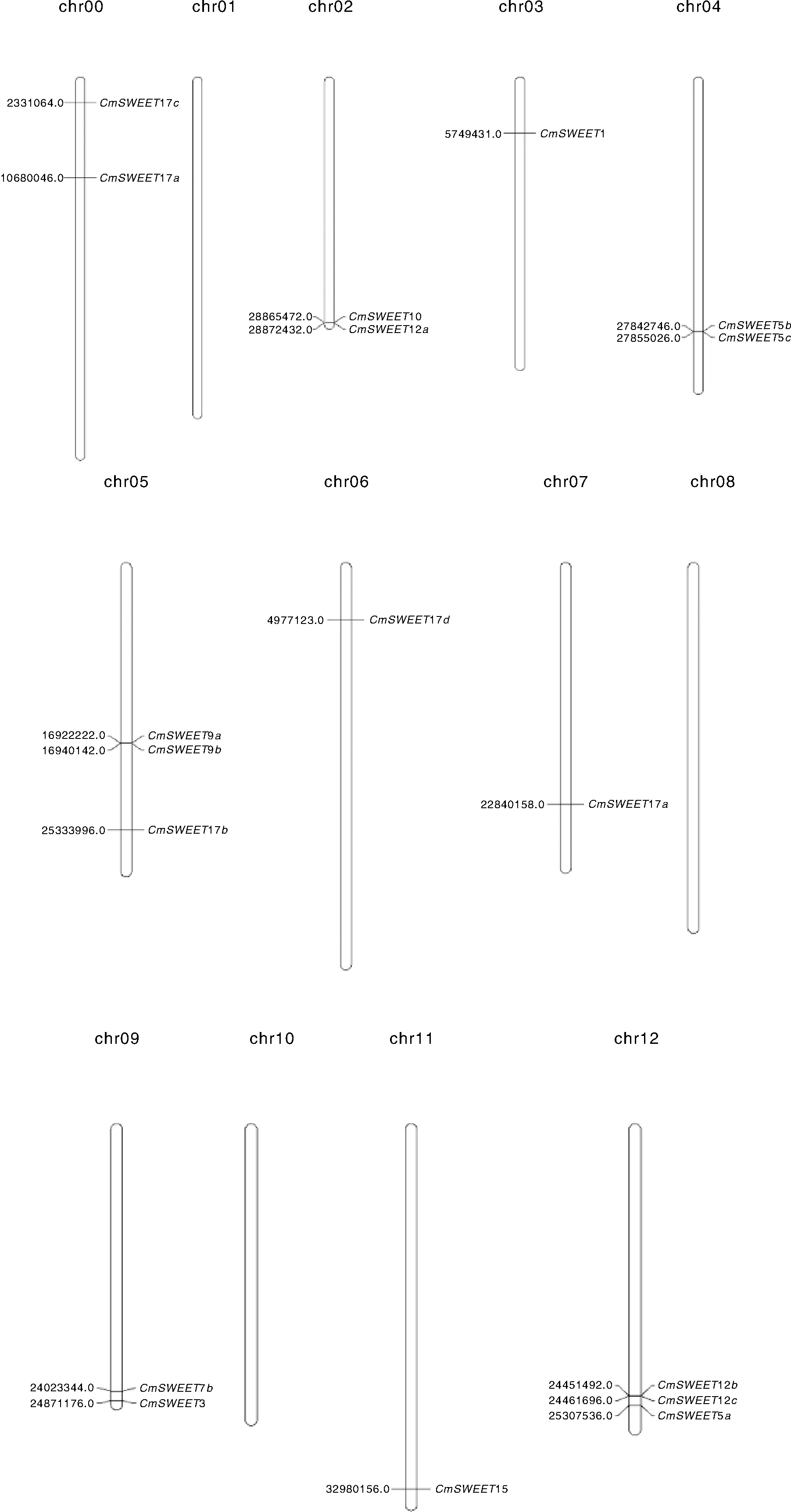
图2 甜瓜SWEETs家族基因染色体定位Fig.2 Chromosome mapping of melon SWEETs family genes
2.4 半定量RT-PCR检测甜瓜SWEETs家族基因的表达模式
为明确甜瓜SWEETs基因的表达模式,分别以根、茎、成熟叶、幼叶、雄花、雌花,以及开花当天未授粉子房及不同发育阶段果实为模板,进行RT-PCR检测12条SWEETs基因的表达(另6条基因引物特异性不佳,未检测),以甜瓜Actin7作为内参。如图3-A所示,在不同营养器官内,CmSWEETs呈现不同表达模式,如CmSWEET1、CmSWEET2和CmSWEET17c在各器官内均有表达,CmSWEET3和CmSWEET7a则未出现在幼叶中,CmSWEET5a、CmSWEET7c、CmSWEET10、CmSWEET12a、CmSWEET12c则主要在根和花器官中有表达。为明确甜瓜SWEETs基因与果实发育的关系,以不同发育阶段的果实作为模板,进行RT-PCR。如图3-B所示,在不同发育阶段的果实中,CmSWEET3、CmSWEET7a和CmSWEET17c在授粉后5~30 d表达量都很高。结果表明CmSWEET3、CmSWEET7a和CmSWEET17c可能与果实发育相关。

图3 甜瓜SWEETs家族基因在不同营养器官(A)与不同果实发育阶段(B)的表达Fig.3 Expression pattern of SWEETs family genes in different vegetative organs (A) and fruits in different developmental stages(B) of melon
2.5 CmSWEET3、CmSWEET7a,CmSWEET17c在果实发育各个阶段的表达量分析
为进一步明确CmSWEET3、CmSWEET7a和CmSWEET17c与甜瓜果实发育的关系,我们进行了qPCR检测。如图4所示,CmSWEET3在果实发育中期,即20 d时表达最高。CmSWEET7a随着果实发育逐渐上升,表达量在40 d时最高。而CmSWEET17c在前期各个时期的表达量差异不大,在成熟时40 d的表达量最低。实时荧光定量PCR的结果进一步验证了普通RT-PCR结果,CmSWEET3、CmSWEET7a作为候选基因进行后续研究。

每个果实作为一个重复,数据来自3个独立的重复,图中的每个值表示均值±SD。qPCR产生的表达量与对照的比值为1.0。Each fruit was set as one replicate, the data were obtained from three separate replicates, each value in the graph showed means ± SD. Expression levels produced by qPCR were expressed as a ratio to the control. which was set at 1.0.图4 三个CmSWEETs基因在不同果实发育期的qPCR表达分析Fig.4 qPCR analysis of 3 CmSWEETs genes during different fruit developmental stages in melon plants
2.6 CmSWEET3、CmSWEET7a的亚细胞定位
为进一步明确CmSWEET3、CmSWEET7a是否为膜蛋白,我们采用本氏烟进行瞬时表达CmSWEET3、CmSWEET7a以此明确其亚细胞定位。如图5所示,激光共聚焦定位观察发现,CmSWEET3、CmSWEET7a定位于细胞膜上。因此,通过亚细胞定位我们初步判断CmSWEET3、CmSWEET7a为膜蛋白。
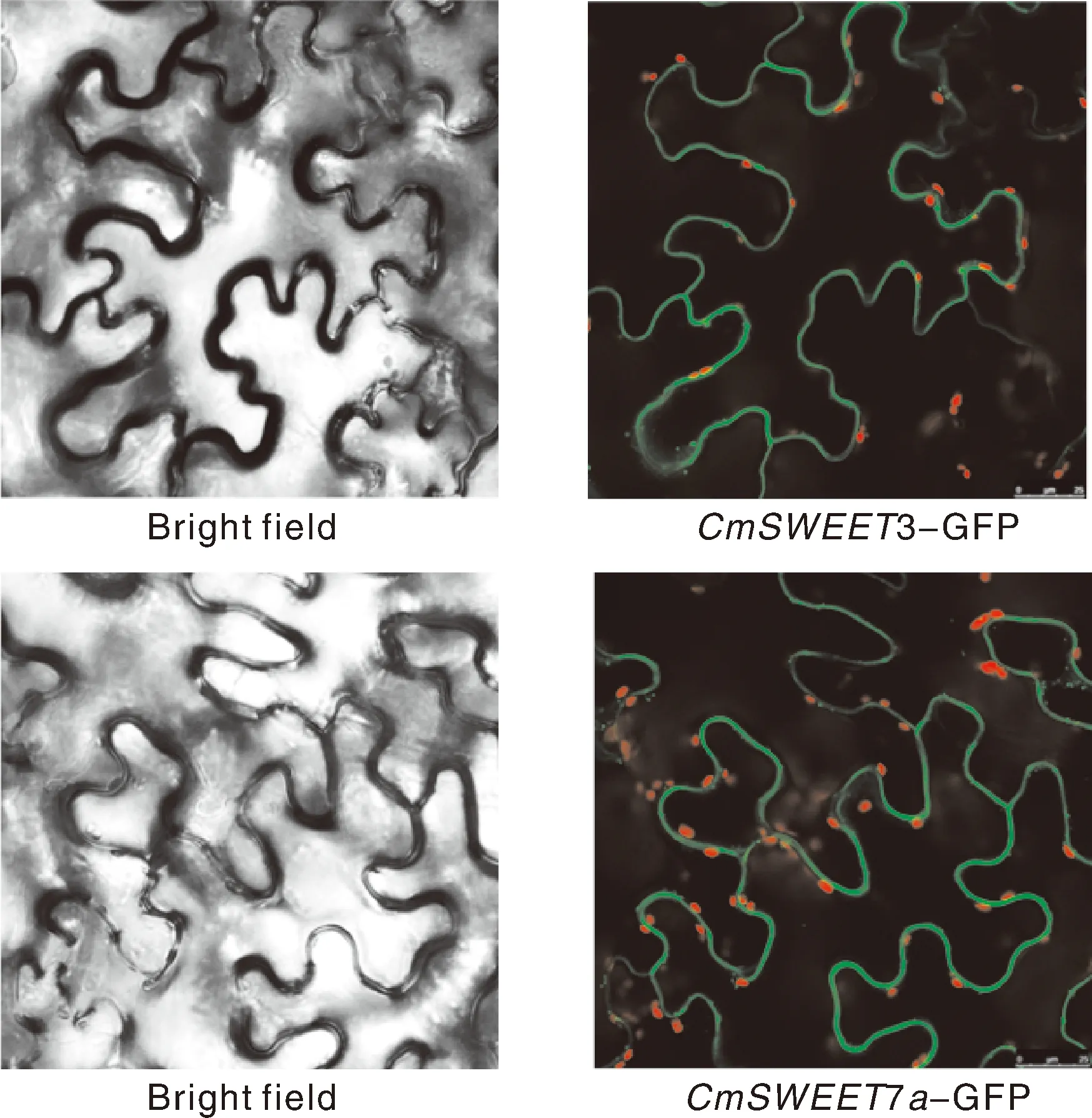
图5 CmSWEET3 和CmSWEET7a 基因在烟草表皮细胞的亚细胞定位Fig.5 Subcellular localization of CmSWEET3 and CmSWEET7a genes expressed in Nicotiana tabacum
2.7 CmSWEET3、CmSWEET7a酵母表达试验
为进一步明确甜瓜SWEETs基因转运糖的功能,将CmSWEET3、CmSWEET7a正义链与反义链分别克隆入酵母表达载体NEV-N,并转入己糖与转化酶缺失突变酵母CSY4000菌株中。在以葡萄糖、果糖(麦芽糖为阳性对照,蔗糖为阴性对照)分别作为碳源的培养基上进行培养发现,转化CmSWEET7a正义链的酵母可以在以葡萄糖和果糖的培养基上生长,如图6所示,表明CmSWEET7a具有转化葡萄糖和果糖这两类己糖的功能,CmSWEET3转化效果不佳(数据未呈现)。

图6 CmSWEET7a在酵母中的表达Fig.6 The expression of CmSWEET7a in yeast
3 结论与讨论
SWEET糖转运蛋白是近年发现的一类具有运输葡萄糖和其他寡糖的蛋白。SWEET介导了很多重要的生理或生化过程,最近研究表明,SWEET糖转运蛋白在果实发育中起调控作用。在苹果中3个SWEETs在幼果中表达量较高,而一个在大果中表达量较为丰富[23]。Zhen等[24]在苹果果实发育中鉴定得到多个在果实发育期高表达的SWEETs基因,通过开发标记基因,鉴定其在群体中与果实可溶性糖含量的关系,最后发现MdSWEET15a和MdSWEET9b作为候选基因可能与苹果中糖积累关联。栽培番茄中SWEET1b、SWEET1c、SWEET2a、SWEET7a、SWEET14在1~3 cm的幼果中具有较高的表达量,随着果实成熟其表达量逐渐降低,SlSWEET12c在1~3 cm的幼果中表达量较低,在果实绿熟期表达量急剧增加达到最大值[25]。最近,Ko等[10]通过构建SlSWEET15的CRISPR功能突变体揭示番茄中SlSWEET15参与果实中糖分卸载。Zhang等[26]在葡萄中用转基因手段证实SWEET10在其果实成熟时负责糖分积累。这些研究提供了SWEETs调控参与果实糖分积累的证据,然而目前关于SWEETs基因在甜瓜果实发育过程中的研究还未被报道。
本研究从甜瓜基因组系统鉴定得到18个SWEETs基因(表2)。根据甜瓜DHL92基因组的注释信息,16个SWEETs基因定位于甜瓜1-12号染色体上,有两条被定位于chr00(未能拼接的片段被归为0号染色体)(图2)。2017年Hu等[27]对黄瓜基因组SWEETs家族基因进行了系统鉴定,获得了17个黄瓜SWEETs基因,该17条基因的表达有70%在繁殖器官中。比较甜瓜与黄瓜中鉴定到的SWEETs基因,发现具有非常高的同源性,本研究中也将18个SWEETs基因,与水稻、黄瓜、番茄作物的SWEETs家族基因氨基酸序列进行多序列比对,同源性最高的是黄瓜。黄瓜与甜瓜同属葫芦科甜瓜属,甜瓜有12条染色体,但黄瓜只有7条染色体,Huang等[28]对黄瓜、甜瓜染色体相关性的研究已揭示葫芦科作物在进化过程中存在着复杂的进化与重排。2021年申长卫等[29]系统鉴定了南瓜中SWEETs基因,共得到21个南瓜SWEETs基因,其研究也证实葫芦科作物中SWEETs存在高度同源性。本研究筛选到3个SWEETs基因在果实发育全程或某个时期表达量较高,预示其可能在果实发育中发挥重要作用(图4)。
糖转运蛋白的亚细胞定位与其代表的功能密切相关,目前研究结果表明,其主要定位于液泡膜和质膜。通常情况下液泡膜定位的糖转运蛋白与胞内糖类储存或者抗逆境胁迫有关,质膜定位的糖转运蛋白和细胞内糖类的外排或输入有关。如蔗糖转运蛋白 SUT1、SUT2 亚族的成员均定位在细胞质膜上,酵母蔗糖吸收功能互补试验也证明其定位于细胞质膜[30]。对SWEET 蛋白的研究显示,其主要定位于韧皮部薄壁组织的细胞膜上,行使将胞内蔗糖转运至质外体中的功能。如拟南芥中 AtSWEET1、AtSWEET8、AtSWEET11、AtSWEET12 和 AtSWEET15 定位于质膜上,负责细胞内糖类的进出[1,31];AtSWEET16 和 AtSWEET17 定位于液泡膜上,介导液泡中糖类的储存[32-33]。研究发现,苹果MdSWEET17定位于液泡膜上,参与细胞内果糖运输[34]。梨 PbSWEET4 定位于质膜,且在成熟叶中高表达,过表达 PbSWEET4 可以显著降低叶片中的蔗糖与叶绿素的含量,推测其参与了叶片光合产物输出,能量物质的过度流失导致 PbSWEET4 转基因植株叶片早衰[35]。在黄瓜中,CsSWEET7a被发现定位于韧皮部伴胞细胞的细胞膜上,通过RNAi干扰实验进一步证实其与黄瓜果实中糖分卸载有关[36]。本研究中为明确甜瓜果实发育相关候选基因CmSWEET3、CmSWEET7a的亚细胞定位,采用本氏烟对其进行瞬时表达,激光共聚焦定位观察发现,CmSWEET3、CmSWEET7a定位在细胞膜上(图5),这为后期揭示其功能奠定了基础。
如前所述,SWEET 转运蛋白的特点是除了可以作为低亲和力的葡萄糖转运蛋白调节葡萄糖跨膜吸收外,还能够运输蔗糖、果糖和半乳糖,因此,知道其底物对于揭示其功能具有重要意义。拟南芥 SWEET 可分为 4 个不同的亚类,属于不同亚类的各种糖转运蛋白优先转运不同的糖组分,如属于分支1的成员AtSWEET1优先运输葡萄糖[37],属于分支2的AtSWEET5 编码半乳糖转运蛋白主要运输 2-脱氧葡萄糖,属于分支3 的AtSWEET11 和 AtSWEET12 主要负责韧皮薄壁组织细胞中蔗糖的运出[38];而分支 4(SWEET16~17)成员既可转运单糖又可转运多糖。最近Anjali等[22]将多个单子叶植物与双子叶植物放在一起聚类分析将SWEETs家族基因分为3个不同的类型(type),类型Ⅰ包含拟南芥中的分支1,优先运输葡萄糖;类型Ⅱ包括拟南芥的分支2和分支4,运输 2-脱氧葡萄糖,既可转运单糖又可转运多糖;类型Ⅲ即对应拟南芥的分支3,运输二元糖,如蔗糖作为底物。本研究通过基因组系统鉴定从甜瓜中获得18个SWEETs基因,通过甜瓜、水稻、黄瓜、番茄4个作物的SWEETs氨基酸序列进行多序列比对,参考Anjali等[22]的分类,甜瓜SWEETs序列中属于类型Ⅰ有2个,类型Ⅱ有6个,类型Ⅲ有10个,其中候选基因CmSWEET7a属于第Ⅱ类,酵母功能缺失实验也证实SWEET7a具有转运葡萄糖或果糖能力。体外酵母功能缺失实验为更深入揭示CmSWEET7a是否参与了甜瓜果实发育过程中糖分从筛管卸载到达薄壁细胞这一重要过程奠定了基础。今后的研究方向将在甜瓜植株内进行过表达或敲除表达从而进行功能验证。

