肾上腺皮质癌组织中COX-2蛋白表达与临床病理特征及预后的关系研究*
刘洪羽,古虎霞,刘定荣,卫惠杰,周丹,代晓璐,杨艳,张冲
(1.齐齐哈尔市第一医院 病理科,黑龙江 齐齐哈尔 161005; 2.重庆大学附属涪陵医院网络信息科,重庆 408099; 3.重庆大学附属涪陵医院 病理科,重庆 408099)
肾上腺皮质癌(adrenocortical carcinoma, ACC)是一种罕见的恶性肿瘤,恶性程度、病死率较高[1-2]。ACC早期症状隐匿,多数患者就诊时肿瘤已有局部侵犯,预后差,5年生存率为16%~40%[3]。目前手术仍是根治ACC的唯一途径,但ACC患者行手术切除后仍存在较高复发风险(复发率为50%~85%)[4]。ACC发病率为0.77~2.0/10万[5],发病率较低,可供研究的ACC患者相对较少,国内外关于ACC患者病理特征、预后等因素的研究较少,目前国内尚缺乏有效预测ACC患者肿瘤切除术后早期复发的生物化学指标。近期研究显示环氧合酶-2(Cyclooxygenase-2, COX-2)参与乳腺癌[6]、结直肠癌[7]、食管癌[8]等多种癌症的发生、发展,与肿瘤细胞的生长、迁移等病理过程关系密切。ACC组织中COX-2阳性表达患者术后预后不良风险高,目前国内关于COX-2表达与临床病理参数及预后关系的报道尚少,基于此,笔者对此进行分析研究,现报道如下。
1 资料与方法
1.1 一般资料
从癌症基因组图谱(TCGA)数据库中获得51例经手术病理确诊为ACC的患者为研究对象。其中,男性24例,女性27例;年龄23~75岁,平均(61.05±9.28)岁;低分化22例,中/高分化29例;欧洲肾上腺肿瘤研究协作网(The European Network for the Study of Adrenal Tumors, ENSAT)分期:Ⅰ、Ⅱ期18例,Ⅲ期33例;有内分泌功能22例、低钾血症8例、低蛋白血症12例。纳入标准:①首次进行手术治疗者;②既往未接受任何形式治疗;③年龄> 18岁;④自愿签署研究知情同意书者。排除标准:①伴有其他部位恶性肿瘤者;②重要脏器严重功能障碍者;③伴有免疫缺陷性疾病、传染性疾病、血液系统疾病、全身系统性疾病者;④伴有精神性疾病、医患沟通障碍者;⑤术前发现远处转移者;⑥有药物滥用史、吸毒史者;⑦伴有严重心脑血管疾病者;⑧存在手术禁忌证者。剔除标准:①依从性差者;②自然失访者。
1.2 方法
1.2.1 病例来源及数据收集 51例ACC患者的基因表达数据和临床信息来自TCGA数据库(https://portal.gdc.cancer.gov/repository)及基因型组织表达(GTEx)数 据 库(https://toil.xenahubs.net/download/gtex_RSEM_gene_tpm.gz)。其中25例行根治性开放手术,14例行腹腔镜手术,12例行达芬奇机器人辅助腹腔镜下手术。手术切取病灶,将距肿瘤组织> 2 cm的组织记为癌旁组织,确保患者所切除组织均包含有癌组织和癌旁组织。术后根据患者个体情况行辅助放化疗等治疗。
1.2.2 免疫组织化学EnVision二步法检测癌组织、癌旁组织中COX-2蛋白表达 染色程度分为无色、淡棕色、棕色、棕褐色,染色范围< 5%、5% ≤染色范围< 25%、25% ≤染色范围< 75%、染色范围≥75%,分别计为0分、1分、2分、3分。计算染色程度与染色范围评分的乘积,将结果为0分者记为阴性表达,否则记为阳性表达。
1.2.3 随访 所有患者术后以门诊复查、住院治疗、电话等方式随访3年,每月随访1次。统计随访期间复发(随访中腹部或肺部增强CT或MRI等影像学证据显示肿瘤新发结节和/或肿大淋巴结出现[9])、生存情况,出现癌因死亡者终止随访。
1.3 统计学方法
数据分析采用SPSS 18.0统计软件。计量资料以均数±标准差(±s)表示,比较用t检验;计数资料以构成比或率(%)表示,比较用χ2检验;绘制Kaplan-Meier生存曲线,比较用Log rank χ2检验;影响因素的分析采用多因素Cox比例风险模型。P<0.05为差异有统计学意义。
2 结果
2.1 ACC患者癌组织与癌旁组织中COX-2蛋白表达的比较
51例ACC患者癌组织、癌旁组织中COX-2蛋白阳性表达率分别为64.71%(33/51)、9.80%(5/51),两者比较,经χ2检验,差异有统计学意义(χ2=32.882,P=0.000),癌组织中COX-2蛋白阳性表达率高于癌旁组织中COX-2蛋白阳性表达率。见图1。
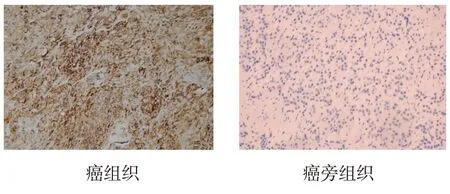
图1 COX-2蛋白在癌组织和癌旁组织中的表达(免疫组织化学EnVision二步法 ×200)
2.2 不同临床病理特征ACC患者癌组织中COX-2蛋白阳性表达率的比较
不同病理分级、ENSAT分期、CD56、Syn Ki-67表达及是否合并微血管侵犯的ACC患者癌组织中COX-2蛋白阳性表达率比较,差异有统计学意义(P<0.05),低分化、ENSATⅢ期、CD56阳性、Syn阳性、Ki-67表达≥ 10%、合并微血管侵犯的ACC患者癌组织中COX-2蛋白阳性表达率高于中/高分化、ENSATⅠ和Ⅱ期、CD56阴性、Syn阴性、Ki-67表达<10%、未合并微血管侵犯的ACC患者(P<0.05)。见表1。
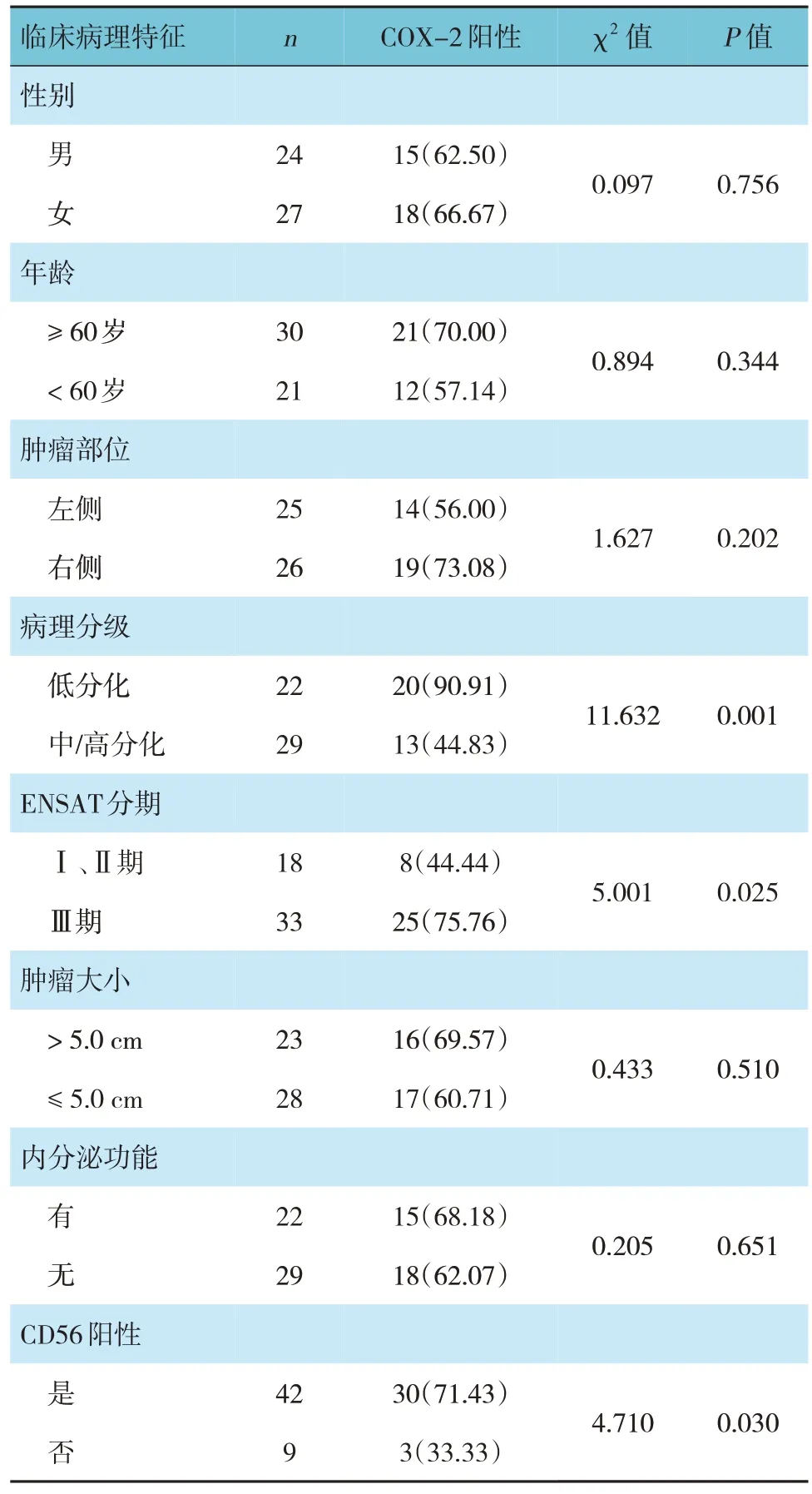
表1 不同临床病理特征ACC患者癌组织中COX-2蛋白阳性表达率的比较 例(%)

续表1
2.3 影响ACC患者预后的多因素Cox比例风险模型分析
51例ACC患者截止到随访结束,6例因失访剔除(4例患者为COX-2蛋白阳性表达者,2例为COX-2蛋白阴性表达者)。45例ACC患者中29例(64.44%)患者术后出现复发,20例(44.44%)死亡。
单因素分析显示,病理分级、ENSAT分期、内分泌功能、Syn阳性、Ki-67表达、血管侵犯、包膜侵犯、COX-2阳性是影响ACC患者肿瘤切除术后复发的因素(P<0.05)(见表2)。以ACC患者肿瘤切除术后是否复发为因变量(否 = 0,是 = 1),以病理分级、ENSAT分期、内分泌功能、Syn阳性、Ki-67表达、血管侵犯、包膜侵犯、COX-2阳性为自变量(上述自变量赋值为原始数值)进行多因素Cox比例风险模型分析,结果显示,病理分级[=4.904(95% CI:2.018,11.918)]、ENSAT分期[=6.025(95% CI:2.479,14.644)]、内分泌功能[=3.927(95% CI:1.616,9.545)]、Ki-67表达[=4.011(95% CI:1.650,9.748)]及COX-2阳 性[=5.114(95% CI:2.104,12.429)]是影响ACC患者术后复发的危险因素(P<0.05)(见表3)。
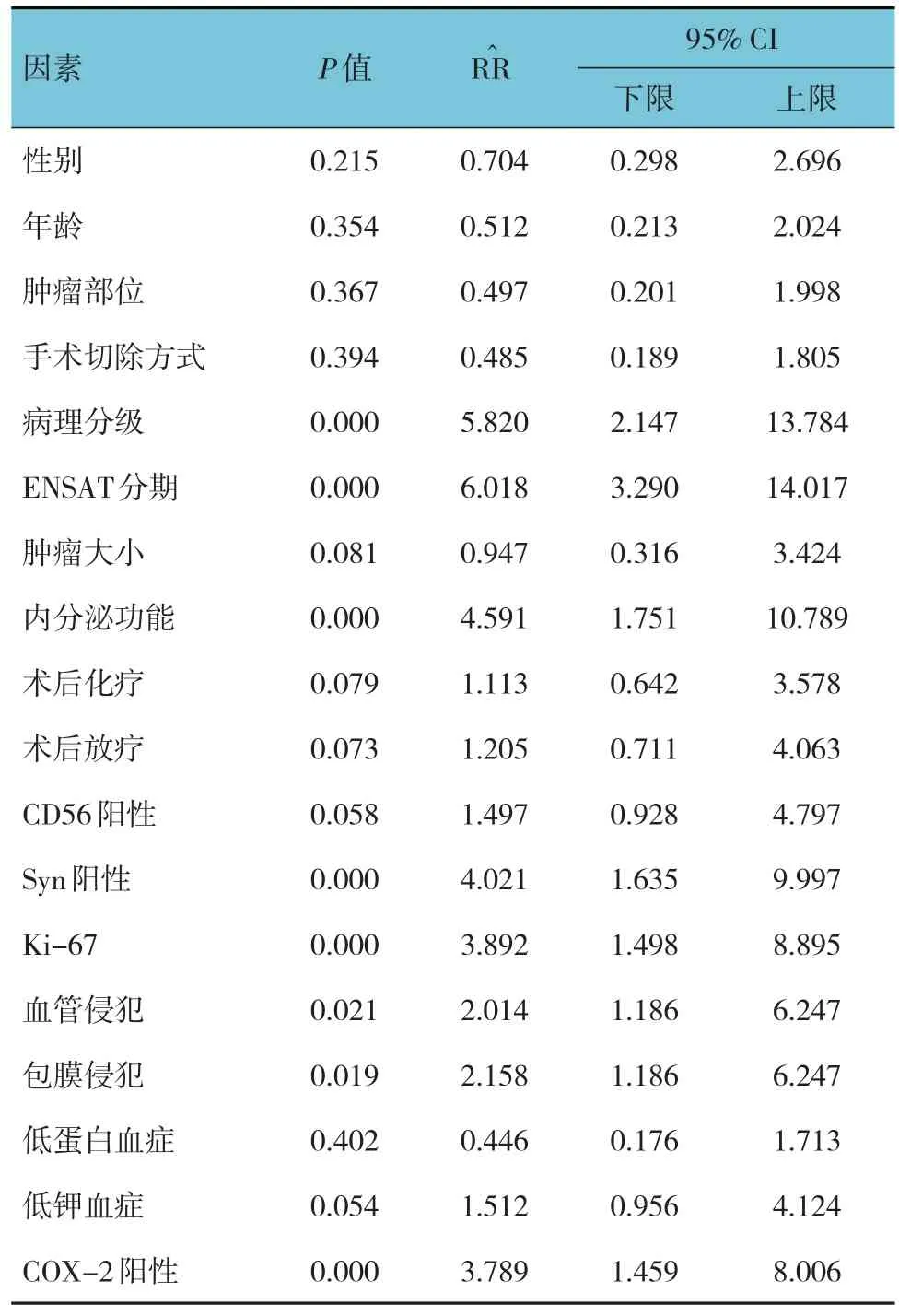
表2 影响ACC患者切除术后复发的单因素分析
单因素分析显示,病理分级、ENSAT分期、内分泌功能、Syn阳性、Ki-67表达、血管侵犯、包膜侵犯、COX-2阳性是影响ACC患者肿瘤切除术后生存的因素(P<0.05)(见表4)。以ACC患者切除术后是否生存为因变量(生存= 0,死亡= 1),以病理分级、ENSAT分期、内分泌功能、Syn阳性、Ki-67表达、血管侵犯、包膜侵犯、COX-2阳性为自变量(上述自变量赋值为原始数值)进行多因素Cox比例风险模型分析,结果显示,病理分级[=4.914(95% CI:2.022,11.942)]、分期[=6.633(95% CI:2.729,16.119)]、内分泌功能[=4.003(95% CI:1.647,9.728)]及COX-2阳性[=5.296(95% CI:2.179,12.872)]是影响ACC患者术后生存的危险因素(P<0.05)(见表5)。
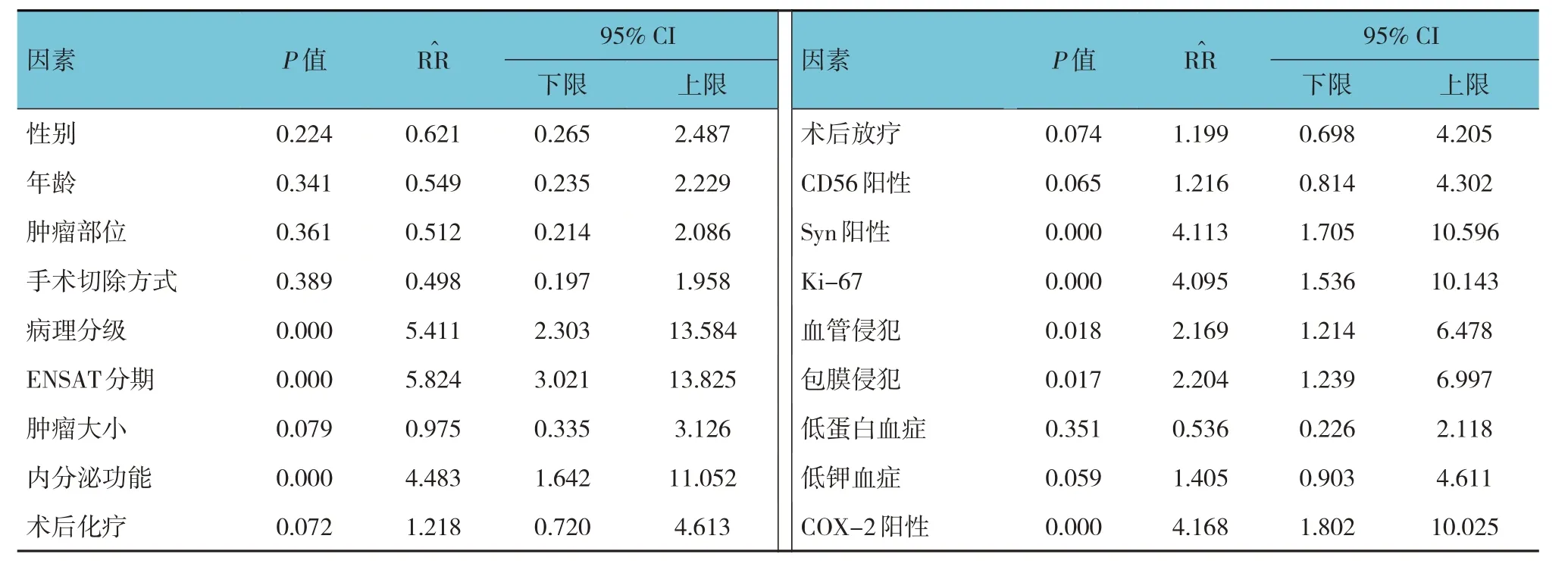
表4 影响ACC患者术后生存的单因素分析
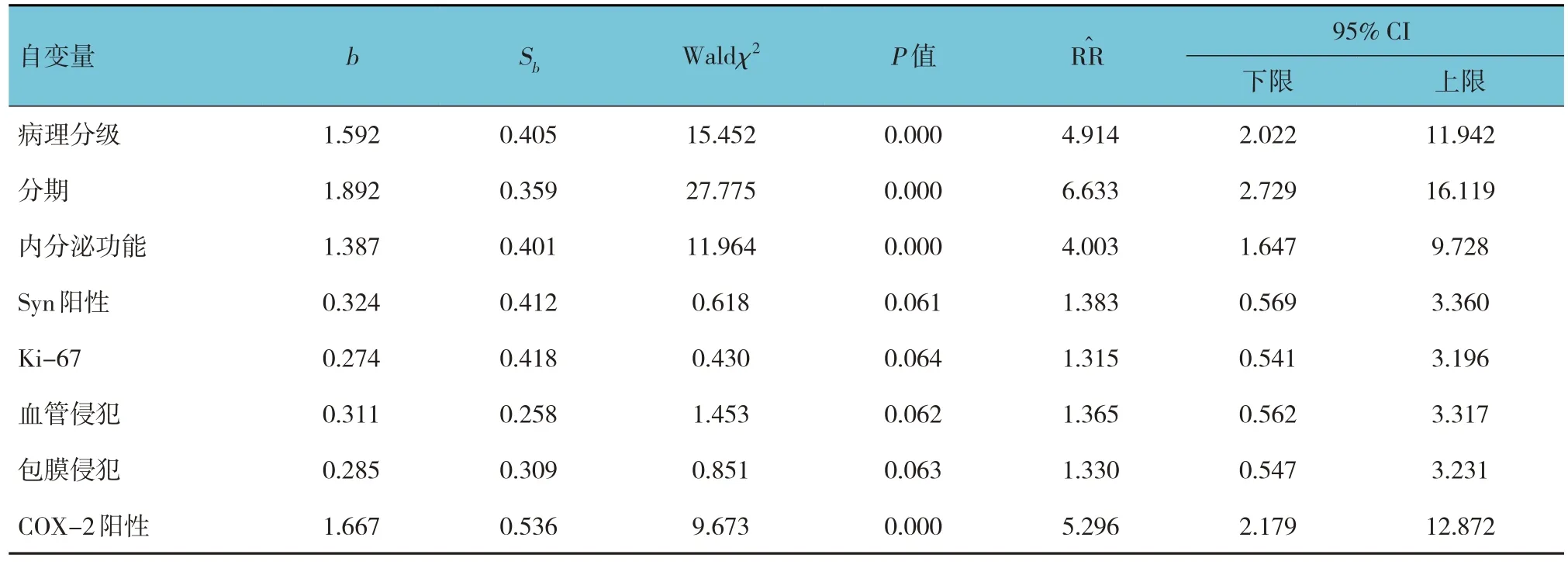
表5 影响ACC患者肿瘤切除术后生存的多因素Cox比例风险模型分析参数
2.4 ACC患者癌组织中COX-2表达与预后的关系
29例COX-2阳性表达患者无病生存7例,16例COX-2阴性表达患者无病生存9例,COX-2阳性表达患者与阴性表达患者的无病生存曲线比较,差异有统计学意义(χ2=5.667,P=0.017);29例COX-2阳性表达患者存活12例,16例COX-2阴性表达患者存活13例;COX-2阳性表达患者与阴性表达患者的总生存曲线比较,差异有统计学意义(χ2=6.761,P= 0.009)。见图2。
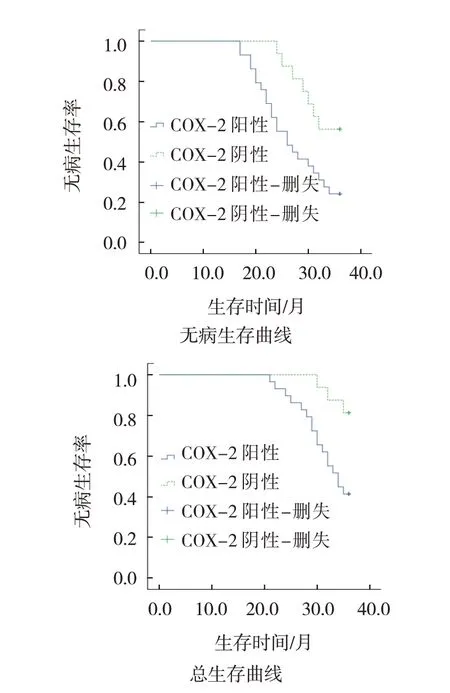
图2 ACC患者Kaplan-Meier生存曲线图
3 讨论
ACC切除术后复发与肿瘤细胞增殖、转移相关细胞因子有关,COX-2是一种酶复合物,可将花生四烯酸转化为前列腺素,是炎症及血管生成的关键介质[10]。COX-2可通过诱导细胞增殖、抑制细胞凋亡、抑制宿主免疫反应等多种途径介导肿瘤演进。COX-2可诱导血管内皮生长因子产生,促进血管生成,并可提高肿瘤细胞黏附能力,刺激癌细胞浸润基底膜组织[11]。COX-2表达的变化可有效反映正常组织和癌组织的增殖活性,对肿瘤复发、转移有重要作用[12]。目前国内外研究[6-8]证实,COX-2与乳腺癌、结直肠癌、食管癌等多种癌症的发生、转移有关,但由于ACC可供研究患者较少,目前国内尚缺乏ACC患者癌组织COX-2表达与临床病理特征及预后生存的关系及关系验证的报道。本研究通过检测ACC患者癌组织、癌旁组织中COX-2表达,分析验证ACC癌组织中COX-2阳性表达与患者临床病理特征、无病生存、总生存状况的关系,为临床提供参考。
本研究发现,ACC患者癌组织中COX-2阳性表达率高于癌旁组织,低分化、ENSATⅢ期、CD56阳性、Syn阳性、Ki-67表达 ≥ 10%、微血管侵犯的ACC患者癌组织中COX-2阳性表达率分别高于中/高分化、ENSATⅠ和Ⅱ期、CD56阴性、Syn阴性、Ki-67表达<10%、未合并微血管侵犯患者,提示ACC患者癌组织中COX-2表达阳性率较高,COX-2与ACC患者病情关联的病理特征有关,可能对临床预测ACC患者预后具有意义。正常生理状态下COX-2表达较少,主要存在于胃、肾脏、中枢神经系统及女性生殖道,但是生长因子、细胞因子、致癌物、致癌基因、慢性炎症等均可刺激其他细胞诱导COX-2过表达,COX-2作为一种与肿瘤恶性生物学行为有关的细胞因子,其与恶性细胞增殖、血管生成、迁移、侵袭及抗凋亡活性密切相关[13]。COX-2可诱导机体氧化应激反应,促进游离自由基整合癌细胞核基因,加速上皮细胞核DNA分裂,破坏肿瘤细胞膜稳定性,提高肿瘤细胞结构蛋白翻译合成速度,提高癌细胞扩增风险[14],进而影响ACC患者病情、预后。
本研究多因素Cox比例风险模型分析结果显示,COX-2阳性表达是影响ACC患者后复发、总生存率的危险因素,对ACC患者癌组织COX-2表达情况与预后生存的关系作出进一步验证,再次提示ACC组织中COX-2阳性表达是影响患者预后的因素,推测可能是因为COX-2可通过影响残留肿瘤细胞染色体末端结构稳定性,增加肿瘤微环境中肿瘤细胞基因突变风险,进而介导肿瘤细胞异常增殖、分化、迁徙、转移等过程[15]。ACC组织COX-2阳性表达患者与阴性表达患者的无病生存曲线、总生存曲线比较有差异,再次印证ACC组织中COX-2表达与患者预后有关,ACC患者癌组织中COX-2阳性表达可增加术后复发风险,减少总生存获益。NAGARAJU等[16]报道COX-2蛋白过表达是胃肠道恶性肿瘤患者无病生存时间较短的独立预后因素;代文意等[17]研究显示,COX-2蛋白表达强度增强是喉癌患者术后复发的危险因素之一;彭卓嵛等[18]研究显示,COX-2阳性表达的结直肠癌患者的术后复发率明显高于阴性表达者;ASGHAR等[19]报道显示,与COX-2阴性表达的乳腺癌患者比较,COX-2阳性表达患者的总生存时间短。上述结果与本研究结果类似,均证明COX-2表达与恶性肿瘤患者预后关系密切。
综上所述,ACC患者癌组织中COX-2表达与临床病理特征及预后有关,COX-2阳性表达患者预后不良风险高。本研究仍存在不足之处,未进一步统计COX-2阳性高表达者与阳性低表达者的临床病理特征和预后情况,其分子机制也值得进一步探讨,针对不足之处后期研究将作进一步完善。

