2017~2021年陕西省实验动物使用单位SPF级大、小鼠质量监测结果分析与评估
吴朋朋张彩勤赵 勇谭邓旭师长宏白 冰
(空军军医大学实验动物中心,西安 710032)
随着生命科学的发展,实验动物已成为其研究的基础与支撑,是医学教学和生物医学研究不可缺少的实验材料。实验动物的质量直接影响实验结果的准确和课题研究的成败,决定研究成果的可行性、重复性和科学性,特别是一些人兽共患性疾病,直接威胁动物饲养人员和研究人员的健康与生命安全[1-2]。因此,做好实验动物的质量检测与评估的相关工作,对实验动物的生产和应用具有重要作用[3-4]。
本中心作为陕西省实验动物质量检测机构(陕西省实验动物质量监督检测中心),根据《实验动物质量管理办法》、《实验动物许可证管理办法》和《陕西省实验动物管理办法》等相关法律法规以及实验动物国家标准[5-8],除了每年对各实验动物生产单位进行质量抽测外,近年来,加大对省内实验动物使用单位的质量抽检,并及时反馈检测结果,对不合格的动物进行处置并做好后期的跟踪监测,确保本地区实验动物使用安全。本文对2017~2021年期间陕西省实验动物使用单位饲养的SPF级大、小鼠质量抽检结果进行了总结分析,探讨了影响动物质量的因素,以期为动物实验过程中的质量管理和监测提供参考依据。
1 材料和方法
1.1 实验动物
抽检的不同品系的S PF级大、小鼠均来自陕西省内实验动物使用单位,各年度抽检单位数量、动物品种及数量见表1。
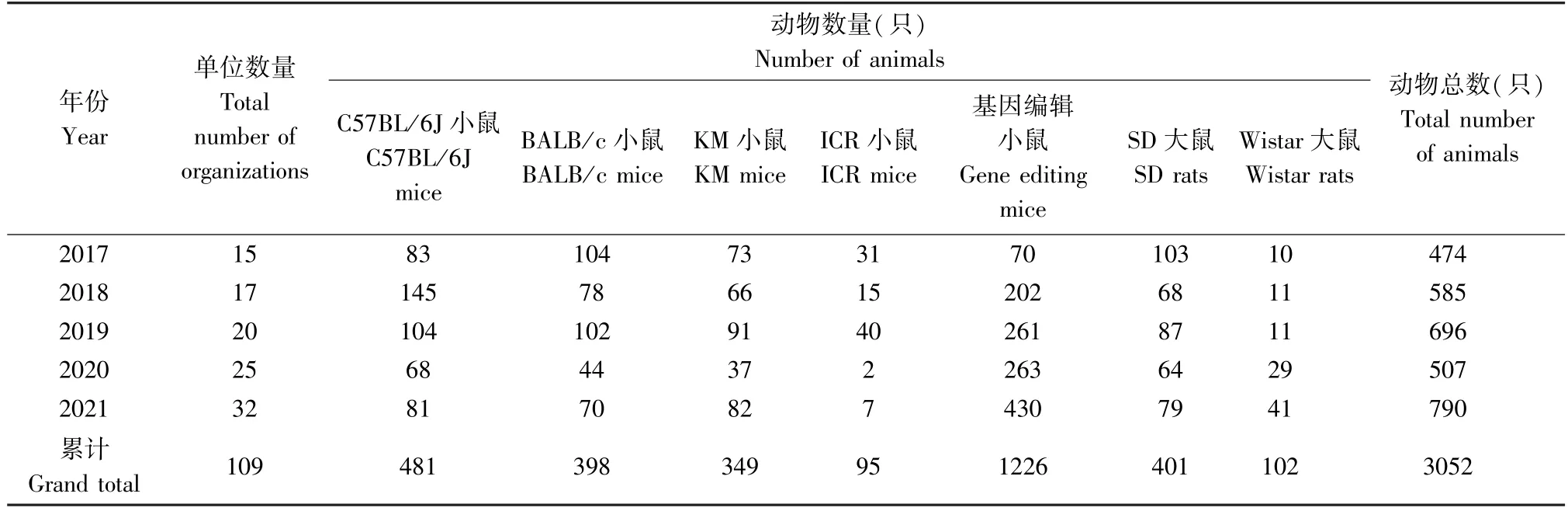
表1 2017~2021年陕西地区实验动物质量监测结果Table 1 Monitoring results of laboratory animals in Shaanxi from 2017 to 2021
1.2 主要试剂与仪器
大、小鼠酶联免疫抗体检测试剂盒购买于苏州西山生物术有限公司和中国食品药品检定研究院,其中苏州西山生物术有限公司小鼠酶联免疫抗体检测试剂盒批号:鼠痘病毒(E22012201)、肝炎病毒(E22040801)、仙台病毒(E22012802)、肺炎病毒(E22031411)、呼肠孤病毒III型(E21102902)、细小病毒(E22012601)、弓形虫(E21112502)、支原体(E22012701)、泰泽病原体(E21120604);大鼠酶联免疫抗体检测试剂盒批号:仙台病毒(E22022503)、汉坦病毒(E22022502)、细小病毒 H-1株(E21102201)、细小病毒KRV株(E21102202)、肺炎病毒(E21121501)、冠状病毒/涎泪腺炎病毒(20210702)、呼肠孤病毒Ⅲ型(20210702)、支原体(E21102901)、弓形虫(E21122801)、泰泽病原体(E21101401);中国食品药品检定研究院小鼠酶联免疫抗体检测试剂盒批号:鼠痘病毒(20210604)、肝炎病毒(20211125)、仙台病毒(20211123)、肺炎病毒(20211003)、呼肠孤病毒III型(20211009)、细小病毒(20211017)、弓形虫(20211109)、支原体(20211104)、泰泽病原体(20210917),大鼠酶联免疫抗体检测试剂盒批号:仙台病毒(20211111)、汉坦病毒(20211025)、细小病毒H-1株(20211023)、细小病毒 KRV 株(20211113)、肺炎病毒(20210914)、冠状病毒/涎泪腺炎病毒(20210917)、呼肠孤病毒Ⅲ型(20210917)、支原体(20211118)、弓形虫(20211008)、泰泽病原体(20211204);细菌培养平板(批号:0032213)、鉴别培养基(批号:20210314)和细菌生化微量管(批号:20210917)由杭州微生物试剂有限公司提供,其余相应检测试剂均参照国家标准配备。多功能酶标仪(Synergy LX)购于美国Bio-Tek公司;生物显微镜(BX3)购于日本奥林巴斯公司;全自动细菌鉴定及药敏分析系统(VITEK 2 Compact)购于法国梅里埃公司。
1.3 实验方法
1.3.1 抽样
抽样按照GB 14922.2-2011《实验动物 微生物等级及监测》进行,在每一房间不同笼架多点采样,根据每个品系动物的种群数量随机采样3~5只,按SPF级动物进行包装、运输,包装箱上注明动物品种、级别、数量及检测项目。
1.3.2 检测
检测项目及方法依据《实验动物 微生物学检测方法》(GB/T 14926.1-2001~GB/T 14926.64-2001)和《实验动物 寄生虫学检测方法》(GB 18448.1-2001~GB 18448.10-2001)执行[7-8],涵盖国家标准中规定的必检项目(细菌、病毒和寄生虫)。为避免交叉污染,所有检测样本的采集均在生物安全柜中实施。采集动物粪便、体表毛发开展寄生虫检测;分离血清,酶联免疫吸附法(enzyme linked immunosorbent assay, ELISA)检测血清中的病毒抗体;采取呼吸道分泌物和肠道内容物,分离培养细菌并进行生化鉴定,确定感染菌群类型[9-11]。检测中发现的病毒和细菌阳性样品均进行二次复检。
1.4 统计学方法
按照相应国家标准对检测结果进行综合判定,符合该病原微生物检测结果者作出阳性报告(感染),不符合者作出阴性报告(未感染)。用SPSS 23.0统计软件对近5年抽检的大、小鼠微生物及寄生虫感染阳性率(或血清抗体阳性率)进行统计学分析,结果以每年检出的阳性动物数占抽检动物总数的百分比进行表示。用单因素方差分析法进行每年间感染情况的差异性分析,以P<0.05表示差异有显著性,最后用GraphPad Prism 8软件进行作图。
2 结果
2.1 2017~2021年SPF级大、小鼠寄生虫检测结果
5年间,累计抽检小鼠2549只,大鼠503只(表2、图1和图2)。检测范围包括皮毛上的蚤、虱和螨等体外寄生虫成虫及其虫卵;肠道内的鞭毛虫、纤毛虫、蠕虫及其虫卵;血清中的弓形虫抗体采用ELISA进行检测。
小鼠主要存在体外寄生虫(螨虫)和肠道鞭毛虫的感染(表2、图1),5年中均有检出,但检出率呈逐年下降趋势。体外寄生虫(螨虫)的检出率由2017年的5.26%(19/361)降为2021年的0.15%(1/670),单位检出率由20.00%(3/15)降为3.12%(1/32);肠道鞭毛虫的检出率由2017年10.53%(38/361)降低为2021年的0.45%(3/670),单位检出率由20.00%(3/15)降为3.12%(1/32)。弓形虫抗体检出率也呈现逐年降低的趋势,由2019年的0.84%(5/598)降至2021年的0.15%(1/670),单位检出率由10.00%(2/20)降为3.12%(1/32)。但是,肠道蠕虫的检出率却由2018年的0.40%(2/506)增加至2021年的2.39%(16/670),单位检出率由5.88%(1/17)增加至9.38%(3/32)。

图1 2017~2021年陕西地区SPF级小鼠寄生虫检测结果Figure 1 Parasite detection results of SPF mice in Shaanxi from 2017 to 2021

表2 2017~2021年陕西地区SPF级大、小鼠寄生虫检测结果Table 2 Parasite detection results of SPF mice and rats in Shaanxi from 2017 to 2021
大鼠也存在体外寄生虫(螨虫)、肠道鞭毛虫和蠕虫的感染(表2、图2)。检测结果显示,体外寄生虫(螨虫)检出率由2017年的7.07%(8/113)降至2018年后无检测出,单位检出率由2017年的40.00%(2/5)降为0.00%;肠道鞭毛虫的检出率由2017年的11.50%(13/113)降低为2021年的0.83%(1/120),单位检出率由60.00%(3/5)降低为7.69%(1/13)。蠕虫检出率由2017年的3.79%(3/79)增长为2021年的7.50%(9/120),单位检出率由20.00%(1/5)增加至2021年的15.38%(2/13)。
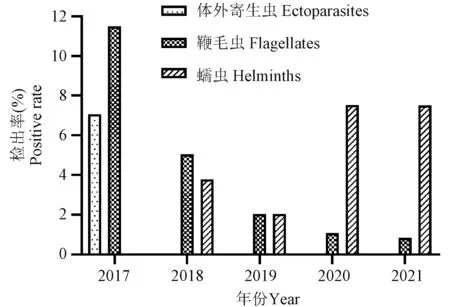
图2 2017~2021年陕西地区SPF级大鼠寄生虫检测结果Figure 2 Parasite detection results of SPF rats in Shaanxi from 2017 to 2021
2.2 2017~2021年SPF级大、小鼠病原微生物检测结果
5年中109家单位的小鼠病原微生物检测结果(表3、图3)显示,小鼠主要存在沙门菌、肺炎克雷伯杆菌、肺炎链球菌、泰泽病原体和支原体的感染,但检出率呈下降趋势。其余必检项目5年内均未检出。其中,沙门菌2017年检出率为2.78%(10/361)、2018年为1.18%(6/506)、2019年0.33%(2/598)到2020年以后均为0.00%,单位检出率由2017年的20.00%(3/15)降低为2021年的0.00%;肺炎克雷伯杆菌仅2018年在1家单位(5.88% 1/17)中检出0.20%(1/506),其余3年均未检出;肺炎链球菌在2017年1家单位(6.67% 1/15)检出0.27%(1/361)后,连续4年均未检出;泰泽病原体血清抗体阳性检出率由2017年2家单位(13.33% 2/15)检出1.38%(5/361)降低至2021年的32家单位均未检出;支原体血清抗体阳性仅在2017年1家单位(6.67% 1/15)中检出(0.27% 1/361),此后连续4年均未检出。

图3 2017~2021年陕西地区SPF级小鼠病原微生物检测结果Figure 3 Pathogenic microorganism test results of SPF mice in Shaanxi from 2017 to 2021
45家单位的大鼠细菌检测结果(表3、图4)显示,大鼠中主要存在金黄色葡萄球菌、沙门菌、绿脓杆菌、肺炎链球菌和泰泽病原体的感染,但检出率呈逐年下降趋势。其余必检项目5年内均未检出。其中,金黄色葡萄球菌2017~2019年连续3年均有1家单位检出,检出率分别为1.77%(2/113)、1.27%(1/79)和1.02%(1/98),此后至2021年再未检出金黄色葡萄球菌;沙门菌仅在2018年1家单位(11.11% 1/9)中检出(2.53% 2/79),其余4年均未检出;绿脓杆菌在2017年(1.77% 2/113)和2018年(2.53% 2/79)均有1家单位检出,2019年至2021年连续3年均未检出;肺炎链球菌仅在2018年1家单位(11.11% 1/9)中检出(1.27% 1/79),其余4年均未检出;泰泽病原体血清抗体阳性仅在2017年有2家单位(40.00% 2/5)检出(4.42% 5/113),此后连续4年均未检出。

表3 2017~2021年陕西地区SPF级大、小鼠病原微生物检测结果Table 3 Pathogenic microorganism test results of SPF mice and rats in Shaanxi from 2017 to 2021
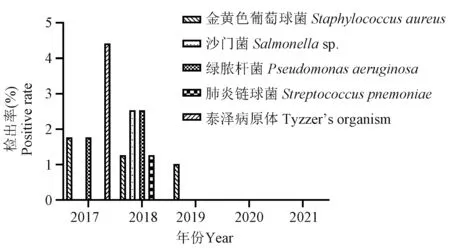
图4 2017~2021年陕西地区SPF级大鼠病原微生物检测结果Figure 4 Pathogenic microorganism test results of SPF rats in Shaanxi from 2017 to 2021
2.3 2017~2021年SPF级大、小鼠病毒抗体检测结果
病毒检测主要采用ELISA方法检测血清中的病毒抗体,检测中发现的阳性血清样本再次采用不同厂家的ELISA检测试剂盒进行2次复检,两次结果均为阳性则判定为感染,检测结果如表4所示。

表4 2017~2021年陕西地区SPF级大、小鼠病毒血清抗体检测结果Table 4 Virological test results of SPF mice and rats in Shaanxi from 2017 to 2021
小鼠病毒血清抗体检测结果(表4、图5)显示,小鼠肝炎病毒、仙台病毒、小鼠肺炎病毒、小鼠细小病毒和小鼠呼肠孤病毒Ⅲ型在2017~2021年均有检出。其余必检项目5年内均未检出。2017年有3家单位(20.00% 3/15)检出小鼠肝炎病毒(阳性率4.71% 17/361),1家单位(6.67% 1/15)检出仙台病毒(阳性率1.39% 5/361),2家单位(13.33% 2/15)检出小鼠细小病毒(阳性率2.22% 8/361)。2018~2021年每年均有不同病毒检出,但阳性单位数和病毒阳性率均呈逐年下降趋势。至2021年,仅有1家单位(3.13% 1/32)检出小鼠肝炎病毒且阳性率降为0.30%(2/670),仙台病毒阳性率降为0.15%(1/670),32家单位均未检出小鼠细小病毒。此外还发现,对于小鼠肺炎病毒和小鼠呼肠孤病毒Ⅲ型,这5年来的血清抗体阳性检出率则呈现逐年上升的趋势:2017年仅1家单位(6.67% 1/15)检出小鼠肺炎病毒(阳性率1.11% 4/361),2019年增长为2家单位(阳性率2.84% 17/598),至2021年该2家单位(6.25% 2/32)小鼠肺炎病毒血清抗体阳性检出率为(2.39% 16/670);而2019年1家单位(5.00% 1/20)检出小鼠呼肠孤病毒Ⅲ型(阳性率0.17% 1/598),至2021年,该单位(3.13% 1/32)依旧有检出(阳性率0.45% 3/670)且比率较过去2年有所增加。

图5 2017~2021年陕西地区SPF级小鼠病毒抗体检测结果Figure 5 Virological test results of SPF mice in Shaanxi from 2017 to 2021
大鼠血清抗体阳性以仙台病毒、大鼠细小病毒、小鼠肺炎病毒和大鼠冠状病毒为主(表4、图6)。其余必检项目5年内均未检出。其中,仙台病毒每年均有检出,但阳性率从最初的3家单位(60.00% 3/5)的7.07%(8/113)降低为2021年1家单位(7.69% 1/13)的0.83%(1/120);大鼠细小病毒和大鼠冠状病毒抗体阳性仅2017年和2018年在个别单位有检出,此后2019~2021年连续3年各单位均未检出;值得注意的是,小鼠肺炎病毒血清抗体阳性率却由最初1家单位(20.00% 1/5)的0.88%(1/113)增长为3家单位(23.08% 3/13)的(10.00% 12/120)。
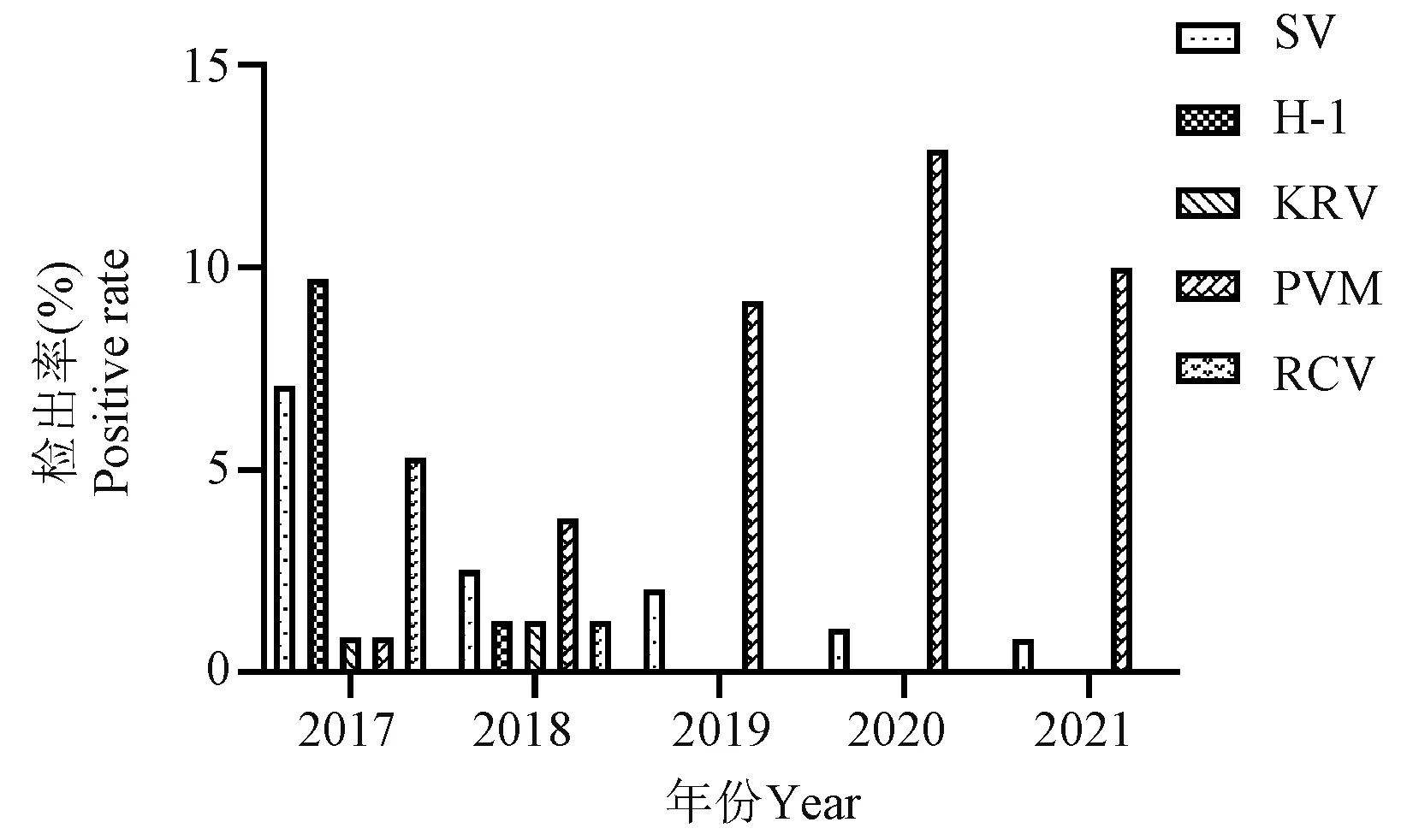
图6 2017~2021年陕西地区SPF级大鼠病毒抗体检测结果Figure 6 Virological test results of SPF rats in Shaanxi from 2017 to 2021
3 讨论
随着生命科学的发展与实验动物许可证制度的不断完善,实验动物质量监测显得尤为重要[12]。定期的质量监测,不仅能够为实验动物的生产和使用提供科学依据,同时也能及时发现实验动物饲养中存在的问题,消除实验动物携带的人畜共患病原体,减少实验动物在生产和使用过程中对人群的感染[13]。对于实验动物使用单位而言,动物质量监测的缺失会导致日常管理出现盲区,动物一旦感染烈性传染病如鼠痘等,可导致整个动物群全军覆没,造成巨大损失[14]。
通过对2017~2021年陕西省实验动物使用单位饲养的SPF级大、小鼠质量抽检结果的分析,发现5年间,陕西地区抽检单位和动物的数量均有所增长,从侧面反映出本地区实验动物使用数量的稳步提升。但值得注意的是,各单位使用的动物质量还存在着一定的问题,总体趋势是病原微生物感染降幅明显,但个别微生物感染控制水平有待提升。具体表现在寄生虫方面,大、小鼠中主要存在体外寄生虫(螨虫)、肠道鞭毛虫和蠕虫的感染(表2);细菌方面存在金黄色葡萄球菌、沙门菌、绿脓杆菌、肺炎克雷伯杆菌、肺炎链球菌、泰泽病原体和支原体的感染(表3);病毒方面则以小鼠肝炎病毒、仙台病毒、小鼠肺炎病毒、小鼠细小病毒、小鼠呼肠孤病毒Ⅲ型、大鼠细小病毒和大鼠冠状病毒血清抗体阳性为主(表4)。在我国广东、四川等地区也有金黄色葡萄球菌和绿脓杆菌检测阳性的报道[15-16]。2014~2019年北京地区实验动物质量抽检结果中,鼠群检出的病原微生物以细小病毒、泰泽病原体、绿脓杆菌、金黄色葡萄球菌等为主[17-18]。可见,本地区与国内其它地区实验鼠群病原体污染的流行趋势基本一致。我国现行标准《实验动物 微生物学等级及监测》中明确规定金黄色葡萄球菌、绿脓杆菌、肺炎克雷伯杆菌是SPF级实验大、小鼠必须检测和排除的病原菌[6],但上述病原菌均属于条件性致病菌,可正常存在于动物体内和环境中,只有当动物免疫功能低下时方可感染动物。国外多数企业将其作为环境监测的参考指标,当认为该病原体可能会对正在进行的实验存在干扰时才进行监测[19-21]。对病原微生物来源进行调查发现,实验动物感染病原微生物主要集中在3个方面:一是来自病原微生物控制不明确的实验动物,占病原微生物来源的83.33%(20/24)。感染动物主要来自于各单位构建的基因编辑动物,其微生物质量状况不明确,造成动物间交叉感染。二是来自实验物品、生物试剂和实验人员的污染,占病原微生物来源的12.50%(3/24)。动物实验区域人员流动频繁,个别实验人员生物安全意识不强,物品消毒灭菌不彻底,洁净与非洁净区域实验仪器、试剂及物品交叉混用,感染性实验废弃物的不规范处置均可造成动物感染。三是屏障设施管理存在漏洞,占病原微生物来源的4.17%(1/24)。饲料、垫料和饮水灭菌消毒不彻底,或是存在污染死角,设施设计及布局的缺陷等均可导致病原微生物的入侵。
针对以上实验动物使用单位的大、小鼠感染现状,在陕西省实验动物管理委员会和专家的监督与指导下,对检测不合格动物所在区域实行了严格消杀处理:不符合SPF级标准要求的实验动物(C57BL/6J、BALB/c小鼠和SD大鼠等),须立即停止实验、处死感染动物并封锁该区域。区域内所有动物分区域、分批次进行病原筛查,及时淘汰病原(血清抗体)阳性动物(或整个种群),对房间环境及IVC系统进行彻底消毒,检测合格后重新引进质量合格的动物开展实验。同时对同房间内其他小鼠进行严密监控,每隔两周进行复查,确保没有交叉感染。珍稀的基因编辑小鼠则可经过相应的生物净化后(剖腹产、胚胎移植或体外受精),采用两次检测法确定是否达到SPF级要求,即在目标小鼠离乳后检测代孕母鼠,分窝留种后检测淘汰的仔鼠,只有两次检测均符合SPF标准方可判定净化合格。合格的基因编辑鼠群转移至微生物最高级别控制区域进行饲养,加强区域管控和环境消毒,严防病原微生物侵入,动物一旦出现污染,立即转入低级别饲养区,待重新进行生物净化后返回。此外,还需加强饲养和实验人员生物安全、消毒灭菌等专业知识的培训,降低动物感染的风险[22]。
上述整改措施的实施,极大改善了本地区各使用单位实验动物病原微生物的感染状况,阳性动物检出率总体呈逐年下降趋势。其中,肺炎克雷伯杆菌、肺炎链球菌和绿脓杆菌等细菌感染动物已经连续4年未检出。然而,肠道蠕虫、小鼠肺炎病毒、小鼠呼肠孤病毒Ⅲ型连续5年均有检出且呈现缓慢增长的趋势,这是因为检出的动物都属于正在实验的动物或珍稀的基因编辑动物,无法淘汰处理,仅靠隔离与消毒,病原防治比较困难。带毒(虫)动物也容易造成周围动物的交叉感染,只有通过微生物净化才能彻底清除病原感染[23]。
通过对陕西省2017~2021年实验动物使用单位屏障环境饲养的SPF级大小鼠病原微生物监测结果的分析,了解到本地区实验动物质量得到较大改善,但也暴露出很多问题。作为实验动物质量检测机构,要坚持不懈的进行日常病原微生物监测,加强生物安全宣传,促使相关单位明确实验动物质量对本行业及生物医药卫生事业的发展至关重要。同时,督促各使用单位持续采取严格的生物安全防控措施,不断提高实验动物饲养管理水平。只有检测机构与各单位相互配合,才能不断降低实验动物病原感染风险,提高实验动物质量,为生命科学的发展提供强有力的支撑。

