重度血小板减少症患者预后列线图的构建和验证
张海琴, 王海波, 顾永梅
(南通大学附属海安医院 重症监护室, 江苏 海安, 226600)
血小板是由骨髓中的巨核细胞系产生, 参与止血和血栓形成的生理和病理过程, 是人体血细胞的主要组成成分。血小板消耗增加、生成受损或被严重破坏可导致不同程度的血小板减少。血小板减少根据血小板的绝对值可分为轻度减少[(100~149)×109/L]、中度减少[(50~<100)×109/L]和重度减少(<50×109/L)。超过60%的重症监护病房(ICU)患者可出现血小板减少症,其中2.3%~27.0%患者出现重度血小板减少症[1-2], 这是ICU止血障碍的最常见原因,血小板减少症与较高的出血和输血风险密切相关[3]。尽管导致血小板减少的机制各不相同,但重度血小板减少症提示危重症患者的临床预后较差[4-5]。列线图是一种直观且易于使用的预测工具,其效能已在多种疾病的早期诊断和预后评估中得到证实[6-7]。本研究通过筛选影响重度血小板减少症患者死亡风险的危险因素,探讨列线图模型用于预测死亡风险的价值,现报告如下。
1 资料与方法
1.1 一般资料
回顾性总结2020年5月—2022年5月在本院确诊重度血小板减少症的340例患者临床资料,按7∶3的比例随机分为模型组238例和验证组102例。纳入标准: ① 年龄>18岁者; ② 入院24 h内检测血常规且符合重度血小板减少症的诊断标准者; ③ 疾病原因明确并接受适合的临床治疗者; ④ 临床资料完整者。排除标准: ① 反复出现不明原因的血液系统疾病者; ② 入院前已经进行血小板输注治疗者; ③ 病情严重者,入院72 h内死亡; ④ 妊娠期、哺乳期女性。本研究经过医院伦理委员会批准(编号: HARY-202009)。
1.2 研究方法
根据住院期间患者是否死亡,对模型组死亡与存活患者的临床资料进行单因素和多因素Logistic回归分析以筛选主要危险因素,应用R软件构建列线图模型。本研究参照文献[1, 3, 5]的相关标准,纳入与患者预后紧密相关的临床资料,主要包括性别、年龄、体质量指数、基础疾病(脑血管疾病、慢性肺疾病、肝脏疾病、糖尿病、恶性肿瘤和脓毒症)、生命体征(体温、血氧饱和度、心率、平均动脉压和呼吸频率)、序贯器官功能衰竭评估(SOFA)评分和简化急性生理学评分Ⅱ(SAPS Ⅱ)评分、机械通气、血小板输注、血管升压药、持续肾脏替代治疗(CRRT)、实验室指标(白细胞计数、血红蛋白、血糖、血肌酐、尿素氮、凝血时间、红细胞分布宽度和丙氨酸氨基转移酶)。
1.3 统计学方法
应用SPSS 25.0统计学软件进行数据分析。比较模型组与验证组患者临床资料的差异性,符合正态分布的计量资料以均数±标准差表示, 2组间比较采用两独立样本t检验; 偏态分布的计量资料以中位数和四分位数表示, 2组间比较采用Mann-WhitneyU检验。计数资料以例数和百分比表示, 2组间比较采用χ2检验。使用单因素和多因素Logistic回归分析筛选影响患者死亡的独立危险因素,采用逐步后退法(纳入标准0.10, 剔除标准0.05)。采用R软件中rms软件包,根据筛选的主要危险因素对应权重值构建列线图模型,然后进行验证,具体包括Bootstrap法计算C-index值、校准曲线和决策曲线分析,采用受试者工作特征(ROC)曲线计算曲线下面积(AUC), 并与SOFA评分和SAPS Ⅱ评分的AUC值比较,采用Z检验。取双侧检验水准0.05, 以P<0.05为差异有统计学意义。
2 结 果
2.1 模型组与验证组临床资料比较
模型组与验证组患者的临床资料比较,差异无统计学意义(P>0.05), 符合随机化原则,具有可比性。见表1。
表1 模型组与验证组临床资料比较中位数(四分位数)][n(%)]
2.2 模型组患者死亡的危险因素分析
对模型组死亡与存活患者的临床资料分别进行单因素和多因素Logistic回归分析,结果显示脑血管疾病、恶性肿瘤、机械通气、血管升压药、CRRT和凝血时间延长是影响重度血小板减少症患者死亡的独立危险因素(P<0.05), 见表2。
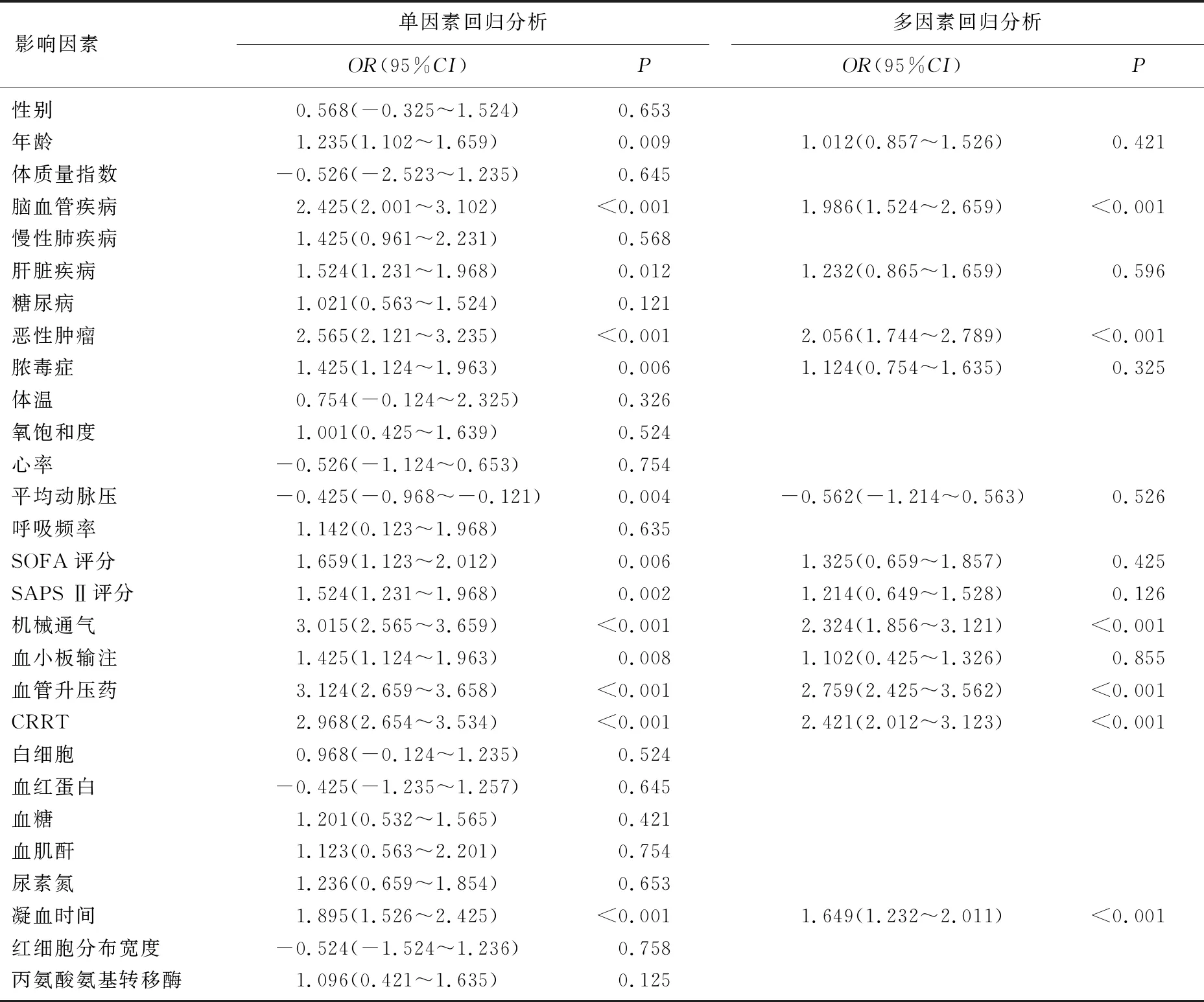
表2 模型组患者死亡的危险因素分析
2.3 重度血小板减少症死亡的列线图模型
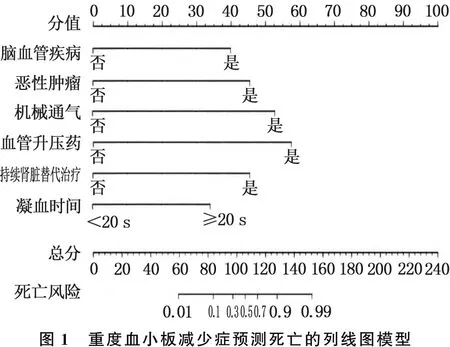
应用R软件根据多因素Logistic回归分析筛选的独立危险因素构建列线图,总分240分。以1例重度血小板减少症未合并脑血管疾病患者为例,分值为0分; 合并恶性肿瘤,分值为45分; 应用机械通气治疗,分值为52分; 应用血管升压药,分值为56分; 未进行CRRT, 分值为0分; 凝血时间为21.5 s, 分值为35分; 各项相加得到总分为188分,对应死亡风险远大于0.99, 提示该患者病死率极高。见图1。
2.4 列线图的验证
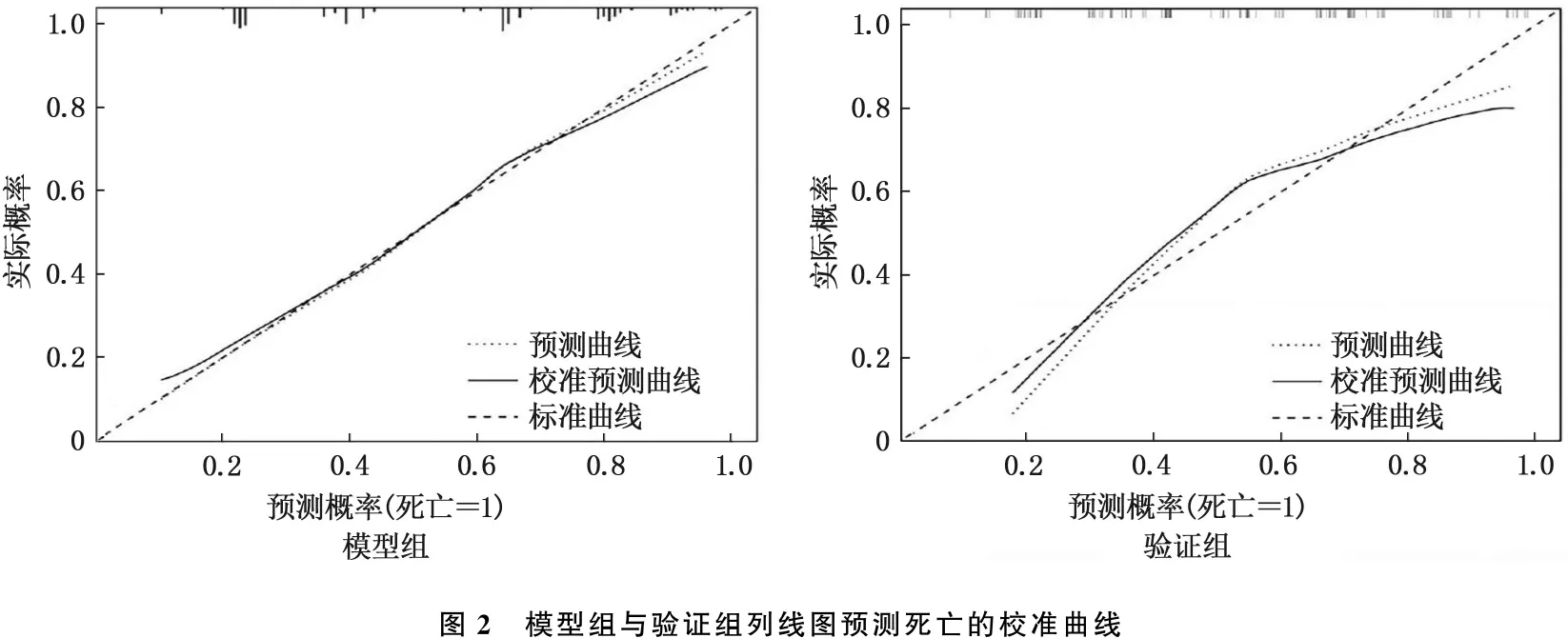
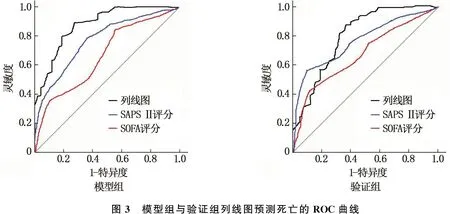
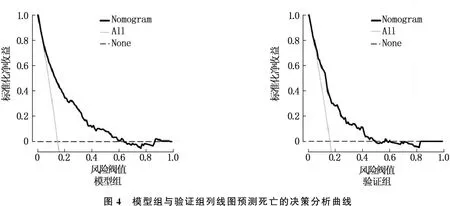
Bootstrap法计算模型组与验证组的C-index值分别为0.912和0.879, 表明模型的预测效能较好。校准曲线显示模型组与验证组的预测概率与实测值基本一致,见图2。ROC曲线计算模型组与验证组的AUC分别为0.889和0.856, 表明预测准确性较高。列线图较SOFA评分、SAPS Ⅱ的AUC均增大,差异有统计学意义(P<0.001), 见图3。决策曲线显示,模型组列线图模型预测重度血小板减少症患者死亡的标准化净收益阈值为0.18~0.6, 验证组列线图模型预测死亡的标准化净收益阈值为0.18~0.5, 2组的临床净获益比均较好。见图4。
3 讨 论
血小板减少症既可以是原发疾病,也可以是其他疾病的并发症[8], 尤其是重度血小板减少症患者的死亡风险极高,早期对患者进行危险分层是采取积极有效的干预策略的前提。既往研究[9-10]筛选了多种指标如年龄、基础疾病、临床治疗策略、血肌酐、超敏C反应蛋白等,并认为其与患者预后有关,但是任何单一指标预测患者预后的效能均有限,尚不能推广应用。
本研究对模型组进行多因素Logistic回归分析,结果显示脑血管疾病、恶性肿瘤、机械通气、血管升压药、CRRT和凝血时间延长是重度血小板减少症患者死亡的独立危险因素(P<0.05), 其中脑血管疾病患者死亡风险是无脑血管疾病患者的1.986倍,恶性肿瘤患者死亡风险是无恶性肿瘤患者的2.056倍,应用机械通气患者死亡风险是无机械通气患者的2.324倍,应用血管升压药患者死亡风险是无血管升压药患者的2.759倍, CRRT患者死亡风险是无CRRT患者的2.421倍,凝血时间延长1个标准差的死亡风险增加0.649倍。有研究[11-12]认为高龄也是导致重度血小板减少症患者死亡的不利因素。罹患脑血管疾病和恶性肿瘤可能是导致重度血小板减少症的重要原发疾病,可导致机体血小板内环境稳态失衡[13-14]。脑血管疾病往往需要抗血小板治疗,这将进一步恶化血小板减少症[15-16]。恶性肿瘤往往需要放化疗,这会进一步破坏血小板功能、降低血小板数量,同时加重机体免疫功能损伤[17]。机械通气、使用血管升压药和CRRT是重度血小板减少症的重要临床支持治疗方法[18-19]。凝血时间是反映机体凝血系统功能的重要指标,重度血小板减少症有微血管衰竭、器官功能障碍和凝血障碍,这些都会增加出血风险[20-23]。
本研究的列线图经多维度验证后具有较好的预测性能。与传统的危重症患者评分系统(SOFA[24]和SAPS Ⅱ[25])相比,列线图模型的风险分层具有更高的临床效益。本研究的局限性为: ① 本研究结果基于单中心回顾性总结,病例选择仍然存在较大可能的偏倚性,影响结果的可靠性; ② 本研究尽管进行了多维度内部验证,但缺乏外部数据的支撑,后续需多中心、前瞻性临床随机对照试验进行验证。
综上所述,重度血小板减少症患者有较高的死亡风险,利用列线图模型能够更好地指导临床医生早期识别死亡高风险人群并进行早期积极干预,改善预后。

