IABP辅助循环救治急性心肌梗死术后并发心源性休克患者的效果研究
张贺川 任明芬
摘要:目的 探究主动脉球囊反搏(IABP)辅助循环救治急性心肌梗死(AMI)术后并发心源性休克(CS)患者的预后情况及其影响因素。方法 回顾性收集2020年1月~2022年1月在驻马店市中心医院重症监护室接受IABP辅助循环治疗的90例AMI术后并发CS患者的临床资料,根据患者出院后1年后临床结局将患者分为生存组和死亡组,生存组61人,死亡组29人。应用Logistic回归分析患者预后影响因素,并使用受试者工作特征(ROC)曲线分析左室射血分数(LVEF)、左室舒张末期内径(LVEDD)、平均动脉压(MAP)对预后的预测价值。结果 生存组LVEF、SVI、CI、MAP均显著高于死亡组,其余指标均均低于死亡组(P<0.05);低LVEF、高LVEDD、低MAP是影响IABP辅助循环治疗AMI术后并发CS患者预后的危险因素(P<0.05);LVEF、LVEDD、MAP均对预测IABP辅助循环治疗AMI术后并发CS患者的预后有一定价值,其中三者联合检测预测价值最高。结论 LVEF、MAP降低,LVEDD升高提示AMI术后并发CS患者的死亡风险增加。
关键词:主动脉球囊反搏;急性心肌梗死;心源性休克
主动脉球囊反搏(IABP)是临床挽救急性心肌梗死(AMI)并发心源性休克(CS)患者生命的常用治疗手段,对减轻CS患者左心负荷、保持其血流稳定有重要意义[1~2]。本研究旨在探究IABP辅助循环救治AMI术后并发CS患者的预后情况及影响因素。
1对象与方法
1.1 一般资料
回顾性收集2020年1月~2022年1月在驻马店市中心医院重症监护室接受IABP辅助循环治疗的90例AMI术后并发CS患者的临床资料,根据患者出院1年后临床结局将患者分为生存组和死亡组生存组61人,死亡组29人。生存组男34例,女27例;年龄51~69岁,平均年龄(59.71±7.24)岁;梗死部位:前壁31例,下壁19例,高侧壁11例。死亡组男16例,女13例;年龄58~79岁,平均年龄(68.89±6.37)岁;梗死部位:前壁14例,下壁9例,高侧壁6例。两组性别、梗死部位比较无显著性差异(P>0.05)。
纳入标准:均进行经皮冠状动脉介入治疗;年龄≥18岁;美国心血管造影和介入协会心源性休克分期C~E期。
排除标准:临床资料不完整;合并严重血管病变;感染、血容量不足等其他原因导致的休克;上机前心肺复苏时间>30 min;合并多器官功能衰竭;入院24 h内死亡。
1.2 研究方法
常规治疗:氧疗、强化降脂、抗血小板聚集、强心、扩冠、营养心肌等,在此基础上采用IABP治疗。采用Seldinger法穿刺股动脉,置入合适的球囊反搏导管,连接主动脉内球囊反搏泵(型号:IAP-0701)。根据患者具体情况选择心电图/压力触发模式,设置反博比例1:(1~3)。治疗过程中给予肝素钠抗凝。当患者病情稳定且能够耐受1:4的反搏比例时考虑撤机。
1.3 观察指标
(1)心功能相关指标:主要包括左室射血分数(LVEF)、左室舒张末期内径(LVEDD)情况、中心静脉压(CVP)、平均动脉压(MAP)、每搏输出指数(SVI)和心脏指数(CI)。
(2)生化指标:主要观察肌钙蛋白I(cTnI)、肌酸激酶同工酶(CK-MB)、B型脑钠肽(BNP)、血清肌酐(SCr)水平和血乳酸(Lac)水平。
(3)观察两组病变支数、血管活性药物使用剂量。
(4)并发症发生情况。
1.4 统计学方法
数据处理采用SPSS23.0统计学软件,所有数据均符合正态分布,计量资料以(±s)表示,采用t检验,计数资料用比率表示,采用χ2检验,并进行多因素回归分析,P<0.05为差异具有统计学意义。
2结果
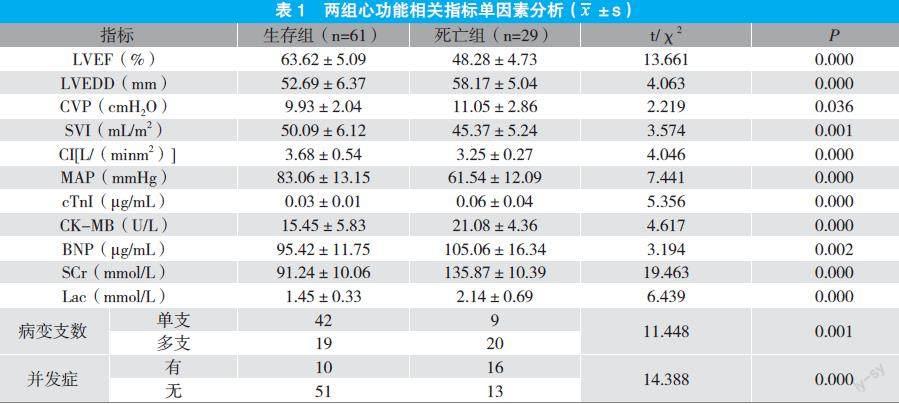
2.1 两组心功能相关指标单因素分析
生存组LVEF、SVI、CI、MAP均顯著高于死亡组,其余指标均显著低于死亡组(P<0.05)。见表1。
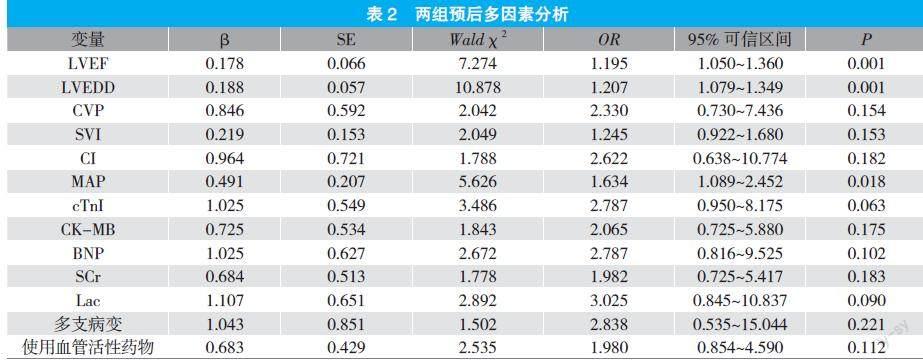
2.2 两组预后多因素分析
LVEF、LVEDD、MAP是影响IABP辅助循环治疗AMI术后并发CS患者预后的危险因素(P<0.05)。见表2。
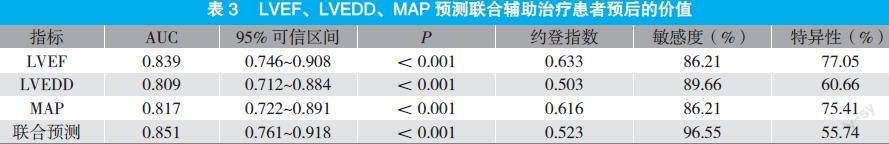
2.3 LVEF、LVEDD、MAP预测IABP辅助循环治疗患者预后的价值
LVEF约登指数最大时对应cut-off为46.37%,AUC为0.839,敏感度为86.21%,特异性为77.05%;LVEDD约登指数最大时对应cut-off为51.52 mm,AUC为0.809,敏感度为89.66%,特异性为60.66%;MAP约登指数最大时对应cut-off为69.61 mmHg,AUC为0.817,敏感度为86.21%,特异性为75.41%;联合检测预测效能最高,AUC为0.851,敏感度为96.55%,特异性为55.74%。见表3。
3讨论
CS是一种及其危险的疾病,若没有得到及时、有效的治疗,患者极其容易死亡。同时受持续血液灌注不足影响,AMI并发CS患者心肺残存功能有限,因此,在维持重要器官氧供的前提下,减少心脏做功、降低心肌氧耗并尽早血运重建是挽救AMI术后并发CS患者生命的前提[3]。IABP利用机械性辅助循环提高主动脉内舒张压,降低心脏后负荷,对改善AMI并发CS患者心功能和微循环灌注不良有积极意义。且相较于体外膜肺氧合等其他循环辅助装置,IABP更加便捷,并发症更少。但IABP治疗也存在一定局限,既往研究表明60%~80%的患者在进行IABP治疗后会发生反搏依赖,同时易出现出血、主动脉破裂、穿孔等并发症[4]。因此,对于IABP治疗后生存方面是否获益目前尚无统一结论。
本研究结果显示,生存组LVEF、SVI、CI、MAP高于死亡组,LVEDD、CVP、cTnI、CK-MB、BNP、SCr、Lac、病变支数、血管活性药物使用剂量低于死亡组;且在LVEF、MAP水平降低,LVEDD水平升高的情况下,AMI术后并发CS患者死亡风险增加。心肌灌注是AMI术后并发CS患者较强的死亡预测因子,AMI并发CS患者部分心肌发生坏死,常导致心肌收缩力下降,组织灌注不足。而LVEDD、LVEF能够检测心肌收缩功能,AMI术后并发CS患者LVEDD越低、LVEF越高,心肌血液灌注恢复越好,预后越好[5]。同时,MAP也是反映患者心肌灌注功能的重要指标,MAP下降易导致心脏等重要器官供血不足,进而引发器官衰竭,对患者生命造成威胁。
综上所述,LVEDD、SVI、MAP及联合检测对提示AMI术后并发CS患者死亡风险有预测价值。
参考文献
[1]田夏秋,王粮山,李呈龙,等.联合血管活性药物-正性肌力药物评分及乳酸预测体外膜肺氧合辅助心脏术后心源性休克患者的预后[J].中华胸心血管外科杂志,2023,39(9):568-572.
[2]李林蔚,成宪武.ECMO在急性心肌梗死合并心源性休克中的研究进展[J].中国实验诊断学,2022,26(1):125-127.
[3]崔晓娜,冯瑞霞,韩雨澎,等.静脉-动脉体外膜肺氧合和主动脉内球囊反搏联合辅助顺序对急性心肌梗死合并心源性休克患者的临床效果比较研究[J].中国全科医学,2023,26(35):4439-4445.
[4]赵卓贤,梁海青,王钊,等.基于美国心血管造影和介入学会心源性休克分类评估主动脉内球囊反搏与预后的关系[J].中华医学杂志,2023,103(10):752-756.
[5]廖付军,鲍海龙,韦波,等.VA-ECMO联合IABP在急性心肌梗死PCI术后并发难治性心源性休克中的应用[J].临床心血管病杂志,2021,37(11):992-997.

