101例腹壁子宫内膜异位症临床特点与诊治分析
冯晓倩 张钦山 赵晓阳 刘弘扬 刘静 封全灵
【摘要】 目的:分析101例腹壁子宮内膜异位症(AWE)患者的临床特点及诊治情况。方法:回顾性分析2017年6月—2022年12月郑州大学第三附属医院收治的101例AWE患者的病例资料,按病灶最深浸润部位分为皮下型组和肌肉型组。分析两组发病年龄、临床症状、潜伏期、病程、剖宫产次数、糖类抗原125(CA125)数值、催乳素(PRL)、阴道微生态情况、治疗方法、复发率等。结果:两组的年龄、剖宫产次数、潜伏期、病程相比,差异均无统计学意义(P>0.05);两组病灶直径、术中出血量、手术时间及彩超血流情况比较,差异均有统计学意义(P<0.05)。两组血清CA125水平进行比较,差异有统计学意义(P<0.05)。两组血清PRL水平进行比较,差异无统计学意义(P>0.05)。85例患者术前行阴道微生态分析,其中22例(25.88%,22/85)存在微生态失衡问题。101例患者均行手术治疗,术后成功随访87例,随访时间3~60个月,术后总复发率3.45%。结论:AWE常继发于剖宫产术后,主要症状多为腹壁瘢痕周围结节和/或周期性疼痛,超声检查有助于AWE的诊断,手术是AWE的主要治疗手段。
【关键词】 腹壁子宫内膜异位症 临床特点 临床分型 剖宫产 阴道微生态
Clinical Characteristics, Diagnosis and Treatment Analysis of 101 Cases of Abdominal Wall Endometriosis/FENG Xiaoqian, ZHANG Qinshan, ZHAO Xiaoyang, LIU Hongyang, LIU Jing, FENG Quanling. //Medical Innovation of China, 2023, 20(36): -123
[Abstract] Objective: To analyze the clinical characteristics, diagnosis and treatment situation of 101 patients with abdominal wall endometriosis (AWE). Method: The case data of 101 AWE patients admitted to the Third Affiliated Hospital of Zhengzhou University from June 2017 to December 2022 were retrospectively analyzed, they were divided into the subcutaneous group and the muscle group according to the deepest infiltration site of the lesion. The age of onset, clinical symptoms, incubation period, course of disease, number of cesarean section, carbohydrate antigen 125 (CA125) value, prolactin (PRL) value, vaginal microecology, treatment method, recurrence rate and so on in two groups were analyzed. Result: There were no significant differences in age, number of cesarean sections, latency and course of disease between the two groups (P>0.05); there were significant differences in lesion diameter, intraoperative blood loss, operative time and ultrasound blood flow situation between the two groups (P<0.05). The difference in serum CA125 level between the two groups was statistically significant (P<0.05). The difference in serum PRL level between the two groups was not statistically significant (P>0.05). A total of 85 patients underwent vaginal microecological analysis before surgery, of which 22 (25.88%, 22/85) had microecological imbalance. All 101 patients received surgical treatment, and 87 patients were followed up successfully after surgery, with a follow-up time of 3 to 60 months. The total recurrence rate was 3.45%. Conclusion: AWE is often secondary to post-caesarean section, and the main symptoms are nodule around scar in abdominal wall and/or periodic pain. Ultrasound examination is helpful for the diagnosis of AWE, surgery is the main treatment for AWE.
[Key words] Abdominal wall endometriosis Clinical characteristics Clinical classification Caesarean section Vaginal microecology
First-author's address: The Third Affiliated Hospital of Zhengzhou University, Zhengzhou 450000, China
doi:10.3969/j.issn.1674-4985.2023.36.028
子宫内膜异位症(endometriosis,EMT)是一种良性雌激素依赖性疾病,其特征是子宫内膜组织在子宫腔外生长。异位内膜最常见的植入部位是盆腔,较少发生在盆腔外,腹壁是最常见的盆腔外子宫内膜异位部位[1]。腹壁子宫内膜异位症(AWE)是指腹壁皮下脂肪层和/或腹壁肌肉中存在子宫内膜异位浸润[2]。腹壁子宫内膜异位症主要分为两种类型,原发性和继发性AWE。原发性AWE发生在无瘢痕的腹部,继发性AWE更常见地发生在腹部手术瘢痕部位,其病因可能是由于子宫内膜细胞在腹部-盆腔手术中通过医源性过程直接植入腹壁软组织[3]。近年来随着剖宫产率的增加,腹壁子宫内膜异位症的发病率也在逐年上升,临床医生也更加重视AWE的诊断和治疗,本文回顾性分析101例AWE患者的临床资料,就AWE的临床分型、临床特点、诊疗方法及复发情况进行总结分析,现报道如下。
1 资料与方法
1.1 一般资料
回顾性分析2017年6月—2022年12月郑州大学第三附属医院收治的101例AWE患者的病例资料。所有患者均接受持续硬膜外麻醉或全麻下子宫内膜异位病灶切除术,手术切缘至病灶外0.5 cm的正常组织,术后经病理学证实为腹壁子宫内膜异位症。术后随访至2023年3月。回顾分析患者的发病年龄、首发症状、潜伏期、病程、剖宫产次数、糖类抗原125(CA125)数值、催乳素(PRL)数值、分型、治疗、复发率等。纳入标准:(1)年龄在18岁至绝经前;(2)经病理组织检查为腹壁子宫内膜异位症;(3)手术前3个月未行激素类药物治疗;(4)均为剖宫产后首次确诊的AWE患者。排除标准:(1)有严重肝肾功能障碍及自身免疫性疾病病史;(2)妊娠期或哺乳期;(3)有严重不良反应;(4)合并子宫肌瘤或子宫腺肌症。本研究经本院医学伦理委员会批准。
1.2 方法
根据AWE的病灶最深浸润部位分为两型,(1)皮下型:病灶大部分位于皮下脂肪层,未达腹直肌前鞘筋膜或侵及腹直肌前鞘筋膜、但未侵及肌肉。(2)肌肉型:病灶最深部位穿透腹直肌鞘并侵及腹直肌,或者病灶均在腹直肌内或侵及腹膜。皮下型组有39例患者,肌肉型组有62例患者。发病潜伏期指末次开腹手术至出现症状的时间,病程指出现症状到手术治疗时间。
1.3 统计学处理
采用SPSS 25.0统计学软件,计量资料中服从正态分布的数据以(x±s)描述,不服从正态分布的以M(P25,P75)表示,两个独立样本定量资料服从正态分布用单因素方差分析,不服从正态分布用Mann-Whitney U检验;计数资料组间比较采用字2检验或Fisher确切概率法。以P<0.05为差异有统计学意义。
2 结果
2.1 基线资料
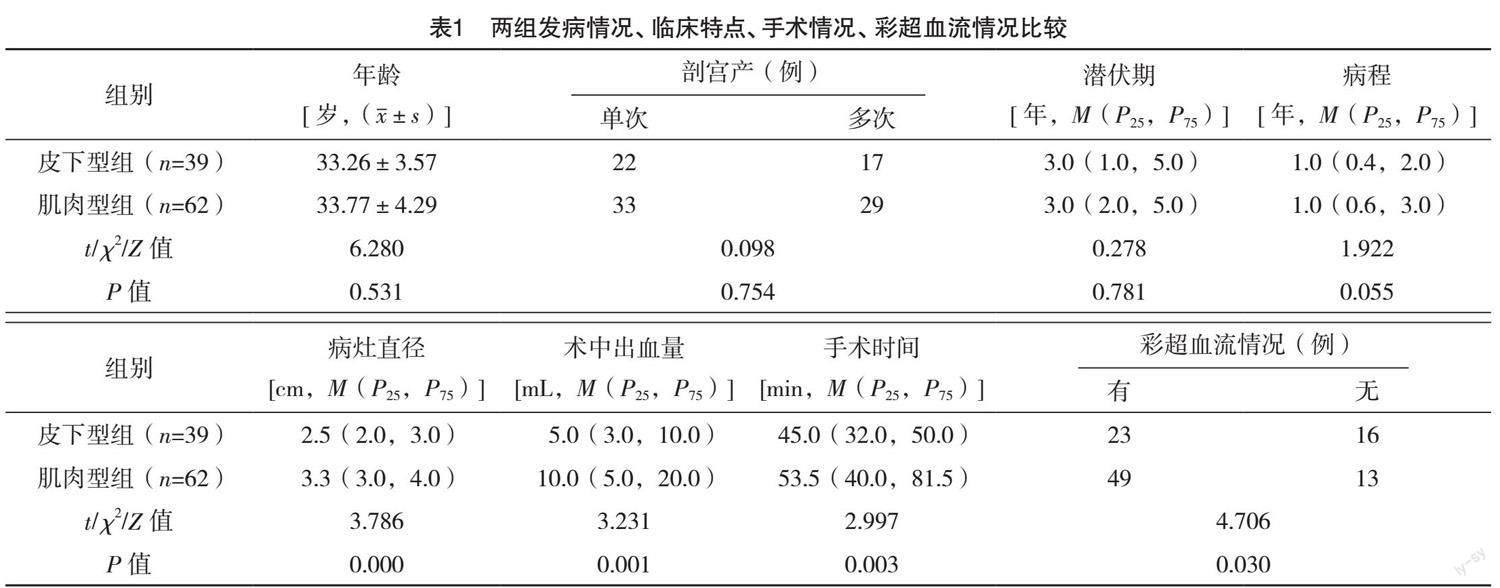
患者年龄23~39岁,平均(33.57±4.02)岁;发病潜伏期1个月~14年[3(1.75,5)年];病程7 d~6年[1(0.5,2.0)年];101例患者均有剖宫产史,既往剖宫产次数1~3次,其中单次剖宫产史者占54.46%(55/101),多次(2次及以上)剖宫产史者占45.54%(46/101)。
2.2 症状和体征
101例患者中,99例(99/101,98.02%)患者就诊时可触及腹壁肿块,96例(96/101,95.05%)有腹壁切口处疼痛,在有腹痛症状的患者中,其中92例(92/96,95.83%)的腹痛症状与月经周期具有相关性。2例(2/101,1.98%)无明显自觉症状,体检时影像学检查提示AWE诊断遂来就诊。
2.3 两组发病情况、临床特点、手术情况、彩超血流情况比较
两组的年龄、剖宫产次数、潜伏期、病程比较,差异均无统计学意义(P>0.05)。两组的病灶直径比较,差异有统计学意义(P<0.05);两组术中出血量比较,差异有统计学意义(P<0.05)。两组的手术时长及彩超血流情况比较,差异均有统计学意义(P<0.05)。见表1。
2.4 诊断结果
2.4.1 超声检查结果 101例患者术前均行超声检查提示AWE诊断,超声诊断符合率95.05%(96/101)。腹壁浅表超声多提示不均质低回声结节,结节个数为1~5个,其中单发结节者77例 (76.24%,77/101),多发结节者(2个及2个以上结节)24例(23.76%,24/101)。101例患者中72例
(71.29%,72/101)病灶内部或其周边可探及点状或丰富血流信号,其中皮下型组患者有23例(31.94%,23/72),肌肉型组患者有49例(68.06%,49/72)。29例(28.71%,29/101)患者病灶内部或周围未及明显血流信号。皮下型和肌肉型两组间超声提示有无血流信号情况相比,差异有统计学意义(字2=4.706,P<0.05)。見表1。
2.4.2 血清CA125水平 84例(83.17%,84/101)患者术前检测血清CA125值为25.9(15.4,37.1)U/mL
(参考值0~35 U/mL)。33例患者CA125数值大于35 U/mL,
占39.29%。35例(41.67%,35/84)皮下型组AWE患者血清CA125数值为18.7(12.5,25.8)U/mL;49例(58.33%,49/84)肌肉型组AWE患者血清CA125数值为35.5(22.8,37.9)U/mL。对两组血清CA125水平进行比较,差异有统计学意义(Z=-3.257,P<0.05)。
2.4.3 血清PRL水平 63例(62.38%,63/101)患者术前检测血清PRL值为455.0 (282.0,853.0)mIU/L
(参考值115~836.2 mIU/L)。17例患者(26.98%,17/63)PRL>836.2 mIU/L。22例(34.92%,22/63)血皮下型AWE患者清PRL数值为371.0 (274.8,904.5)mIU/L。41例(65.08%,41/63)肌肉型AWE患者血清PRL数值为492.4 (290.5,801.0)U/mL。对两组血清PRL水平进行比较,差异无统计学意义(Z=-0.461,P>0.05)。
2.4.4 阴道微生态情况 85例患者术前行阴道微生态分析,其中10例(11.76%,10/85)患有细菌性阴道炎,3例(3.53%,3/85)患有真菌性阴道炎,9例(10.59%,9/85)存在菌群失调问题,63例(74.12%,63/85)检测结果为正常菌群。
2.5 药物治疗、随访及复发情况
2.5.1 药物治疗 术前曾用药治疗患者有24例,其中口服消炎止痛药者4例,中药或中成药9例,口服避孕药2例,GnRH-a 9例,大多数患者术前用药效果不佳,仅可暂时缓解症状,但停药后立即复发。术后91例进行药物治疗,其中GnRH-a 74例,地诺孕素10例,口服避孕药3例,中成药2例,放置曼月乐环2例。
2.5.2 手术治疗 101例患者均行手术治疗,其中94例患者记录了病灶与切口的位置关系:位于切口右侧者48例(51.06%,48/94),位于切口左侧者28例(29.79%,28/94),位于切口中部者10例(10.64%,10/94),位于切口两侧者8例(8.51%,8/94)。
101例患者病灶大小1.5~6 cm[3.0(2.0,4.0)cm]。3例患者切除病灶后切口张力较大,术中同时行补片修补术,此3例均为肌肉型AWE患者,平均病灶大小5.17 cm。
2.5.3 随访与复发 101例患者中成功随访87例,随访时间3~60个月,其中术后药物治疗82例,2例(2.44%)复发,仅行手术治疗5例,1例(20.00%)复发,总复发率为3.45%(3/87)。此3例复发患者病灶直径平均值为5.83cm,且均为肌肉型AWE。
3 讨论
3.1 AWE的发生机制
EMT的发病机制目前主要有子宫内膜种植学说、诱导学说和体腔上皮化生学说[4]。桑普森首先提出了种植学说,这种观点认为,在月经期间,回流的子宫内膜细胞从输卵管逃逸,并植入周围的盆腔结构。这一理论也有助于解释AWE的发病机制,在剖宫产过程中,子宫内膜细胞通过子宫切口逸出并植入腹部伤口[5]。自发性AWE发生在无瘢痕腹部,种植学说不能解释此种AWE的发病机制,Teng等[6]研究认为,抗凋亡机制及免疫耐受机制的改变或与AWE的发病有关。本研究中,所有患者既往均有剖宫产手术史,Khan等[7]研究认为剖宫产是AWE发生的独立危险因素,与本研究相符合。
3.2 临床特征
AWE好发于育龄期女性,本研究中患者的平均年龄为(33.57±4.02)岁,与蒋梦雨等[1]研究中报道的平均年龄(32.54±4.69)岁结果较为一致。本研究中的AWE患者潜伏期3年(1.75,5)年,与文献[8]报道结果较为相似。腹壁子宫内膜异位症的典型症状是与腹壁切口附近包块相关的周期性疼痛[9]。本研究中99例(98.02%)患者就诊时可触及腹壁肿块,96例患者(95.05%)有腹壁切口处疼痛,无明显症状体检时发现者仅有2例,因此,依据病史、症状和体格检查,对于大多数AWE能做出正确的术前诊断。本研究发现皮下型和肌肉型AWE患者的病灶直径,手术时间和术中出血量,差异均有统计学意义,可能由于肌肉型AWE病灶处于血流更加丰富的肌层,病灶生长较快,侵及部位较深、范围较广,手术难度增加,手术时间、术中出血量、手术风险也随之相应增加,因此应早诊断、早发现、早治疗。
3.3 辅助检查结果
术前超声检查不仅准确率高,方便快捷,而且还可对AWE进行分型,有利于制订针对性的手术方案,做好麻醉方式、手术方式和相关合作科室的相应准备,本研究中超声诊断符合率95.05%(96/101),诊断准确率较高,因此术前常规检查可选取超声[10]。CT和MRI检查可更加精准的评估病灶大小及病灶与周围组织关系,但由于CT和MRI检查费用相对高昂,且操作便捷性不如超声,所以并不作为AWE的术前常规检查。但是对于怀疑恶变者,应完善CT、MRI检查,如需确诊需进一步行穿刺活检。对两种病变类型的血流信号情况进行比较,结果提示肌肉型AWE血流信号更加丰富,超声血流信号的检查对病灶位置分型也具有一定的指导意义。
血清CA125检查已经成为内异症的常用辅助检查项目,但对于AWE,其意义有待商榷。Barbosa等[11]研究发现,轻中度子宫内膜异位症患者的血清CA125水平无显著差异。黄坚等[12]认为,若将CA125的截断值定为35 U/mL时,其诊断AWE诊断的敏感度为21.43%。本研究中84例患者術前检测血清CA125,其中33例患者(39.29%,33/84)CA125数值大于35 U/mL,肌肉型AWE患者(n=49)CA125水平高于皮下型AWE患者(n=35),这一结果可能是因为肌肉型病灶相对较大且损伤范围广泛。可见CA125对AWE的诊断与分型判别有一定的价值。
PRL是垂体及垂体外细胞分泌的神经肽激素,垂体外分泌组织主要有子宫内膜、乳腺、淋巴结、胸腺、泪腺、汗腺、脾等。PRL具有多重效应,也是一种免疫调节因子,具有显著的生物活性功能。有文献报道,子宫内膜异位症女性的血清催乳素水平显著升高,但主要集中在盆腔子宫内膜异位症和子宫内膜异位症合并不孕症的患者中[13]。Lima等[14]认为血清催乳素水平较高可能与子宫内膜异位症的进展有关。本研究中有17例患者(26.98%,17/63)血清PRL水平超过参考值上限,这可能与AWE患者雌孕激素比值升高、异位内膜分泌PRL、异位病灶引起的疼痛所致的精神应激有关,也有研究认为PRL升高的原因可能与免疫反应有关,子宫内膜异位症女性的细胞免疫力下降,外周血中的NK细胞活性降低,由于免疫细胞活性降低,机体通过复杂的神经-内分泌-免疫调节,反馈性地调节升高PRL,从而激活免疫细胞[15-16]。因此血清PRL水平升高可在一定程度上协助诊断AWE。
阴道微生态系统主要包括阴道微生物群、个体内分泌系统、阴道局部免疫系统及阴道的解剖结构,在正常条件下其处于动态平衡中,并不引起疾病[17]。有研究表明微生物群可以通过影响宿主的表观遗传、免疫和/或生化功能在子宫内膜异位症的发展中发挥作用[18]。本研究中有22例AWE患者(25.88%,22/85)的阴道微生态发生了变化,目前对于子宫内膜异位症和阴道微生态的因果关系还存在争议,有研究认为,内异症是炎症性、免疫性疾病,该疾病的发生与发展影响了机体的免疫系统和内分泌系统[19],导致子宫内膜异位症患者容易发生阴道微生态失衡。目前关于阴道微生态与AWE的关系的研究相对较少,阴道微生态是否参与了AWE的发病及纠正阴道微生态失衡是否有利于AWE的治疗仍需进一步研究。
本研究中大部分病灶位于切口右側(51.06%,48/94),且大部分位于筋膜以下累及肌肉(61.39%,62/101),可能与剖宫产手术时主刀医生大多位于患者右侧,容易将子宫内膜带到切口右侧位置及肌层血流丰富,异位子宫内膜易于种植有关。有关研究表明药物治疗对AWE效果欠佳,目前手术是治疗AWE的最佳方式,本研究中术前有24例患者使用药物治疗,均效果不佳或用药后症状缓解但停药后复发,可能与AWE病灶被纤维组织包裹,药物不易到达病灶发挥效应有关,但也有学者认为术前用药可以控制症状、缩小病灶,有利于手术的顺利进行。术后大多数患者的症状都得到缓解,本研究中总复发率为3.45%,低于赵学英等[20-21]研究中的复发率,可能与本研究随访时间较短有关。目前尚无证据证明术后应用药物治疗能够降低AWE复发率,可能与术中已将病灶切除干净,没有病灶残留有关,需更大样本量的前瞻性研究去证实。
综上所述,AWE多发生于有剖宫产史或其他腹部手术史的育龄期女性,主要症状是腹壁肿块和腹部切口处周期性疼痛,应仔细询问病史及进行体格检查,影像学诊断首选超声,必要时可选择行CT或MRI确定病变范围及病灶与周围组织的关系从而确定手术方案。血清学检查CA125和PRL水平可在一定程度上协助诊断AWE。部分AWE患者存在阴道微生态失衡,但缺乏大数据支持和前瞻性研究验证。对于AWE患者术前药物治疗效果欠佳,手术切除病灶是最佳治疗方案,目前尚无证据支持术后药物治疗能够降低复发率,还需进一步探究术后药物治疗对AWE复发的影响。
参考文献
[1]蒋梦雨,李留霞,朱迎.腹壁子宫内膜异位症231例临床特点及诊治预后分析[J].中国实用妇科与产科杂志,2020,36(4):361-364.
[2] LEE J S,KIM Y J,HONG G Y,et al.Abdominal wall endometriosis treatment by ultrasound-guided high-intensity focused ultrasound ablation: a case report[J].Gynecological Endocrinology,2019,35(2):109-111.
[3] BENEDETTO C,CACOZZA D,DE SOUSA COSTA D,et al.
Abdominal wall endometriosis: report of 83 cases[J].International Journal of Gynecology & Obstetrics,2022,159(2):530-536.
[4] GIUDICE L C,KAO L C.Endometriosis[J].The Lancet,2004,364(9447):1789-1799.
[5] HORTON J D,DEZEE K J,AHNFELDT E P,et al.Abdominal wall endometriosis: a surgeon's perspective and review of 445 cases[J].The American Journal of Surgery,2008,196(2):207-212.
[6] TENG C C,YANG H M,CHEN K F,et al.Abdominal wall endometriosis: an overlooked but possibly preventable complication[J/OL].Taiwanese Journal of Obstetrics and Gynecology,2008,47(1):42-48.
[7] KHAN Z,ZANFAGNIN V,EL-NASHAR S A,et al.Risk factors, clinical presentation, and outcomes for abdominal wall endometriosis[J].Journal of Minimally Invasive Gynecology,2017,24(3):478-484.
[8] CARSOTE M,TERZEA D C,VALEA A,et al.Abdominal wall endometriosis (a narrative review)[J].International Journal of Medical Sciences,2020,17(4):536-542.
[9] BLANCO R G,PARITHIVEL V S,SHAH A K,et al.Abdominal wall endometriomas[J].The American Journal of Surgery,2003,185(6):596-598.
[10]成寧海,朱兰,郎景和,等.腹壁子宫内膜异位症手术创面的修复[J].中华医学杂志,2006,86(27):1919-1921.
[11] BARBOSA C P,SOUZA ? M B DE,BIANCO B,et al.
Frequency of endometriotic lesions in peritoneum samples from asymptomatic fertile women and correlation with CA125 values[J].Sao Paulo Medical Journal,2009,127(6):342-345.
[12]黄坚,石一复.不同部位子宫内膜异位症与血清CA125水平的关系[J].现代妇产科进展,2006,15(1): 39-41.
[13] GAO Y,SHEN M,MA X,et al.Seven hormonal biomarkers for diagnosing endometriosis: meta-analysis and adjusted indirect comparison of diagnostic test accuracy[J/OL].Journal of Minimally Invasive Gynecology,2019,26(6):1026-1035.e4.https://pubmed.ncbi.nlm.nih.gov/30965114/.
[14] LIMA A P,MOURA M D,ROSA E SILVA A A. M.Prolactin and cortisol levels in women with endometriosis[J].Brazilian Journal of Medical and Biological Research = Revista Brasileira De Pesquisas Medicas E Biologicas,2006,39(8):1121-1127.
[15] OOSTERLYNCK D J, CORNILLIE F J, WAER M,et al.Women with endometriosis show a defect in natural killer activity resulting in a decreased cytotoxicity to autologous endometrium[J].Fertility and Sterility,1991,56(1):45-51.
[16]陈峥峥,凌斌.催乳素在子宫内膜异位症发病机制中作用的研究进展[J].国外医学(计划生育/生殖健康分册),2006(5):273-276.
[17]孙芳梅.子宫内膜异位症和子宫腺肌病患者阴道微生态对比分析[J].现代养生,2022,22(20): 1709-1712.
[18] ATA B,YILDIZ S,TURKGELDI E,et al.The endobiota study: comparison of vaginal, cervical and gut microbiota between women with stage 3/4 endometriosis and healthy controls[J].Scientific Reports,2019,9(1):2204.
[19] CAPOBIANCO A,COTTONE L,MONNO A,et al.The peritoneum: healing, immunity, and diseases[J].The Journal of Pathology,2017,243(2):137-147.
[20]赵学英,郎景和,冷金花,等.腹壁子宫内膜异位症的临床特点及复发相关因素分析[J].中华妇产科杂志,2004,39(2):97-100.
[21]黄艳,彭超,徐海燕,等.腹壁子宫内膜异位症179例诊治分析[J].中国妇产科临床杂志,2019,20(4): 312-316.
(收稿日期:2023-07-14) (本文编辑:白雅茹)

