金丝桃苷调控miR-375/CXCL1轴影响脑缺血再灌注损伤研究*
夏丽秀,肖 瑞,郑 莉
(湖北省中西医结合医院老年病科,武汉 430000)
脑缺血患者在临床上具有较高的致死率,脑缺血对中老年患者的健康造成严重威胁。再灌注治疗是一种能有效缓解脑缺血的技术,但是突然对脑组织血流量进行改善容易导致患者出现再灌注损伤,即缺血再灌注损伤(I/R)[1-2]。氧化应激诱导的细胞凋亡、细胞坏死等病理过程均参与I/R发展[3]。开展I/R分子机制研究对于开发更多有效药物、识别新的生物靶点具有重要意义。
金丝桃苷(Hyp)又名槲皮素-3-O-β-D-吡喃半乳糖苷,属于黄酮醇苷化合物(化学结构式见图1),具有抗炎、利尿、降血糖、保护心脑血管等作用[4]。研究显示,Hyp能上调miR-138的表达,保护缺氧诱导的心肌细胞损伤[5]。有研究发现,Hyp通过一氧化氮信号通路减轻缺氧葡萄糖再灌注诱导的皮质神经元损伤[6]。然而,Hyp对神经细胞氧葡萄糖剥夺/复氧(OGD/R)损伤的作用机制仍有待进一步明确。
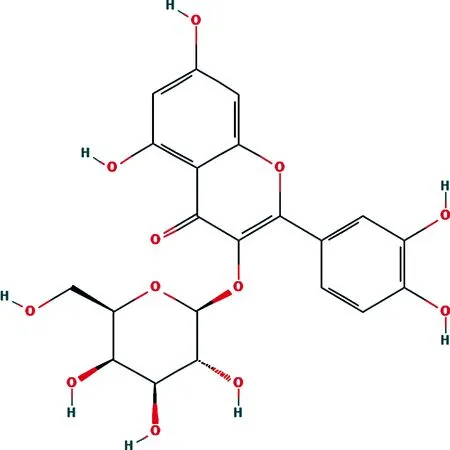
图1 Hyp化学结构式
有研究表明,miR-375上调可通过抑制SP1,减轻多巴胺能神经元的损伤[7]。上调miR-375被证实参与了毛蕊异黄酮对大鼠脑I/R的保护作用[8]。C-X-C趋化因子配体1(CXCL1)是趋化因子的亚类,具有募集并激活白细胞的功能,参与多种疾病发展[9]。皮质神经元来源的外泌体miR-181c-3p通过下调缺血性脑损伤大鼠星形胶质细胞CXCL1来抑制神经炎症[10]。miR-429通过抑制CXCL1对脑微血管内皮细胞OGD/R诱导损伤发挥保护作用[11]。本研究旨在探讨Hyp在I/R中的作用,并结合生物信息学分析和细胞实验探究其在I/R治疗中的潜在机制。
1 材料与方法
1.1 材料
Hyp(C21H20O12,相对分子质量464.37,纯度>98%,中国药品生物制品检定所),小鼠脑神经瘤(N2a)细胞(中国科学院上海细胞生物研究所),标准胎牛血清、细胞培养专用青链霉素混合液、Annexin V-FITC 细胞凋亡检测试剂盒、电化学发光(ECL)超敏发光液(北京索莱宝科技有限公司),无糖DMEM、D-葡萄糖溶液(武汉普诺赛生命科技有限公司),CCK-8试剂盒、双荧光素酶基因检测试剂盒(上海翊圣生物科技有限公司),全波长多功能酶标仪[美谷分子仪器(上海)有限公司],流式细胞仪(美国BD公司),Trizol试剂、聚偏二氟乙烯(PVDF)膜(上海碧云天生物技术有限公司),实时聚合酶链式反应(PCR)扩增仪StepOnePlus(美国Abi公司),第一链cDNA合成试剂盒、2×SYBR Green PCR SuperMix(美国Apexbio公司),引物由南京金斯瑞生物科技股份有限公司合成,抗-CXCL1、抗-甘油醛-3-磷酸脱氢酶(GAPDH)、抗-免疫球蛋白G(英国Abcam公司),Lipofectamine 3000(美国Thermo Fisher公司)。过表达、敲减质粒与miRNA模拟体与抑制剂(上海吉玛制药技术有限公司)。
1.2 方法
1.2.1生物信息学分析
从基因表达综合数据库GEO(https://www.ncbi.nlm.nih.gov/geo/)中获得I/R相关芯片表达数据(GSE78731),且对I/R中差异表达的基因进行分析。使用DAVID 3.0在线网站(https://david.ncifcrf.gov/)对基因进行GO富集分析。DisGENET 6.0网站(http://disgenet.org/search)用于检索I/R风险基因。STRING 11.0网站(http://string-db.org/)用于蛋白互作用分析。DIANA TOOLS在线网站(http://snf-515788.vm.okeanos.grnet.gr)用于对miRNA进行Pathway富集分析。StarBase在线网站(http://starbase.sysu.edu.cn/index.php)、TargetScan在线网站(http://www.targetscan.org/vert_71/)用于检索基因的上游靶标。
1.2.2临床样本
收集2019年8月至2020年6月在本院治疗的35例I/R患者血浆,用于miR-375/CXCL1表达检测。另外收集35例年龄与性别均匹配的健康志愿者血浆作为对照(Control)。所有血液样品均在液氮中保存备用。所有参与者均对本研究知晓并签署书面知情同意书。
1.2.3体外I/R模型建立
采用神经母细胞瘤细胞N2a建立I/R细胞模型。OGD/R处理:细胞在缺氧(5%CO2、95%N2)的无糖培养基中孵育4 h;用含有4.5 g/L葡萄糖和10%胎牛血清的DMEM培养基替换无糖培养基,在常氧条件下再孵育24 h。对OGD/R处理后的N2a细胞分别添加10、30、100 μmol/L的Hyp进行处理以确定最佳使用浓度,Control细胞添加等量的二甲基亚砜(DMSO)。
1.2.4细胞转染
构建CXCL1敲减(si-CXCL1)及过表达(OE-CXCL1)质粒,分别以si-NC与NC作为对照,将以上质粒与miR-375抑制剂(inh-miR-375)及阴性对照(inh-NC)转染至N2a细胞,转染过程按照Lipofectamine 3000转染试剂盒说明书进行。
1.2.5CCK-8检测细胞活力
N2a细胞接种于96孔培养板,每孔5×103个细胞。分别在培养的0、24、48、72 h向每个培养孔中加入10 μL的CCK-8试剂,再孵育2 h后使用多功能酶标仪检测各孔吸光度值,检测波长为450 nm。
1.2.6流式细胞术检测细胞凋亡
收集N2a细胞,Binding Buffer重悬,每管中加入1×105个细胞,分别使用5 μL Annexin V-FITC与5 μL 碘化丙啶(PI)进行避光染色,15 min后通过流式细胞仪检测,分析细胞凋亡率。
1.2.7实时荧光定量PCR(qRT-PCR)检测CXCL1的mRNA表达
采用Trizol试剂提取血浆或N2a细胞的总RNA。逆转录试剂盒合成cDNA。在实时PCR扩增仪StepOnePlus上使用2×SYBR Green PCR SuperMix试剂盒进行qRT-PCR分析。使用2-ΔΔCT法计算mRNA相对表达量,U6作为miR-375的内参,GAPDH作为CXCL1的内参。
1.2.8Western blotting检测CXCL1的蛋白表达
采用RIPA裂解液裂解细胞,BCA试剂盒测定蛋白浓度,行聚丙烯酰胺凝胶电泳(SDS-PAGE),将蛋白转移至PVDF膜上。室温下使用5%脱脂牛乳封闭1 h。4 ℃下将膜与一抗CXCL1(1∶100)、GAPDH(1∶1 000)过夜孵育。之后加入辣根过氧化物酶(HRP)标记的二抗免疫球蛋白G(1∶2 000)孵育1 h。ECL显影并借助I-mage J软件计算蛋白相对灰度值。
1.2.9双荧光素酶报告实验验证miR-375和CXCL1的靶向关系
合成CXCL1野生型(WT)与突变型(MUT)的3′UTR端片段并克隆到荧光素酶报告载体,使用Lipofectamine 3000将CXCL1-WT、CXCL1-MUT分别与miR-375 mimic或miR-375 NC共转染至N2a细胞,在37 ℃、含5%CO2的环境中培养48 h。使用双荧光素酶检测试剂盒评估各组细胞的荧光素酶活性。
1.3 统计学处理
2 结 果
2.1 Hyp对ODG/R处理的N2a细胞增殖和凋亡的影响
与Control细胞比较,OGD/R细胞增殖活力被抑制,凋亡增加,而加入Hyp后,细胞增殖活力有所改善、凋亡减少,且随Hyp浓度的增加呈剂量依赖性(P<0.05),见图2。因100 μmol/L浓度的Hyp对N2a细胞的影响最显著,因此将该浓度处理的细胞用于后续实验。
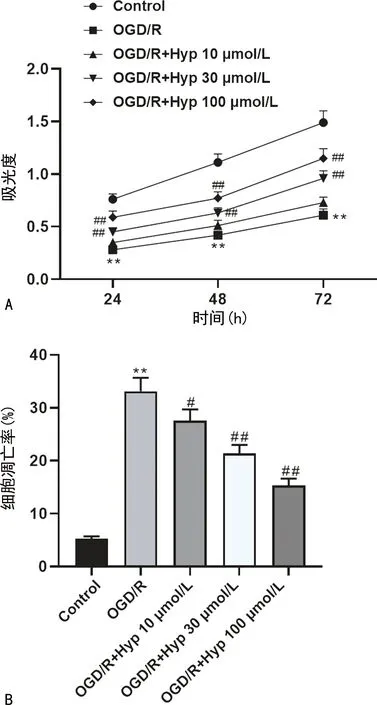
A:不同细胞增殖活力;B:不同细胞凋亡率;**:P<0.01,与Control比较;#:P<0.05,与ODG/R比较;##:P<0.01,与OGD/R比较。
2.2 生物学分析结果
GSE78731数据集中大脑中动脉闭塞(MCAO)模型大鼠中差异表达的基因,见图3。对MCAO组中表达上调的基因进行GO功能富集分析,结果显示,基因被富集在一条炎性通路(GO:0006954~inflammatory response)中。将该通路中富集的基因CCL7、CD8A、SPP1、CCL2、CXCL1、SERPINA3N与I/R发病风险基因进行蛋白互作用分析,发现CXCL1其他基因具有较强关联。
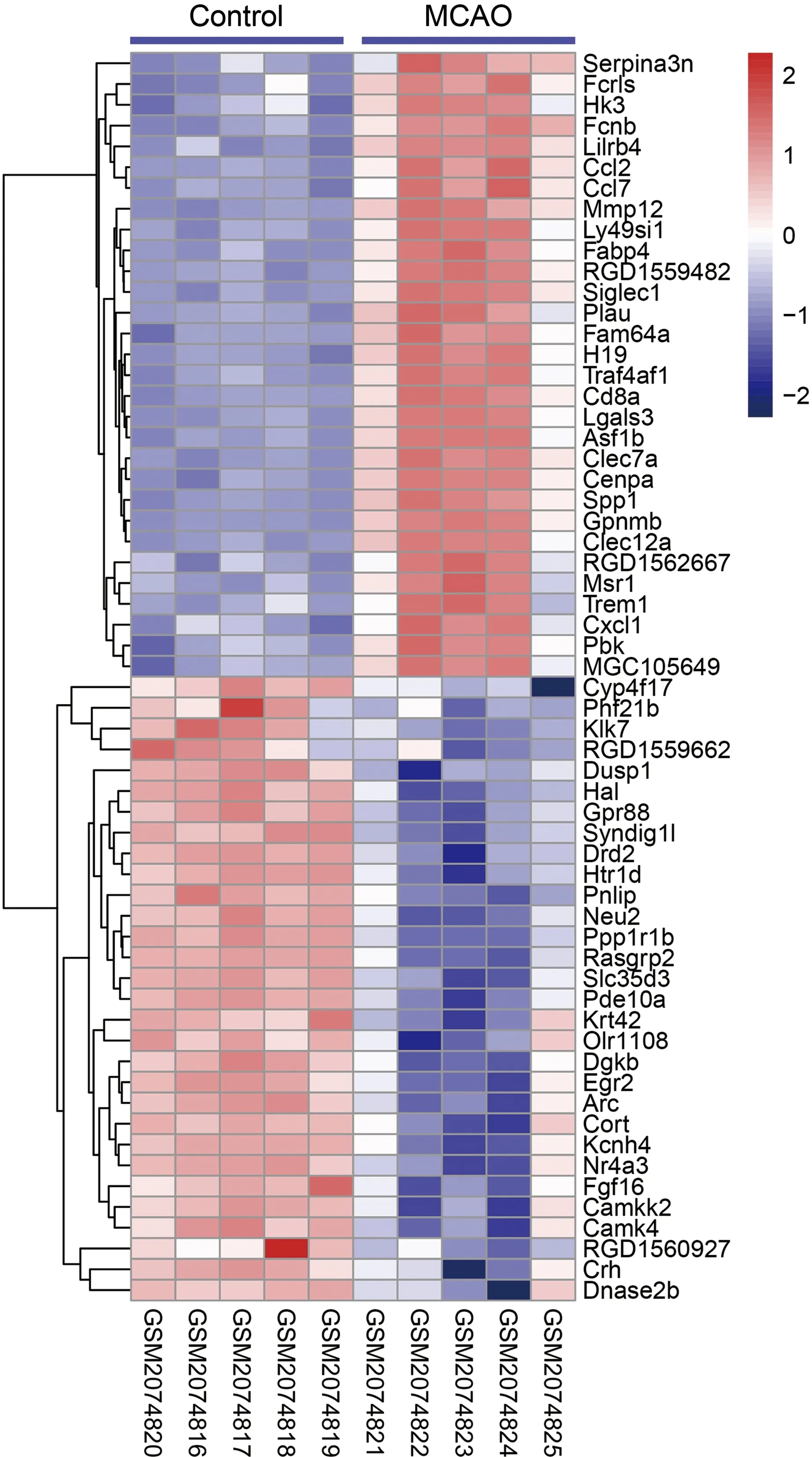
图3 GSE78731数据集MCAO差异表达基因
2.3 Hyp对OGD/R模型中CXCL1表达水平的影响
与Control比较,I/R患者血浆中CXCL1的表达显著增强(P<0.05),见图4A。与Control比较,OGD/R CXCL1的mRNA和蛋白表达增强,但其表达增强能被Hyp抑制(P<0.05),见图4B~D。
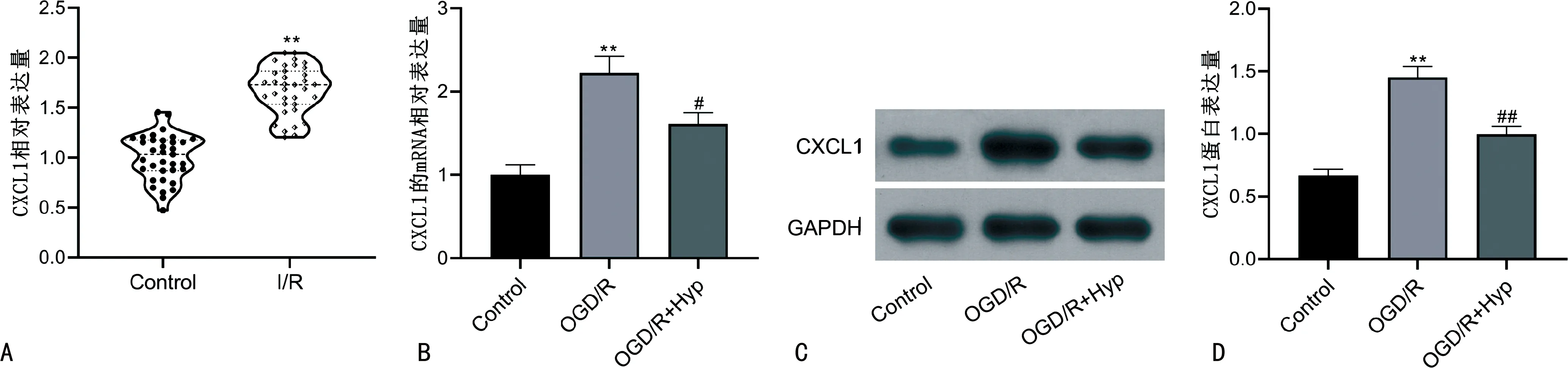
A:不同患者血浆中CXCL1相对表达量;B:不同细胞CXCL1的mRNA相对表达量;C:不同细胞CXCL1的蛋白表达情况;D:Western blotting实验统计结果。**:P<0.01,与Control比较;#:P<0.05,与OGD/R比较;##:P<0.01,与OGD/R比较。
2.4 Hyp对N2a细胞存活的促进作用
与Control比较,OGD/R细胞增殖活力明显降低、凋亡增加,而OGD/R+Hyp细胞活力较OGD/R明显升高、凋亡减少(P<0.05)。与OGD/R+Hyp+NC比较,OGD/R+Hyp+OE-CXCL1细胞增殖活力降低、凋亡增加(P<0.05),见图5。

A:不同细胞增殖活力;B:不同细胞流式细胞术检测结果;C:不同细胞凋亡率统计。**:P<0.01,与Control比较;##:P<0.01,与OGD/R比较;^:P<0.05,与OGD/R+Hyp+NC比较;^^:P<0.01,与OGD/R+Hyp+NC比较。
2.5 miR-375下游靶标情况
使用StarBase、TargetScan在线预测网站搜索CXCL1的上游靶miRNA并取交集(图6A)。miR-375与CXCL1的特异性结合位点见图6B。DIANA TOOLS对交集miRNA进行pathway注释分析,发现miR-375富集在Hippo信号通路(hsa04390)、p53信号通路(hsa04115)两个通路中,Hippo与p53信号通路以往均被证实与I/R密切相关[12-13](图6C)。双荧光素酶报告实验结果显示,miR-375 mimic能显著降低CXCL1-WT的荧光素酶活性(P<0.05),见图6D。qRT-PCR结果显示,miR-375在I/R患者血浆与OGD/R模型中均表达降低(P<0.05)见图6E、F。与miR-NC比较,miR-375 mimic CXCL1的mRNA和蛋白表达被抑制(P<0.05),见图6G。
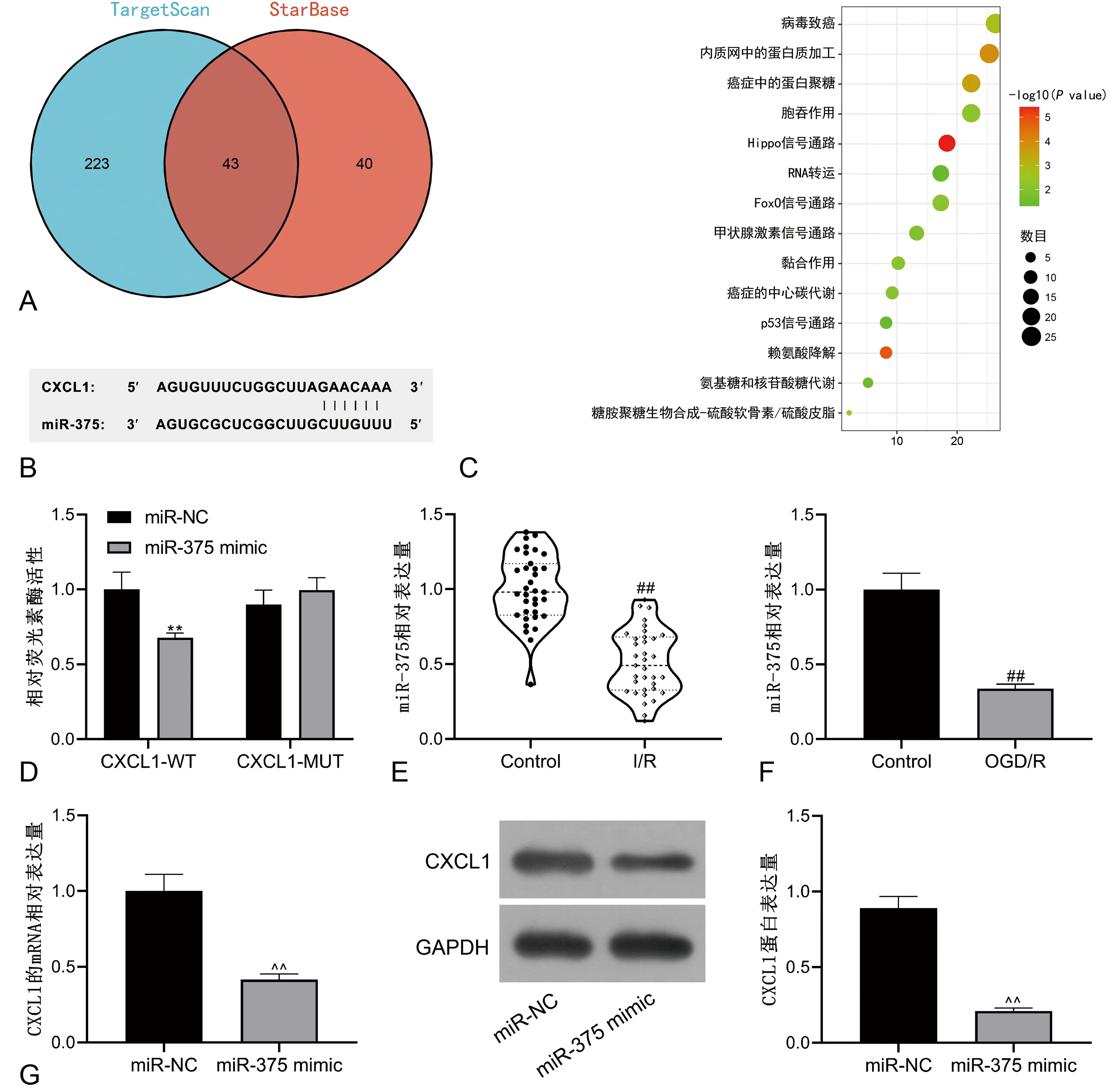
A:StarBase、TargetScan网站预测结果;B:miR-375与CXCL1的特异性结合位点;C:miRNA的通路分析结果;D:双荧光素酶报告检测结果;E:qRT-PCR检测miR-375在I/R患者血浆中的表达;F:qRT-PCR检测miR-375在OGD/R模型中的表达;G:CXCL1的mRNA相对表达量;H:CXCL1的蛋白表达情况;I:Western blotting实验统计结果。**:P<0.01,与miR-NC和CXCL1-WT共转染比较;##:P<0.01,与Control比较;^^:P<0.01,与miR-NC比较。
2.6 Hyp在miR-375/CXCL1轴的作用
与Control比较,OGD/R细胞增殖活力被抑制,凋亡增加,加入Hyp后细胞增殖活力提高,凋亡减少(P<0.05)。与OGD/R+Hyp+inh-NC比较,OGD/R+Hyp+inh-miR-375细胞增殖活力减少,凋亡增加(P<0.05)。与OGD/R+Hyp+inh-miR-375+si-NC比较,OGD/R+Hyp+inh-miR-375+si-CXCL1细胞增殖活力提高,凋亡减少(P<0.05)。见图7。
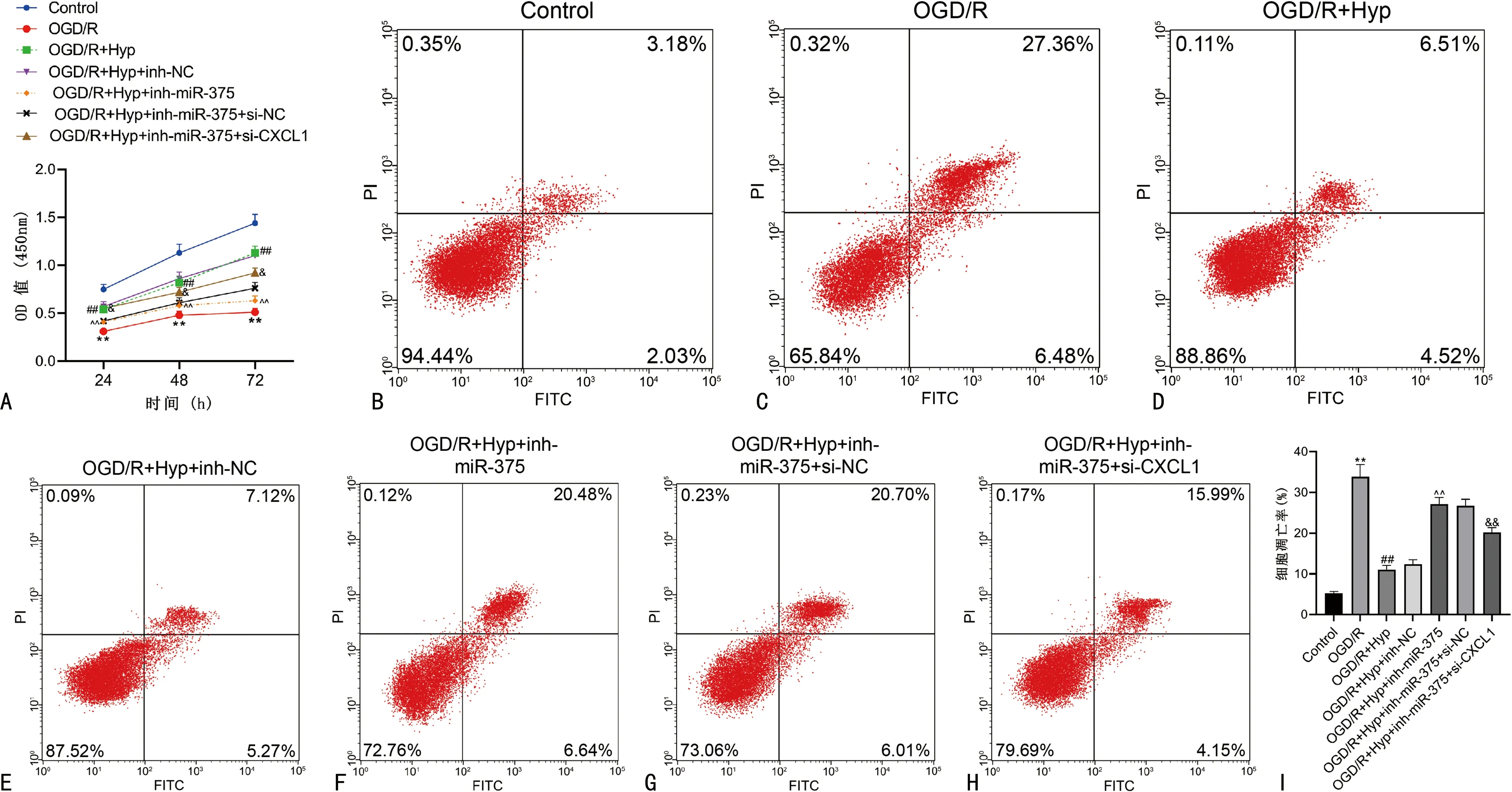
A:不同细胞增殖活力;B~H:不同细胞流式细胞术检测结果;I:不同细胞凋亡率统计。**:P<0.01,与Control比较;##:P<0.01,与OGD/R比较;^^:P<0.01,与OGD/R+Hyp+inh-NC比较;&:P<0.05,与OGD/R+Hyp+inh-miR-375+si-NC比较;&&:P<0.01,与OGD/R+Hyp+inh-miR-375+si-NC比较。
3 讨 论
Hyp广泛存在于各种植物中,如金丝桃科、桔梗科、杜鹃花科、藤黄科等[14]。已有研究证明,Hyp可显著减轻I/R诱导的急性肾损伤、肾小管细胞凋亡和氧化应激[15]。此外也有研究证实,Hyp通过激活多巴胺能神经元Nrf2/HO-1信号,抑制6-羟基多巴胺诱导的氧化应激[16]。本研究通过构建脑I/R体外细胞模型,证实了Hyp能够减少OGD/R处理的N2a细胞凋亡,促进细胞增殖活力。这与之前Hyp改善脑缺血损伤的研究结果一致[17]。
进一步对Hyp在脑I/R中发挥作用的潜在机制进行探究。本研究借助GEO数据库中I/R相关芯片,筛选了在I/R中差异表达的基因并将CXCL1纳入研究。VICTORIA等[18]在研究中发现,CXCL1在I/R模型小鼠中表达增强。本研究进一步通过临床检测和细胞实验证实了CXCL1在脑I/R患者与OGD/R细胞模型中的表达升高。此外,实验发现OGD/R诱导的细胞内高表达CXCL1被Hyp抑制。继续干预CXCL1的表达并设计功能实验,结果显示,与Control比较,OGD/R细胞活力被抑制,凋亡增加,而Hyp在改善细胞凋亡、促进细胞活力方面效果明显。但转染CXCL1后Hyp对OGD/R细胞的保护作用被抑制,提示Hyp对脑I/R的改善作用可能是通过抑制CXCL1的表达来实现。本研究证实了miR-375与CXCL1存在靶向结合关系,qRT-PCR实验证实了miR-375在脑I/R患者与OGD/R模型中表达下调,miR-375可能在脑I/R发展中发挥重要作用。以往研究显示,敲除MALAT1可通过调节miR-375/PDE4D轴减轻大鼠脑I/R损伤[19]。另外,miR-375能够通过靶向Ctgf减轻脑I/R损伤[20]。WANG等[21]发现,上调miR-375表达能够促进毛蕊异黄酮对脑缺血再灌注大鼠的保护作用。本研究发现,与OGD/R组比较,加入Hyp能够抑制N2a细胞凋亡,但是Hyp的作用被inh-miR-375部分抵消。敲减CXCL1也能部分逆转inh-miR-375对Hyp的作用,提示Hyp对I/R细胞模型的影响可能是通过调控miR-375/CXCL1实现的。
本研究也存在一定不足之处。例如,仅从临床检测及体外I/R细胞实验的角度对I/R中miR-375/CXCL1的差异表达进行了验证,未进一步从体内动物实验的角度对miR-375/CXCL1作用网络的影响及Hyp在I/R中的作用进行探究。此外,未进一步探究Hyp可能调控的信号通路,这也是作者之后要重点关注的方向。
综上所述,本研究证实Hyp通过调控miR-375/CXCL1轴影响OGD/R处理的N2a细胞增殖和凋亡,进一步明确了Hyp在I/R中发挥保护作用的分子机制,为I/R的治疗提供了潜在的新靶点。

