乳腺癌保乳术后及乳房重建术后患者放疗期间CBCT验证摆位误差分析*
包 兴,卫 鑫,白明华,贾 辉,黄 珊,郭昱言△
(1.西安交通大学第二附属医院肿瘤放疗科,西安 710004;2.陕西省人民医院肿瘤内科,西安 710068;3.中国科学院大学附属肿瘤医院/浙江省肿瘤医院,杭州 310022)
乳腺癌是女性最常见的恶性肿瘤之一[1],手术是乳腺癌的主要治疗方法。近年来,越来越多的患者对美容的需求及接受度提高,乳腺癌保乳术及乳腺癌改良根治术后乳房重建已越来越多地应用于临床。目前常见的重建术式包括扩张器植入术、自体皮瓣移植术等[2-3]。对于有放射治疗(简称放疗)指征,尤其是保乳术后患者,进行术后放疗可提高局部控制率,降低复发转移率,延长患者的生存期[4]。乳腺癌术后放疗通常持续5周左右,而在分次放疗期间,容易产生摆位误差,造成靶区的漏照,增加正常组织受量[5]。研究发现,对乳腺癌术后患者进行锥形束计算机断层扫描(CBCT)图像引导,可及时校正摆位误差,提高放疗精准度[6]。CBCT目前已广泛应用于各个医院放疗中,可对靶区位置进行验证,并及时降低误差[7]。CBCT可提供患者治疗体位的容积信息,对治疗体位的校准价值较高,在不同的验证系统中已成为图像引导放疗(IGRT)的“金标准”[8-9]。随着外科技术的发展,放疗靶区精准度不断提高,这也对乳腺癌术后放疗过程中的摆位精准度提出了更高要求。本研究通过CBCT验证对3种常见的美容术式术后患者放疗过程中的摆位误差进行回顾性分析,对美容术后(尤其是乳腺癌保乳术后)患者放疗实施及计算机断层扫描(CT)验证频率提供指导。现报道如下。
1 资料与方法
1.1 一般资料
选取2020年6月至2021年8月就诊于西安交通大学第二附属医院放疗科的乳腺癌保乳术、改良根治+扩张器植入术及皮瓣移植术后患者共99例,对其病例资料进行回顾性分析。入组患者均为女性,年龄26~76岁,中位年龄49岁;病灶位置:左侧51例,右侧48例;术后病理Ann Abor分期(美国肿瘤联合会第八版):Ⅰ期18例,Ⅱ期50例,Ⅲ期27例,另外4例经术前新辅助化疗达完全缓解;T0为4例,T1为52例,T2为35例,T3为7例,T4为1例;N0为40例,N1为35例,N2为12例,N3为12例;术后辅助化疗71例,新辅助化疗25例,未化疗3例;调强放疗(IMRT)73例,容积旋转调强放疗(VMAT)26例;保乳术后患者60例(保乳组),改良根治+扩张器植入术后患者29例(扩张器组),皮瓣移植术后患者10例(皮瓣组);照射野为乳腺/胸壁者23例,照射野为乳腺/胸壁+锁骨上区者76例。所有患者均自愿接受CBCT扫描并签署知情同意书。
1.2 方法
1.2.1摆位固定与CT扫描
患者仰卧于乳腺托架上,双上肢上举外展,选取合适的定位头枕(科莱瑞迪)固定头颈部,固定颈胸膜,按三维激光定位系统,在患者体表标记“十字”线,定位点以铅点标记;采用西门子定位CT(Definition AS 20 Open RT)进行定位扫描,层厚5 mm,扫描范围:C1椎体上缘至L2椎体下缘。
1.2.2靶区勾画
采用Varian靶区勾画及治疗计划系统,依据放疗肿瘤协作组(RTOG)标准进行靶区及心脏、双肺、脊髓、患侧肱骨头等危及器官的勾画。根据患者具体情况及治疗意愿,制定治疗计划,选择5~7个射野,选择以切线野为主的IMRT或VMAT进行治疗。
1.2.3CBCT验证与图像配准
采用影像引导加速器进行CBCT扫描和治疗,应用机载影像系统1.6将治疗前通过CBCT获取的影像与定位CT图像进行自动匹配,并经治疗医师及技师手动微调,最终取得的CBCT图像与治疗计划CT图像进行配准,经系统自动计算获取前后(VRT)方向、头脚(LNG)方向、左右(LAT)方向的偏移量,以偏移量绝对值比较患者的摆位误差。
1.3 统计学处理
2 结 果
2.1 不同方向偏移量情况
偏移量中位数:VRT方向为0.1 cm,LAT方向为0.1 cm,LNG方向为0.2 cm。VRT方向96.38%的位移分布<0.3 cm,2.67%的位移分布为0.3~0.5 cm,0.19%的位移分布>0.5 cm;LAT方向89.92%的位移分布<0.3 cm,9.26%的位移分布为0.3~0.5 cm,0.82%的位移分布>0.5 cm;83.57%的LNG方向位移分布<0.3 cm,15.61%的位移分布为0.3~0.5 cm,0.82%的位移分布>0.5 cm。
2.2 经CBCT验证3组不同方向偏移量比较
经CBCT验证,保乳组、扩张器组、皮瓣组在VRT、LAT、LNG方向的偏移量,见表1。进一步分析显示,在VRT方向,保乳组患者的偏移量大于扩张器组(P=0.025 1)和皮瓣组(P=0.022 9),而扩张器组与皮瓣组患者的偏移量比较差异无统计学意义(P=0.480 8)。在LAT方向,保乳组患者的偏移量大于扩张器组,差异有统计学意义(P=0.029 4);保乳组患者的偏移量略大于皮瓣组,但差异无统计学意义(P=0.060 1);扩张器组与皮瓣组患者的偏移量比较差异无统计学意义(P=0.677 8)。在LNG方向,保乳组患者的偏移量大于扩张器组(P=0.001 1)和皮瓣组(P=0.017 3),而扩张器组与皮瓣组患者的偏移量比较差异无统计学意义(P=0.888 6)。见图1。经CBCT验证,在同样的固定方式下,保乳组患者在VRT、LAT及LNG方向上均较其余两种美容术式有更大的偏移量。
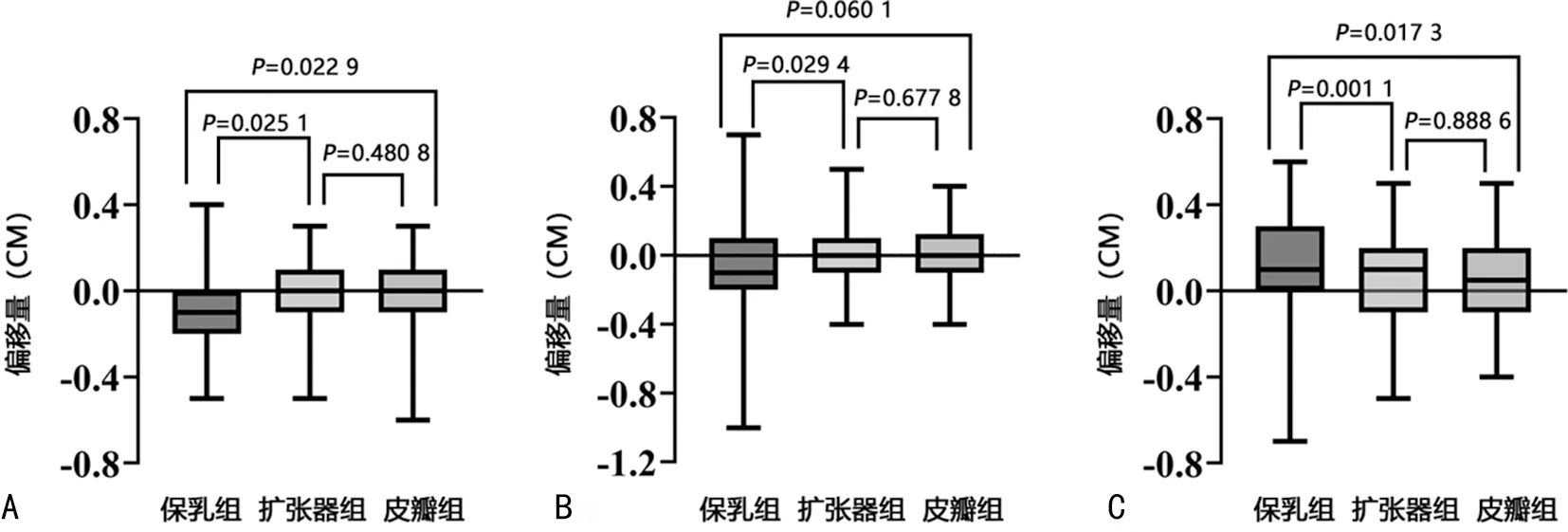
A:VRT方向;B:LAT方向;C:LNG方向。
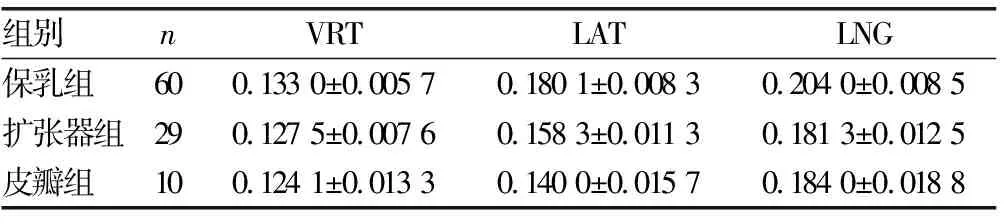
表1 经CBCT验证3组患者不同方向的偏移量
2.3 3组患者首次CBCT验证偏移量比较
3组患者首次CBCT验证结果显示,保乳组、扩张器组、皮瓣组在VRT、LAT、LNG方向的偏移量两两比较,差异无统计学意义(P>0.05),提示在后续摆位过程中,保乳组患者摆位误差更大,会影响放疗的精确性,需要寻找能减小摆位误差的方法。见图2。
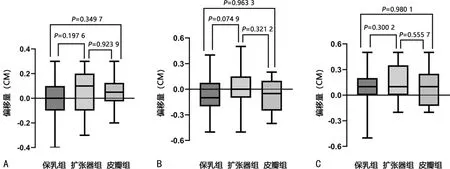
A:VRT方向;B:LAT方向;C:LNG方向。
2.4 保乳组不同照射野、不同验证方式的偏移量比较
对保乳组患者做进一步分析,其中照射野为乳腺/胸壁者22例,照射野为乳腺/胸壁+锁骨上区者38例;进行前3次连续CBCT验证者26例,进行每周1次CBCT验证者34例;病灶位于左侧者33例,病灶位于右侧者27例。对于不同照射野的保乳组患者,其在VRT、LAT、LNG方向的偏移量比较,差异无统计学意义(P>0.05),见图3A。对于进行前3次连续CBCT验证与每周1次CBCT验证的保乳组患者,其在VRT、LAT方向的偏移量减小,但差异无统计学意义(P>0.05);而在LNG方向,两者偏移量并无差异(P=0.568 3),见图3B。
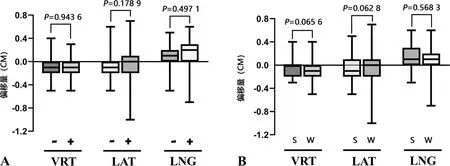
A:不同照射野的偏移量情况;B:前3次连续CBCT验证与每周1次CBCT验证的偏移量情况;-:照射野为乳腺/胸壁;+:照射野为乳腺/胸壁+锁骨上区;S:前3次连续CBCT验证;W:每周1次CBCT验证。
2.5 保乳组不同情况下首次CBCT验证的偏移量比较
对于不同照射野的保乳组患者,其在VRT、LAT、LNG方向首次CBCT验证的偏移量比较,差异无统计学意义(P>0.05),见图4A。对于进行前3次连续CBCT验证与每周1次CBCT验证的保乳组患者,其在VRT、LAT、LNG方向首次CBCT验证的偏移量比较,同样差异无统计学意义(P>0.05),见图4B。提示单次的CBCT验证具有随机性,连续3次CBCT验证可能会减小乳腺癌保乳术后患者放疗过程中的摆位误差。
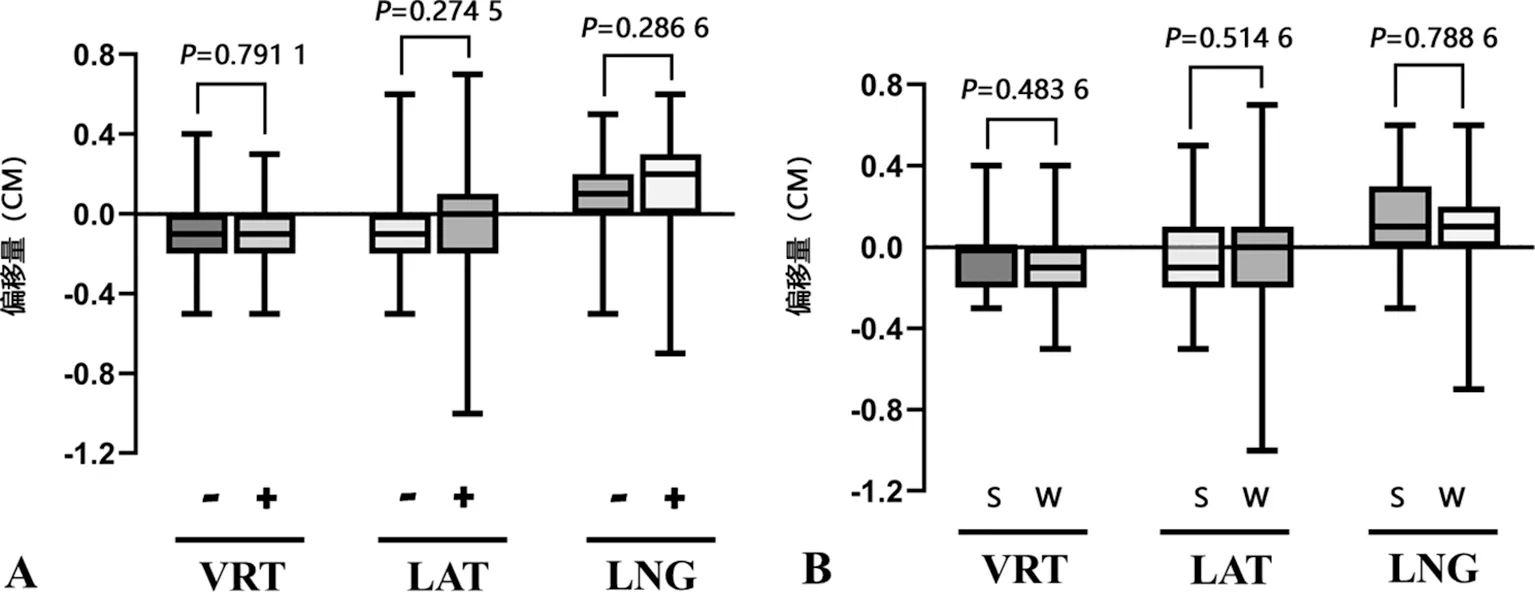
A:首次CBCT验证中不同照射野的偏移量情况;B:前3次连续CBCT验证与每周1次CBCT验证中,首次CBCT验证偏移量情况;-:照射野为乳腺/胸壁;+:照射野为乳腺/胸壁+锁骨上区;S:前3次连续CBCT验证;W:每周1次CBCT验证。
3 讨 论
乳腺癌患者术后放疗过程中存在摆位误差,这会对放疗精准度造成一定影响,使靶区范围出现一定的位移,增加放疗不良反应。目前,已有相关报道对乳腺癌术后摆位误差进行研究,但大多数研究均针对保乳术后患者。由于乳腺癌治疗临床效果得到提高,患者生存时间延长,乳腺癌术后乳房重建也逐渐被越来越多的患者接受。但对这部分患者的术后放疗研究较少,且大多集中于手术与放疗的时间先后。乳腺癌术后采用不同方式进行乳房重建术患者及保乳术后患者在放疗期间摆位误差是否存在差异,如何提高其放疗摆位精确性等,目前尚缺乏相关报道。
放疗期间多种因素会造成摆位误差,如不同固定方式、患者生理特征等[10]。也有研究发现,保乳术后患者的体重指数、胸围、乳腺体积均与摆位误差存在相关性[11]。心脏搏动、老年患者皮肤松弛(年龄)、温度等也与摆位误差有关[12-14]。本研究对乳腺癌保乳术后、改良根治+扩张器植入术后、皮瓣移植术后患者放疗期间的摆位误差进行了分析,发现不同手术方式的放疗患者,在放疗期间的摆位误差存在差异,其中保乳组患者的摆位误差大于其他两组。
乳腺癌术后乳房重建与保乳术后患者相比,对放疗精确性有更高的要求。乳腺癌术后应用假体植入进行乳房重建,患者放疗后的组织血供及顺应性均会下降,导致放疗后的假体取出率约为10%。而对于扩张器+永久性假体进行重建的患者,放疗与永久性假体替换时间的相关性尚无定论[15]。本研究中,扩张器组经CBCT验证,在VRT、LAT、LNG方向的偏移量均较小,90%以上患者的偏移量<3 mm。因此,对此部分患者,结合本研究,在放疗期间可进行每周1次CBCT验证。
对于预期需行术后放疗的患者,应用自体组织进行乳房重建可减少感染等假体重建的术后并发症,此为术后乳房重建的更优选择之一[2,16]。对于皮瓣重建术后患者,放疗后重建的失败率小于3%,提示这部分患者术后可安全地进行放疗[15]。本研究也发现,经CBCT验证,放疗过程中皮瓣组在VRT、LAT、LNG方向的偏移均较小,可能是因为皮瓣组患者较保乳组的组织脂肪含量低,不易发生位移。因此,对于皮瓣组患者,仅进行每周1次的CBCT验证就可保证放疗期间靶区的精确性。
采用IGRT技术,可通过配准定位靶区并纠正分割间设置偏差,从而降低远期并发症发生率[17],提高疗效[18]。配准方式的不同也会影响放疗的精准度,如采用自动灰度配准、自动骨性标志配准及手动配准等,均会导致配准精度及稳定性存在差异[19]。有研究发现,通过4D CT联合CBCT可减小摆位误差,缩小计划靶体积范围,减少患者正常组织照射剂量[12]。也有研究提示,早期乳腺癌保乳术后患者,在VMAT放疗期间行每周1次的CBCT,可减少摆位误差,提高靶区的准确性及适形性,减少正常器官受量[20]。
CBCT验证通常每周进行1次[21-22],早期多次验证可提高后期放疗精确性[23]。在患者IGRT放疗过程中,会重复进行约25次CBCT验证。每进行1次CBCT扫描,大约产生3~5 cGy剂量,而每天用Varian系统进行1次CBCT验证,可产生90~150 cGy剂量[24]。国外有患者在放疗期间每天进行CBCT验证[7]。有研究表明,患者每次治疗前行CBCT验证校准摆位误差,得到的实际剂量分布优于每周行1次CBCT[25]。国内大多数中心仅进行每周1次的CBCT验证[23],主要考虑CBCT存在辐射,频繁进行CBCT会额外增加辐射剂量,增加不良反应和患者经济负担。本研究对摆位误差相对较大的保乳组做进一步分析,发现放疗期间进行前3次连续CBCT验证可能会减小乳腺癌保乳术后患者放疗过程中的摆位误差,但差异无统计学意义(P>0.05),可能与入组例数较少有关。此外,本研究发现,在治疗过程中单次CBCT验证具有随机性,前3次或前5次连续验证可较好地评估患者习惯性偏移方向及偏移量,对患者及技术员摆位有一定的提示,能减少后续治疗中的摆位误差。此验证方式已在多个中心进行应用,但尚未见到相关统计及报道。在后续研究中,作者还将纳入更多病例,进一步探索放疗期间CBCT验证频率,以期更好地为临床治疗提供指导。

