经肛门微创外科手术治疗良性直肠肿瘤的效果及并发症观察
简锦亮 杨春康 林瑞榕 陈昌江 官申
经肛门微创外科手术(transanal endoscopic microsurgery,TEM)是由德国Gerhard Buess所发明设计的,1983年首次进行了报道[1]。TEM的器械设计精巧,通过肛门插入特制的单孔内镜外科系统及器械,在直视下或经显示器在直肠腔内完成相应的操作。TEM具有腹腔镜、内镜及显微外科手术三种技术的优点,对比传统经肛局部切除术,具有显露良好、切除精确的优点,可以切除高位直肠肿瘤及部分低位乙状结肠肿瘤,并且可以获取更高质量的肿瘤标本,利于进行精确的病理分期[2],但其设备昂贵,操作难度较大。目前临床上直肠良性肿瘤治疗多行经肛门局部切除手术,但传统经肛门局部切除手术是在直视下进行肿瘤切除,肿瘤需位于距肛缘6~8 cm,小于4 cm为宜,其存在操作空间受限、视野局限。本研究回顾性总结2012年7月—2018年1月在福建省肿瘤医院胃肠肿瘤外科接受治疗的112例直肠良性肿瘤患者的临床资料。通过描述在单中心直肠良性肿瘤使用TEM的经验,比较TEM与传统经肛门局部切除手术的差异,评估其安全性和治疗效果,以便在临床工作中合理、科学、有根据的选择手术方式,以期为经肛门微创外科手术治疗直肠良性肿瘤的标准制定提供参考。
1 资料与方法
1.1 一般资料
本研究经福建省肿瘤医院医学伦理委员会批准。选择2012年7月—2018年1月福建省肿瘤医院112例直肠良性肿瘤的患者作为研究对象进行回顾性分析。其中传统经肛门局部切除术76例(对照组),经肛门微创外科手术36例(观察组)。
1.2 纳入与排除标准
纳入标准:(1)一般状态良好,具有手术适应证,具备良好依从性,并配合进行术后随访的患者。(2)对直肠神经内分泌瘤及直肠腺瘤的诊断需符合国际疾病分类第10版(international classification of diseases-10,ICD-10)的标准[3],并经组织病理证实。(3)术前检查资料完整。(4)年龄、性别不限。排除标准:(1)有直肠恶性肿瘤或既往有直肠恶性肿瘤病史者。(2)直肠多发肿瘤者如家族性腺瘤性息肉病等。(3)合并其他器官恶性肿瘤者。(4)术前病理为良性,但术后病理确诊癌变需补充根治性手术者。(5)临床相关的资料严重缺失或不全者。
1.3 方法
1.3.1 术前检查及准备
两组患者术前均按照相同方法进行检查评估,包括直肠指诊评估肿瘤位置、常规实验室检查(如血液检查、肿瘤标志物检查)、结肠镜检查、直肠腔内彩超检查、直肠磁共振等。术前口服导泻剂(如聚乙二醇电解质散)进行肠道准备,使用与传统经腹直肠手术相同的抗生素(头孢替安、左奥硝唑),均行气管插管全麻。
1.3.2 手术方法
观察组:行TEM,手术体位的选择应根据肿瘤位置进行,让肿瘤尽量位于6点方向,便于操作,如肿瘤位于前壁,选择俯卧折刀位;肿瘤位于后壁,选择膀胱截石位;肿瘤位于直肠侧壁,选择侧卧位。首先,手术区域按经腹直肠手术进行常规消毒铺巾,并置入双腔气囊导尿管,排空膀胱,解除膀胱压力。接着,用手指扩张肛门至4指宽后,置入并安转TEM系统。充入二氧化碳,维持直肠腔内二氧化碳压力在13~15 mmHg,然后通过直肠镜观察肿瘤病灶,确认肿瘤位置后用针形电刀多点电灼标记预切除部位,切除线位于肿瘤外径0.5~1.0 cm,接着用超声刀或针形电刀环周切除肿物,切除深度至黏膜下层或肌层,切除过程中需要尽可能保证标本的完整性,切除后标本小心经TEM系统拖出肛门外。然后用生理盐水冲洗手术创面,彻底止血后使用倒刺线进行连续缝合或使用抗菌薇乔线间断缝合,对拢直肠断面,退出TEM系统。
对照组:行传统经肛门局部切除术,根据肿瘤位置选择相应适宜的手术体位,同法扩肛至4指宽后,将肛门撑开器置入肛门内,探查确认肿瘤位置后,用电刀或超声刀于距肿物外缘外约0.5~1.0 cm处环周切除肿物,抓取牵拉需小心,避免标本破坏,切除深度至黏膜下层或肌层,取出肿瘤后,冲洗手术创面,止血后用倒刺线进行连续缝合或使用抗菌薇乔线间断缝合对陇直肠创面。
两组标本取出后均使用大头针在泡沫板上进行固定,并标记上、下、左、右切缘,接着用10%中性福尔马林溶液完全浸泡,送病理科行常规病理检查。
1.4 观察指标
观察两组术中出血量、手术时间;术后并发症(术后出血、大便失禁、肛周疼痛、发热、尿潴留);手术标本完整性、术后首次排气时间、术后开始进食流质时间;肿瘤距肛门距离,肿瘤直径,术后住院天数。
1.5 统计学方法
采用统计学软件SPSS 26.0处理研究数据,计量资料用 (±s)表示,正态分布的资料组间比较采用两独立样本t检验,非正态分布的资料采用 Mann WhitneyU检验,计数资料以n(%)表示,计数资料组间比较采用χ2检验或Fisher确切概率法,以P<0.05为差异有统计学意义。
2 结果
2.1 两组一般资料比较
观察组男21例,女15例;年龄26~87岁,平均(54.91±12.36)岁;肿瘤类型:直肠腺瘤29例,直肠神经内分泌瘤7例;肿瘤直径1~6 cm,平均(3.55±1.26)cm。对照组男45例,女31例;年龄32~83岁,平均(57.88±11.75)岁;肿瘤类型:直肠腺瘤61例,直肠神经内分泌瘤15例;肿瘤直径2~5 cm,平均(2.95±0.77)cm。对比两组患者的一般资料,差异无统计学意义(P>0.05),具备可比性。
2.2 两组手术一般情况比较
观察组手术时间、术中出血量、术后首次排气时间、术后开始进食时间及术后住院天数均明显低于对照组,且观察组肿瘤距肛门距离及肿瘤直径大于对照组,差异有统计学意义(P<0.05)。见表1。
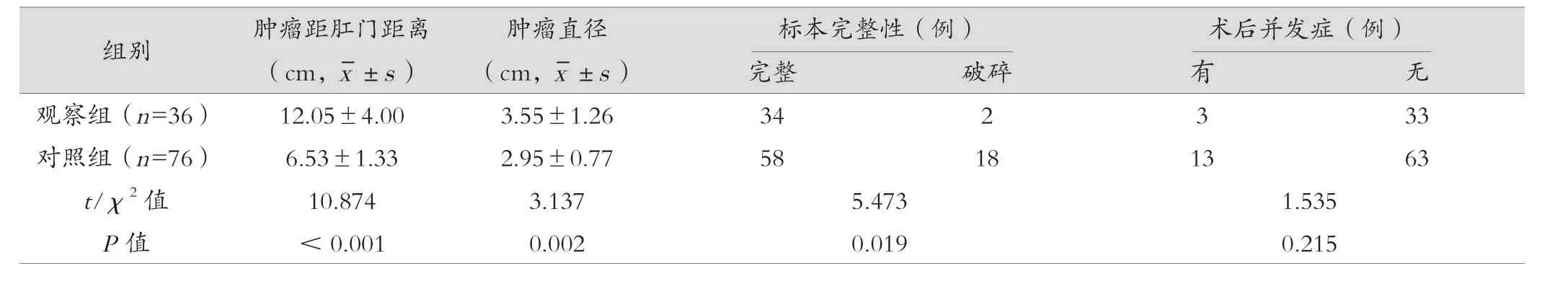
表1 (续)
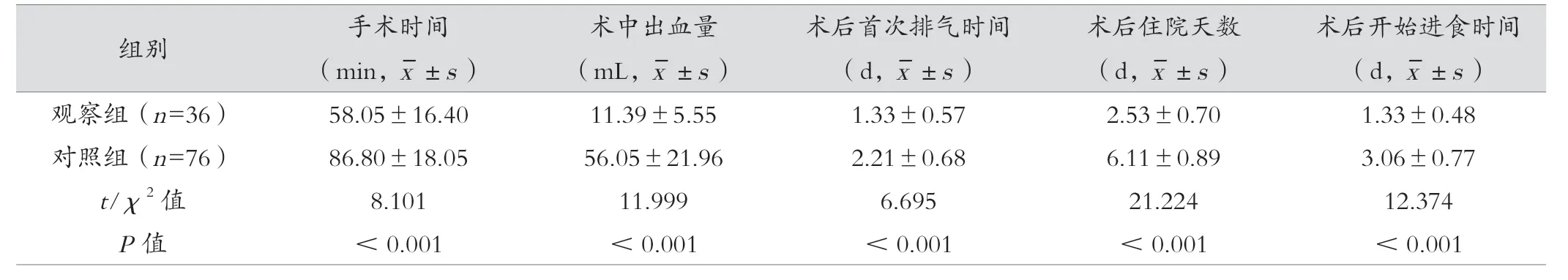
表1 两组手术一般情况比较
2.3 两组术后并发症发生情况比较
观察组术后并发症总发生率(8.333%)显著低于对照组(17.105%),但差异无统计学意义(P>0.05)。见表2。
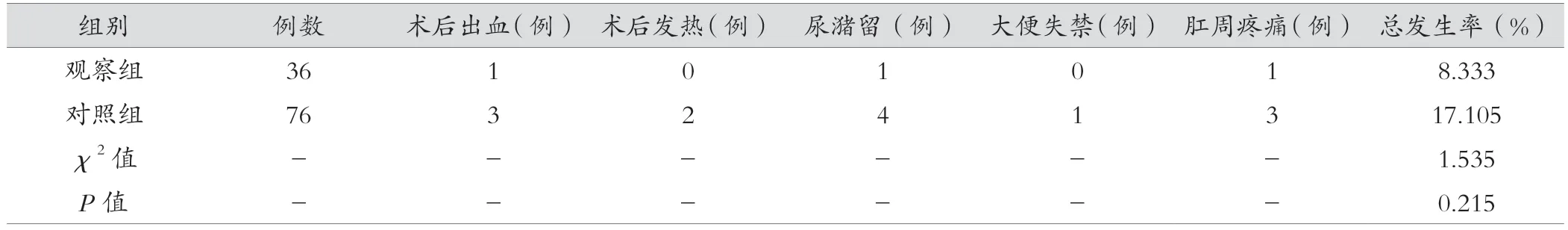
表2 两组术后并发症发生情况比较
3 讨论
直肠良性肿瘤是消化道的常见良性疾病,体积较小的良性肿瘤可行肠镜下切除,而对于体积较大、范围较广的良性肿瘤需行外科手术治疗。但是因直肠的生理解剖特殊性,受肛门内外括约肌及骨盆的制约,肛管直肠的口径十分有限,使得手术的操作空间相应狭小[4]。既往临床上常采取经骶局部切除、经肛门入路或经腹入路进行,但均会造成不同程度影响,且并发症较多。TEM技术兼具腹腔镜、内镜及显微外科手术的技术优势,弥补了传统经肛门局部切除术术野暴露差、创伤大、标本完整性破坏等缺陷。TEM具有经自然腔道、暴露良好、切除精确的优点,是一种微创、安全、有效的手术方式[5],近年来在临床广泛开展,其适应证包括:(1)直肠腺瘤(宽基或无蒂的)、直肠神经内分泌瘤、直肠脂肪瘤或乙状结肠下段腺瘤等良性肿瘤;(2)病理学特征良好的早期(T1N0)直肠癌或乙状结肠下段癌;(3)直肠癌或乙状结肠下段癌的老年患者有行根治手术禁忌证的,可行姑息性切除并配合放化疗;(4)直肠或乙状结肠手术后的吻合口狭窄或直肠良性狭窄;(5)多次肠镜无法取得病理的直肠肿瘤进行大块活检或切除活检,直肠出血的诊断与治疗。禁忌证包括:(1)肛门括约肌功能不佳的患者,术中置入直径4 cm的直肠镜,可能导致肛门失禁;(2)适合根治性手术的进展期直肠癌;(3)直肠多发肿瘤者[6]。对于腹膜反折以上的直肠前壁肿瘤及乙状结肠肿瘤操作时需注意,此部位进行操作时,比较容易切穿肠壁全层进入腹腔,从而引起腹腔感染。但是TEM在直肠中上段及乙状结肠下段病变的局部切除手术中有明显的优势[7-8]。同时大量研究[4,9-12]提示TEM具有术中出血少、术后并发症轻的优势,与本研究结果相符。
TEM具有镜下放大效果,同时通过CO2气体的持续泵入,维持肠腔内的恒定压力,让术者可以在充分展开的肠腔内进行手术操作,操作空间相较于传统经肛门局部切除术大为增加[13]。直肠腔道经过CO2气体充气放大后,肿瘤病灶显露更充分,更能提高手术操作的精确度,能合理控制切缘、切除深度,有利于保证肿瘤组织完整切除,便于准确进行病理活检判断浸润深度。Ben等[14]研究亦发现TEM的切除质量更好,手术切缘较少呈阳性。另外传统经肛门局部切除常需要使用特殊的扩肛器械或肛门拉钩来扩大手术操作空间及手术野,而上述操作会增加肠管张力,容易导致肠管及肛管的损伤,相应就增加手术中及手术后创面出血的风险,而TEM器械固定后可保证充分视野,无需进一步牵拉病灶,可减少暴露病灶及手术创面止血的时间,减少术后出血、术后疼痛、盆腔脓肿、腹腔感染等并发症。同时TEM具有更长的操作距离,其直肠镜可到达直肠中上段及乙状结肠下段,最远可以切除距离肛缘约25 cm范围内的肿瘤,该术式对患者造成的创伤小,本研究结果也提示观察组术后住院天数、肛门第一次排气时间及首次开始进食的时间明显短于对照组,与已报道的此类研究结果相仿[7,10]。提示TEM患者术后恢复时间较短,同时有利于促进肛门功能尽早恢复。
直肠癌是常见的消化道肿瘤,在我国其发病率逐年升高,对国人生命健康造成巨大威胁。随着腹腔镜技术的进展,基于TEM平台的经肛全直肠系膜切除手术目前陆续在国内外多个中心进行开展并报道了相关经验[15-17],该手术方式可更有利确保手术标本的环周切缘的安全,降低直肠癌患者局部发放风险,减少患者创伤,获得更好的根治效果,同时经肛取出标本,具有更好的微创和美容效果。孙东辉等[18]报道了27例腹腔镜联合应用TEM器械的直肠癌根治术,其结果显示所有患者均无腹腔感染、吻合口瘘等并发症。白雪杉等[19]报道了105例经TEM切除直肠癌,结果显示TEM局部切除pT1期直肠癌安全、有效。国外有部分研究发现[20-21],对于经过新辅助放化疗后有强烈保器官意愿的患者降期后进行TEM治疗可取得良好根治效果。
综上所述,TEM治疗直肠良性肿瘤可获得满意疗效,与传统经肛门手术相比具有手术快、出血少、促进患者术后快速恢复及减少并发症的优势。结合ERAS理念优化围手术期干预,可进一步缩短患者术后恢复时间,减轻围手术期患者的应激反应,减少并发症及对患者身体免疫功能的影响。TEM临床应用越来越广,同时随着设备的创新、技术的成熟,将来可使更多直肠良性肿瘤及直肠癌患者获益。

