急性疼痛与慢性疼痛对奖赏加工的影响及神经机制*
刘沛菡 张火垠 张旭凯 李 红 雷 怡
·研究前沿(Regular Articles)·
急性疼痛与慢性疼痛对奖赏加工的影响及神经机制*
刘沛菡1张火垠2张旭凯1李 红1雷 怡1
(1四川师范大学脑与心理科学研究院, 成都 610066) (2深圳大学心理学院, 深圳 518060)
疼痛和奖赏能够为个体提供不同的行为动机和主观价值体验, 寻求奖赏和避免疼痛对于生存都很重要。疼痛可划分为急性疼痛和慢性疼痛, 奖赏可区分为预期阶段的动机成分和体验阶段的享乐成分。奖赏对疼痛的抑制作用已经被广泛证实, 但关于疼痛对奖赏的影响, 目前的研究结果并不一致。因此需要进一步区分并探究急性疼痛与慢性疼痛对奖赏加工不同阶段的影响, 分析两种疼痛对奖赏加工产生不一致影响的现象。这种现象出现的原因可能与急性疼痛向慢性疼痛转变过程中出现的奖赏加工能力缺陷有关。未来可以考虑从改善奖赏加工能力缺陷的角度进行检测和治疗, 提前预防急性疼痛向慢性疼痛转变。
疼痛, 急性疼痛, 慢性疼痛, 奖赏, 动机成分, 享乐成分
1 引言
疼痛和奖赏是调节人类感知和行为的两个基本激励因素, 寻求奖赏和避免疼痛对于个体的生存适应极为重要(Porreca & Navratilova, 2017)。因此, 疼痛、奖赏以及两者之间的相互作用在当前心理学研究中备受关注。疼痛是一种对感觉、情感以及认知维度的综合体验, 不仅会引起躯体上的痛苦感受, 还会引发情感上的不愉快体验, 从而促使个体采取行动来缓解或逃避疼痛。相反, 获得奖赏是一种能够引起个体愉快情绪的体验, 在奖赏影响下个体的认知与行为同样会发生变化(Berridge et al., 2009)。
国际疼痛研究协会(International Association for the Study of Pain, IASP)将疼痛单独定义为:一种与实际或潜在的组织损伤相关的不愉快的感官和情感体验, 根据持续时间长短, 分为急性疼痛和慢性疼痛。急性疼痛是对组织损伤和急性炎症的一种不愉快的、复杂的、动态的心理生理反应, 通常是由外部伤害性刺激引起的短暂疼痛感受, 如不小心割伤、撞伤、术后急性疼痛等。急性疼痛持续时间较短, 能够在正常的自然愈合期内消失, 不会对日常生活造成较大的影响。此外, 急性疼痛还具有保护性的生物学功能, 可以减少引起风险的行为, 促进组织愈合, 如手指割伤后, 及时地采用药物处理, 不仅可以缓解疼痛, 还可以降低感染的风险。急性疼痛如果长期存在且持续时间超出正常的自然愈合期, 就会转变为慢性疼痛(Chapman & Vierck, 2017; Navratilova et al., 2016)。IASP将持续或复发超过3个月的疼痛定义为慢性疼痛。由于慢性疼痛带来的长时间消极情绪状态会使个体出现情绪障碍和认知障碍, 如抑郁、焦虑、睡眠障碍、快感缺失、认知功能受损等, 导致生活质量显著下降, 因此慢性疼痛也被定义为长期持久的身心疼痛(Murray & Lopez, 2013)。
奖赏则能引起与疼痛相反的心理生理反应, 给个体带来愉快的积极心理生理感受。奖赏加工过程涉及奖赏预期和奖赏体验两个阶段。奖赏预期阶段包含动机成分, 使个体产生明确的欲望和计划, 主导奖赏加工的开始; 奖赏体验阶段包含享乐成分, 表征个体对奖赏价值的感知, 即对奖赏的喜爱程度, 主导奖赏加工的完成。奖赏预期阶段的动机成分和奖赏体验阶段的享乐成分分别表示着奖赏加工的动机和情感特征。已有研究证实奖赏回路会根据疼痛产生适应性变化(Baliki & Apkarian, 2015), 即在疼痛影响下奖赏加工的动机和情感特征会发生变化。慢性疼痛与情绪障碍的共病可能是由于奖赏加工过程的缺陷所导致的。有研究发现慢性偏头痛患者在头痛发作期间会出现异常的奖赏加工, 如对金钱奖赏加工的神经反应改变, 导致行为动机下降, 出现快感缺失症状(Kim et al., 2021)。因此, 疼痛状态下奖赏加工的不同变化, 尤其是慢性疼痛对奖赏加工的影响, 可能是造成疼痛与情绪障碍共病的原因之一(Finan et al., 2021)。
疼痛的动机−决策模型认为, 疼痛和奖赏分别通过消极和积极动机系统引出、驱动并维持行为, 当两者同时存在时, 个体必须根据自身状态、潜在威胁和奖赏价值来决定应该优先考虑两者中的何者。该模型的一个基本假设是, 任何比疼痛更重要的东西都可能会缓解疼痛, 任何比奖赏更重要的东西都可能会降低奖赏价值(Becker et al., 2012; Fields, 2004, 2007)。根据这一假设, Becker等人(2013)在急性疼痛研究中发现, 金钱奖赏能够减少个体的疼痛感受, 而金钱损失会增加个体的疼痛感受, 表明金钱奖赏对急性疼痛具有缓解作用。随后, Becker等人(2020)还发现奖赏可以增强个体对急性疼痛的辨别能力。除了奖赏对疼痛的影响外, Gandhi等人(2013)发现急性疼痛增加了个体寻求奖赏的动机, 而Salcido等人(2018)在慢性疼痛的研究中发现, 啮齿动物避免疼痛的动机取代了获取食物奖赏的动机, 这表明小鼠认为慢性疼痛带来的潜在威胁大于当前环境中食物奖赏的价值。这些研究共同验证了动机−决策模型的基本假设, 疼痛和奖赏的关系会根据特定的环境和目标进行调整, 二者相互影响。
尽管疼痛的动机−决策模型认为疼痛与奖赏两者会相互影响, 但目前的研究更多针对奖赏对疼痛的影响进行总结(Mitsi & Zachariou, 2016; Watanabe & Narita, 2018), 而较少针对疼痛对奖赏的影响进行系统性地梳理与回顾。因此, 需要通过全面剖析疼痛对奖赏加工的影响, 揭示二者相互作用的机制。目前研究发现急性疼痛可能会增加寻求奖赏的动机(Gandhi et al., 2013); 而慢性疼痛可能会导致奖赏敏感性降低, 减少寻求奖赏的动机(Tayloret al., 2016)。因此, 急性疼痛和慢性疼痛对奖赏加工中动机成分和享乐成分的影响可能并不一致。本篇综述首先简要阐明急性疼痛和慢性疼痛如何影响奖赏加工; 随后对可能导致两种疼痛对奖赏加工产生差异性影响的原因进行分析比较; 最后, 根据现有研究的不足, 对未来研究方向以及临床应用进行展望。
2 急性疼痛对奖赏加工的影响
2.1 急性疼痛影响奖赏加工的行为机制
在啮齿动物研究中, Salcido等人(2018)发现, 当疼痛和奖赏同时存在时, 动物会根据自身疼痛状况来判断食物奖赏此时存在的价值, 并表现出接近或回避奖赏的行为。Foo等人(2009)通过给大鼠注射不同剂量的福尔马林来诱发不同程度的急性疼痛, 比较大鼠在不同程度疼痛条件下食用巧克力的差异, 结果发现伪注射组和0.5%剂量组大鼠均未表现出疼痛反应, 且进食过程不受任何影响; 而1.5%剂量组大鼠虽然表现出疼痛反应, 但进食行为未受影响。该研究表明, 以此方式诱发的急性疼痛并不会改变大鼠寻求食物奖赏的动机和对食物奖赏的偏好。而Low和Fitzgerald (2012)通过对大鼠足底造成切口来诱发更剧烈的急性疼痛, 结果发现急性疼痛会增加大鼠寻求食物奖赏的动机, 但并没有改变其对食物奖赏的喜爱程度。尽管上述研究的结果存在差异, 但均表明在急性疼痛条件下, 动物寻求食物奖赏的动机始终大于避免疼痛的动机, 以至于表现出更多接近奖赏的行为, 而急性疼痛诱发方式的差异可能是造成结果不一致的主要原因。
在人类研究中, Gandhi等人(2013)首次探索了急性疼痛对奖赏加工的影响。该研究通过热痛刺激将被试分为疼痛组和对照组, 随后被试需要完成金钱激励延迟任务(monetary incentive delay, MID)。MID任务能够有效地区分奖赏加工的预期阶段和体验阶段(Zald & Treadway, 2017), 任务中包含高、中、低三种不同的金钱奖赏, 首先会出现一个金钱激励线索提示随后的奖赏大小, 提示后会有一个短时间的延迟(预期阶段), 接着在目标出现时被试需要尽快地按键以获得相应奖赏, 最后根据被试表现给予反馈(体验阶段)。实验中记录按键反应时(reaction time, RT)作为衡量动机成分的指标, RT越短, 表示动机越强; 记录对奖赏喜爱程度的评分作为衡量享乐成分的指标。研究结果发现, 相比于对照组, 疼痛组在高奖赏条件下RT更短, 但两组对奖赏的喜爱评分没有差异, 表明急性疼痛会增加个体的奖赏动机, 但不影响个体的享乐体验。Wang等人(2018)在研究中也发现了类似现象, 经受急性疼痛后的个体在金钱决策任务中表现出对金钱收益更强的期望, 并试图获得更多的收益。此外, Darbor等人(2016)在研究中记录了个体在接受冷压疼痛后摄入芝士蛋糕的数量以及喜爱程度, 结果发现, 疼痛组虽然对芝士蛋糕的喜爱程度并未改变, 但却摄入了更多的芝士蛋糕, 更形象地证明了急性疼痛会增加个体寻求奖赏的动机, 而不影响对奖赏的体验。
研究者随后深入考察了急性疼痛与奖赏加工之间的关系, 发现急性疼痛对奖赏预期阶段和体验阶段的影响会受到其他因素如个体主观效用的调节。主观效用指个体主观地赋予特定刺激价值, 用以将不同决策可能产生的结果进行对比。刺激的主观效用取决于内部因素和外部因素, 如身体需求、个人偏好、环境条件等状态变量(Kurnianingsih & Mullette-Gillman, 2016)。例如, 在饥饿时, 食物令人感到满足, 此时食物的主观效用价值较高; 而在饱腹时个体满足感会减少, 此时食物的主观效用价值降低(Cameron et al., 2014)。此外, 主观效用还取决于特征变量, 如个体对疼痛的敏感性, 主观效用会导致人类感知产生变化(Kurnianingsih & Mullette-Gillman, 2016)。Becker等人(2017)在研究中考虑到金钱奖赏对疼痛敏感性的影响, 先对个体是否愿意接受8种不同强度的电刺激以获得5美分或15美分两种不同的金钱奖赏进行测试, 计算个体的主观效用指数。结果发现, 个体赋予金钱的主观效用随着电刺激造成的急性疼痛有所改变。在急性疼痛条件下, 主观效用指数较高的个体受到金钱奖赏的驱动, 愿意接受更强烈的疼痛以获得金钱奖赏, 表明奖赏动机增加; 主观效用指数较低的个体更容易受到疼痛刺激的驱动, 减少对奖赏的动机和享乐体验。因此, 行为研究结果普遍表明, 对人类个体而言, 急性疼痛对奖赏加工的影响可能直接作用于奖赏预期阶段(表1), 而非奖赏体验阶段。
2.2 急性疼痛影响奖赏加工的神经机制
奖赏加工的动机成分指促使个体接近和获得奖赏的激励动机, 与多巴胺系统直接相关(Berridgeet al., 2009)。奖赏信息通过激活背外侧黑质(substantia nigra, SN)和腹内侧被盖区(medial ventral tegmental area, mVTA)中的多巴胺神经元, 将相关信息投射到伏隔核核心(nucleus accumbens, NAc core), 编码奖赏信息的激励显著性, 即激励唤醒度; 奖赏信息还通过激活腹内侧SN和VTA的多巴胺神经元, 将相关信息投射到伏隔核壳(NAc shell), 编码奖赏的激励效价。这些多巴胺神经元为个体寻求奖赏提供动机信号, 使个体学习并认识到寻求奖赏是最佳选择, 增加寻求奖赏的行为(Taylor et al., 2016)。例如, 动物研究发现, NAc中多巴胺的增加使得小鼠寻求食物奖赏的动机增强, 可能揭示多巴胺与寻求奖赏的动机具有直接相关性(Peciña et al., 2003)。此外, 多巴胺也会传递与厌恶刺激相关的显著信号, 如疼痛(Bromberg- Martin et al., 2010)。Scott等人(2006)发现纹状体中多巴胺的增加伴随着个体疼痛强度评分以及不愉快体验的增加, 证明多巴胺可能参与个体对厌恶性刺激的加工。因此, 以多巴胺系统作为中介, 多巴胺活动可以传递奖赏和疼痛的相关信息。研究发现, 急性疼痛的出现使个体多巴胺释放增加, 强化个体对奖赏的价值判断, 同时也增加了个体寻求奖赏的动机。在此基础上, 个体根据疼痛的动机−决策模型来调节避免或忍受疼痛的动机, 并做出接近或回避奖赏的适当行为反应。

表1 急性疼痛对奖赏加工的影响
注:MID: 金钱激励延迟范式; PET: 正电子发射断层扫描技术; fMRI: 功能磁共振成像技术; RT: 反应时; SCR: 皮肤电。
奖赏加工的享乐成分指个体对奖赏带来的积极情感体验的喜爱程度, 其变化反映出个体对奖赏价值的评估, 并间接影响个体寻求奖赏的动机。研究表明享乐成分与阿片系统具有直接相关性, 该系统的享乐热点集中在NAc、腹侧苍白球(Ventral Pallidum, VP)等区域, 这些区域的激活增强会增加个体对奖赏的享乐体验以及喜爱程度(图1) (Berridge & Kringelbach, 2015)。啮齿动物研究中, Peciña和Berridge (2005)在大鼠的享乐热点中注射微量阿片激动剂后观察大鼠的面部口腔表情, 发现大鼠对蔗糖的喜爱程度增加了400%以上, 证明了阿片系统与享乐成分具有相关性。此外, 人类研究中, Zubieta (2001)使用正电子发射断层扫描(positron emission tomography, PET)技术检测了急性疼痛条件下健康个体大脑中阿片受体的变化, 结果发现阿片受体的激活与消极情感评分的降低相关, 表明阿片系统的激活可以减少疼痛带来的厌恶感受, 增加愉悦感受。因此, 急性疼痛条件下, 阿片系统的变化会影响奖赏加工中的享乐成分。
急性疼痛对享乐成分的影响也会受到内侧前额叶皮层(medial prefrontal cortex, mPFC)活动的调节。研究者采用功能性磁共振成像(functional magnetic resonance imaging, fMRI)技术检测急性疼痛对奖赏回路的影响(Wang et al., 2020), 被试需要在急性疼痛条件下完成猜牌游戏(card-guessing game), 即猜测卡牌上的数字相对于5的大小, 猜对后个体能够赢得金钱奖赏, 猜错则被扣除奖赏, 完成所有任务后通过7点评分对任务中输赢金钱奖赏的愉悦程度进行评分。结果发现, 在急性疼痛条件下, 个体的mPFC激活越强, 报告的主观愉悦感受越多, 奖赏的享乐体验越强。mPFC是奖赏回路中的关键区域, 在编码奖赏的概率和价值中起到重要作用。在疼痛条件下, mPFC激活增强可能表明个体在该环境中重新评估并赋予了金钱奖赏更高的价值, 意味着疼痛对mPFC活性的调节可能会改变个体对奖赏的认知评价和情绪反应(Etkin et al., 2011; Huckins et al., 2019)。
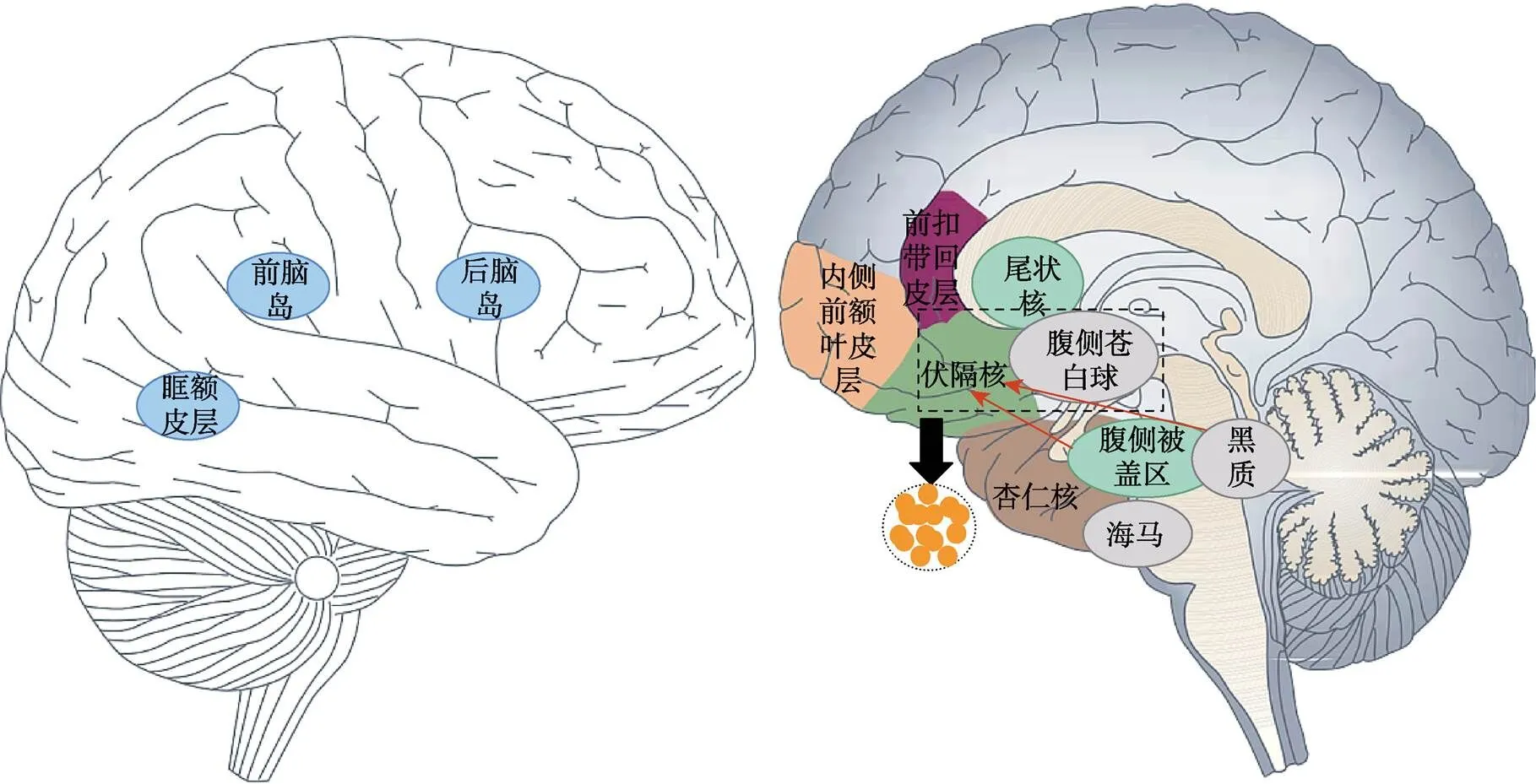
图1 奖赏成分涉及的主要脑区
注:A. 奖赏相关脑区; 伏隔核和腹侧苍白球两个脑区内都具有享乐热点(黄点); 腹侧被盖区和黑质将多巴胺神经元投射到伏隔核中。
综上可知, 急性疼痛对奖赏加工中的动机成分和享乐成分都会产生影响。急性疼痛可以增加个体寻求奖赏的动机, 其神经机制在于急性疼痛条件下多巴胺释放的增加, 能够充分将奖赏信息投射至NAc进行相应的编码, 从而增加个体寻求奖赏的行为。急性疼痛对奖赏享乐体验的影响可能与急性疼痛条件下阿片系统的功能变化以及mPFC的调节作用有关。
3 慢性疼痛对奖赏加工的影响
3.1 慢性疼痛影响奖赏加工的行为机制
急性疼痛与慢性疼痛对个体的感知与情绪的影响存在差异。慢性疼痛主要会影响个体的奖赏强化学习能力、奖赏敏感性等因素, 还会由于长期的负面情绪感受出现快感缺失症状, 从而影响个体寻求奖赏的动机和体验。
首先, 在啮齿动物研究中, Schwartz等人(2017)和Liu等人(2014)分别在小鼠身上诱发慢性炎症性疼痛、神经病理性疼痛和慢性广泛性疼痛(chronic widespread pain, CWP)后, 检测了小鼠对蔗糖的偏好和消耗模式。结果发现随着慢性疼痛的持续发展, 小鼠对蔗糖的偏好和消耗都明显减少, 表明慢性疼痛减少了小鼠寻求奖赏的动机。近期有研究者采用趋近−回避任务范式(approach/ avoidance paradigm, AAP)探索啮齿类动物的慢性疼痛对奖赏的影响, 同样发现慢性炎症性疼痛有效抑制了小鼠寻求食物奖赏的动机, 即避免疼痛的动机取代了缓解饥饿的动机(Salcido et al., 2018)。然而, 也有研究发现, 在大鼠身上诱发的术后神经病理性疼痛并没有影响小鼠对食物奖赏的动机和享乐体验(Okun et al., 2016)。因此, 啮齿动物的研究表明慢性疼痛可能会影响奖赏加工的动机成分和享乐成分, 但具体的影响变化还需要进一步的探究。
随后, 在人类研究中, 研究者发现慢性疼痛患者的奖赏强化学习能力减弱, 这可能是慢性疼痛减少个体寻求奖赏的动机和享乐体验的重要机制(Cowen et al., 2018)。奖赏强化学习能力指在不断获得奖赏的过程中根据奖赏预测错误信号(Reward predictionerror signal, RPE)学习如何获得奖赏、体验奖赏, 并指导个体在相关信息出现时, 根据先前经验, 再次获得奖赏的能力。奖赏的强化学习能力在应对疼痛时发挥关键作用(Gureje et al., 2008; Zald & Treadway, 2017)。研究发现慢性疼痛患者存在异常的RPE, 缺乏基于先前奖赏的学习能力, 导致患者无法及时更新奖赏相关信息, 从而降低奖赏敏感性并出现快感缺失症状(Rizvi et al., 2021)。
首先, 奖赏敏感性与获得奖赏的积极预期有关, 高奖赏敏感性有助于激励个体进行寻求奖赏的活动, 而低奖赏敏感性会减少从事此类活动的动机(Nusslock & Alloy, 2017)。Becerra-García和Robles Jurado (2014)通过基于行为激活/抑制系统特征(行为激活系统对奖赏信号敏感, 行为抑制系统对厌恶信号敏感)的行为激活/抑制量表(behavioral activation system/withdrawal system, BAS/ BIS)发现女性纤维肌痛(fibromyalgia, FM)患者奖赏敏感性降低并导致寻求奖赏的动机下降(McFarland et al., 2006)。其次, 快感缺失与奖赏加工中的享乐成分有关(Admon & Pizzagalli, 2015)。早期Marbach等人(1983)使用了66项身体快感缺失量表对慢性腰痛(Chronic low back pain, CLBP)患者的身体快感缺失症状进行评估, 发现CLBP患者身体快感缺失症状严重, 表明CLBP降低了个体对快乐的感知。另一项对CLBP患者的研究发现, 尽管CLBP患者与健康个体对食物甜度、脆度等感官知觉评分没有差异, 但对食物的喜爱程度降低, 表明CLBP患者对食物奖赏的享乐体验降低(Geha et al., 2014)。而Small和Apkarian (2006)发现慢性背痛(Chronic back pain, CBP)患者对食物奖赏的享乐体验与健康个体没有差异。最近一项研究对比了CBP患者与健康个体对社会性奖赏——愉悦触摸的感受, 结果发现CBP患者对他人愉悦触摸的正性评价更低(Nees et al., 2019)。而Kocsel等人(2019)采用MID任务探讨发作性偏头痛(episodic migraine, EM)对金钱奖赏加工的影响, 结果发现, EM患者在奖赏预期阶段的反应与对照组无异, 但在奖赏体验阶段的反应发生显著改变, 表现为对金钱奖赏的愉悦反应减少, 享乐体验下降。因此, 不同类型的慢性疼痛均存在明显的快感缺失症状, 导致患者无法正常感受奖赏带来的积极情绪体验, 进一步减少了患者寻求奖赏的行为。但由于疼痛和奖赏刺激类型的不同, 快感缺失的程度也可能不同, 未来还需要对此进行区分探究。
3.2 慢性疼痛影响奖赏加工的神经机制
近期研究将不同类型的慢性疼痛患者作为研究对象, 使用MID任务范式将奖赏加工的预期阶段和体验阶段更好地区分开来进行研究(表2)。Martucci等人(2018)等发现在预期阶段, 与健康对照组相比, FM患者对金钱奖赏线索的唤醒评分降低, mPFC活动显著减少; 而NAc活动略有减少, 未达到显著水平。与NAc的活动类似, 患者的VTA、前扣带回皮层(anterior cingulate cortex, ACC)和前岛叶(anterior insula, AI)等奖赏回路相关脑区的活动略有减少, 表明患者可能认为奖赏概率低, 从而减少了寻求奖赏的行为。接着Martucci等人(2019)又比较了服用阿片类药物与未服用阿片类药物的FM患者奖赏加工神经活动的变化, 发现在预期阶段两组FM患者的NAc活动与健康对照组相比没有差异; 然而, 未服药组FM患者mPFC活性异常, 而服药组FM患者mPFC活性与健康对照组相比没有差异, 表明使用阿片类药物使慢性疼痛患者对金钱奖赏的神经反应相对“正常化”, 意味着慢性疼痛患者的内源性阿片系统可能存在异常。
此外, 眶额皮层(orbital prefrontal cortex, OFC)在奖赏回路中是编码快乐的重要中心, 与享乐成分相关(Berridge & Kringelbach, 2015), OFC的异常活动会影响奖赏体验阶段的加工。Kocsel等人(2019)认为EM患者对金钱奖赏的享乐体验减少正是由于OFC结构和功能存在缺陷, 该观点与Jin等(2013)和Kim (2021)在研究中的发现一致:EM患者OFC、mPFC、NAc以及背侧前扣带回皮层(dorsal anterior cingulate cortex, dACC)等奖赏回路相关大脑区域发生异常变化, 这一变化可能是导致EM患者出现疼痛症状和消极情绪的神经机制。有研究同时招募了FM患者和CLBP患者, 并将慢性疼痛的临床表现与大脑活动变化进行相关分析, 发现慢性疼痛患者表现出了更高的抑郁状态和快感缺失(Kim et al., 2020)。在奖赏预期阶段, 行为结果发现慢性疼痛患者的按键RT更长, 表明其寻求奖赏的动机下降; fMRI结果发现慢性疼痛患者纹状体激活减少, 与较小的行为激励、较高的抑郁得分以及快感缺失显著相关。
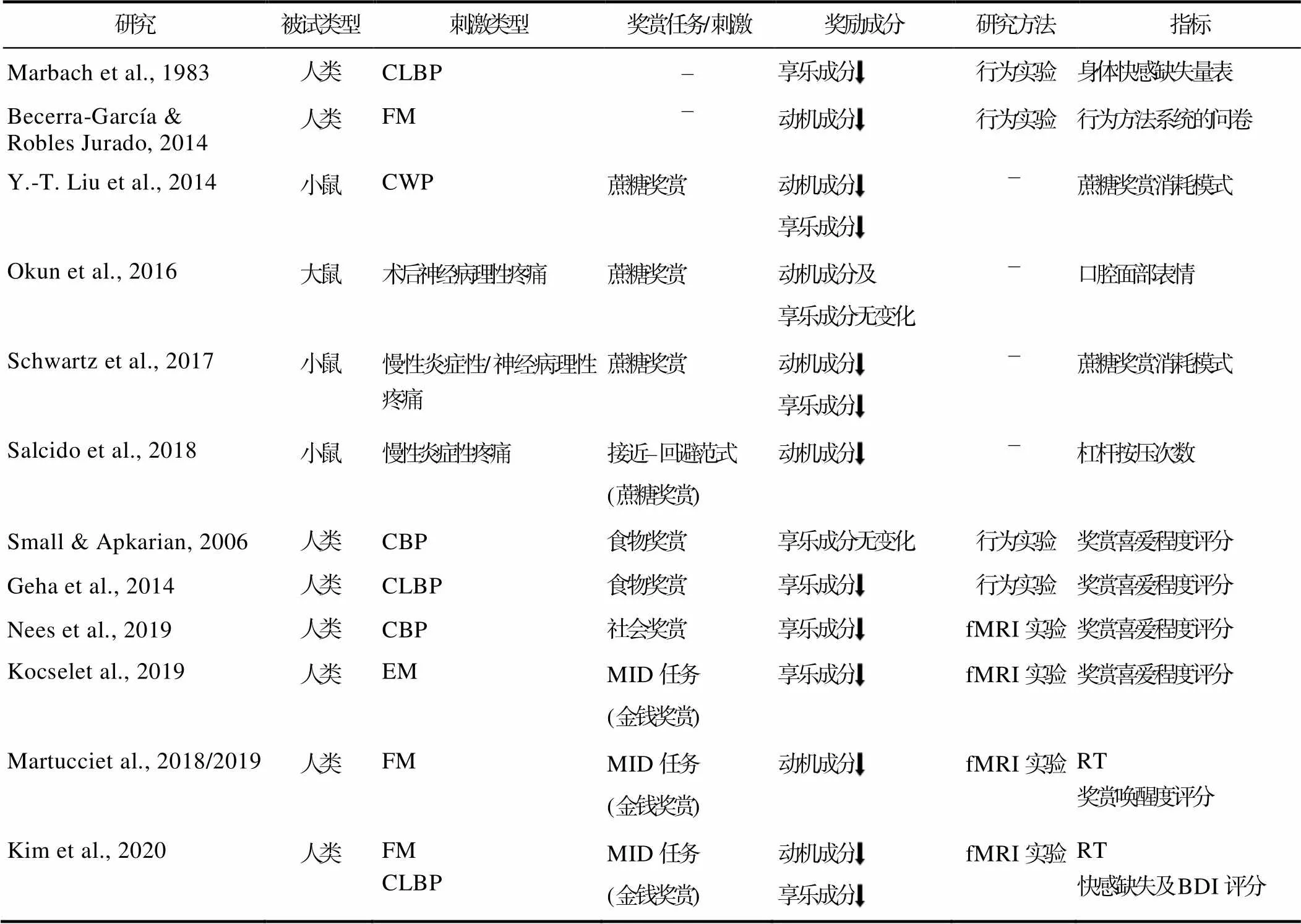
表2 慢性疼痛对奖赏加工的影响
注:CLBP: 慢性腰痛; FM: 纤维肌痛; CWP: 慢性广泛性疼痛; CBP: 慢性背痛; EM: 发作性偏头痛; MID: 金钱激励延迟范式; fMRI: 功能磁共振成像技术; RT: 反应时; BDI: 贝克抑郁量表。
神经影像学的证据表明, 奖赏的动机成分和享乐成分分别与多巴胺系统和阿片系统直接相关(Berridge et al., 2009; Berridge & Kringelbach, 2015), 慢性疼痛患者寻求奖赏的动机和对奖赏的享乐体验均表现出较低水平, 可能是该群体的多巴胺系统和阿片系统发生病变。Wood等人(2007)使用PET技术比较了FM患者与健康个体接受高渗盐水注射时引起的深部肌肉疼痛感受。结果发现健康个体的纹状体多巴胺释放与疼痛感受呈正相关; FM患者疼痛感受更强烈, 其纹状体多巴胺释放出现异常, 且与疼痛感受不具有相关性。因此, 研究者认为多巴胺系统活动异常以及多巴胺反应性中断可能是造成FM患者广泛疼痛和不适的关键因素。另一项研究发现FM患者的NAc、杏仁核(amygdala, AMY)和dACC等疼痛调节区域内的阿片受体可用性下降, 表明FM患者内源性阿片系统活动可能出现异常(Harris et al., 2007)。近期啮齿动物和人类研究进一步证实了慢性疼痛影响下内源性阿片系统的异常变化。Thompson等人(2018)在大鼠身上诱发慢性神经性疼痛后, 发现大鼠背侧纹状体(dorsal striatum)、岛叶(insula)和运动皮层(motor cortex)中阿片受体可用性降低, 并进一步发现其对蔗糖偏好的变化与阿片受体的活性呈显著正相关。Finan等人(2021)发现慢性疼痛患者在获取奖赏时包含多巴胺和阿片系统的腹侧纹状体(ventral striatum, VS)、NAc等大脑区域激活减弱, 患者可能出现阿片类药物使用障碍(opioid use disorder, OUD)。OUD被认为会逐渐导致参与奖赏加工的皮质−纹状体回路出现功能缺陷, 使患者对奖赏的反应性降低, 出现“奖赏缺乏”综合症, 以至于慢性疼痛患者无法对奖赏进行正常的享乐体验。因此, 阿片受体变化可能是慢性疼痛的直接结果。
除了神经递质系统的异常, 与健康个体相比, 慢性疼痛患者还会表现出异常的脑区激活。在动物研究中, 研究者采用趋近−回避冲突范式发现大鼠的边缘下皮层(infralimbic cortex, IL)-NAc回路的活性与抑制疼痛预测线索(pain-predictive cue, PPC)引起的回避反应有关(Schwartz et al., 2017)。其中, PPC对个体具有保护作用, 但对奖赏导向行为具有潜在的破坏性, 成功的奖赏导向行为通常需要抑制PPC引起的回避行为。NAc是奖赏回路的关键区域, 可以接收整合来自IL的输入, 编码奖赏相关信息, 抑制对PPC的回避并维持对奖赏的渴望, 从而促进奖赏导向行为。Schwartz等人(2017)研究发现大鼠在慢性疼痛状态下, IL-NAc回路中神经元活动受损, 无法成功抑制PPC引起的回避行为, 从而减少了寻求蔗糖奖赏的行为动机, 表明慢性疼痛会损害与奖赏加工密切相关的IL-NAc神经回路。人类对PPC回避行为的抑制已经被证实受到mPFC和VS内NAc的调节, mPFC对应于啮齿动物的IL区域(Baliki et al., 2012)。
人类慢性疼痛的纵向研究发现, mPFC-NAc回路的功能性连接预测了从急性到慢性疼痛状态的转变(Baliki et al., 2012)。Baliki等人(2012)对亚急性背痛患者(subacute back pain, SBP)进行了为期1年的随访, 探究了mPFC-NAc回路的变化与持续性背痛(subacute back pain persisting, SBPp)或疼痛恢复(subacute back pain recovering, SBPr)之间的关联。在1年的随访中对患者进行了4次检查, 在第2次检查时SBPr患者的疼痛感受显著下降并低于SBPp患者, 而SBPp患者在4次检查中疼痛感受持续存在, 根据IASP对慢性疼痛的定义, SBPp可能发展成为慢性疼痛。fMRI结果还发现SBPp患者mPFC与NAc之间功能性连接的增强预示着疼痛感受的持续, 这意味着皮质−纹状体回路的变化与从急性到慢性疼痛的转变有关。随后有研究者将早期、急性/亚急性和慢性背部疼痛患者的大脑激活模式与疼痛、情绪、奖赏相关的元分析图进行了比较(Hashmi et al., 2013)。疼痛图涉及岛叶、丘脑(thalamus)、躯体感觉皮层(somatosensory cortex, S1)和ACC的激活; 情绪图涉及AMY、海马(hippocampus)、OFC和mPFC的激活; 奖赏图与情绪图中OFC和mPFC的激活重叠(Yarkoni et al., 2011)。Hashmi等人(2013)发现急性背部疼痛和SBPr患者的大脑活动主要涉及疼痛和奖赏回路的激活; 与急性/SBPr患者相比, CBP和SBPp患者的大脑活动中疼痛回路激活减少, 奖赏回路激活不变, 但情绪回路激活增加, 这主要是因为mPFC在CBP患者中表现出特异性激活。此外, SBPp从疼痛到情绪相关大脑区域的活动转移程度与mPFC与NAc之间的功能性连接强度变化有关, 这种功能性连接强度的变化随着时间的推移而稳定, 并以80%的准确率预测CBP的发展。因此, 动机/奖赏回路和情绪回路的功能性连接会影响对疼痛感受的处理, 其适应性变化可以预测疼痛的慢性化, 而在慢性疼痛发展过程中mPFC-NAc功能性连接的异常变化会损害个体的奖赏加工能力。
在对青少年的纵向fMRI研究中发现, 青少年14~15岁时背侧纹状体在奖赏体验过程中的不同反应显著预测了16~17岁时疼痛抱怨的程度(Nees et al., 2017), 证明奖赏享乐体验相关神经机制的变化不仅被疼痛所影响, 还可以预测慢性疼痛的发展。上述研究共同证明了慢性疼痛可能导致皮质−纹状体回路出现功能障碍, mPFC-NAc功能性连接的增强可以预测疼痛的严重程度、持续性以及疼痛的情感反应, 这些神经回路的变化可能是急性疼痛向慢性疼痛转变的标志。
综上可知, 慢性疼痛会减少寻求奖赏的动机以及对奖赏的享乐体验, 该现象可能与慢性疼痛对大脑神经活动机制的影响有关。慢性疼痛导致多巴胺系统和阿片系统出现异常, 无法正常传递奖赏相关信息; 其次, 疼痛持续存在并发展成为慢性疼痛的过程中会导致奖赏回路中mPFC-NAc功能性连接发生变化, 并使奖赏加工相关大脑区域激活减少。这些神经机制的变化表明奖赏回路根据疼痛发生的适应性变化可以预测疼痛的慢性化。
4 急性疼痛和慢性疼痛影响奖赏加工的差异分析
急性疼痛和慢性疼痛虽然都会带来疼痛的躯体感受和厌恶的情感反应, 但两者对奖赏加工的影响在很大程度上存在差异。尤其是针对奖赏的动机成分, 急性疼痛会增加个体寻求奖赏的动机, 而慢性疼痛会减少这种行为动机。对于奖赏的享乐成分, 急性疼痛对奖赏享乐体验的影响受到不同因素的调节后, 可能增加或减少, 而慢性疼痛通常会减少这种享乐体验。这可能是由于急性疼痛和慢性疼痛本身存在诸多方面的差异, 造成差异的因素主要有以下几点:
第一, 急性疼痛和慢性疼痛症状表现不同。急性疼痛可以提醒个体潜在或真实存在的损伤, 持续时间短; 而慢性疼痛的存在不具有明确意义, 持续时间通常超过正常愈合期。临床研究表明疼痛是导致抑郁和焦虑的一个风险因素, 同时抑郁和焦虑也可能在慢性疼痛中发挥作用, 影响慢性疼痛的治疗效果。因此, 慢性疼痛与情绪障碍存在着显著的共病现象(DosSantos et al., 2017)。研究发现, 高达60%的慢性疼痛患者表现出抑郁症状, 甚至部分患者同时患有重度抑郁症。慢性疼痛和抑郁之间的关系是双向的, 两者的并存导致临床诊断复杂化, 整体治疗效果不佳(Roughan et al., 2021; Sheng et al., 2017)。此外, 流行病学研究表明睡眠障碍是导致慢性疼痛的风险因素, 睡眠不足或睡眠紊乱均会导致痛觉过敏和自发性疼痛症状的发展或加重。在慢性疼痛患者中, 53%至90%的患者表现出临床程度的失眠, 其经历失眠的可能性是健康个体的18倍。睡眠障碍和疼痛之间的双向关系通过慢性疼痛的恶性循环持续存在并加剧疼痛, 睡眠障碍也会进一步增加慢性疼痛患者的抑郁和焦虑(Haack et al., 2020; Nijs et al., 2018)。慢性疼痛与情绪障碍和睡眠障碍的共病, 使个体快感缺失症状加剧, 导致慢性疼痛患者无法像急性疼痛条件下的健康个体一样正常判断和感受奖赏带来的愉悦感受, 并通过所处环境改变对奖赏的价值判断, 增加寻求奖赏的动机和对奖赏的享乐体验, 即慢性疼痛减少了奖赏加工中的动机过程和享乐体验。
第二, 急性疼痛和慢性疼痛的多巴胺系统和阿片系统活动不同。急性疼痛条件下, 多巴胺系统会传递出奖赏和厌恶刺激的相关信号, 提示个体对奖赏做出价值判断, 进一步做出寻求奖赏或避免疼痛的动机决策(Taylor et al., 2016)。同时, 急性疼痛会激活内源性阿片系统, 增加奖赏带来的愉悦感受, 减少疼痛带来的厌恶感受(Zubieta, 2001)。而慢性疼痛患者的多巴胺系统和阿片系统都出现了一定程度的损坏(Navratilova et al., 2016; Wood et al., 2007), 在疼痛和奖赏同时出现时, 两种系统无法正常激活和释放相应的神经递质来传递调节价值判断和行为动机的信号。因此, 慢性疼痛患者会表现出行为动机和享乐体验的减少(Apkarian et al., 2004; Becker et al., 2011)。抑郁症的发生和发展涉及到许多与神经可塑性变化相关的神经递质系统, 其中, 阿片受体通过调节这些神经递质系统发挥抗抑郁作用。然而, 慢性疼痛患者的多巴胺和阿片系统存在功能上的损坏, 暗示了慢性疼痛患者的奖赏加工缺陷可能是由于与抑郁症的共病导致的(Sheng et al., 2017)。
第三, 急性疼痛和慢性疼痛的大脑神经活动机制不同。在基于相同奖赏的情况下, 急性疼痛使奖赏回路中VS和OFC激活增加, 这两个区域的激活会增加奖赏带来的愉悦感受, 同时增加寻求奖赏的动机(Kamping et al., 2013); 而慢性疼痛使疼痛回路中S1和岛叶激活增加, 这两个区域的激活会增加疼痛感受(Eisenberger, 2012)。除此之外, 在急性疼痛条件下发现mPFC激活增加, 且mPFC-NAc的功能性连接减弱, 个体表现出享乐体验和行为动机的增加(Wang et al., 2020)。而在慢性疼痛状态下发现mPFC、NAc以及OFC激活减少, mPFC-NAc的功能性连接增强, 皮质−纹状体回路出现功能障碍, 使个体表现出更高的快感缺失和奖赏相关行为动机的下降(Schwartz et al., 2017)。尽管在两种疼痛的影响下都发现了mPFC-NAc的功能性连接发生了变化, 但行为动机的变化却不一致, 说明了mPFC-NAc的功能性连接的变化可能预测了急性疼痛向慢性疼痛的转变。皮质−纹状体回路的功能障碍代表着奖赏回路发生障碍, 尤其是mPFC在两种疼痛中激活的显著差异, 可能说明慢性疼痛导致奖赏回路发生了明显改变。
第四, 急性疼痛和慢性疼痛的奖赏加工机制也发生了相应变化。疼痛的下行传导通路与奖赏回路重叠, 在急性疼痛条件下, 奖赏相关信息由ACC、PFC、岛叶和AMY等前脑区域输出到达导水管周围灰质(periaqueductal grey, PAG), 再向喙侧腹髓质(rostroventral medulla, RVM)投射, 并通过该通路中涉及的多巴胺系统和内源性阿片系统传递出疼痛和奖赏的相关信号, 影响奖赏加工, 同时间接抑制了疼痛上行传导通路中脊髓传入投射的伤害性神经元(Bushnell et al., 2013)。而慢性疼痛患者mPFC、NAc、ACC等区域激活的减少, 导致下行传导通路损坏, 奖赏相关信息无法通过这条通路正常输出后进行加工(Loggia et al., 2014)。因此, 急性疼痛和慢性疼痛奖赏加工机制的异常主要发生在疼痛的下行传导通路中, 慢性疼痛导致大脑活动变化的区域主要在下行传导通路上, 而这条通路与奖赏回路在很大程度上存在重叠, 因此导致了奖赏加工机制的变化。
综上所述, 急性疼痛和慢性疼痛对奖赏加工产生不同影响的原因可能有:个体主观感受、神经活动机制、神经递质系统和奖赏加工机制的差异。急性疼痛是由外部伤害性刺激引起的短期疼痛感受, 而慢性疼痛可能由急性疼痛长期存在转变而来, 也可能由外部压力造成长期的身心疼痛。在急性疼痛条件下, 与奖赏回路重叠的大脑区域激活增强, 增强了奖赏加工的动机成分和享乐成分; 在慢性疼痛状态下这些大脑区域的激活出现异常, 减少了奖赏加工的动机成分和享乐成分。
5 总结与展望
本文对急性疼痛和慢性疼痛对奖赏加工过程的影响分别进行探讨, 发现奖赏加工在急性疼痛和慢性疼痛条件下受到的影响并不一致。急性疼痛增加了寻求奖赏的动机(Darbor et al., 2016; Gandhi et al., 2013; Wang et al., 2018); 增加或减少奖赏的享乐体验, 这其中受到不同因素的调节(Becker et al., 2017; Wang et al., 2020)。而慢性疼痛减少了患者寻求奖赏的动机(Becerra-García & Robles Jurado, 2014), 并在多数情况下减少了患者的享乐体验(Geha et al., 2014; Marbach et al., 1983)。疼痛影响奖赏的神经机制主要与多巴胺系统、阿片系统以及mPFC的神经活动变化有关。急性疼痛与慢性疼痛对奖赏加工产生的差异性影响是由两种疼痛症状上的差异以及相关神经机制的变化所造成的(Harris et al., 2007; Schwartz et al., 2017; Wood et al., 2007)。由于目前研究结果之间的不一致性, 未来还有许多问题需要关注和解决。
首先, 需要解决在研究中可能存在的实验环境、奖赏刺激和疼痛刺激不一致的问题。第一, 无法确定上述研究是否都在相同的实验环境中进行, 例如在Darbor等(2016)的研究中, 被试经历疼痛后进入一个放松自由的环境中选择是否摄入食物奖赏, 而在Wang等(2020)的研究中, 被试需要在疼痛状态下进入一个封闭环境中完成相应任务才能获得奖赏, 因此不能排除由于环境条件不同导致研究结果产生差异的可能。第二, 相关研究使用的奖赏刺激有主要奖赏, 如食物; 也有次要奖赏, 如金钱。这两种奖赏对人类而言的意义是不同的, 食物是人类生存所必需的奖赏, 而金钱是在保证生存的条件下提高生活质量的奖赏, 因此具有不同需求的个体对两种奖赏会进行不同的加工(Yang et al., 2021)。第三, 急性疼痛相关研究所使用的疼痛刺激通常都是在实验室内通过施加疼痛刺激来诱发的, 如热痛刺激、冷压刺激等, 但这些疼痛与生活中实际经历的急性疼痛存在差异, 尤其是临床环境下的急性疼痛。在身体感受层面上, 实验环境中的疼痛基本不存在外部切口且疼痛时长可控, 而临床环境中的术后疼痛存在外部伤口且可能感染并出现炎症, 疼痛时长不可控, 有发展为慢性术后疼痛(prevalence of chronic postsurgical pain, CPSP)的风险。在心理感受层面上, 实验结束后实验室疼痛不会影响个体的日常生活; 术后疼痛可能使个体产生对伤口愈合的担心, 从而产生疼痛相关的情绪困扰, 如焦虑、抑郁以及睡眠障碍, 影响个体基本生活(Glare et al., 2019; Kehlet, 2018)。慢性疼痛相关研究选择了不同类型的慢性疼痛患者, 如慢性腰痛、纤维肌痛、慢性背痛以及发作性偏头痛, 这些慢性疼痛可能具有不同的症状表现, 患者患病的时间长短以及采取的治疗方案都可能不同, 这些差异都可能对奖赏加工造成不同的影响。
未来研究需要确保实验环境、奖赏刺激以及疼痛刺激具有可比性, 可以在相同的实验环境中比较不同疼痛刺激对同一种奖赏刺激加工的影响或比较同一种疼痛对不同奖赏刺激加工的影响, 更准确地比较疼痛影响奖赏加工的差异。针对不同的奖赏刺激, 可以在疼痛状态下比较需求不同的个体如何进行奖赏加工; 除了可控的实验室疼痛, 针对术后急性疼痛, 可以探究各类特定的术后疼痛患者在奖赏加工过程中的行为表现与神经机制, 预防术后急性疼痛转变为慢性术后疼痛; 针对慢性疼痛, 选择被试时不仅需要控制慢性疼痛的共病症状, 如抑郁、焦虑、睡眠障碍, 还需要控制患病的时长以及治疗方案、药物服用的差异。
其次, 还需要解决实验范式和衡量指标不一致的问题。针对食物奖赏, 目前研究没有统一的实验范式, 但流程相似——在被试处于疼痛状态时摄入食物, 记录食物的摄入量以及对食物的喜爱程度(Darbor et al., 2016; Geha et al., 2014; Small & Apkarian, 2006)。进食范式是一个很直观的范式,具有很强的生态效度, 能够更好地反应个体在疼痛状态下对奖赏的需求, 更有效地模拟了个体在生存需要中的行为反应。但进食范式中使用的食物以及食物的配比用量没有进行严格的控制, 对食物的喜好存在很大的个体差异; 该范式也无法准确区分疼痛对奖赏加工不同阶段的影响。未来研究可以对进食范式的流程进行规范, 确定并收集统一的行为指标来进行衡量, 控制个体在食物喜好上的差异。针对金钱奖赏, 通常会采用两种较为规范的实验范式。第一, 金钱激励延迟任务, 该范式已经被证实可以有效地分离奖赏加工预期阶段和体验阶段的神经特征(Knutson et al., 2001)。在任务过程中通过记录目标出现时按键的反应时作为衡量动机的指标; 记录对奖赏的喜爱程度作为衡量享乐体验的指标。相较于其他范式, 使用该范式可以较为准确地获得在疼痛影响下奖赏加工机制的变化结果(Gandhi et al., 2013)。在未来研究中, 可以对该范式进行改善, 除了记录按键反应时作为衡量动机的指标外, 还可以记录个体为了获得奖赏而付出的按键努力, 即按键次数。第二, 猜牌游戏, 该游戏通常是让参与者猜测牌面大小是否大于一个既定的数字, 猜牌游戏中的获胜概率只有50%, 其中没有涉及奖赏强化学习, 在这个任务中只能观察到奖赏体验阶段的变化(Wang et al., 2020)。因此, 需要进一步采用具有奖赏预测误差的学习任务, 来确定疼痛是否会改变奖赏加工的其他过程, 如MID任务。未来研究在统一范式的基础上, 可以结合不同的奖赏刺激和疼痛刺激进行研究, 使用统一的实验范式和衡量指标可以使研究具有可重复性, 研究结果也会更具可比性和说服力。
再次, 可以进一步探索急性疼痛和慢性疼痛对于奖赏加工影响时的大脑即时神经活动变化。研究领域标准(Research Domain Criteria, RDoC)提出, 新的研究分类方法需要“基于可观察的行为和神经生物学测量的维度”, 而不仅仅基于主观报告。未来研究可以使用遗传、神经回路、行为和自我报告评估等不同分析方法对RDoC矩阵中涉及奖赏与疼痛的正负效价系统进行测量(Lonsdorf & Richter, 2017)。具体来说, 可以结合事件相关电位技术(event-related potential, ERP)中区分奖赏预期阶段和体验阶段的ERP成分, 如刺激前负波(stimulus-preceding negativity, SPN)、奖赏正波(reward-related positivity, RewP) (李琪等, 2017; 李丹阳等, 2018; 陈乐乐等, 2020), 观察主观报告与客观神经活动变化是否具有一致性, 是否会存在主观报告与潜在的客观神经反应不一致的情况。ERP技术具有更高的时间分辨率, 可以进一步解决研究中所用指标精确度不高的问题。
最后, 可以基于急性疼痛与慢性疼痛的差异, 探究慢性疼痛的多样性对奖赏加工是否造成不同的影响以及奖赏加工回路的不同变化。第一, 与急性疼痛相比, 在FM、CBP患者表现出多巴胺系统、阿片系统以及mPFC活动的异常变化(Harris et al., 2007; Wood et al., 2007)。同样可以推测在其他类型的慢性疼痛中如神经性头痛、慢性腰肌劳损等, 相关的神经递质系统和神经活动同样受损。但不同类型的慢性疼痛引起的大脑活动变化可能存在差异, 导致对奖赏加工神经机制的影响不同。未来研究可以分别测量不同类型慢性疼痛对奖赏加工神经回路的影响, 评估预测慢性疼痛随着时间进程的变化, 提前做好预防治疗的措施, 如提前通过药物或认知行为干预改善患者的奖赏加工能力。由于急性与慢性疼痛在mPFC的激活上存在差异, 未来建议选择慢性疼痛患者mPFC脑区作为治疗靶点, 使用经颅直流电刺激 (transcranial direct current stimulation, tDCS)或经颅磁刺激技术(transcranial magnetic stimulation, TMS)进行调节干预, 再将予以奖赏作为干预治疗手段。第二, 慢性疼痛与情绪障碍存在共病(DosSantos et al., 2017), 共病可能是由于奖赏加工的缺陷所导致的,而共病也可能进一步导致奖赏加工的缺陷加剧, 三者存在相互影响。不同类型的慢性疼痛可能与不同的情绪障碍存在共病, 奖赏加工神经机制的变化也存在差异。未来研究可以在探究不同类型慢性疼痛对奖赏加工的影响的基础上, 进一步探究奖赏加工不同程度的缺陷、不同类型慢性疼痛以及情绪障碍三者的关系。根据三者的关系, 评估总结不同类型共病出现的概率, 在预测慢性疼痛发展变化的同时, 也可以提前预防与多种情绪障碍产生共病的可能性, 使对慢性疼痛的治疗更具有针对性和有效性。
陈乐乐, 黄蓉, 贾世伟. (2020). 反馈相关负波与成瘾.,(6), 959−969.
李丹阳, 李鹏, 李红. (2018). 反馈负波及其近10年理论解释.,(9), 1642−1650.
李琪, 许晶, 郑亚. (2017). 刺激前负波:奖赏期待的电生理指标.,(7), 1114−1121.
Admon, R., & Pizzagalli, D. A. (2015). Dysfunctional reward processing in depression.,, 114−118.
Apkarian, V. A., Sosa, Y., Krauss, B. R., Thomas, S. P., Fredrickson, B. E., Levy, R. E., Harden, N. R., & Chialvo, D. R. (2004). Chronic pain patients are impaired on an emotional decision-making task.,(1-2), 129−136.
Baliki, M. N., & Apkarian, A. V. (2015). Nociception, pain, negative moods, and behavior selection.,(3), 474−491.
Baliki, M. N., Petre, B., Torbey, S., Herrmann, K. M., Huang, L., Schnitzer, T. J., Fields, H. L., & Apkarian, A. V. (2012). Corticostriatal functional connectivity predicts transition to chronic back pain.,(8), 1117−1119.
Becerra-García, J. A., & Robles Jurado, M. J. (2014). Behavioral approach system activity and self-reported somatic symptoms in fibromyalgia: An exploratory study.,(1), 89−92.
Becker, S., Gandhi, W., Chen, Y. J., & Schweinhardt, P. (2017). Subjective utility moderates bidirectional effects of conflicting motivations on pain perception.,(1), 7790.
Becker, S., Gandhi, W., Elfassy, N. M., & Schweinhardt, P. (2013). The role of dopamine in the perceptual modulation of nociceptive stimuli by monetary wins or losses.,(7), 3080−3088.
Becker, S., Gandhi, W., & Schweinhardt, P. (2012). Cerebral interactions of pain and reward and their relevance for chronic pain.,(2), 182−187.
Becker, S., Kleinböhl, D., Baus, D., & Hölzl, R. (2011). Operant learning of perceptual sensitization and habituation is impaired in fibromyalgia patients with and without irritable bowel syndrome.,(6), 1408−1417.
Becker, S., Löffler, M., & Seymour, B. (2020). Reward enhances pain discrimination in humans.,(9), 1191−1199.
Berridge, K. C., & Kringelbach, M. L. (2015). Pleasure systems in the brain.,(3), 646−664.
Berridge, K. C., Robinson, T. E., & Aldridge, J. W. (2009). Dissecting components of reward: ‘Liking’, ‘wanting’, and learning.,(1), 65−73.
Bromberg-Martin, E. S., Matsumoto, M., & Hikosaka, O. (2010). Dopamine in motivational control: Rewarding, aversive, and alerting.,(5), 815−834.
Bushnell, M. C., Čeko, M., & Low, L. A. (2013). Cognitive and emotional control of pain and its disruption in chronic pain.,(7), 502−511.
Cameron, J. D., Goldfield, G. S., Finlayson, G., Blundell, J. E., & Doucet, É. (2014). Fasting for 24 hours heightens reward from food and food-related cues.,(1), e85970.
Chapman, C. R., & Vierck, C. J. (2017). The transition of acute postoperative pain to chronic pain: An integrative overview of research on mechanisms.,(4), 359.e1−359.e38.
Cowen, S. L., Phelps, C. E., Navratilova, E., McKinzie, D. L., Okun, A., Husain, O., Gleason, S. D., Witkin, J. M., & Porreca, F. (2018). Chronic pain impairs cognitive flexibility and engages novel learning strategies in rats.,(7), 1403−1412.
Darbor, K. E., Lench, H. C., & Carter-Sowell, A. R. (2016). Do people eat the pain away? The effects of acute physical pain on subsequent consumption of sweet-tasting food.,(11), e0166931.
DosSantos, M. F., de Souza Moura, B., & DaSilva, A. F. (2017). Reward circuitry plasticity in pain perception and modulation.,, 790.
Eisenberger, N. I. (2012). The pain of social disconnection: Examining the shared neural underpinnings of physical andsocial pain.,(6), 421−434.
Etkin, A., Egner, T., & Kalisch, R. (2011). Emotional processing in anterior cingulate and medial prefrontal cortex.,(2), 85−93.
Fields, H. (2004). State-dependent opioid control of pain.,(7), 565−575.
Fields, H. (2007). Understanding how opioids contribute to reward and analgesia.,(3), 242−246.
Finan, P. H., Letzen, J., Epstein, D. H., Mun, C. J., Stull, S., Kowalczyk, W. J., ... Preston, K. L. (2021). Reward responsiveness in patients with opioid use disorder on opioid agonist treatment: Role of comorbid chronic pain.,(9), 2019−2027.
Foo, H., Crabtree, K., Thrasher, A., & Mason, P. (2009). Eating is a protected behavior even in the face of persistentpain in male rats.,(3−4), 426−429.
Gandhi, W., Becker, S., & Schweinhardt, P. (2013). Pain increases motivational drive to obtain reward, but does not affect associated hedonic responses: A behavioural study in healthy volunteers.,(7), 1093−1103.
Geha, P., deAraujo, I., Green, B., & Small, D. M. (2014). Decreased food pleasure and disrupted satiety signals in chronic low back pain.,(4), 712−722.
Glare, P., Aubrey, K. R., & Myles, P. S. (2019). Transition from acute to chronic pain after surgery.,(10180), 1537−1546.
Gureje, O., von Korff, M., Kola, L., Demyttenaere, K., He, Y., Posada-Villa, J., ... Alonso, J. (2008). The relation between multiple pains and mental disorders: Results from the World Mental Health Surveys.,(1-2), 82−91.
Haack, M., Simpson, N., Sethna, N., Kaur, S., & Mullington, J. (2020). Sleep deficiency and chronic pain: Potential underlying mechanisms and clinical implications.,(1), 205−216.
Harris, R. E., Clauw, D. J., Scott, D. J., McLean, S. A., Gracely, R. H., & Zubieta, J.-K. (2007). Decreased central μ-opioid receptor availability in fibromyalgia.,(37), 10000−10006.
Hashmi, J. A., Baliki, M. N., Huang, L., Baria, A. T., Torbey, S., Hermann, K. M., Schnitzer, T. J., & Apkarian, A. V. (2013). Shape shifting pain: Chronification of back pain shifts brain representation from nociceptive to emotional circuits.,(9), 2751−2768.
Huckins, J. F., Adeyemo, B., Miezin, F. M., Power, J. D., Gordon, E. M., Laumann, T. O., ... Kelley, W. M. (2019). Reward-related regions form a preferentially coupled system at rest.,(2), 361−376.
Jin, C., Yuan, K., Zhao, L., Zhao, L., Yu, D., von Deneen, K. M., ... Tian, J. (2013). Structural and functional abnormalities in migraine patients without aura.,(1), 58−64.
Kamping, S., Bomba, I. C., Kanske, P., Diesch, E., & Flor, H. (2013). Deficient modulation of pain by a positive emotional context in fibromyalgia patients.,(9), 1846−1855.
Kehlet, H. (2018). Postoperative pain, analgesia, and recovery—Bedfellows that cannot be ignored.,(1), S11−S16.
Kim, D. J., Jassar, H., Lim, M., Nascimento, T. D., & DaSilva, A. F. (2021). Dopaminergic regulation of reward system connectivity underpins pain and emotional suffering in migraine.,, 631−643.
Kim, M., Mawla, I., Albrecht, D. S., Admon, R., Torrado-Carvajal, A., Bergan, C., ... Loggia, M. L. (2020). Striatal hypofunction as a neural correlate of mood alterations in chronic pain patients.,, 116656.
Knutson, B., Fong, G. W., Adams, C. M., Varner, J. L., & Hommer, D. (2001). Dissociation of reward anticipation and outcome with event-related fMRI.,(17), 3683−3687.
Kocsel, N., Galambos, A., Szabó, E., Édes, A. E., Magyar, M., Zsombók, T., ... Juhász, G. (2019). Altered neural activity to monetary reward/loss processing in episodic migraine.,(1), 5420.
Kurnianingsih, Y. A., & Mullette-Gillman, O. A. (2016). Neural mechanisms of the transformation from objective value to subjective utility: Converting from count to worth.,.
Liu, X., Wang, N., Gu, L., Guo, J., Wang, J., & Luo, F. (2019). Reward processing under chronic pain from the perspective of “Liking” and “Wanting”: A Narrative Review.,, 6760121.
Liu, Y.-T., Shao, Y.-W., Yen, C.-T., & Shaw, F.-Z. (2014). Acid-induced hyperalgesia and anxio-depressive comorbidity in rats.,, 105−110.
Loggia, M. L., Berna, C., Kim, J., Cahalan, C. M., Gollub, R. L., Wasan, A. D., ... Napadow, V. (2014). Disrupted brain circuitry for pain-related reward/punishment in fibromyalgia.,(1), 203−212.
Lonsdorf, T. B., & Richter, J. (2017). Challenges of fear conditioning research in the age of RDoC.,(3), 189−199.
Low, L. A., & Fitzgerald, M. (2012). Acute pain and a motivational pathway in adult rats: Influence of early life pain experience.,(3), e34316.
Marbach, J. J., Richlin, D. M., & Lipton, J. A. (1983). Illness behavior, Depression and anhedonia in myofascial face and back pain patients.,(1), 47−54.
Martucci, K. T., Borg, N., MacNiven, K. H., Knutson, B., & Mackey, S. C. (2018). Altered prefrontal correlates of monetary anticipation and outcome in chronic pain.,(8), 1494−1507.
Martucci, K. T., MacNiven, K. H., Borg, N., Knutson, B., & Mackey, S. C. (2019). Apparent effects of opioid use on neural responses to reward in chronic pain.,(1), 9633.
McFarland, B. R., Shankman, S. A., Tenke, C. E., Bruder, G. E., & Klein, D. N. (2006). Behavioral activation system deficits predict the six-month course of depression.,(2−3), 229−234.
Mitsi, V., & Zachariou, V. (2016). Modulation of pain, nociception, and analgesia by the brain reward center.,, 81−92.
Murray, C. J. L., & Lopez, A. D. (2013). Measuring the global burden of disease.,(5), 448−457.
Navratilova, E., Morimura, K., Xie, J. Y., Atcherley, C. W., Ossipov, M. H., & Porreca, F. (2016). Positive emotions and brain reward circuits in chronic pain.,(8), 1646−1652.
Nees, F., Becker, S., Millenet, S., Banaschewski, T., Poustka, L., Bokde, A., … IMAGEN consortium. (2017). Brain substrates of reward processing and the μ-opioid receptor: A pathway into pain?,(2), 212−219.
Nees, F., Usai, K., Löffler, M., & Flor, H. (2019). The evaluation and brain representation of pleasant touch in chronic and subacute back pain.,, 100025.
Nijs, J., Mairesse, O., Neu, D., Leysen, L., Danneels, L., Cagnie, B., ... Goubert, D. (2018). Sleep disturbances in chronic pain: Neurobiology, assessment, and treatment in physical therapist practice.,(5), 325−335.
Nusslock, R., & Alloy, L. B. (2017). Reward processing and mood-related symptoms: An RDoC and translational neuroscience perspective.,, 3−16.
Okun, A., McKinzie, D. L., Witkin, J. M., Remeniuk, B., Husein, O., Gleason, S. D., ... Porreca, F. (2016). Hedonic and motivational responses to food reward are unchanged in rats with neuropathic pain.,(12), 2731−2738.
Peciña, S., & Berridge, K. C. (2005). Hedonic hot spot in Nucleus Accumbens Shell: Where do mu-Opioids cause increased hedonic impact of sweetness?,(50), 11777−11786.
Peciña, S., Cagniard, B., Berridge, K. C., Aldridge, J. W., & Zhuang, X. (2003). Hyperdopaminergic mutant mice have higher “Wanting” but not “Liking” for sweet rewards.,(28), 9395−9402.
Porreca, F., & Navratilova, E. (2017). Reward, motivation, and emotion of pain and its relief.,(1), S43−S49.
Rizvi, S. J., Gandhi, W., & Salomons, T. (2021). Reward processing as a common diathesis for chronic pain and depression.,, 749−760.
Roughan, W. H., Campos, A. I., García-Marín, L. M., Cuéllar-Partida, G., Lupton, M. K., Hickie, I. B., ... Rentería, M. E. (2021). Comorbid chronic pain and depression: Shared risk factors and differential antidepressant effectiveness.,, 643609.
Salcido, C. A., Harris Bozer, A. L., McNabb, C. T., & Fuchs, P. N. (2018). Assessing the aversive nature of pain with an operant approach/avoidance paradigm.,, 59−63.
Schwartz, N., Miller, C., & Fields, H. L. (2017). Cortico- Accumbens regulation of approach-avoidance behavior is modified by experience and chronic pain.,(8), 1522−1531.
Scott, D. J., Heitzeg, M. M., Koeppe, R. A., Stohler, C. S., & Zubieta, J.-K. (2006). Variations in the human pain stress experience mediated by ventral and dorsal basal ganglia dopamine activity.,(42), 10789− 10795.
Sheng, J., Liu, S., Wang, Y., Cui, R., & Zhang, X. (2017). The link between depression and chronic pain: Neural mechanisms in the brain.,, 9724371.
Small, D. M., & Apkarian, V. A. (2006). Increased taste intensity perception exhibited by patients with chronic back pain.,(1−2), 124−130.
Taylor, A. M. W., Becker, S., Schweinhardt, P., & Cahill, C. (2016). Mesolimbic dopamine signaling in acute and chronic pain: Implications for motivation, analgesia, and addiction.,(6), 1194−1198.
Thompson, S. J., Pitcher, M. H., Stone, L. S., Tarum, F., Niu, G., Chen, X., ... Bushnell, M. C. (2018). Chronic neuropathic pain reduces opioid receptor availability with associated anhedonia in rat.,(9), 1856−1866.
Wang, C., Bao, C., Gao, J., Gu, Y., & Dong, X. (2020). Pain modulates neural responses to reward in the medial prefrontal cortex.,(5), 1372−1381.
Wang, C., Gao, J., Ma, Y., Zhu, C., & Dong, X.-W. (2018). Physical pain increases interpersonal trust in females.,(1), 150−160.
Watanabe, M., & Narita, M. (2018). Brain reward circuit and pain. In B.-C. Shyu & M. Tominaga (Eds.),(Vol. 1099, pp. 201−210). Springer Singapore.
Wood, P. B., Schweinhardt, P., Jaeger, E., Dagher, A., Hakyemez, H., Rabiner, E. A., Bushnell, M. C., & Chizh, B. A. (2007). Fibromyalgia patients show an abnormal dopamine response to pain.,(12), 3576−3582.
Yang, X., Liu, X., Zeng, Y., Wu, R., Zhao, W., Xin, F., ... Becker, B. (2021). Secondary rewards acquire enhanced incentive motivation via increasing anticipatory activity of the lateral orbitofrontal cortex.,(7), 2339−2355.
Yarkoni, T., Poldrack, R. A., Nichols, T. E., van Essen, D. C., & Wager, T. D. (2011). Large-scale automated synthesis of human functional neuroimaging data.,(8), 665−670.
Zald, D. H., & Treadway, M. T. (2017). Reward processing, neuroeconomics, and psychopathology.,(1), 471−495.
Zubieta, J.-K., Smith, Y. R., Bueller, J. A., Kilbourn, M. R., Jewett, D. M., ... Stohler, C. S. (2001). Regional mu opioid receptor regulation of sensory and affective dimensions of pain.,(5528), 311−315.
Effects of acute versus chronic pain on reward processing and the underlying neural mechanisms involved
LIU Peihan1, ZHANG Huoyin2, ZHANG Xukai1, LI Hong1, LEI Yi1
(1Institute for Brain and Psychological Sciences, Sichuan Normal University, Chengdu 610066, China)(2School of Psychology, Shenzhen University, Shenzhen 518060, China)
Pain and reward can provide individuals with different behavioral motivations and subjective value experiences, and both reward seeking and pain avoidance are important for survival. Pain can be divided into acute and chronic pain, and reward can be distinguished into a motivational component in the anticipatory phase and a hedonic component in the experiential phase. The inhibitory effect of rewards on pain has been widely demonstrated, but current findings are inconsistent regarding the effect of pain on rewards. Therefore, it is necessary to further distinguish and explore the effects of acute pain and chronic pain on different stages of reward processing and to analyze the phenomenon that the two types of pain produce inconsistent effects on reward processing. The reason for this phenomenon may be related to the deficits in reward processing abilities that occur during the transition from acute to chronic pain. In the future, we may consider the detection and treatment from the perspective of improving the defective reward processing ability to prevent the transition from acute to chronic pain in advance.
pain, acute pain, chronic pain, reward, motivational component, hedonic component
2021-10-15
*国家自然科学基金面上项目(32271142 、31871130)、广东省“脑科学与类脑研究”重大科技专项:自闭症诊疗方法研究(2018B030335001); 教育部哲学社会科学研究重大课题攻关项目(21JZD063); 深圳科学与技术研究项目(JCYJ20200109144801736)资助。
雷怡, E-mail: 642034842@qq.com
B845

