临床药师参与1例儿童难治性肺炎支原体肺炎的抗感染治疗实践*
戢太阳,田先地,李志浩
(湖北医药学院附属国药东风总医院药学部,湖北 十堰 442008)
难治性肺炎支原体肺炎(RMPP)是危重的儿童急性呼吸系统疾病,其发病机制主要与大环内酯类药物耐药、免疫损伤、气道黏液高分泌及混合感染等有关[1-2]。近年来由于临床滥用大环内酯类药物导致其耐药菌株出现,严重威胁儿童生命健康。治疗肺炎支原体感染的非大环内酯类抗感染药物主要包括喹诺酮类和四环素类,但均会影响儿童发育,使用受限[3]。RMPP患儿的抗感染治疗方案需综合考虑,多方参与,但目前临床药师参与儿童RMPP治疗的相关文献报道较少[4]。我院临床药师参与1例RMPP患儿抗感染治疗方案的制订及药学监护,取得较好效果,可为临床药师今后参与RMPP治疗提供参考。现报道如下。
1 病例资料
患儿,女,4岁,体质量15 kg,因“发热、咳嗽7 d”于2020年4月11日入院。入院前7 d患儿无明显诱因出现发热,体温(T)最高38.8℃,伴干咳,于当地诊所就诊,患儿家属表示患儿曾予头孢类药物(具体不详)静脉滴注治疗5 d,症状无好转,为进一步治疗转入我院儿科。
患儿平素体健,无特殊病史,否认食物、药物过敏史。入院体格检查,T 38.3℃,脉搏(P)112次/分,呼吸频率(R)26次/分,血压(BP)95/60 mmHg(1 mmHg=0.133 kPa),神清、精神可,呼吸稍促,伴轻微喘息,无口唇发绀,咽部充血,双肺可闻及哮鸣音及湿罗音。入院当日血白细胞计数(WBC)8.78×109/L,中性粒细胞百分比(NEU%)75.6%,C反应蛋白(CRP)11.88 mg/L,血清淀粉样蛋白A(SAA)69.8 mg/L,降钙素原(PCT)0.046 ng/mL。血呼吸道病原体IgM抗体:肺炎支原体(+),血肺炎支原体抗体滴度>1∶160。呼吸道病毒抗原七项检测阴性,胸部CT提示右肺上叶感染。入院诊断为肺炎支原体肺炎。
2 治疗经过
入院当日予头孢曲松+阿奇霉素方案抗感染,同时予甲泼尼龙1 mg/(kg·d)抗炎,布洛芬退热、布地奈德联合异丙托溴铵雾化吸入平喘,同时完善相关检查。
入院第3天,患儿仍间断发热,且咳嗽、喘息未见明显改善,给予鼻导管吸氧,甲泼尼龙剂量调整为2 mg/(kg·d),同时加用免疫球蛋白(总量1g/kg,分3天给予)。
入院第6天,患儿再次发热,伴气促加重、呼吸困难。吸氧下R 50次/分,P 120次/分。复查血常规,WBC 13.92×109/L,NEU%92.4%,CRP 162.2 mg/L,SAA>200 mg/L,PCT 2.454 ng/mL,血清铁蛋白525.5 ng/mL,血清乳酸脱氢酶483 U/L,血清G试验及GM试验阴性,结核杆菌斑点试验(T-SPOT)阴性;复查胸部CT提示双肺炎症,病变较前进展。患儿炎性反应明显增强,考虑病情加重并出现并发症,转入儿童重症监护室(PICU),给予无创呼吸支持治疗,加用万古霉素抗感染,继续使用免疫球蛋白(总量1 g/kg,分2天给予)。
入院第10天,患儿气促较前好转,阵发性咳嗽次数减少,仍有间断发热。血常规,WBC 5.75×109/L,NEU%83.7%,CRP 82 mg/L,PCT 0.639 ng/mL。血呼吸道病原体IgM抗体:肺炎支原体(+),咽拭子肺炎支原体核酸及大环内酯类药物耐药基因突变位点(+)。全院会诊后考虑耐药肺炎支原体感染,告知其家长相关风险获益并征得同意后,停用之前所有抗感染药物,更换为莫西沙星抗感染治疗,2 d后患儿体温恢复正常,咳嗽、咳痰改善,精神、食欲好转,行纤维支气管镜检查见双肺支气管黏膜炎性改变,较多黏性分泌物,予肺泡灌洗。
入院第15天,患儿肺泡灌洗液GM试验(+),肺泡灌洗液涂片染色镜检、培养鉴定为烟曲霉;肺泡灌洗液呼吸道病毒核酸13项检出肺炎支原体-DNA(+),痰培养检出烟曲霉菌,复查胸部CT示双肺感染灶有所吸收。遂加用伏立康唑片,甲泼尼龙减量为1 mg/(kg·d),余治疗不变。
入院第20天,患儿病情明显好转,准予带药出院。患儿住院期间主要用药情况见表1(qd为每日用药1次;q6 h、q12 h分别为每6 h、12 h用药1次;ivgtt为静脉滴注,po为口服)。出院后予伏立康唑片(100 mg,12 h 1次)、阿奇霉素干混悬剂(150 mg,每日1次)口服序贯治疗。出院6周后随访,患儿痊愈,预后良好。
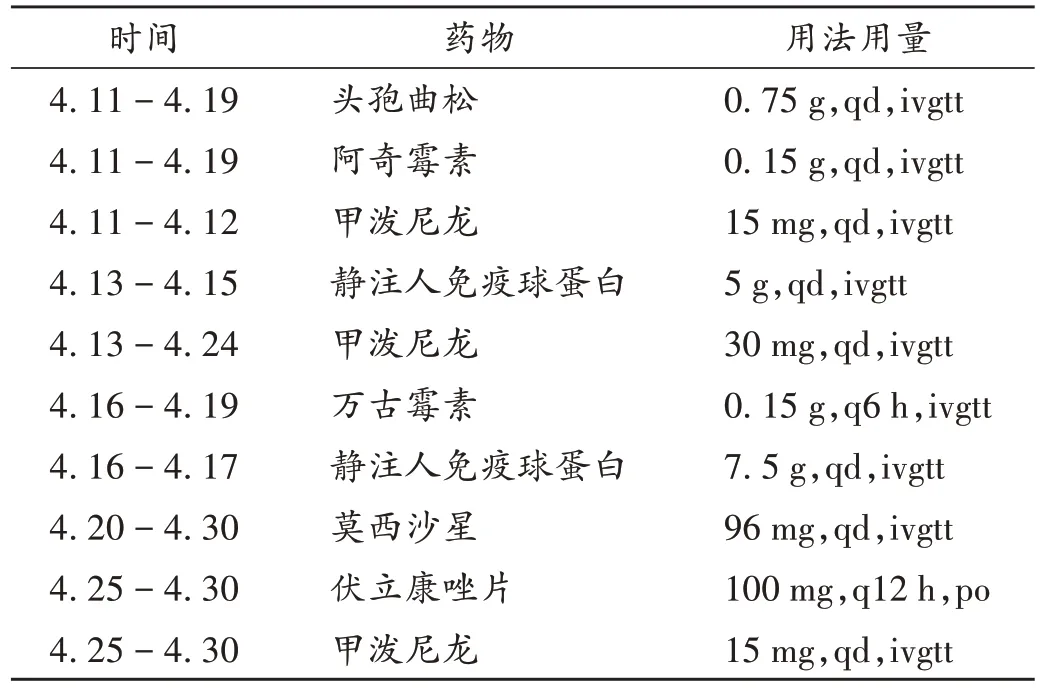
表1 患儿住院期间主要用药情况Tab.1 Main medication of the child during the hospitalization
3 讨论
3.1 抗感染药物选择
本例患儿以肺炎支原体肺炎入院,经阿奇霉素足剂量、足疗程治疗后效果欠佳。入院第10天,咽拭子肺炎支原体核酸及大环内酯类药物耐药基因检测阳性,RMPP诊断明确。《儿童肺炎支原体肺炎诊治专家共识(2015年版)》[5]、《中国儿童社区获得性肺炎诊疗规范(2019年版)》[6]均指出,对大环内酯类药物耐药的RMPP患儿可酌情使用四环素类或喹诺酮类药物。
鉴于我院无多西环素和米诺环素注射剂型,全院会诊未考虑将四环素类纳入该RMPP重症患儿的首选药物。《中国成人社区获得性肺炎诊断和治疗指南(2016年版)》[7]推荐治疗肺炎支原体感染优选的喹诺酮类药物有莫西沙星和左氧氟沙星。莫西沙星作为第4代喹诺酮类药物,对肺炎支原体具有高敏感性,且相比左氧氟沙星具有抗菌谱更广、半衰期更长、肺部组织浓度更高、更不易发生耐药等特点[8]。
邢颖等[9]对于社区获得性肺炎的随机对照试验研究结果显示,莫西沙星在治疗的痊愈率、有效率和细菌清除率方面均明显优于左氧氟沙星,两者用药后药品不良反应(ADR)发生率无显著差异。对于莫西沙星在儿童肺炎支原体肺炎中的应用疗效,杨梅等[10]的研究结果显示,莫西沙星治疗重症肺炎支原体肺炎患儿临床疗效显著(有效率接近90%),并可明显缩短病程,改善预后。因此,临床药师在全院会诊中建议换用莫西沙星行耐药肺炎支原体的抗感染治疗,临床医师采纳该建议。
3.2 莫西沙星用于患儿的安全性及剂量
喹诺酮类药物因在药物研发和评估的早期阶段中对幼年动物关节和软骨的损伤,临床对其应用于患儿一直较谨慎[11]。但是,近年来越来越多的人类研究显示,尚无明确证据表明喹诺酮类药物影响儿童骨关节的生长发育,也无证据表明其会造成负重关节的软骨损害[12-14]。因此,有研究推测,物种差异可能是影响关节损伤的一个重要因素[15],但仍需开展长期、大样本的流行病学研究支持。国外研究显示,莫西沙星口服或静脉给药(平均疗程22 d)所致ADR占总ADR的9.9%,主要包括胆红素升高(1.0%)、转氨酶升高(2.3%)和QT间期延长(6.0%),但未见关节和软骨损害发生,该研究认为,虽然该药ADR相对较多,但并非导致提前停药的主要原因,定期检测并在感染性疾病专家的指导下用于患儿较安全[16]。杨梅等[10,17]报道的两项研究中均给予患儿静脉滴注莫西沙星10 mg/(kg·d),每日1次(单日最大剂量400 mg),患儿用药期间均未出现该药物ADR,说明短期使用莫西沙星较安全。
对于该患儿的莫西沙星用量,临床药师查阅循证医学数据库,参考国外药品说明书中儿童用药剂量,并参考莫西沙星治疗儿童耐药结核病的剂量推荐[18]及相关文献报道[19-20],同时考虑到我院相应药品规格,医师与药师共同商议后决定暂给予每次60 mL(约6.4 mg/kg),每日1次,静脉滴注,疗程根据患儿病情发展及时调整。患儿使用2 d后,体温恢复正常,咳嗽、咳痰等症状趋于缓解。该例患儿使用莫西沙星属超药品说明书用药,临床药师积极协助医师,完成了相关备案工作,并与其家属进行了充分沟通并获得其知情同意。
3.3 莫西沙星ADR监护
临床药师应告知护士,在给患儿使用莫西沙星时应缓慢滴注,避免配好的药液受日光暴晒。注意监测莫西沙星常见ADR,如胃肠道反应、肝功能损害、头痛、头晕、失眠等;以及严重ADR,如光敏反应、肌腱炎和肌腱破裂、QT间期延长及中枢神经系统毒性等。一旦患儿出现不适,注意及时停药。密切监测患儿治疗期间的体温变化,及时复查感染相关指标及细菌学检查结果以评估疗效。该例患儿在抗感染治疗方案调整2 d后,体温恢复正常,治疗10 d后好转出院,说明莫西沙星治疗儿童RMPP效果较好。患儿用药期间未发生与抗感染药物相关ADR,说明莫西沙星短期使用较安全。莫西沙星对儿童软骨是否有远期影响,依赖于长期随访资料,从近两年的随访资料来看,该患儿生长发育正常,未出现软骨及关节相关损伤,但仍需长期数据进一步评估。
3.4 小结
目前,儿童使用喹诺酮类药物治疗的经验及临床对其用药后潜在不利影响的了解较少。本研究中纳入1例对大环内酯类药物耐药的RMPP患儿,临床药师参与确定其抗感染药物和用量,充分考虑到儿童药物代谢动力学和药物效应动力学的特殊性,确定了最佳的抗感染治疗方案,协助医师完成了该例超药品说明书用药的备案工作并获得患儿家属知情同意,用药过程中对ADR进行重点监护,保障了患儿用药安全有效。本研究为喹诺酮类药物在儿童中安全、合理使用提供了证据支持,对儿童RMPP的抗感染治疗有一定的指导意义。但本研究也存在局限性,如仅为个案报道,又因暂无儿童RMPP系统性治疗方案的指南可供参考,临床药师仅结合该患儿病情并综合国内外循证级别较高的指南及相关文献进行分析后给出个体化治疗方案。对于儿童RMPP的治疗需多学科协作,今后仍需开展更多大样本的临床研究来积累临床治疗经验和循证医学证据。

