白藜芦醇抑制TLR4/NF-κB通路对毛细支气管炎小鼠的保护作用
高凯霞 吴福玲 石 涛 高 萌 张雪静 秦英飞 邝哲姝
滨州医学院附属医院儿科(滨州 256600)
毛细支气管炎多由呼吸道合胞病毒(respiratory syncytial virus,RSV)感染引起,常见于2~6月婴幼儿,临床特点主要表现为喘息、三凹征、气促[1]。目前的治疗方案以抗感染、控制喘息等对症支持治疗为主,尚无特异性治疗方法。RSV毛细支气管炎涉及到由多种细胞和细胞因子参与的固有免疫应答和适应性免疫应答[2]。其中Toll样受体(Toll-like receptors, TLRs),特别是TLR3、TLR4、TLR7等受体及其衔接蛋白与RSV感染关系密切[3]。而NF-κB是一种核转录因子,具有多种生物学活性,NF-κB途径可调节与喘息相关的呼吸道炎症基因,抑制NF-κB活性可减轻气道炎症反应,从而改善气道重塑[4]。已有相关研究表明,机体感染 RSV 后可激活TLR3通路,进而激活NF-κB,通过信号传导,引起下游炎性细胞因子的过度表达,加重气道炎症反应[5]。白藜芦醇(resveratrol,Res)是一种非黄酮类多酚有机化合物,广泛存在于葡萄、虎杖等70多种植物中,口服容易吸收,可随尿液、粪便代谢排出,其具有抗炎、抗过敏、抗氧化、抗肿瘤等多种生物学作用[6]。近年来,白藜芦醇的有益作用已在哮喘、肺纤维化、肺动脉高压和其他肺部疾病中被证明[7-8]。而TLR4与毛细支气管炎相关的具体机制仍不完全清楚。本文通过建立毛细支气管炎小鼠模型并予白藜芦醇干预,来探讨白藜芦醇对毛细支气管炎小鼠肺组织TLR4/NF-κB通路的调控作用。
1 材料与方法
1.1 实验材料
1.1.1 试剂 白藜芦醇、BCA蛋白浓度测定试剂盒购自Solarbio;兔抗鼠多克隆抗体GAPDH、TLR4及NF-κB购自武汉三鹰公司;胎牛血清购自四季青公司;小鼠白介素- 6(interleukin,IL- 6)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)试剂盒为上海朗顿公司产品。
1.1.2 制备RSV病毒 RSV A2株由山东省病毒研究所馈,将液氮冻存人宫颈癌 (Hela) 细胞复苏后,用含 10%培养液常规传代培养。将病毒悬液接种于Hela细胞,在37 ℃、2%FBS培养基中培养,至80%细胞发生病变时反复冻融,1 000 r、5 min 收集RSV病毒悬液,空斑实验检测病毒滴度。
1.1.3 实验动物 选取30只6~8周龄18~22 g B/C雄性小鼠,购自朋悦实验动物繁育有限公司,许可证号:SCXK(鲁) 2019-0003,由滨州医学院附属医院动物房分笼饲养适应1周。
1.2 方法
1.2.1 分组造模 将30只小鼠随机分为对照组、RSV组及给药组(白藜芦醇25 mg/kg)[9],每组小鼠10只。RSV组和给药组均予RSV病毒悬液滴鼻100 μL/天,连续2天[10],对照组予100 μL 磷酸盐缓冲液(PBS)滴鼻2天对照;给药组滴鼻2小时后予白藜芦醇25 mg/kg、0.2 mL腹腔注射,连续3天。对照组和RSV组滴鼻2小时后予0.2 mL PBS腹腔注射,连续3天。造模过程中无小鼠死亡。
1.2.2 收集肺泡灌洗液 (bronchoalveolar lavage fluid,BALF) 造模结束后第2天进行取材,5%水合氯醛(剂量0.1 mL/10 g)麻醉小鼠,充分暴露气管,用1 mL 灌洗液灌洗气管,重复抽吸3次,确保回收量大于0.8 mL,低温高速离心取上清液,-20 ℃ 冰箱保存。
1.2.3 肺组织病理观察 采取颈部脱臼法处死小鼠,剥离小鼠肺组织,取右肺中叶用10%多聚甲醛灌注固定48小时,用升序蔗糖脱水,包埋剂包埋,冰冻切片机切片,厚度约5 μm,切片后固定,固定时间为30 s~1 min,清水稍冲洗1~2 s。苏木素染色,时间大概为3~5 min;然后清水洗去苏木素,大概5~10 s。促蓝液返蓝5~10 s;清水稍冲洗1~2 s。伊红染色10~20 s,然后脱水、透明、中性树胶封固。400倍光镜下观察。
1.2.4 ELISA法测定 BALF中IL- 6、TNF-α的水平 按照试剂盒说明书步骤检测BALF中IL- 6、TNF-α的含量,根据标准品做出标准曲线,计算各组炎性因子水平变化。
1.2.5 Western blot 检测各组小鼠肺组织中TLR4、NF-κB蛋白水平 用匀浆器提取肺组织蛋白,BCA法测蛋白浓度,根据蛋白分子量大小值配胶,上样量为50 g进行电泳,将蛋白转膜,用5%脱脂奶粉封闭2小时,一抗(兔抗鼠多克隆抗体TLR4 1:1 000、兔抗鼠多克隆抗体NF-κB 1:1 000、兔抗鼠多克隆抗体GAPDH 1:5 000) 4 ℃冰箱孵育过夜,TBST 洗膜3次,10分钟/次,摇床孵育二抗(辣根过氧化物酶标记的山羊抗兔 IgG 1:5 000)2小时,TBST 洗膜3次,10分钟/次,于暗室曝光。分析软件分析条带吸光度值(A值) 。结果用A TLR4/A GAPDH、A NF-κB /A GAPDH表示。
1.2.6 逆转录-定量PCR(RT-qPCR)检测TLR4 mRNA、NF-κB mRNA表达 将肺组织(100 mg)加入1mL Trizol研磨匀浆,提取总RNA。总RNA根据PrimeScript RT试剂盒的说明进行逆转录。使用SYBR©-Green Master Mix(Takara Bio,Inc.)进行qPCR。根据制造商的方案;在推荐的参数下进行扩增:在94 ℃的初始变性3 min,扩增40个循环,94 ℃ 20 s,55 ℃ 15 s和72 ℃ 25 s,最后在94 ℃延伸20 s。用2-ΔΔCT法计算目的基因的表达水平。

基因名称序列大小引物序列(5'→3')TLR4 310 F:GGTGAGAAATGAGCTGGTAR:TCTGCTAAGAAGGCGATANF-κB425F:GCGCATCCAGACCAACAATAACR:GCCGAAGCTGTGGACACTGAPDH526F:CCACTTGAAGGGTGGAGCR: TGAAGTCGCAGGAGACAA
1.3 统计分析
2 结 果
2.1 小鼠BALF中IL- 6、TNF-α的水平
RSV组炎性因子水平升高,给药组可降低毛细支气管炎小鼠BALF中炎症因子水平。ELISA结果显示,对照组小鼠BALF中IL- 6的表达量为(12.26±6.25)pg/mL;RSV组小鼠BALF中IL- 6的表达量为(95.63±8.32)pg/mL,高于对照组,差异有统计学意义(P<0.05);给药组小鼠BALF中IL- 6的表达量为(54.32±10.42)pg/mL,较RSV组降低,差异有统计学意义(P<0.05),见图1。对照组小鼠B中TNF-α的表达量为(27.58±6.37)pg/mL;RSV组小鼠BALF中TNF-α的表达量为(57.23±16.45)pg/mL,高于对照组,差异有统计学意义(P<0.05);给药组小鼠BALF中TNF-α的表达量为(42.36±17.43)pg/mL,较RSV组降低,差异有统计学意义(P<0.05),如图2。

图1 ELISA法测小鼠BALF中IL- 6表达量

图2 ELISA法测小鼠BALF中TNF-α表达量
2.2 小鼠肺组织病理学表现
白藜芦醇治疗可减轻毛细支气管炎小鼠模型的病理损害。对照组肺组织肺泡结构无明显变化,支气管周围炎症细胞浸润不明显,黏膜结构、肺泡组织无明显变化(图3A)。与对照组相比,RSV组肺组织病理改变明显,表现为支气管黏膜增厚,气道狭窄,多发炎性细胞浸润,气管平滑肌增厚,还观察到明显的毛细血管充血、肺泡融合扩大和肺泡间隔增宽(图3B)。与RSV组比较,给药组肺组织病理改变较轻,支气管黏膜增厚较轻,炎症细胞浸润较少(图3C)。

图3 小鼠肺组织病理改变(HE染色,×400)
2.3 肺组织中TLR4、NF-κB蛋白的表达水平
RSV组较对照组小鼠肺组织中TLR4、NF-κB蛋白表达升高(P<0.05),给药组TLR4、NF-κB蛋白表达较RSV组降低,差异有统计学意义(P<0.05),见图4、图5。
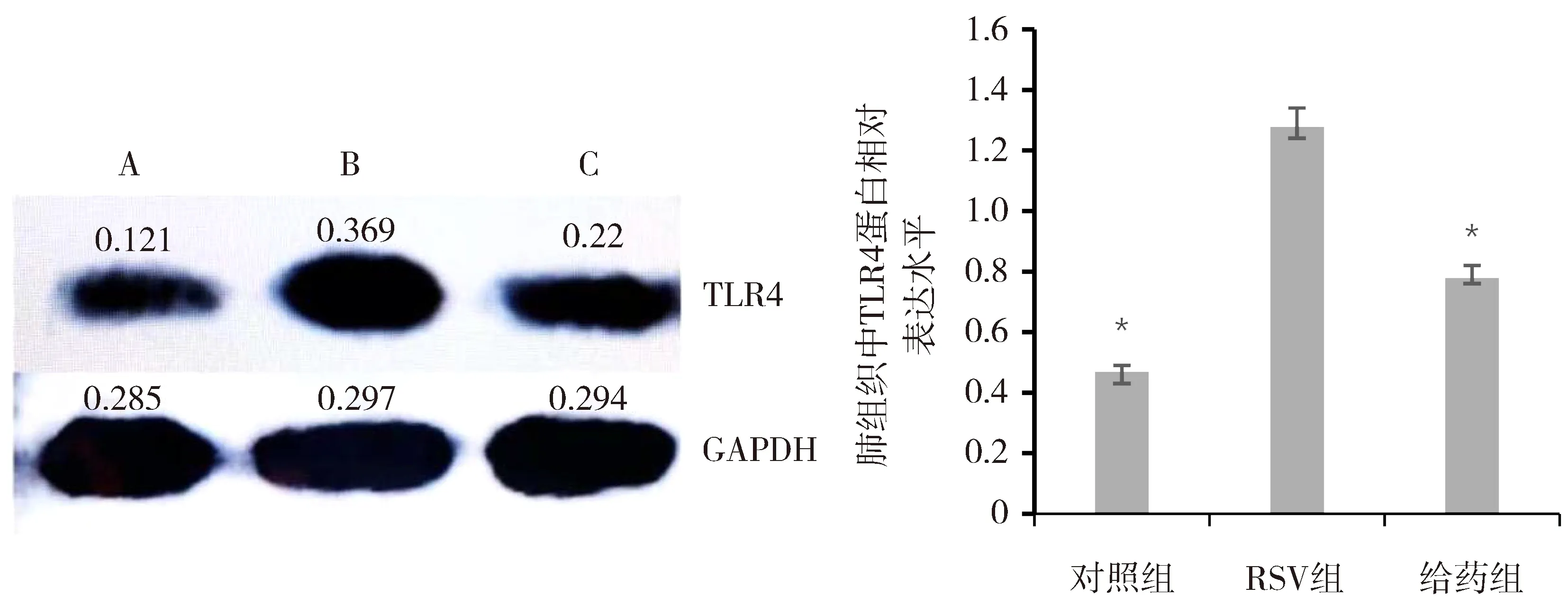
图4 Western blot 检测肺组织 TLR4蛋白变化

图5 Western blot 检测肺组织NF-κB蛋白变化
2.4 肺组织中TLR4 mRNA、NF-κB mRNA的表达水平
实验设定对照组TLR4 mRNA表达量为1.00;RSV组TLR4 mRNA相对表达量为(3.732±0.75),较对照组小鼠表达升高(P<0.05);白藜芦醇给药组TLR4 mRNA相对表达量为(1.494±0.34),较RSV组降低,差异有统计学意义(P<0.05),见图6。
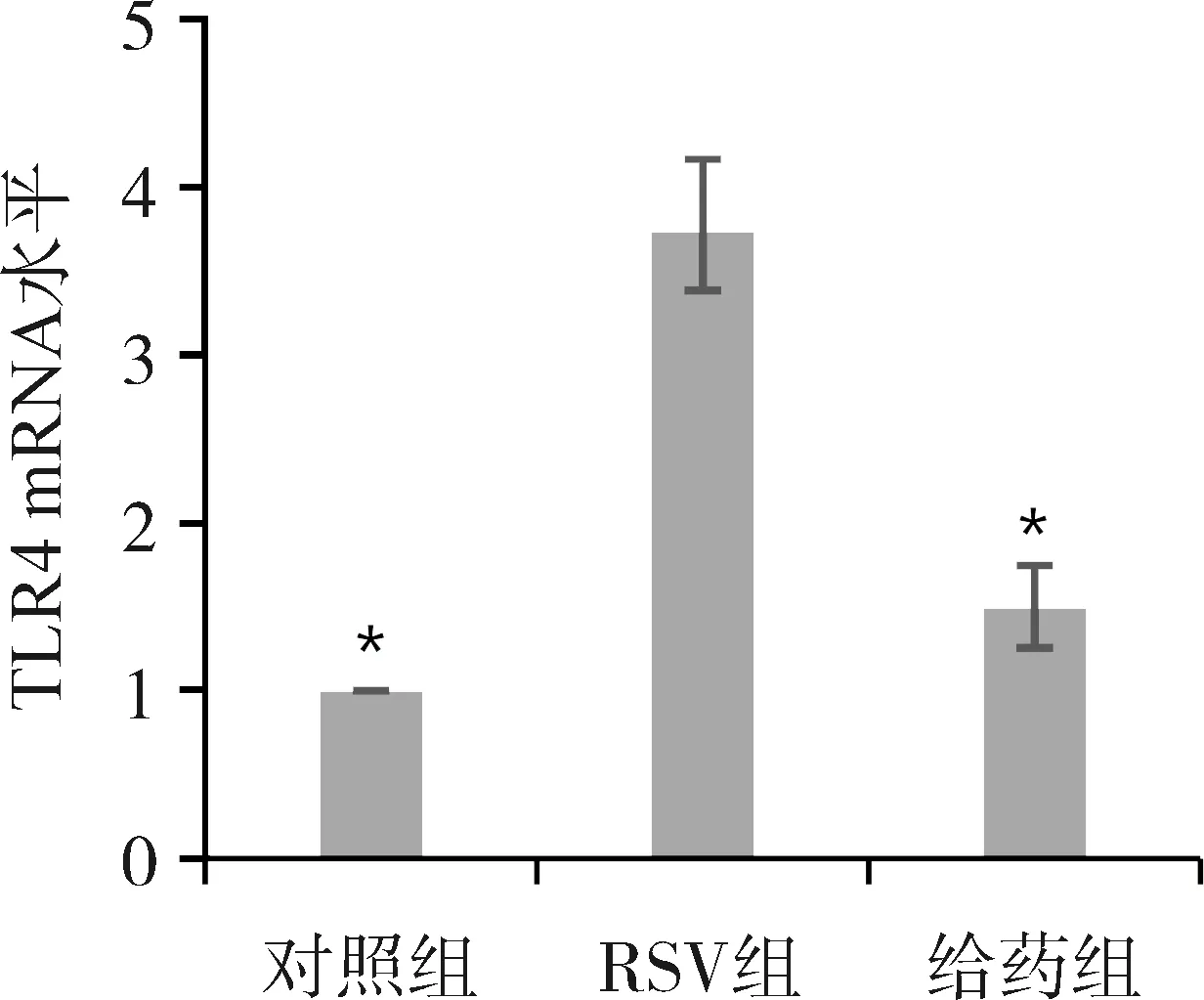
图6 RT-PCR检测各组小鼠肺组织中TLR4 mRNA的表达
实验设定对照组NF-κB mRNA表达量为1.00;RSV组NF-κB mRNA相对表达量为(6.634±0.97),较对照组小鼠表达升高(P<0.05);给药组NF-κB mRNA相对表达量为(4.128±0.52),较RSV组降低,差异有统计学意义(P<0.05),见图7。

图7 RT-PCR检测各组小鼠肺组织中NF-κB mRNA的表达
3 讨 论
毛细支气管炎多由RSV病毒感染引起[11]。它起病急、病情发展快,严重者可出现烦躁不安、紫绀甚至呼吸衰竭等表现,危害幼儿健康[12]。研究表明,炎症反应不仅促进该病的发生发展,还能降低儿童免疫反应,增加其他并发症[13]。因此,毛细支气管炎的治疗不仅需要减轻炎症反应,还需减少气道腺体分泌和增强机体免疫能力。
TLRs属于进化保守的模式识别蛋白,启动和调节先天免疫反应,到目前为止已被证明具有功能的10个人类TLR中的每一个都能识别不同的分子模式[14]。TLRS在RSV感染过程中发挥着重要的作用,是研究RSV感染的新的方向。机体感染RSV后激活TLRs通路,进而激活NF-κB,从而导致前炎性细胞因子(TNF-α、IL-1β、IL- 6、IL-8等)过度表达[15],这些生物活性介质,使气道呈现高反应,加重气道局部炎症,威胁患儿身体健康。实验证明,用脂多糖感染小鼠导致肺炎后,可激活TLR4信号,导致活化NF-κB表达和促炎细胞因子TNF-α、IL-1β和IL- 6的产生[16]。实验研究表明,RSV感染机体后可促使肺泡巨噬细胞分泌大量TNF-α,且分泌量与感染严重程度有关[17]。本实验中检测RSV毛细支气管炎小鼠BALF中IL- 6、TNF-α水平高于空白对照组,肺组织中TLR4、NF-κB蛋白水平及mRNA水平高于空白组,提示RSV感染小鼠后可能是激活TLR4/NF-κB信号通路激发炎症反应,并与以上实验数据相统一。
我们现在知道TLR4能够感知各种微生物结构,包括RSV的融合F蛋白[18]。TLRs家族中的TLR4可与抗原结合迅速,并通过激活相关激酶向下游传递信号发挥其功能,是激活炎症通路和合成、分泌高水平炎症介质的启动因素[19]。何月贤等[20]通过收集121例毛细支气管炎患儿,均由RSV感染导致,研究发现观察组血清TLR4、TGF-β1水平高于对照组,且升高的程度影响病情的严重程度。实验结果提示血清中TLR4、转化生长因子-β1表达上调通过介导免疫应答反应和炎症反应而参与发病过程,并影响疾病严重程度。我们实验中通过构建毛细支气管炎小鼠模型,检测小鼠肺组织中TLR4蛋白、TLR4 mRNA较空白对照组明显升高,与上述何月贤检测患儿血清研究结果一致,这表明了TLR4参与了毛细支气管炎的发病和发展过程。
白藜芦醇是一种多酚化合物,存在于多种药用植物中。随着研究进展,发现白藜芦醇生物活性较多,尤其在免疫调节、抗病毒、抗炎等方面作用显著[21]。白藜芦醇可以通过干扰免疫细胞调节、促炎细胞因子的合成和基因表达来调节免疫[22]。白藜芦醇最显著的作用是减轻炎症,主要是通过调节NF-κB途径实现[23]。李明等[24]通过RSV滴鼻感染小鼠建立肺炎模型,研究低、中、高剂量白藜芦醇给药组肺组织炎症因子水平,说明白藜芦醇可以改善RSV引起的肺部炎症反应,并具有剂量依赖性。故本实验中给药组选取最佳给药剂量25 mg/kg给药,检测各组小鼠BALF中TNF-α、IL- 6因子的水平,得出白藜芦醇可以减轻毛细支气管炎小鼠肺内炎症,这与以上实验结果一致。
本研究中,给药组小鼠喘息症状及肺泡灌洗液中IL- 6 、TNF-α水平较RSV组明显下降。说明白藜芦醇可以抑制毛细支气管炎小鼠肺内的炎症反应,减少炎症因子的释放,进而改善预后。同时实验得出,给药组小鼠肺组织中TLR4、NF-κB 的蛋白表达水平及 TLR4 mRNA、NF-κB mRNA的表达水平均比RSV组低,进一步明确了白藜芦醇对毛细支气管炎小鼠抑制的保护机制可能是通过抑制 TLR4介导的炎症通路实现的。
综上,白藜芦醇能明显改善毛细支气管炎小鼠的症状,减轻肺内炎症反应,降低炎症因子含量和肺组织中TLR4、NF-κB的表达,从而发挥对毛细支气管炎小鼠的保护作用,证实该保护作用可能是通过抑制TLR4/NF-κB通路介导的免疫炎症反应实现的。

