四种蔬菜土壤真菌群落组成与多样性
扈进冬,李红梅,吴远征,魏艳丽,李纪顺
(齐鲁工业大学(山东省科学院) 山东省科学院生态研究所 山东省应用微生物重点实验室,山东 济南 250103)
山东是蔬菜种植和生产大省,蔬菜播种面积达200万公顷,产量达1.1 亿吨[1],设施蔬菜栽培面积保持在86.7万公顷以上,约占全国的四分之一[2]。但连年种植模式以及不合理的施肥、用药,耕作土壤板结、酸化、碱化、土传病害等问题严重影响了作物的产量和品质。姜、大葱、黄瓜和草莓是重要的蔬菜品种,莱芜大姜、章丘大葱、曲堤黄瓜还是当地特产和全国农产品地理标志产品,均存在连年栽培、土壤环境质量下降问题,制约着这些作物的健康和可持续生产。
土壤微生物是土壤生态系统的重要组成部分,其数量、种类及群落结构等与地理位置、土壤类型、作物类型、土壤肥力等密切相关,并在一定程度上反映了土壤的环境质量。真菌是微生物群落的重要组分,有些真菌具有促进土壤有机质转化、营养元素循环、作物生长、控制作物病害等有益作用,也有些真菌会导致植物病害并影响植物产量和质量。受温度、酸碱度、水分和养分等多种土壤环境因子的影响[3-4],单一作物连作模式下土壤病原真菌会不断累积,有益真菌的相对含量则不断降低,减弱了土壤真菌群落结构的稳定性,造成土壤真菌群落生态失衡和作物产量降低[5-7]。本文选用姜和大葱、黄瓜和草莓分别作为露地蔬菜和设施蔬菜的典型代表,通过荧光定量PCR(quantitative polymerase chain reaction,qPCR)和扩增子测序技术,检测并分析了这些作物土壤中真菌群落组成及多样性状况,结合土壤理化性质测定,分析了土壤真菌群落与环境相关因子间的关系,以期阐释不同真菌群落多样性与蔬菜土壤环境质量关系,为土壤环境质量的改善提升提供理论依据。
1 材料与方法
1.1 土壤采样与处理
1.1.1 取样位点概况
土壤采样点分别位于济南市历城区张而镇、莱芜区、济阳区曲堤镇、章丘区。随机选取草莓大棚样品10个、黄瓜大棚样品10个、大葱种植区样品10个、大姜种植区样品10个,每个采样点间隔大于1 000 m以上。
1.1.2 采样方法与处理
土壤样品采集时间为2021年9月中旬,使用土壤采集器采集土壤样品,取样时去除表层土,钻取0~20 cm土壤,每个采样点随机5点取样混合后作为1个土壤样品,置入冰盒内低温保存。样品均匀混合后过20目细筛去除石块和植物残体,-80 ℃保存备用。剩余土壤(约200 g)置于室内自然风干,用于土壤理化性质测定,包括:pH、电导率、全氮(TN)、碱解氮(AN)、速效磷(RP)、速效钾(RK)测定。
每个土样准确称取0.3 g冷冻土壤,使用DNeasy PowerSoil Kit (QIAGEN, USA)土壤微生物DNA提取试剂盒提取土壤基因组DNA,0.8%琼脂糖凝胶电泳检测DNA提取质量后-20 ℃保存。
1.2 实时荧光定量 PCR
以土壤基因组 DNA 为模板,采用引物 ITS1F (5′- CTTGGTCATTTAGAGGAAGTAA -3′)和 ITS2R(5′- GCTGCGTTCTTCATCGATGC -3′ )[8]进行实时qPCR,测定土壤真菌 ITS 序列拷贝数。以含有酿酒酵母的18SrRNA基因的质粒的10倍稀释液产生标准曲线(基因拷贝数范围从3.0×103到3.0×107)。采用三步方案进行qPCR反应:在95 ℃ 10 min; 95 ℃ 30 s,50 ℃ 30 s,72 ℃ 1 min,共40个循环反应;循环结束后,样品加热到95 ℃,立刻降至60 ℃保持5 s,每5 s提高0.5 ℃递增到95 ℃,建立熔解曲线。qPCR反应体系(20 μL)包括10 μL 2×SG Fast qPCR Master Mix预混液(生工生物工程(上海)股份有限公司),20 μmol/L正向和反向引物各1 μL,DNF Buffer 2 μL,5 μL分子级水和1 μL土壤样品DNA。每样本均三次重复,结果表示为每克土壤目标拷贝数,根据标准曲线计算各样本中总真菌ITS 序列拷贝数。
1.3 真菌ITS基因的Illumina MiSeq测序
每种作物分别选择了10个DNA样本用于土壤真菌群落分析。PCR扩增选取真菌ITS基因的ITS2区,使用带Barcode序列的引物对ITS3(CCAGCASCYGCGGTAATWCC)和ITS4(ACTTTCGTTCTTGATYRA)[9]进行两轮PCR扩增。扩增完成后对其产物进行纯化,纯化产物Qubit2.0定量,根据测定DNA浓度将样品等比例混合均一化形成测序文库,在上海生工生物工程股份有限公司Illumina MiSeq测序平台PE300进行高通量测序。
1.4 数据处理与统计分析方法
土壤理化性质检测数据采用GraphPad Prism (ver.8.0)进行统计分析,采用Duncan’s新复极差法分析数据差异显著性;高通量测序完成后经过数据处理获得在97%相似水平下的OTU表,采用R语言(windows版v.4.1.0) vegan、picante包计算香农指数和操作分类单元数、使用FunGuild数据库(http://www.stbates.org/guilds/app.php)[10]进行真菌功能预测分析,ggplot2包绘制真菌群落丰度、α-多样性和土壤真菌FunGuild功能分类组成的相对丰度(单因素方差分析(single-way ANOVA)在P<0.05的概率水平下确定最小显著差异)[11]。使用STAMP软件分析不同作物土壤中真菌群落和功能的相对丰度[12];使用深圳微生态科技有限公司提供的生物信息云平台进行RDA分析(https://www.bioincloud.tech)。
2 结果
2.1 不同作物土壤的理化性质
表1显示不同作物土壤中6种环境因子组间存在明显差异(P<0.05),露地蔬菜土壤与设施蔬菜土壤之间差异明显,其中露地蔬菜作物姜和大葱土壤中的全氮含量与电导率大大低于设施蔬菜作物黄瓜和草莓土壤,黄瓜土壤的全氮、有效磷、速效钾、碱解氮以及电导率均显著高于其他作物土壤,而大葱土壤中的全氮、有效磷、速效钾、碱解氮相对较低。

表1 四种蔬菜作物种植土壤理化性质Table 1 Physical and chemical properties of different crops’ soils
2.2 不同作物土壤中真菌群落的丰度
以真菌ITS拷贝数为指标,采用qPCR检测了不同作物土壤真菌群落丰度,如图 1 所示,四种作物土壤中,大葱土壤中真菌群落丰度最低,姜土壤真菌群落丰度最高,且有显著差异(P<0.05);黄瓜和草莓土壤真菌群落丰度介于大葱和大姜土壤之间,二者没有显著性差异。
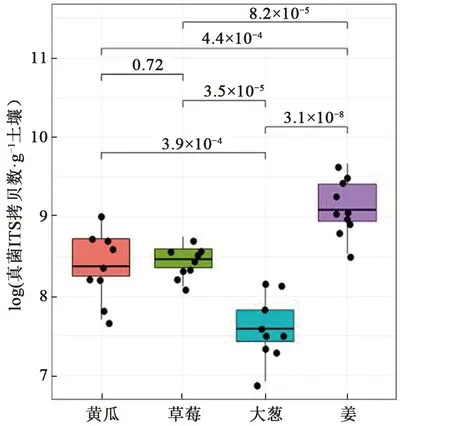
注:图中数字表示采用t检验计算的两种作物土壤之间的具有差异的概率值。图1 不同作物的土壤真菌群落丰度Fig.1 Abundance of soil fungal communities in different crops
2.3 不同作物土壤中真菌群落α-多样性
测序后40个土壤样本共得到高质量序列1 476 130条。在97%的相似性水平下聚类操作分类单元(OTU),同时过滤丰度低于万分之一的OTU,并按照最少序列数样本整体抽平到13 563条序列,经UNITE数据库比对后40个样本共聚类得到541个真菌OTU。
图2显示,大葱土壤真菌群落多样性最丰富,草莓土壤真菌群落多样性最差(香农指数);与黄瓜、草莓设施蔬菜土壤相比,露地作物大葱和大姜的土壤真菌群落丰富度更高(香农指数,但黄瓜和姜之间差异不显著,P<0.05)。姜土壤真菌群落丰富度最高,黄瓜土壤真菌群落丰富度最低;与设施黄瓜、草莓土壤相比,露地大葱和姜土壤真菌群落丰富度更高(操作分类单元数OTUs,P<0.05)。露地作物大葱和姜之间,设施黄瓜和草莓之间的真菌群落丰富度和群落多样性差异不显著(P>0.05)。

图2 不同作物土壤中真菌群落α多样性Fig.2 Alpha-diversity of fungal communities in the soils of different crops
2.4 不同作物土壤真菌群落结构分析
依据物种注释结果,对不同作物土壤样本的物种进行分类,得到不同作物土壤样本在门水平下的物种相对丰度柱状堆积图。如图3所示,子囊菌门(Ascomycota)是不同作物土壤中最主要的真菌门类,占比73.36%~84.61%;其次担子菌门(Basidiomycota)、壶菌门(Chytridiomycota)、被孢霉门(Mortierellomycota)也是含量比较丰富的优势菌门,但在不同作物土壤中占比有明显差异,如担子菌门在黄瓜和草莓土壤中相对丰度低于1%,而大葱和姜土壤中担子菌门相对丰度均大于6%。通过STAMP差异比较不同作物土壤样本之间物种在门水平上的相对丰度,发现草莓土壤与大葱土壤的子囊菌门、壶菌门和担子菌门相对丰度差异显著(P<0.05);草莓土壤与姜土壤的子囊菌门和担子菌门相对丰度差异显著(P<0.05);草莓土壤与黄瓜土壤的担子菌门相对丰度差异显著(P<0.05);黄瓜土壤与大葱土壤的子囊菌门和壶菌门相对丰度差异显著(P<0.05);黄瓜土壤与姜土壤的被孢霉门相对丰度差异显著(P<0.05);其余组合之间无显著性差异。

注:纵轴表示真菌门类群,每一列表示对应门类的平均相对丰度,不同颜色表示不同作物土壤,最右边是对应的P值。图3 不同作物土壤真菌群落在门水平上的差异检验Fig.3 Difference test of phylum level of soil fungal communities for different crops
2.5 不同作物土壤中功能真菌类群的丰度分析
图4显示了不同作物土壤中功能真菌类群的相对丰度,在姜、黄瓜、大葱和草莓土壤的功能真菌类群中排泄物腐生菌、植物腐生菌、土壤腐生菌等营腐生真菌相对丰度分别为37.05%、12.26%、32.97%、43.68%,是土壤真菌的重要功能类群;草莓土壤中营腐生真菌占比最高,显著高于黄瓜、大葱土壤中营腐生真菌类群丰度(P>0.05)。姜、黄瓜、大葱和草莓土壤中植物病原菌相对丰度分别为3.21%、0.72%、4.24%和2.24%;黄瓜土壤中植物病原真菌类群占比最低,但与其余三种作物土壤中植物病原真菌类群丰度无显著差异(P>0.05)。

图4 不同作物土壤中功能真菌的组成Fig.4 Composition of functional fungi in the soils of different crops
2.6 不同作物土壤真菌群落与土壤环境因子的关联分析
不同作物土壤理化性质与土壤真菌群落间的冗余分析(redundancy analysis,RDA)如图5所示。结果展示了不同作物土壤真菌群落与pH、总氮、碱解氮、有效磷、速效钾、电导率6种环境因子的相关性,排序轴RDA1和排序轴RDA2方差变量解释分别为31.76%和22.17%,累计解释了土壤真菌群落结构累积方差变量的53.93%,说明RDA排序结果是比较可靠的,在不同作物土壤中6种环境因子对其真菌群落组成有显著性影响(P<0.05);排序轴RDA1与碱解氮的正相关性最大,相关性系数为0.999 2;排序轴RDA2 与pH的正相关性最大,相关性系数为0.300 8;与电导率值的负相关性最大,相关性系数为-0.806 9(表2),6种环境因子中pH和RP与土壤真菌群落的相关程度最大,分别为0.438 7和0.367 3。
从真菌群落组成上看,在土壤中相对丰度大于0.5%的真菌门类中,子囊菌门受pH的影响最大,呈正相关,而与电导率呈负相关;捕虫霉门(Zoopagomycota)受电导率影响较大、呈正相关;被孢霉门受RP影响最大,呈负相关;毛霉门(Mucoromycota)受RK影响较大,呈负相关;壶菌门受全氮和碱解氮影响较大,呈负相关;担子菌门受电导率影响较大、呈负相关(图5)。
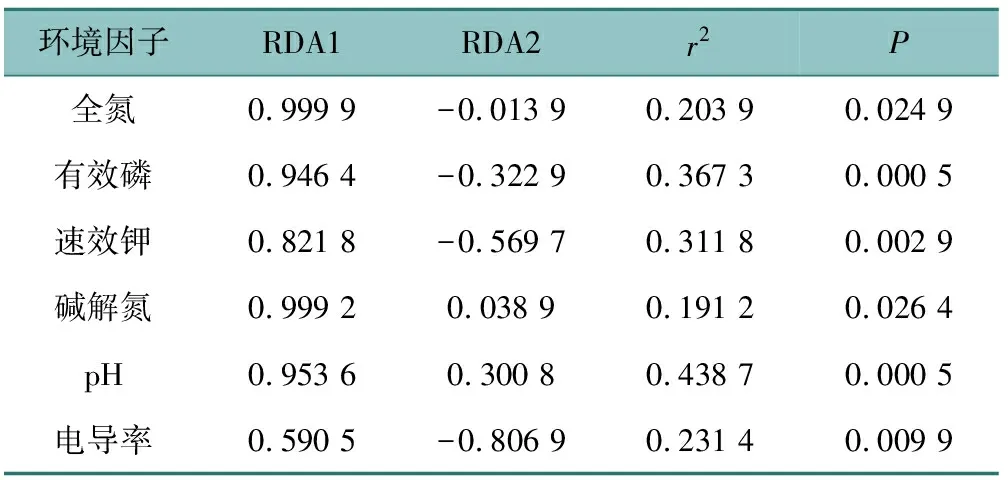
表2 排序轴RDA与环境因子的相关关系Tab.2 Correlation between the sorting axes RDA and environmental factors

图5 不同作物土壤真菌群落组成及门水平真菌类群与环境因子的RDA分析Fig.5 Redundancy analysis of the relationship between crop soil fungal community composition or phylum level fungal groups and environmental factors
3 讨论
通过土壤DNA的高通量测序结果可以看出,子囊菌、担子菌、被孢菌门、壶菌门、捕虫霉门等真菌类群相对丰度占比较高,是土壤真菌的主要真菌组分,在总的土壤真菌中平均占比大于1%;毛霉门和捕虫霉门也是重要的真菌门类,占比次之。多样性分析表明大葱和姜土壤中真菌群落香农指数高,OTU数多,多样性更为丰富;黄瓜和草莓土壤样品取自大棚,香农指数低,OTU数低,多样性较低。此外,本项研究发现露地蔬菜土壤子囊菌含量低于设施蔬菜土壤子囊菌含量,分别为72.37%、73.45%、93.28%和83.61%;被孢霉门含量相对较高,分别为3.08%、5.83%和1.91%和0.92%。有研究表明在发病土壤中子囊菌Ascomycota的相对丰度更高,而在健康土壤中被孢霉门Mortierellomycota却更多[13],还有文献报道,在富含有机质的土壤中被孢霉丰度很高,是土壤碳及养分转化的关键真菌类群[14]。上述结果说明露地蔬菜土壤微生物生态状况优于设施蔬菜土壤微生物生态。究其原因,从土壤理化性质分析结果可以看出,农户在设施蔬菜种植过程施用比露地蔬菜更多的化学肥料,使得设施蔬菜土壤中N、P、K营养成分明显高于露地蔬菜土壤,土壤电导率值偏高,土壤板结,从而造成了土壤微生物群落失衡。
依据FunGuild数据库在线比对结果获得姜、黄瓜、大葱和草莓土壤中植物病原菌相对丰度,姜和大葱的相对丰度更高,似乎其土壤真菌群落变得比设施蔬菜更不适宜,但将高通量测序获得的相对丰度乘以qPCR定量获得的土壤总真菌绝对量则发现,黄瓜和草莓土壤中病原真菌ITS序列拷贝数分别为每克土壤1.84×106和8.54×106,而大葱和姜土壤中的病原真菌ITS序列拷贝数分别为每克土壤5.67×105和2.78×107上述结果显示,不同作物土壤中病原真菌相对丰度无明显差异,但伴随土壤真菌总丰度的增加病原真菌绝对量会同比大幅升高,大大增加了作物病害发生几率,这与当前莱芜姜种植区茎基腐病、姜根腐病等土传病害频发相一致[15],需要引起高度重视。因此,需从改善土壤质量入手,增施木霉、芽孢杆菌等有益菌,减施化学肥料,配施有机肥,降低土壤真菌丰度,改善真菌群落结构,为作物营造健康土壤环境。
真菌是土壤的重要组分,与细菌、原生动物等微生物共同参与土壤的养分和水分的生物地球化学循环[15],并在多方面影响作物生长、控制作物疾病发生[4-5],其丰度和组成可作为土壤健康评估的重要指标[16-17],本研究分析了不同作物土壤真菌群落组成和多样性,并探讨了其与环境因子相互关系,为土壤环境质量的改善、提升提供了理论依据。

