基于转录组分析外源H2S对拟南芥芥子油苷生物合成的影响
祁红学,吴丽华,李利红*
基于转录组分析外源H2S对拟南芥芥子油苷生物合成的影响
祁红学1,吴丽华2,李利红1*
(1.晋中学院化学化工系,山西 榆次 030619;2.太原师范学院生物系,山西 榆次 030619)
外源硫化氢(H2S)喷施拟南芥幼苗后,利用高通量测序技术对植株地上组织进行转录组测序,分析差异表达基因的生物学功能和代谢通路,探究H2S对芥子油苷生物合成的调控作用.结果表明,100μmol/L H2S处理3d后,拟南芥植株共有3160个基因差异表达,涉及细胞代谢、结合、催化、转录调控、物质转运、信号转导等过程.通过KEGG富集分析发现,差异表达基因在多个初生代谢和次生代谢通路显著富集,其中芥子油苷生物合成途径中9个基因差异表达(8个上调和1个下调),均为参与脂肪族芥子油苷合成的关键酶基因,而吲哚族芥子油苷合成相关基因表达无明显改变.同时,硫代谢、半胱氨酸和甲硫氨酸代谢、谷胱甘肽代谢途径中多个基因上调表达,说明外源H2S可增强体内硫相关代谢活动,进而促进植物体内脂肪族芥子油苷的合成.转录因子差异表达分析显示,正向调控脂肪族芥子油苷合成的基因表达上调,而抑制其合成的基因表达水平降低,说明H2S可通过调控MYB转录因子的表达来调节植物体内脂肪族芥子油苷的合成.对芥子油苷生物合成途径中部分关键酶基因及相关MYB转录因子表达模式进行实时荧光定量PCR(qRT-PCR)分析,发现其与测序结果一致,证实了转录组测序结果的可靠性,同时也进一步证明了H2S对植物体内芥子油苷生物合成的调控作用.
H2S;拟南芥;转录组;芥子油苷;差异基因
硫化氢(H2S)是继一氧化氮(NO)和一氧化碳(CO)之后的第三种气体信号分子,不仅参与调控植物生长发育[1-2],还在植物抵抗逆境胁迫过程中发挥重要作用[3].Müller等[4]研究表明,H2S熏蒸有效增加拟南芥植株体内谷胱甘肽(GSH)和半胱氨酸(Cys)含量,说明外源H2S促进植物体内的硫代谢过程,从而影响细胞内的氧化还原状态.Chen等[5]发现外源H2S参与调控菠菜体内可溶性糖、多胺、脯氨酸和甜菜碱的生物合成,增加叶片渗透势和相对含水量,提高菠菜幼苗的耐旱性. Shi等[6]研究发现,低浓度H2S诱导拟南芥体内氨基酸、有机酸、糖及一些次级代谢产物含量增加,病程相关基因表达水平提高,植株抵抗生物胁迫的能力增强.可见,H2S参与调节植物体内多个生理代谢过程,从而提高植物对环境的适应性.
芥子油苷是十字花科植物中一类重要的含氮、含硫的植物次生代谢物质,通常由β-D葡萄糖连接磺酸盐醛肟基团和来源于氨基酸的侧链组成[7-8].根据侧链氨基酸来源的不同,芥子油苷通常分为脂肪族、芳香族和吲哚族三大类.拟南芥中的芥子油苷以脂肪族和吲哚族为主[9].芥子油苷及其降解产物具有多种不同的生物活性,参与植物的防卫反应,还具有抗癌和抗氧化活性等[10-11].已有研究表明,施加硫肥诱导油菜营养器官和花中芥子油苷含量均显著升高,而持续缺硫导致拟南芥幼苗芥子油苷含量明显下降,说明环境中硫含量直接影响芥子油苷的合成[12-13].此外,当温度、光照、水分等环境因子发生改变,或者植物受到昆虫取食、病原菌侵害、机械损伤、盐胁迫等时,植物会通过调节体内芥子油苷的合成来增强其抗逆性,但是有关这些生物和非生物因素对芥子油苷代谢的调控机制并不清楚[14-15]. H2S是植物体内重要的信号分子,也是硫代谢途径中非常重要的中间产物,环境中的H2S可能会影响植物体内的硫代谢过程,并参与调节芥子油苷的合成,进而在植物逆境胁迫应答过程中发挥重要作用.
H2S参与调控植物生理活动是涉及许多基因的复杂过程,利用高通量转录组测序能够全面、快速地分析H2S对植物的影响及其分子机理,还能进一步挖掘H2S在植物体中的生理功能.本研究以拟南芥为试材,外源喷施H2S后,采用高通量测序技术对其地上组织进行转录组测序分析,研究植物响应H2S的相关代谢途径,阐明H2S对植物芥子油苷合成的调控机理,从而为植物抗逆生产实践提供理论依据.
1 材料与方法
1.1 植株培养
拟南芥(L.)Columbia生态型(Col-0).4℃春化2d后播种于营养土中,培养温度(22±1)℃,光/暗周期为16h/8h,光照强度140μmol/ m2/s,相对湿度约70%.
1.2 H2S处理
试验以NaHS作为外源H2S供体.取4周龄拟南芥植株,根据文献资料及前期预实验的结果[5],我们选用50, 100, 200μmol/L H2S喷施拟南芥叶片.每隔3h喷1次,每天8:00~20:00共喷施4次.设置喷施等量蒸馏水的拟南芥植株为对照.每处理3次重复,每重复20株拟南芥.在H2S喷施3d后,分别取各处理组拟南芥植株地上部分用于生理指标、转录组测序和qRT-PCR分析.
1.3 生理指标检测
过氧化氢(H2O2)含量测定采用分光光度法,丙二醛(MDA)含量测定用硫代巴比妥酸(TBA)反应法,过氧化氢酶(CAT)活性测定用紫外吸收法,谷胱甘肽硫转移酶(GST)活性采用1-氯-2,4-二硝基苯(CDNB)比色法,谷胱甘肽过氧化物酶(GPX)活性测定采用5,5′-二硫代双(2-硝基苯甲酸)(DTNB)直接法.
1.4 转录组测序
100μmol/L H2S处理3d后,取对照组和H2S处理组拟南芥植株地上组织,用Trizol法提取总RNA,利用磁珠富集mRNA,经RT-PCR扩增构建cNDA文库.库检合格后,用Illumina平台进行测序. RNA提取、建库和转录组测序均委托北京百迈克生物科技有限公司完成.
计算H2S处理组与对照组信号比值(Fold Change, FC),并用log2FC>1为标准筛选差异表达基因.运用ClusterProfiler软件对差异表达基因进行GO功能注释分析,根据KEGG数据库对差异表达基因进行KEGG通路富集分析.
1.5 qRT-PCR检测

表1 qRT-PCR引物序列
利用转录组测序提取的总RNA,PrimeScriptTMRT Master Mix (Takara) 试剂盒合成 cDNA作为模板,使用ABI 7500Real-Time PCR System对目的基因进行扩增,反应体系参照SYBR Premix Ex TaqTMII(Takara)试剂盒的方法,反应程序:94℃,30s;94℃, 5s,60℃,30s,40个循环.以作为内参基因,用2-∆∆CT方法计算相对表达量.引物序列使用见表1.
2 结果与分析
2.1 外源H2S处理后拟南芥植株抗氧化能力分析
由图1可见,50μmol/L H2S处理后,拟南芥植株H2O2和MDA含量无明显改变,抗氧化酶CAT活性和抗氧化物GSH含量增加,而GST和GPX活性与对照组相比无显著变化.100μmol/L H2S处理诱导拟南芥植株H2O2含量增加,同时CAT活性显著升高,GSH含量及GST和GPX活性提高,MDA含量与对照组相比显著降低. 200 μmol/L H2S处理后,拟南芥植株体内H2O2含量、CAT和GST活性无明显变化,GSH含量和GPX活性、MDA含量显著增加.
H2S参与调节植物的生长、发育、成熟和衰老过程,还可从不同水平增强植物应答各种非生物胁迫和生物胁迫的能力[16-17].本研究中,H2S处理后拟南芥植株抗氧化酶CAT活性升高,GSH含量、GST和GPX活性提高,有效清除活性氧H2O2,说明适宜浓度H2S可提高植株抗氧化能力,尤其是提高含硫抗氧化物及其相关防御酶水平,增强植物对环境胁迫的耐受性.
结果表明,100μmol/L H2S处理引发细胞的生理防御.因此,我们选用该处理进行转录组测序分析,研究H2S对植物的影响及其分子机理.

图1 H2S处理对拟南芥植株中抗氧化能力的影响
2.2 外源H2S处理后拟南芥差异表达基因及GO功能注释分析
100μmol/L H2S处理3d后,在拟南芥地上组织中共发现差异表达基因(DEG)3160个,其中上调表达基因1500个,下调表达基因1660个.对差异表达基因进行GO功能注释,将这些基因分为36类,归纳为细胞组分(Cellular Component)、生物过程(Biological Process)与分子功能(Molecular Function)三大部分(图2).在细胞组分中,细胞、细胞成分、细胞器、膜组分富集差异基因较多;在生物过程中,细胞进程、代谢过程、应激反应、生物调节过程富集差异基因较多;在分子功能中,结合、催化、转录、转运功能组富集差异基因较多.由此可见,H2S处理诱导拟南芥多个基因差异表达,涉及细胞代谢、结合、催化、转录调控、物质转运、信号转导等过程.

图2 H2S处理后拟南芥差异表达基因GO功能注释
2.3 外源H2S处理后拟南芥差异表达基因的KEGG通路富集分析
对H2S诱导的差异表达基因进行KEGG通路注释,发现共有1134个差异基因注释到123个通路,分布在细胞过程、环境信息处理、遗传信息处理、代谢和有机系统5大生物过程中.
通过KEGG富集分析发现,在差异表达基因显著富集的前20个通路中(图3),有18个为代谢通路,包括谷胱甘肽代谢、2-氧代羧酸代谢、氨基酸代谢(半胱氨酸和甲硫氨酸代谢、苯丙氨酸、酪氨酸和色氨酸生物合成、缬氨酸、亮氨酸和异亮氨酸降解、氨基酸的生物合成、缬氨酸、亮氨酸和异亮氨酸生物合成)、脂质代谢(甘油磷脂代谢、脂肪酸代谢、α-亚麻酸代谢、类固醇生物合成、不饱和脂肪酸的生物合成、亚油酸代谢)、糖类代谢(淀粉和蔗糖代谢、糖酵解/糖异生、半乳糖代谢)、次级代谢产物合成(芥子油苷生物合成和异喹啉生物碱生物合成),说明H2S参与调控植物的多个初生代谢和次生代谢过程.
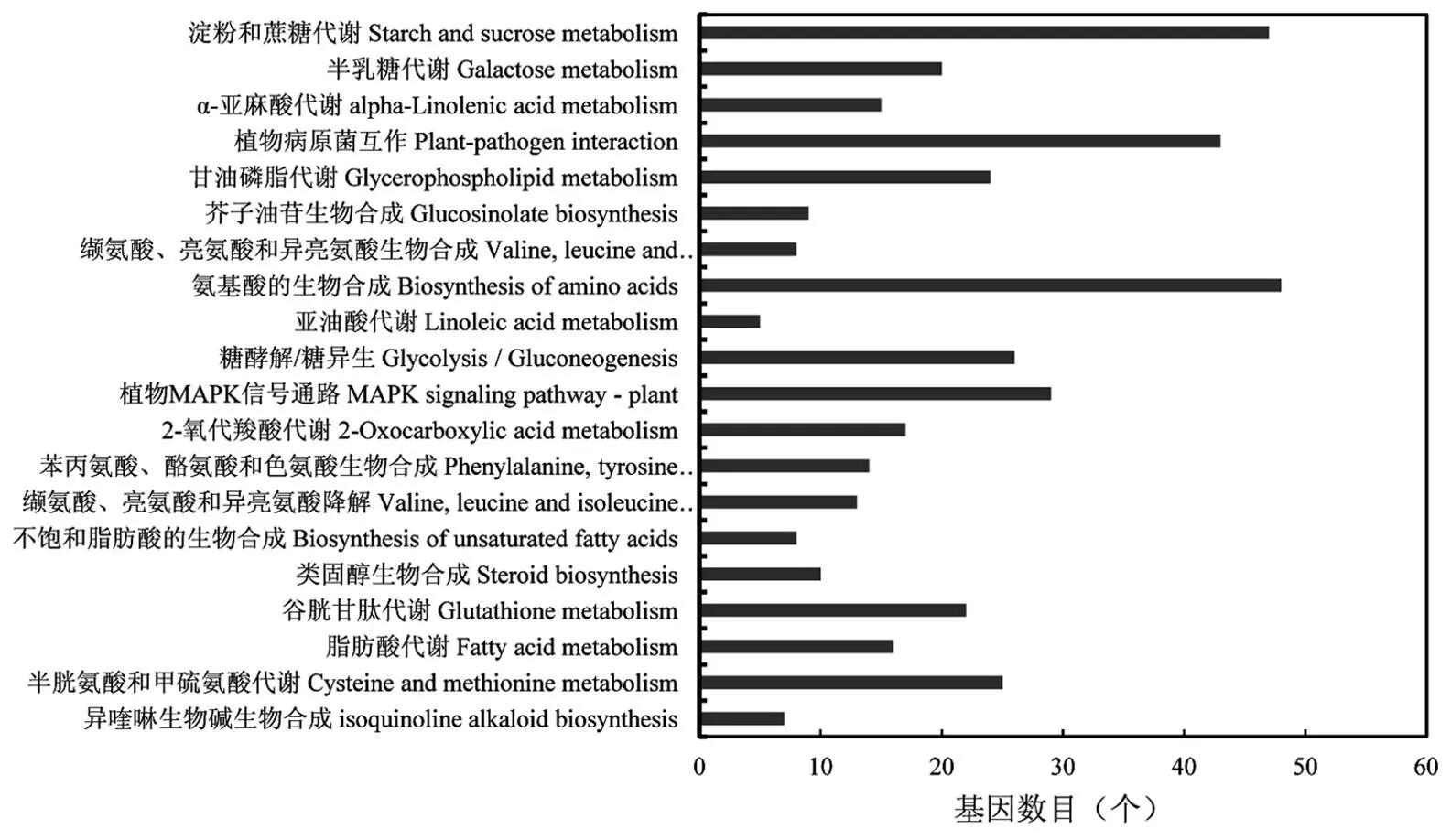
图3 H2S处理后拟南芥差异表达基因KEGG富集通路
外源H2S处理后,拟南芥转录组差异表达基因显著富集于氨基酸、糖类和脂质代谢途径的多个通路中.氨基酸可用于蛋白质合成,还能作为一些次生代谢产物合成的前体,促进细胞内的次生代谢产物的积累[18].糖类不仅可为植物的生长发育提供能量,还可作为信号分子参与调节基因和蛋白的表达、细胞周期、初生和次生代谢及生长和发育进程等[19-20].脂质作为主要的生物分子,在植物中发挥着结构成分、能量存储、信号分子和表面覆盖物等重要作用[21].因此,H2S信号分子参与植物体内氨基酸、糖类和脂质的代谢调控,进而影响植物的生长发育及逆境胁迫应答过程.
2.4 外源H2S处理后拟南芥芥子油苷生物合成及相关代谢通路分析
2.4.1 芥子油苷生物合成途径基因表达分析 芥子油苷是一种广泛存在于十字花科植物中的次生代谢产物. H2S处理后,拟南芥植株芥子油苷生物合成途径中共9个基因显著差异表达,上调表达基因8个,下调表达基因1个.与氨基酸侧链延长有关的氨基酸氨基转移酶(branched-chain-amino-acid aminotransferase,和)、异丙基苹果酸脱氢酶(isopropylmalate dehydrogenase,)、异丙基苹果酸脱氢酶异构酶(isopropylmalate isomerase,和)基因上调表达,下调表达.参与芥子油苷核心结构形成的细胞色素P450单加氧酶(cytochrome P450,和)、磺基转移酶(sulfotransferase 17,)基因表达上调.
进一步研究发现,、、、、/和均为参与脂肪族芥子油苷合成途径的关键基因,而吲哚族芥子油苷合成途径基因无明显改变,说明响应外源H2S的主要是脂肪族芥子油苷.Kim等[22]报道增加硫水平能明显增加油菜中脂肪族芥子油苷含量. Chen等[23]发现白菜中脂肪族芥子油苷的含量受供硫水平的影响很大,而吲哚族芥子油苷的含量主要受到供氮水平的影响.这可能是因为吲哚族芥子油苷是由色氨酸衍生而来,而脂肪族芥子油苷侧链来源于甲硫氨酸,受环境中供硫水平的影响更明显[24-25].
2.4.2 硫代谢和谷胱甘肽代谢途径基因表达分析 H2S处理后,拟南芥植株硫代谢途径中共有9个基因显著差异表达,上调表达基因8个,下调表达基因1个.上调表达基因分别为腺苷酰硫酸还原酶1/2/3 ()、腺苷酰硫酸激酶1/2/3()、丝氨酸乙酰转移酶4()和半胱氨酸合酶(),下调表达基因为O-乙酰丝氨酸(硫醇)裂解酶().
在谷胱甘肽代谢途径中,共有显著差异表达基因22个,上调表达基因16个,下调表达基因6个.其中,多个谷胱甘肽硫转移酶(glutathione S-transferase,和)、谷胱甘肽过氧化物酶(glutathione peroxidase,和)和脱氢抗坏血酸还原酶(dehydroascorbate reductase,和)基因表达水平显著提高.
外源H2S处理后,拟南芥硫代谢途径、谷胱甘肽代谢途径中多个基因上调表达,说明环境中的H2S可促进体内硫还原产物半胱氨酸的合成,进而生成抗氧化物质谷胱甘肽,同时其相关防御酶GST和GPX基因表达水平和活性提高,在植物逆境胁迫应答过程中发挥重要作用[26-27].同时,外源H2S增强植物体内硫相关代谢过程,为脂肪族芥子油苷合成提供硫供体,从而促进脂肪族芥子油苷的合成代谢,介导植物对外界环境刺激的防御性反应.
2.5 外源H2S处理后拟南芥转录因子表达分析
转录因子通过激活或抑制基因的表达,在植物的生长发育、形态建成及对外界环境的反应中起着重要的调控作用[28-29]. H2S处理后,拟南芥植株共有307个转录因子差异表达,其中上调表达131个,下调表达176个.其中,AP2/ERF差异表达共41个,占到13.36%;WRKY共22个,占到7.17%;MYB共20个,占到6.51%,bZIP共17个,占到5.54%;DREB和C2H2均为7个,分别占到2.28%;bHLH为5个,占到1.63%;TCP和HSF均为4个,分别占到1.30%;NAC为3个,所占比例为0.98%(表2).

表2 H2S处理后拟南芥差异表达的部分转录因子
研究表明,植物MYB转录因子如MYB28、MYB29、MYB76、MYB34和MYB51参与芥子油苷代谢网络的调控[30-31].本研究中,H2S处理后,正向调控脂肪族芥子油苷合成的表达显著上调,而抑制脂肪族芥子油苷合成的表达水平降低,说明H2S可通过调控MYB转录因子表达促进植物体内脂肪族芥子油苷的合成.
2.6 差异表达基因的qRT-PCR分析
为了证实测序结果的可靠性,对芥子油苷生物合成途径中的关键差异表达基因及相关转录因子进行qRT-PCR分析.结果表明(图4),H2S处理后,、、和基因表达量分别为对照的3.26倍、2.21倍、3.71倍和1.97倍,基因表达量为对照的68.28%,与测序的结果一致,说明由测序筛选出的差异表达基因的信息是可靠的,同时也进一步证明了H2S可通过调控拟南芥芥子油苷生物合成途径关键酶基因和相关的转录因子,参与调节体内芥子油苷的合成代谢.本研究将为深入挖掘H2S对植物次生代谢的调控机制提供理论参考,同时也提示可以利用外源H2S提高植物体内次级代谢产物的含量,从而增强植物抵御生物和非生物胁迫的能力.
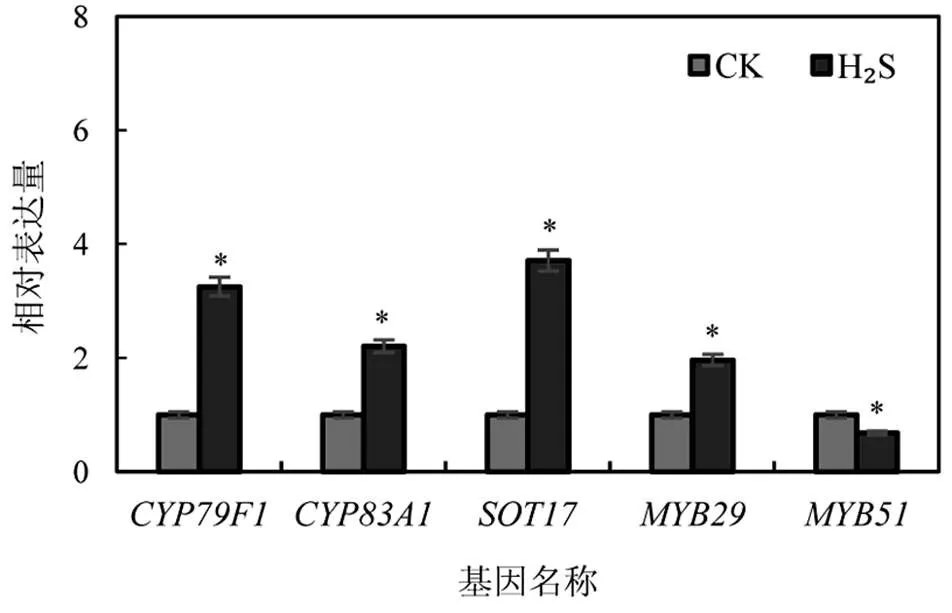
图4 H2S处理后拟南芥差异表达基因的qRT-PCR分析
3 结论
3.1 本文利用转录组测序技术,研究发现外源H2S诱导拟南芥3160个基因差异表达,参与调节植物体内多个初生代谢和次生代谢过程,为深入探索H2S在植物中的生理功能提供大量分子水平的数据参考.
3.2 H2S通过提高拟南芥芥子油苷生物合成途径关键酶和相关转录因子的基因表达水平,同时增强硫相关代谢活动,促进体内脂肪族芥子油苷的合成,从而抵御不良环境对植物的侵害.
[1] 尚玉婷,张妮娜,上官周平,等.硫化氢在植物中的生理功能及作用机制 [J]. 植物学报, 2018,53(4):565-574.
Shang Y T, Zhang N N, Shangguan Z P, et al. Physiological function and mechanism of hydrogen sulfide in plants [J]. Bulletin of Botany, 2018,53(4):565-574.
[2] Xuan L, Li J, Wang X, et al. Crosstalk between hydrogen sulfide and other signal molecules regulates plant growth and development [J]. Internaional Journal of Molecular Sciences, 2020,21:4593.
[3] Zhang J, Zhou M, Zhou H, et al. Hydrogen sulfide, a signaling molecule in plant stress responses [J]. Journal of Integrative Plant Biology, 2021,63(1):146-160.
[4] Müller M, De Kok L J, Weidner W, et al. Differential effects of H2S on cytoplasmic and nuclear thiol concentrations in different tissues ofroots [J]. Plant Physiology and Biochemistry, 2002,40:585- 589.
[5] Chen J, Shang Y T, Wang W H, et al. Hydrogen sulfide-mediated polyamines and sugar changes are involved in hydrogen sulfide- induced drought tolerance inseedlings [J]. Frontiers in Plant Science, 2016,7:1173.
[6] Shi H, Ye T, Han B, et al. Hydrogen sulfide regulates abiotic stress tolerance and biotic stress resistance in[J]. Journal of Integrative Plant Biology, 2015,l57:628-640.
[7] Thinh Nguyen V P, Stewart J, Lopez M, et al. Glucosinolates: natural occurrence, biosynthesis, accessibility, isolation, structures, and biological activities [J]. Molecules, 2020,25(19):4537.
[8] Mitreiter S, Gigolashvili T. Regulation of glucosinolate biosynthesis [J]. Journal of Experimental Botany, 2021,72(1):70-91.
[9] Harun S, Abdullah-Zawawi M R, Goh H H, et al. A comprehensive gene inventory for glucosinolate biosynthetic pathway in[J]. Journal of Agricultural and Food Chemistry, 2020,68(28): 7281-7297.
[10] Poveda J, Eugui D, Velasco P. Natural control of plant pathogens through glucosinolates: an effective strategy against fungi and oomycetes [J]. Phytochemistry Reviews, 2020,19(4):1045-1059.
[11] Liu Z C, Wang H P, Xie J M, et al. The roles of cruciferae glucosinolates in disease and pest resistance [J]. Plants, 2021,10(6): 1097.
[12] Mao P, Li Q, Li Y, et al. The beneficial functions of blue light supplementary on the biosynthesis of glucosinolates in pakchoi (L. ssp.) under greenhouse conditions [J]. Environmental and Experimental Botany, 2022,197:104834.
[13] Rangkadilok N, Nieolas M E, Bennett R N, et al. The effect of sulfur fertilizer on glucoraphanin levels in Broccoli (L. var.) at different growth stages [J]. Journal of Agricultural and Food Chemistry, 2004,52(9):2632-3639.
[14] 陈亚州,陈思学,阎秀峰.环境对植物芥子油苷代谢的影响 [J]. 生态学报, 2008,28(6):2828-2833.
Chen Y Z, Chen S X, Yan X F. Effect of environment on glucosinolate metabolism in plant [J]. Acta Ecologica Sinica, 2008,28(6):2828- 2833.
[15] 庞秋颖,陈思学,于 涛,等.盐胁迫对拟南芥和盐芥莲座叶芥子油苷含量的影响 [J]. 生态学报, 2011,31(16):4534-4541.
Pang Q Y, Chen S X, Yu T, et al. Effects of salt stress onglucosinolate contents inandrosette leaves [J]. Acta Ecologica Sinica, 2011,31(16):4534-4541.
[16] Li G, Shah A A, Khan W U, et al. Hydrogen sulfide mitigates cadmium induced toxicity inby modulating physiochemical attributes, osmolyte metabolism and antioxidative machinery [J]. Chemosphere, 2021,263:127999.
[17] 裴雁曦.植物中的气体信号分子硫化氢:无香而立,其臭如兰 [J]. 中国生物化学与分子生物学报, 2016,32(7):721-733.
Pei Y X. Gasotransmitter hydrogen sulfide in plants: stinking to high heaven, but refreshing to fine life [J]. Chinese Journal of Biochemistry and Molecular Biology, 2016,32(7):721-733.
[18] Amir R, Galili G, Cohen H. The metabolic roles of free amino acids during seed development [J]. Plant Science, 2018,275:11-18.
[19] Miao H, Cai C, Wei J, et al. Glucose enhances indolic glucosinolate biosynthesis without reducing primary sulfur assimilation [J]. Scientific Reports, 2016,6:31854.
[20] 张 琳,范晓明,林 青,等.锥栗种仁转录组及淀粉和蔗糖代谢相关酶基因的表达分析 [J]. 植物遗传资源学报, 2015,16(3):603-611.
Zhang L, Fan X M, Lin Q, et al. Transcriptome analysis for developing kernel and expression analysis of starch and sucrose metabolism- related genes in[J]. Journal of Plant Genetic Resources, 2015,16(3):603-611.
[21] Li-Beisson Y, Beisson F, Riekhof W. Metabolism of acyl-lipids in[J]. Plant Journal, 2015,82(3):504-522.
[22] Kim S J, Matsuo T, Watanabe M, et al. Effect of nitrogen and sulphur application on the glucosinolate content in vegetable turnip rape (L.) [J]. Soil Science and Plant Nutrition, 2002,48: 43-49.
[23] Chen X J, Zhu Z J, Ni X L, et al. Effect of nitrogen and sulfur supply on glucosinolates inssp.[J]. Agricultural Sciences in China, 2006,5(8):603-608.
[24] Li L, Zhang H, Chai X, et al. Transcriptome and proteome conjoint analysis revealed that exogenous sulfur regulates glucosinolate synthesis in Cabbage [J]. Plants, 2021,10(10):2104.
[25] Heikal Y M, El-Esawi M A, Galilah D A. Morpho-anatomical, biochemical and molecular genetic responses of canola (L.) to sulphur application [J]. Environmental and Experimental Botany, 2022,194:104739.
[26] Birke H, De Kok L J, Wirtz M, et al. The role of compartment-specific cysteine synthesis for sulfur homeostasis during H2S exposure in[J]. Plant and Cell Physiology, 2015,56:358-367.
[27] 李利红,郭宇茹,侯俊鑫,等.H2S信号在拟南芥响应SO2胁迫过程中的作用[J]. 中国环境科学, 2022,42(6):2904-2910.
Li L H, Guo Y R, Hou J X, et al. Functions of H2S signal in response to SO2stress in[J]. China Environmental Science, 2022,42(6):2904-2910.
[28] Gigolashvili T, Berger B, Flügge U I. Specific and coordinated control of indolic and aliphatic glucosinolate biosynthesis by R2R3-MYB transcription factors in[J]. Phytochemistry Reviews, 2009,8:3–13.
[29] Pireyre M, Burow M. Regulation of MYB and bHLH transcription factors: A glance at the protein level [J]. Molecular Plant, 2015,8(3): 378-388.
[30] Zuluaga D L, Graham N S, Klinder A, et al. Overexpression of the MYB29 transcription factor affects aliphatic glucosinolate synthesis in[J]. Plant Molecular Biology, 2019,101:65–79.
[31] Frerigmann H, Gigolashvili T. MYB34, MYB51, and MYB122 distinctly regulate indolic glucosinolate biosynthesis in[J]. Molecular Plant, 2014,7(5):814-828.
Effect of H2S on glucosinolate biosynthesis inbased on transcriptomics.
QI Hong-xue1, WU Li-hua2, LI Li-hong1*
(1.Department of Chemistry and Chemical Engineering, Jinzhong University, Yuci 030619, China;2.Department of Biology, Taiyuan Normal University, Yuci 030619, China)., 2023,43(2):957~963
Glucosinolates are a group of nitrogen- and sulfur-containing secondary metabolites in cruciferous plants, which are closely related to environmental factors. In this study, transcriptome sequencing oftreated with hydrogen sulfide (H2S) was performed, and the biological functions and metabolic pathways of differentially expressed genes were analyzed to explore the regulatory effect of H2S on glucosinolate biosynthesis in plants. The results showed that a total of 3160 genes were differentially expressed inseedlingssprayed with 100μmol/L H2S for 3 days, including genes involved in metabolism, binding, catalysis, transcription regulation, transport and signal transduction. KEGG enrichment analysis showed that differentially expressed genes were significantly enriched in multiple primary and secondary metabolism. After exogenous H2S treatment, nine genes (8up-regulated and 1down-regulated) involved in aliphatic glucosinolates biosynthesis were identified to be differentially expressed, but genes associated with indole glucosinolates biosynthesis showed no obvious change. Meantime, several genes that participated in sulfur metabolism, cysteine and methionine metabolism, and glutathione metabolism were up-regulated, suggesting that exogenous H2S can enhance sulfur-related metabolic pathways, which would promote the aliphatic glucosinolates biosynthesis in plants. Transcription factor analysis showed thatwas up-regulated, which could positively regulate the aliphatic glucosinolates biosynthesis. And, which would inhibit the aliphatic glucosinolates biosynthesis, was down-regulated. These results suggested that H2S could regulate the aliphatic glucosinolates biosynthesis in plants through MYB transcription factors. The qRT-PCR analysis of several genes involved in the glucosinolate biosynthesis verified the accuracy of transcriptomic sequencing, which further proved that H2S participated in the regulation of glucosinolate biosynthesis in plants.
hydrogen sulfide;;transcriptome;glucosinolate;differentially expressed gene
X171.5
A
1000-6923(2023)02-0957-07
祁红学(1981-),男,甘肃通渭人,副教授,博士,主要研究方向为生态毒理学.发表论文10余篇.
2022-07-12
国家自然科学基金资助项目(21307087);山西省应用基础研究计划项目(201901D111299,201901D111301)
* 责任作者,副教授,lihongli19821129@163.com

