Bacillus sp. Z2对稀土钇的固定及阻控水稻吸收效应
王伟英,徐成龙,陈盈盈,朱 笃,2*
sp. Z2对稀土钇的固定及阻控水稻吸收效应
王伟英1,徐成龙1,陈盈盈1,朱 笃1,2*
(1.江西师范大学生命科学学院,江西省亚热带植物资源保护与利用重点实验室,江西 南昌 330022;2.江西科技师范大学生命科学学院,江西 南昌 330013)
本文从赣南稀土矿区分离获得一株耐钇(Y)的根际植物促生细菌Z2,初步鉴定为芽孢杆菌属细菌,摇瓶发酵条件下能够有效减少Y3+生物有效性,其作用机理可能是菌体吸附、pH值升高以及活性代谢产物与Y3+结合的共同作用.水稻砂培过程中添加Z2菌能够显著减少水稻根部Y的积累:0.08mmol/L处理条件下减少49%(<0.05),0.35mmol/L处理条件下减少43% (<0.01).植物螯合肽响应水稻根部积累的稀土钇,金属硫蛋白和谷胱甘肽转硫酶无明显变化.研究结果表明Z2菌可作为潜在的菌种资源,在细菌修复稀土污染农田和保障水稻安全生产中应用.
稀土钇;根际植物促生菌;钝化修复;水稻
我国稀土矿储量约占世界的80%,江西赣南离子吸附型中重稀土矿储量占全国的2/3,是稀土矿输出大省[1].过去几十年里,赣南离子型稀土矿的大规模开采导致矿区及周边土壤大面积(>100km2)高浓度稀土(409~1035mg/kg)残留[2-3].矿区废水随径流进一步污染周边地表及地下水,使矿区周边土壤贫瘠、酸化严重、稀土及重金属含量超标;导致植物矮小,生物量过低,给矿区周边生态修复和农业生产造成困难[4].研究表明高浓度稀土可抑制植物生长,稀土通过食物链的传播进入人体,对血液和呼吸系统造成损伤[5].赣南离子吸附型稀土矿的大规模开采导致矿区及周边土壤和水系大面积高浓度稀土(钇为主)残留,稀土元素影响植物生长且可被植物富集积累,进一步威胁粮食安全.
土壤微生物作为土壤中物质转化的重要驱动者,参与土壤元素的生物地球化学循环,改良土壤特性,影响植被生长发育,这尤其体现在根际微环境中的植物促生菌plant growth-promoting rhizobactera (PGPR)[6].促生菌通过合成IAA、ACC脱氨酶或增加土壤中营养元素的生物有效性(如N、P和K)来改善植物营养和增强其对胁迫环境的抗逆能力[7]. PGPR也可通过产生抗生素、分泌铁载体和诱导系统抗性等方式抑制或减轻病原微生物和虫害对植物生长的不良影响,从而调节植物对生物胁迫环境的适应[8].PGPR能够通过降低土壤pH值,合成螯合剂来改变重金属的生物有效性,从而提高植物对重金属的提取效率[9-10],并通过改变植物根系分泌物、调节细胞壁合成与组装相关蛋白[11]、重金属转运蛋白和重金属螯合剂合成相关蛋白(如有机酸、铁载体和生物表面活性剂等)的表达来巩固重金属的耐受性及其吸收和富集[12].另一方面,微生物本身或作用于根系,以吸附、沉淀、还原、碱化和络合等方式降低土壤中重金属的生物有效性[13],从而减少植物对土壤中重金属的吸收或向植物地上部分的迁移[14].研究表明PGPR对植物富集重金属的效果往往因PGPR菌种、植物种类和重金属离子的种类及浓度的不同而截然不同(促进或抑制).
虽然,现有的关于微生物协同植物修复稀土污染土壤的相关报道很少,但已有结果显示其与重金属研究结论十分相似,即PGPR对植物富集稀土的效果与微生物、植物和稀土金属离子种类和浓度显著相关[15-16].适应了特定金属的微生物和植物在重金属修复中具备显著优势[17].本文从赣南稀土矿区筛选获得一株稀土钇耐受的PGPR,命名为Z2;进一步通过研究该菌与Y3+的相互作用、促生特性及其对水稻富集稀土钇的影响,以探究该菌作为农用PGPR的潜力,为细菌修复稀土污染农田和保障水稻安全生产提供菌种资源和技术途径.
1 材料与方法
1.1 菌种分离和鉴定及对Y耐受性分析
土壤样品取自赣南稀土尾矿区(114°50′13.12″E, 24°50′20.47″N),采集了矿区周围不同植物生长的根际土壤.利用含50mg/L Y3+的LB培养基筛选获得耐钇细菌,从中挑选一株耐受性较好的细菌命名为Z2,利用细菌通用引物27F (5′-AGAGTTTGATCCTG- GCTCAG-3′)和1492R (5′-GGTTACCTTGTTACG- ACTT-3′)扩增Z2的16S rRNA.由上海生工生物工程有限公司完成测序,将测序得到的序列在NCBI数据库中进行BLAST比对,选取同源性序列利用MEGA 5.05软件系统发育树,从而确定菌株的分类地位.
用YCl3·6H2O(麦克林)溶于水配置10g/L Y3+母液,过滤除菌.在100mL 1/5浓度的LB培养基(酵母浸粉1g,胰蛋白胨 2g,NaCl 2g,去离子水1000mL)中分别加入10g/L Y3+母液0,0.025,0.05,0.25,0.5,1,2, 4mL,使培养基中Y3+终浓度为0,5,10,50,100,200, 400,800mg/L.配置好的平板分三个区域各点接5μL Z2种子液(LB培养液中培养12h),30°C倒置培养2d,观察菌落生长情况.
1.2 Z2振荡培养过程中对Y生物有效性的影响
稀土离子在酸性条件下可保持自由离子状态,一般地,当pH大于5.0稀土离子已形成氢氧化物沉淀.根据文献报道,液体摇瓶培养条件下通常采用1/5浓度的LB培养基研究细菌对重金属的固定作用,故本文采用1/5浓度的LB培养基研究Z2生长过程中对Y3+生物有效性的影响.100mL 1/5浓度的LB培养基中添加0.125mL Y3+母液使其Y3+初始浓度为25mg/L,接种100μL Z2种子液,30°C,150r/min.设置5次生物学重复.每天取样测定OD600和培养基pH.样品经12000r/min离心2min,利用ICP-MS测定上清液中Y3+浓度.
1.3 Z2菌与钇相互作用表观形貌
Z2菌在LB培养基中过夜培养后离心收集菌体,无菌去离子水清洗两遍后,用0.85% NaCl溶液将Z2菌调整成OD600为1.0,然后添加适量Y3+母液,使其终浓度为5mmol/L.上述吸附体系置于试管涡旋振荡器上室温条件下吸附反应2h.反应结束后离心分离菌体,无菌去离子水洗两遍,利用无水乙醇分散菌体至适宜浓度后滴至导电胶上,利用红外灯照射干燥后在场发射扫描电镜观察Z2菌与Y相互作用表观形貌.利用EDS分析试样中元素组成及mapping可视化元素P和Y的分布.
1.4 Z2菌溶磷分析
无机磷固体培养基:葡萄糖10g,NaCl 0.3g, (NH4)SO40.5g,KCl 0.3g,MgSO4·7H2O 0.3g, FeSO4·7H2O 0.03g,MnSO4·4H2O 0.03g,Ca3(PO4)25g,琼脂20g,蒸馏水1000mL;在无机磷固体平板上点接2μL Z2种子液,30°C倒置培养2d,观察溶磷透明圈.另配置无机磷液体培养基,接种100μL Z2种子液,30°C,150rpm培养6d.每天取样测定pH值,有效磷含量.利用钼锑抗比色法测定有效磷含量.钼锑抗比色法参照文献[18]进行,简单概括为:利用浓硫酸、钼酸铵和酒石酸锑钾配置成钼锑储贮存液,加入抗坏血酸后得钼锑钪显色剂.取离心后的培养液1mL于50mL容量瓶,加去离子水至3/5处,加2滴二硝基苯酚指示剂,用氢氧化钠溶液调节溶液至微黄色,加5mL钼锑钪显色剂定容.在波长700nm处测吸光度(OD值),KH2PO4用于有效磷标准曲线的制作.根据标准曲线计算培养液中有效磷含量.
1.5 水稻砂培试验
水稻种子催芽:取饱满的水稻种子将其浸没于去离子水中4h,然后置于湿润的滤纸上25°C黑暗萌发2d即可露白.
取500mL洁净烧杯,装入300g灭菌石英砂(20~40目),倒入50mL1/2浓度的霍格兰营养液(营养液组成如下(mg/L): KNO3607, Ca(NO3)2·4H2O 945, MgSO4·7H2O 493,NH4H2PO4115, H3BO32.86, MnCl2·4H2O 2.13, ZnSO4·7H2O 0.22,CuSO4·5H2O 0.08, H2MoO4·H2O 0.02, FeSO4·7H2O 5.57, Na2-EDTA 7.45)使液面刚好没过石英砂,营养液中添加Y3+母液使其终浓度分别为0.08mmol/L(此为低浓度处理组)和0.35mmol/L(此为高浓度处理组),不含Y3+的营养液组作为对照.0,0.08,0.35mmol/L Y3+三组实验又分别设置Z2接种与不接种组,即6组实验,每组3次生物学重复,共18杯石英砂,每杯置入5颗已露白的大小相近的水稻种子,其中Z2接种组方式为利用Z2菌悬液(107cfu/mL)浸种2h;播种后再在石英砂杯中倒入5mL菌悬液.水稻砂培置于人工气候箱,光照25°C 16h,黑暗22°C 8h,湿度70%,每天浇水保持液面高出石英砂约2cm,每3d浇一次营养液(不含Y3+).种植30d收获.
1.6 水稻干重、钇含量及植物螯合肽(PCS)、金属硫蛋白(MT)和谷胱甘肽转硫酶(GST)指标测定
培养结束后将水稻连根拔起,冲洗根部黏连的石英砂后将根部置于5mmol/L CaCl2溶液中15min,水洗两遍用以去除表面结合的Y.将根和地上部分分离,55°C烘干至恒重后称重.准确称取烘干后的叶片和根0.1g,加入浓HNO3:H2O2(30%)=4:1,100°C预消解20min,180°C,消解10min后过0.45μm膜.利用ICP-MS测定消解液中Y3+浓度,按照如下公式计算水稻根和地上部稀土钇含量.

式中:植物为经ICP–MS测定出的稀释后样品中Y浓度,mg/L;为测试样品的体积,mL;植物为测试样品的质量,g.
对于PCS、MT和GST指标测定,培养好的水稻拔出后,根部清洁后立即取样液氮速冻后置于-80°C保存待用.样品取出用液氮研磨至粉末状,称取0.10g迅速加入预冷的0.1mol/L PBS(pH7.4)介质制备成10% 组织匀浆,10000rpm离心15min.取上清液测定PCS、MT和GST含量.PCS、MT和GST含量测定采用酶联免疫吸附试剂盒(上海晶抗),即双抗体夹心法测定样本中目标蛋白水平.大致步骤如下:用纯化的目标抗体包被微孔板,制成固相抗体,往包被单抗的微孔中依次加入标准品和待测样品,再与辣根过氧化物酶(HRP)标记的目标抗体结合,形成抗体-抗原-酶标抗体复合物,经过彻底洗涤后加底物四甲基联苯胺(TMB)显色.TMB在HRP酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色.颜色的深浅和样品中的目标蛋白质呈正相关.用酶标仪在450nm波长下测定吸光度,通过标准曲线计算样品中目标蛋白的浓度.
1.7 数据处理
上述实验均设置至少3次生物学重复,数据统计分析在SPSS 17.0软件中进行.用Origin 8.5、Adobe Illustrator CS6和Adobe Photoshop CS6软件进行绘图.
2 结果与分析
2.1 Z2菌16S rRNA基因序列分析
Z2菌株的16S rRNA基因核苷酸序列长度为 1515bp,序列信息已提交至NCBI数据库(https: //www.ncbi.nlm.nih.gov/),可通过登录号ON954726获取.将所获得的序列进行同源性比对,发现其与strain NBRC 101232菌株高度相似,结合其形态特征、培养特征和16S rRNA基因序列系统发育分析结果,初步鉴定其为芽孢杆菌属细菌.

图1 芽孢杆菌属16S rRNA基因序列系统发育树
2.2 Z2菌对Y的耐受
由图2可见,Z2菌在含不同浓度Y3+的平板上菌落大小明显不同,低浓度Y3+(5,10mg/L)平板的菌落直径明显大于不添加Y3+的对照组,当Y3+浓度达到50mg/L时,菌落直径明显减小,当1/5浓度的LB培养基中添加的Y3+浓度超过100mg/L时,菌落基本不能生长.这说明Y3+对Z2菌的生长表现为“低促高抑”现象.

图2 Z2菌在含不同浓度Y3+的1/5 浓度的LB培养基上的生长情况(图中数字表示Y3+添加浓度,单位为mg/L)
2.3 Z2菌降低溶液中Y3+浓度

图3 Z2菌液体摇瓶条件下Y3+浓度和生物量及pH值变化
由图3可知,Z2菌在液体摇瓶发酵条件下,能降低溶液中Y3+浓度.随着培养时间的延长,溶液中Y3+浓度从24.78mg/L逐渐降低至第4d的2.83mg/L.菌体生长非常迅速,24h基本达到稳定期,第4d时, OD600有所增加,可能是由于培养液中代谢产物的积累造成的干扰.培养基pH在培养过程中有所提高,由初始5.67至第4d达到7.06.菌体在第1d即达到稳定期,但培养基中Y3+浓度变化不大,pH值上升不明显,说明此时菌体表面吸附对Y3+浓度的降低影响不大;培养至第2d,Y3+浓度急剧下降至14.20mg/L,减少了43%,至第4d 培养基中Y3+减少了89%;在此过程中OD600与pH值变化并不显著,可见Z2菌在发酵过程中减少溶液中Y3+浓度的主要原因可能不是菌体吸附和培养基pH值的升高,可能是菌体生长后期产生了一些活性代谢产物与Y3+形成了稳定化合物导致溶液中自由Y3+含量的降低.
2.4 Z2菌对Y3+的表面吸附
Z2菌体吸附剂在初始浓度为5mmol/L Y3+体系中吸附2h后能将Y3+吸附至菌体表面.图4a 可见短杆状细菌菌体,通过元素mapping可见,磷元素图谱与钇元素图谱十分相似(图4b、4c),这说明菌体表面吸附了大量Y元素.能谱结果显示该区域含有Y元素(图4d).
2.5 Z2菌溶磷能力
通过溶磷固体平板测试法发现生长至第2d就能产生明显的透明圈(图5a),通过溶磷液体摇瓶后,利用钼锑钪比色法测定无机磷液体培养液中有效磷含量,结果表明如图5b所示.溶液中有效磷浓度先升高后降低,溶液有效磷浓度在培养第3d达到最大值,为345.42mg/L,是对照组平均值(4.42mg/L)的101倍,然后迅速下降接近初始值.溶液pH值与有效磷浓度变化趋势相反,在第2d时pH值达到最低,为5.07,之后回升并稳定在8.2左右(图5c).对照组pH值保持不变,维持在8.41左右.利用SPSS分析有效磷浓度与pH值相关性,结果显示二者显著负相关(Pearson Correlation = -0.761,<0.05).
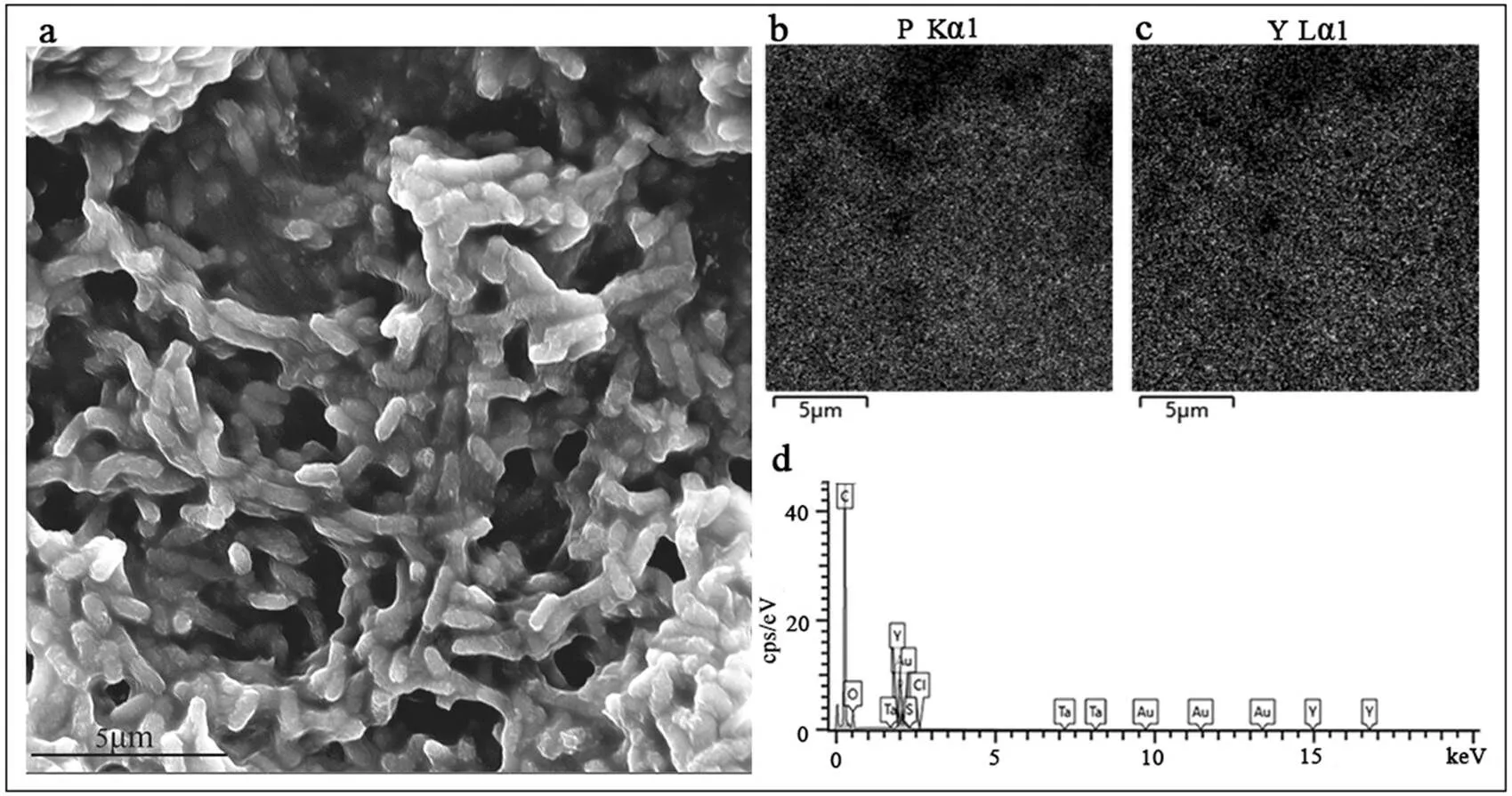
图4 SEM-EDS观察Z2菌体对Y的表面吸附
a,SEM观察菌体形貌;b,c分别为元素P和Y的mapping图谱;d,EDS
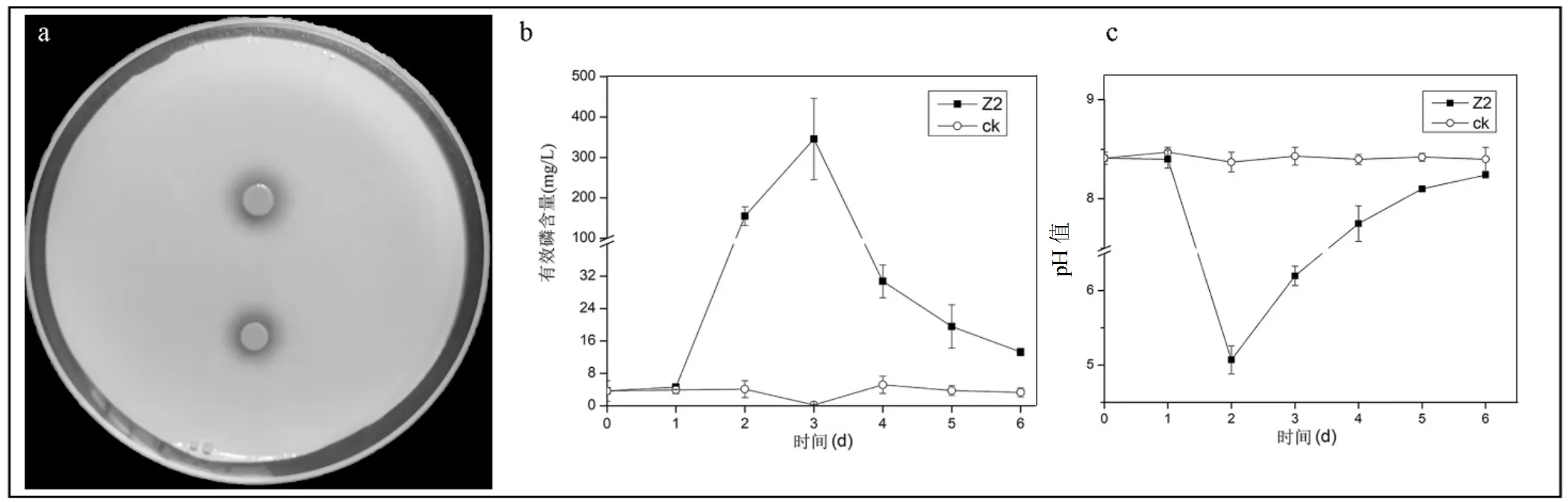
图5 Z2菌株溶磷能力的测定
a,Z2在无机磷固体培养基上产生的溶磷圈;Z2在无机磷液体培养基中发酵过程中有效磷含量b及发酵液pH值变化c
2.6 Z2菌对水稻生长的促进作用及对水稻积累Y的影响
利用石英砂和霍格兰营养液种植水稻30d后,发现在不同浓度Y3+处理下,水稻根的干重无显著差异,地上部分干重在低浓度Y3+处理条件下有所增加,高浓度Y3+处理条件下有所下降,但均未达到显著差异.且接种Z2菌株对水稻根和地上部分干重无显著影响(图6).
虽然Z2对水稻干重的促进效果不显著,但在对水稻根和地上部分Y含量检测时发现,不论在低浓度还是高浓度Y3+处理条件下,接种Z2菌均能够减少水稻根部Y的积累(图7). 0.35mmol/L处理条件下水稻根部Y积累量达到1357mg/kg,地上部分积累量仅为41mg/kg,可见在砂培30d过程中Y在水稻根到地上部分的转移能力较弱.
且接种Z2能够显著减少水稻根部Y的积累,0.08mmol/L处理条件下减少49%(<0.05), 0.35mmol/L处理条件下减少水稻根部Y积累量的43% (<0.01).

图6 不同Y3+处理下接种与不接Z2菌对水稻干重的影响

图7 不同Y3+处理条件下接种Z2对水稻植株钇积累量的影响
*指<0.05,**指<0.01
2.7 Z2菌对不同浓度Y3+处理条件下水稻根部PCS、MT及GST含量的影响
由图8可知,在水稻根部,GST含量最为丰富(> 600ng/L),其次是PCS,含量>50ng/L;MT的含量最低,小于10ng/L.随着Y3+处理浓度的增加,MT和GST含量均未表现出显著差异.对于PCS,在0.08mmol/L Y3+处理条件其含量较不添加Y3+处理时无显著差异,但当Y3+处理浓度达到0.35mmol/L 时,PCS含量显著上升达到120ng/L,但接种Z2又使水稻根部PCS含量下降,这与水稻根部Y含量的结果高度吻合,说明水稻根部对Y响应的耐受蛋白是PCS,MT和GST在水稻根部对Y响应过程中可能未有明显的作用.
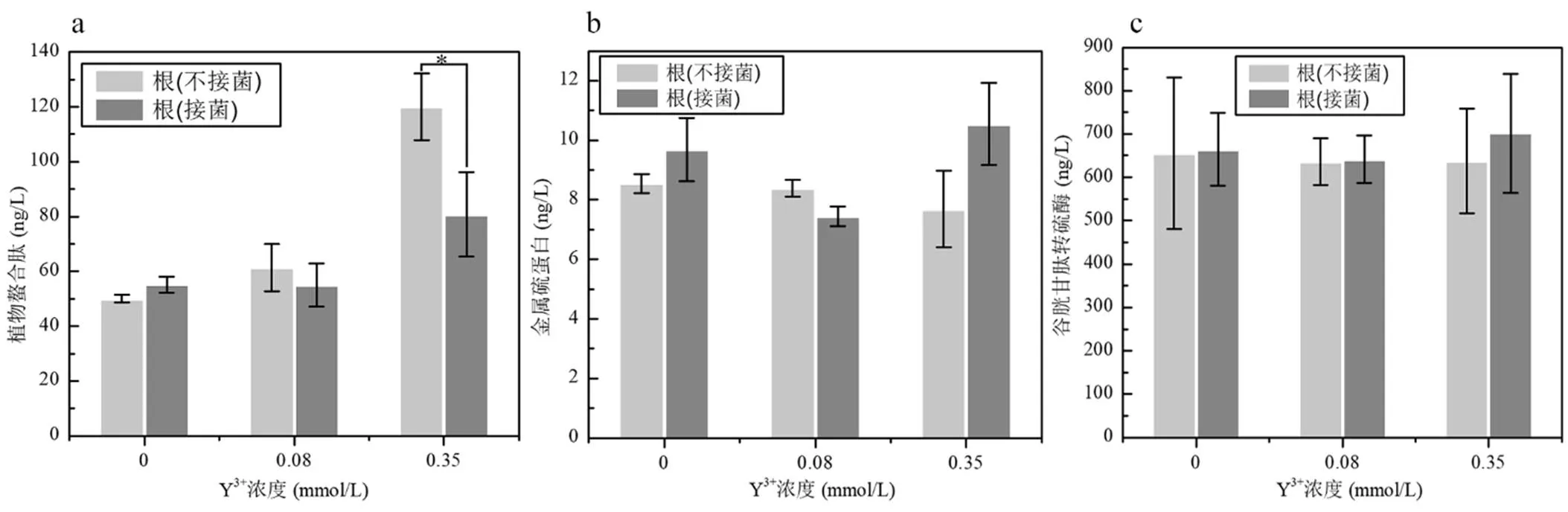
图8 不同浓度Y3+处理条件下接种Z2对水稻根部PCS、MT及GST含量变化的影响
3 讨论
PGPR在重金属污染修复中的基础研究已屡见不鲜[17-19].然而PGPR在稀土金属污染修复过程中的作用研究还不多,本研究以稀土钇为对象,分离获得耐钇的PGPR,初步探究了其植物促生特性,研究了其对Y的固定作用,进一步探究其对水稻富集稀土Y的影响,为稀土污染修复提供菌种资源.
3.1 Z2菌的植物促生特性
PGPR通过促进植物生长、提高抗逆性从而影响植物对重金属的积累:多种PGPR能够通过改良土壤、溶磷、分泌IAA、铁载体及ACC脱氨酶等促进植物生长和产量增加[20-21]; Z2作为植物促生菌,其能够有效溶解无机磷使溶液中有效磷含量高达345.42mg/L,其溶磷与pH呈显著负相关.对于Z2产植物激素IAA及铁载体能力,初步的Salkowski显色与CAS平板检测显示其有一定的产IAA和铁载体能力.研究结果显示Z2菌对砂培水稻的干重没有显著的促进作用,这可能是由于营养液中有效磷浓度足够Z2菌和水稻生长过程中对磷的需求,因此Z2的溶磷特性没有体现.
3.2 Z2菌对Y的固定作用机制
接种PGPR能够促进植物对重金属污染土壤的修复,其作用机制首先是PGPR的促生特性对植物中重金属浓度的稀释作用;其次,PGPB可以通过分泌螯合剂、酸化、碱化和氧化还原反应等来影响重金属的生物利用度:1)活化机制:PGPB通过产有机酸来活化土壤中Cd,接种布丘氏菌属SaSR13增强了东南景天根系分泌物(尤其是苹果酸和草酸)的含量,从而显著提高了Cd的生物利用度和植物对其的吸收能力[22];此外PGPB分泌的生物表面活性剂[23]、铁载体[24]增加重金属在土壤环境中的溶解度来改变重金属迁移率和生物利用度.2)稳定机制:许多重金属和细胞表面的阴离子官能团结合,可以有效固定土壤中的重金属[25],微生物还可通过吸附、沉淀、碱化和络合过程降低土壤中重金属的生物利用度[13];微生物因其比表面积大,繁殖速度快,并且对广泛的环境条件具有一定的适应能力,因此被广泛用作生物吸附剂去除环境中的重金属[26-27].本文中Z2菌在摇瓶培养条件下使溶液中有效Y浓度从24.78mg/L降低至2.83mg/L.菌体生物量在第1d即达到稳定期,但溶液中有效Y浓度急剧减少出现在第2d,整个培养过程中pH值虽有上升,但幅度不大(图3),虽然菌体表面确实能够吸附大量Y(图4),但可以推断Z2菌对Y的固定作用可能不仅是菌体表面的功能基团对Y的吸附、pH值升高,活性代谢产物与Y结合可能也是减少Y生物有效性的重要因素.
3.3 Z2菌阻控水稻根Y吸收效应
前期已进行赣南足洞稀土矿区土壤样品采集与分析,研究结果显示当前尾矿及周边地区土壤中仍有很高的稀土残留,取样点土壤稀土总量平均值为750 (±180) mg/kg,其中Y含量最高,达到370 (±79) mg/kg,矿区水系中Y3+浓度约为30mg/L(即0.35mmol/L).稀土金属对生物的影响同微量元素类似,表现为“低促高抑”[28-29].Hu等[30]发现0.08mmol/L镧离子可促进水稻叶绿素的合成,故本研究利用0.08mmol/L Y3+作为低浓度处理组, 0.35mmol/L作为高浓度处理组用以研究当地水体中实际浓度的Y3+对水稻的影响. Z2菌在水稻砂培条件下虽然没有促进植株的生长,但能够显著减少水稻根对稀土Y的积累:0.08mmol/L处理条件下减少49%(<0.5),0.35mmol/L处理条件下减少43% (< 0.01).表明Z2可作为潜在的菌种资源用以保证水稻粮食的安全生产.
3.4 水稻中重金属耐受相关蛋白质对Y的响应
PCS、MT和GST是常见的与重金属耐受密切相关的三种蛋白质分子[31-32],对于植物富集稀土金属后耐受蛋白的响应情况是否与重金属类似,因此,本文探究了水稻根部三种耐受蛋白的对Y的响应情况.结果显示PCS是水稻对Y响应的耐受蛋白,MT和GST无明显变化.研究结果可为进一步深入探究水稻耐受稀土的分子机制提供基础数据和理论指导.
4 结论
4.1 本文从赣南稀土矿区分离获得一株耐钇的植物根际细菌Z2,经过形态和16S rRNA扩增子测序鉴定为芽孢杆菌属细菌;Z2菌液体摇瓶条件下能够显著减少Y的生物有效性,培养至第2d有效Y浓度下降50%,第4d有效Y浓度减少89%;其作用机理可能是菌体吸附、pH升高以及活性代谢产物与Y结合的共同作用.Z2能够有效溶解无机磷使溶液中有效磷含量高达345.42mg/L,是良好的PGPR菌种.
4.2 水稻砂培过程中添加Z2菌能够显著减少水稻根部Y的积累,0.08mmol/L处理条件下减少49% (<0.05),0.35mmol/L处理条件下减少水稻根部Y积累量的43% (<0.01).
4.3 植物螯合肽响应水稻根部积累的稀土钇,金属硫蛋白和谷胱甘肽转硫酶无明显变化.研究结果表明Z2菌可作为潜在的菌种资源,在细菌修复稀土污染农田和保障水稻安全生产中应用.
[1] Yang X, Li A, Li X, et al. China’s ion-adsorption rare earth resources, mining consequences and preservation [J]. Environ. Dev., 2013,8(1): 131-136.
[2] Liu C, Liu W, Ent A, et al. Simultaneous hyperaccumulation of rare earth elements, manganese and aluminum inin response to soil properties [J]. Chemosphere, 2021,282(1):131096.
[3] Chao Y, Liu W, Chen Y, et al.Structure, variation, and co-occurrence of soil microbial communities in abandoned sites of a rare earth elements mine [J]. Environ. Sci. Technol., 2016,50(21):11481-11490.
[4] Liu W, Guo M, Liu C,et al.Water, sediment and agricultural soil contamination from an ion-adsorption rare earth mining area [J]. Chemosphere, 2019,216:75-83.
[5] Li X, Chen Z, Chen Z, et al. A human health risk assessment of rare earth elements in soil and vegetables from a mining area in Fujian province, Southeast China [J]. Chemosphere, 2013,93(6):1240-1246.
[6] Kong Z, Wu Z, Glick B, et al. Co-occurrence patterns of microbial communities affected by inoculants of plant growth-promoting bacteria during phytoremediation of heavy metal-contaminated soils [J]. Ecotoxicology and Environmental Safety, 2019,183:109504.1-10.
[7] Wang X, Wang Q, He L, et al.Metal(loid)-resistant bacteria reduce wheat Cd and As uptake in metal(loid)-contaminated soil [J]. Environ. Pollut., 2018,241:529-539.
[8] 马 莹,骆永明,滕 应,等.根际促生菌及其在污染土壤植物修复中的应用[J]. 土壤学报, 2013,50(5):1021-1031.
Ma Y, Luo Y, Teng Y et al. Plant growth promoting rhizobacteria and their role in phytoremediaton of heavy metal contaminated soils. Acta Pedologica Sinica, 2013,50(5):1021-1031.
[9] Guo J, Muhammad H, Lv X,et al. Prospects and applications of plant growth promoting rhizobacteria to mitigate soil metal contamination: A review [J]. Chemosphere, 2020,246:125823.
[10] Ling C, He L, Wang Q, et al. Synergistic effects of plant growth- promoting neorhizobium huautlense t1-17and immobilizers on the growth and heavy metal accumulation of edible tissues of hot pepper [J]. J. Hazard. Mater., 2016,312:123-131.
[11] Wang X, Wang Q, Nie Z, et al.Q2-8 reduces wheat plant above-ground tissue cadmium and arsenic uptake and increases the expression of the plant root cell wall organization and biosynthesis-related proteins [J]. Environ. Pollut., 2018b,242:1488- 1499.
[12] Sheng X, He L, Wang Q, et al. Effects of inoculation of biosurfactant- producingsp. j119 on plant growth and cadmium uptake in a cadmium-amended soil [J]. J. Hazard. Mater., 2008,155:17-22.
[13] Bruno L, Karthik C, Ma Y,et al.Amelioration of chromium and heat stresses in Sorghum bicolor by Cr6+reducing thermostolerant plant growth promoting bacteria [J]. Chemosphere, 2020,244:125521.
[14] Cheng C, Wang R, Sun L, et al. Cadmium-resistant and arginine decarboxylase-producing endophyticsp. C40 decreases cadmium accumulation in host rice (Oryza sativa Cliangyou 513) [J]. Chemosphere, 2021,275(570):130109.
[15] Hao L, Zhang Z, Hao B, et al. Arbuscular mycorrhizal fungi alter microbiome structure of rhizosphere soil to enhance maize tolerance to La. Ecotox. Environ. Sa., 2021,212(9):111996.
[16] Guo W, Zhao R, Zhao W, et al. Effects of arbuscular mycorrhizal fungi on maize (L.) and sorghum (L. Moench) grown in rare earth elements of mine tailings [J]. Appl. Soil. Ecol., 2013,72:85-92.
[17] 王 立,汪 根,马 放,等.超积累植物与丛枝菌根真菌共生及其联合吸收积累重金属的效应[J]. 生物工程学报, 2021,37(10):3604-3621.
Wang L, Wang G, Ma F, et al. Symbiosis between hyperaccumulators and arbuscular mycorrhizal fungi and their synergistic effect on the absorption and accumulation of heavy metals: a review [J]. Chin. J. Biotech., 2021,37(10):3604-3621.
[18] 范延辉,王 君,尚 帅,等.两株根际真菌的耐盐、溶磷、促生效果及其分类鉴定[J]. 土壤通报, 2022,53(1):127-134.
Fan Y, Wang J, Shang S, et al. Salt-tolerant, phosphate-dissolving and growth-promoting effects of two rhizosphere fungi and their classification and identification [J]. Chinese J. Soil Sci., 2022,53(1): 127-134.
[19] 黄 程,吴子君,何颖慧,等.鄱阳湖-乐安河段湿地耐Cu, Zn, Pb植物促生菌的分离,筛选及鉴定[J]. 微生物学通报, 2018,45(6):1283- 1294.
Huang C, Wu Z, He Y et al. Isolation, screening and identification of Cu, Zn and Pb resistant plant growth-promoting bacteria from Le’ an River-Poyang Lake Wetland [J]. Microbiol. China, 2018,45(6):1283- 1294.
[20] Ostrowski M, Ciarkowska A, Jakubowska A. The auxin conjugate indole-3-acetyl-aspartate affects responses to cadmium and salt stress in. [J]. Journal of Plant Physiology, 2016,191:63-72.
[21] Zhang Y, He L, Chen Z. Characterization of lead-resistant and ACC deaminase-producing endophytic bacteria and their potential in promoting lead accumulation of rape [J]. J. Hazard. Mater., 2011, 86(2/3):1720-1725.
[22] Wu K, Luo J, Li J, et al. Endophytic bacteriumsp. SaSR13improves plant growth and cadmium accumulation of hyperaccumulator[J]. Environmental Science and Pollution Research International, 2018,25(22):21844-21854.
[23] Mishra S, Lin Z Q, Pang S M, et al. Biosurfactant is a powerful tool for the bioremediation of heavy metals from contaminated soils [J]. Journal of Hazardous Materials, 2021,418:126253.
[24] Khan A, Singhl P, Srivastava A. Synthesis, nature and utility of universal iron chelator - Siderophore: A review [J]. Microbiological Research, 2018,212-213:103-111.
[25] Jacob J M, Karthik C, Saratale R G, et al. Biological approaches to tackle heavy metal pollution: A survey of literature [J]. Journal of Environmental Management, 2018,217:56-70.
[26] Priyadarshanee M, Das S. Biosorption and removal of toxic heavy metals by metal tolerating bacteria for bioremediation of metal contamination: A comprehensive review [J]. Journal of Environmental Chemical Engineering, 2021,9(1):104686.
[27] Wang W, Xu C, Jin Y, et al.The accumulation of rare-earth yttrium ions bysp.ZD28 [J]. AMB express, 2020,10:25.
[28] Ochi K, Tanaka Y, Tojo S. Activating the expression of bacterial cryptic genes by rpoB mutations in RNA polymerase or by rare earth elements [J]. Journal of Industrial Microbiology and Biotechnology, 2014,41(2):403–414.
[29] Wen K, Liang C, Wang L, et al. Combined effects of lanthanumion and acid rain on growth, photosynthesis and chloroplast ultrastructure in soybean seedlings [J]. Chemosphere, 2011,84(5):601-608.
[30] Hu H, Wang L, Li Y, et al. Insight into mechanism of lanthanum (iii) induced damage to plant photosynthesis [J]. Ecotoxicol. Environ. Saf., 2016,127:43-50.
[31] Grispen V, Hakvoort H, Bliek T, et al. Combined expression of the arabidopsis metallothionein mt 2b and the heavy metal transporting atpase hma4enhances cadmium tolerance and the root to shoot translocation of cadmium and zinc in tobacco [J]. Environmental & Experimental Botany, 2017,72(1):71-76.
[32] Zhang W, Yin K, Li B, et al. A glutathione s-transferase from proteus mirabilis involved in heavy metal resistance and its potential application in removal of Hg2+[J]. J. Hazard. Mater., 2013,261:646- 652.
sp. Z2 immobilized rare earth yttrium and reduced the absorption of Y in rice.
WANG Wei-ying1, XU Cheng-long1, CHEN Ying-ying1, ZHU Du1,2*
(1.Key Laboratory of Protection and Utilization of Subtropical Plant Resources of Jiangxi Province, College of Life Sciences, Jiangxi Normal University, Nanchang 330022, China;2.Key Laboratory of Bioprocess Engineering of Jiangxi Province, College of Life Science and Technology Normal University, Nanchang 330013, China)., 2023,43(2):927~934
A rhizosphere growth-promoting bacterium Z2 resistant to yttrium (Y) was isolated from the rare earth mining area in southern Jiangxi Province. It was identified assp., which could effectively reduce the bioavailability of Y3+under shake-flask fermentation. The mechanism may be the combined effect of bacterial adsorption, pH increasing and active metabolite which can bind with Y3+. In pot experiment, Z2 could significantly reduce the accumulation of Y in rice root by 49% (<0.05) and 43% (<0.01) under 0.08 and 0.35mmol/L Y3+treatment conditions, respectively. Phytochelatin was responsive to the increase of yttrium content in rice roots, metallothionein and glutathione s-transferase did not change significantly. The results indicated that Z2 could be used as a potential strain resource in the remediation of rare-earth contaminated farmland and in the safe production of rice.
rare earth yttrium;plant growth-promoting rhizobactera;immobilization;rice
X171,X172
A
1000-6923(2023)02-0927-08
王伟英(1989-),女,江西九江人,实验师,博士,主要从事环境微生物相关研究.发表论文6篇.
2022-07-13
江西省自然科学基金资助项目(20192BAB214002);江西省亚热带植物资源保护与利用重点实验室开放基金项目(YRD201907)
* 责任作者, 教授, zhudu12@163.com

