长期复合重金属污染对土壤解磷微生物的影响
刘荣灿,刘晓霞,冯 洋,赵乾程,胡雪松,杜闫彬,于彩虹*
长期复合重金属污染对土壤解磷微生物的影响
刘荣灿1,刘晓霞2,冯 洋2,赵乾程1,胡雪松1,杜闫彬1,于彩虹1*
(1.中国矿业大学(北京),北京 100083;2.北京市耕地建设保护中心,北京 100074)
为进一步了解长期重金属污染压力下解磷微生物群落分布及潜在功能的变化,采用宏基因组学技术系统分析了北京某金矿周边土壤中含phoD基因或pqqE基因的解磷微生物对不同程度的复合重金属污染的响应.结果表明:重金属对解磷微生物确有影响,随重金属浓度增加,解磷微生物相对丰度逐渐降低,酸杆菌门(Acidobacteria)、放线菌门(Actinobacteria)是重金属复合污染土壤中的解磷微生物的优势菌门.重金属是与解磷微生物群落最显著相关的因素,重金属As、Pb、Zn对解磷微生物影响较大,Nitrospirae、Acidobacteria、Gemmatimonadete、Proteobacteria更易受到重金属的影响发生群落结构改变,其中Nitrospirae对Cr、Cu、Pb、Zn、As、Cd多种重金属表现出敏感性.有效磷浓度与解有机磷微生物多样性呈显著正相关关系(<0.05),碱性磷酸酶活性与解无机磷微生物多样性显著负相关,而土壤有机质、总氮、pH值对重金属污染土壤中解磷微生物多样性无显著影响.研究结果为进一步探索长期重金属污染压力下解磷微生物的生态适应机制提供参考.
解磷微生物;重金属;phoD;pqqE
磷是所有生物群维持基本代谢活动和生态系统功能最重要的元素之一[1].土壤中的磷按存在状态分为无机磷和有机磷,按能否被植物利用可分为无效磷和有效磷.通常情况下,土壤中95%的磷为无效磷,以难溶性有机磷与无机磷酸盐矿物[2]形式存在,剩下不超过5%为可溶性无机磷酸盐[3],能与土壤重金属阳离子结合起到固定重金属的作用.因此,探究重金属对无效磷转化为有效磷的影响机制对土壤重金属污染修复具有重要意义.
驱动无效磷转化为有效磷的微生物被称为解磷微生物.分为解有机磷微生物与解无机磷微生物[4].一般认为两者之间没有绝对界限,部分微生物同时具有解有机磷与解无机磷两种作用[5].解有机磷微生物通过分泌各种酶类溶解难溶性有机磷,其中碱性磷酸酶(ALP)是最重要的酶.编码碱性磷酸酶的同源基因有phoA,phoX和phoD.其中phoD基因编码的碱性磷酸酶(PhoD)在土壤中最常见,其在土壤中的丰度也远高于phoA和phoX,被认为是土壤中最重要的碱性磷酸酶基因[6].解无机磷微生物通过分泌H+、有机酸等将难溶性无机磷酸盐矿物溶解释放可溶性无机磷酸根[7],其中由葡萄糖脱氢酶(GDH)和辅因子吡咯喹啉醌(PQQ)共同催化葡萄糖合成[9]葡萄糖酸是主要机制[8].PQQ对细菌利用葡萄糖产酸溶解无机磷起到关键作用[10-11].在编码PQQ的基因簇pqqABCDE中,土壤偏中性条件下pqqE基因表达量最高[13],pqqE基因也被认为最具代表性[14].目前对解无机磷基因的研究较少,公开发表的文章仅局限于细菌产酸途径中的调节基因[12].近年来宏基因组学技术发展快速,通过研究关键解磷基因phoD和pqqE的丰度、微生物群落的组成和分布的变化来探究解磷微生物如何适应环境压力成为可能[15].然而,更多的研究集中在磷肥、环境跨度等因素上,重金属对解磷微生物群落的影响仍缺乏全面了解.
土壤重金属污染作为世界范围环境问题备受关注[16-18].解磷微生物是土壤中可溶性无机磷酸盐的潜在供应体,能够持续转化有效磷,部分可用来固定和钝化重金属,降低其在土壤中的迁移性和生物可利用性[19],解磷微生物可以在一定程度钝化土壤重金属[20],且菌株对不同重金属降解的实验室研究愈发受到重视[21-28].土壤中的重金属污染会严重影响土壤微生物的组成、丰度和多样性,降低土壤肥力进而使其生态系统服务功能受损[18],phoD与pqqE作为解磷功能基因为探究重金属污染土壤中解磷微生物群落的变化提供了有效方法.同时明晰土壤中解磷微生物群落对重金属的响应机制对于开重金属修复技术具有重要的意义.
本文研究了金矿周边不同程度复合重金属污染的农田土壤中含有phoD或pqqE基因解磷微生物的关键类别,明晰了解磷微生物群落对不同浓度重金属的响应,重点探讨了重金属浓度与解磷微生物之间的相关性,为进一步探索解磷微生物应对土壤重金属污染的机制提供依据.
1 材料与方法
1.1 土壤取样
从北京市某废弃金尾矿周边农田中采集土壤样品,在前期调研的基础上,沿废弃河道选取重金属污染程度的L、M、H3块取样地,根据5点取样法每块地选择3个采样点,选择3个重复,每个采样点设置D1(0~20cm)、D2(20~40cm)、D3(40~60cm)、D4(60~80cm)、D5(80~100cm)5个采样深度,按照等量、随机、多点混合的原则取样,以保证土壤样本的代表性.每个样品取样完毕后混合均匀,用塑料带密封,记录下取样地点、日期等基本信息.共取得45份土壤样品,完全混合后分为两部分进行DNA测序与土壤理化性质测定.
1.2 土壤理化性质、重金属浓度、碱性磷酸酶活性测定
按照《土壤农业化学分析方法》[29]分析土壤中理化性质、《土壤酶及其研究法》[30]分析土壤酶活性,简要方法如下:
土壤中总氮(TN):采用凯氏定氮法测定;氨氮、亚硝酸盐氮、硝酸盐氮:采用氯化钾溶液提取-分光光度法(HJ 634-2012)测定;土壤溶解性有机碳(TOC):称过2mm筛的风干土样10g,按水土比2:1添加蒸馏水,在25℃下恒温振荡30min后(180r/min),用0.45mm滤膜抽滤,滤液直接在TOC-1020A有机碳分析仪(Elementar,德国产)上测定;土壤pH值:称取风干土样10g,加入25mL的去CO2蒸馏水,浸提30min后用pH计(YOKEPHS-3E.Shanghai,China)测定;土壤有机质(SOM):重铬酸钾-硫酸氧化法测定;土壤有效磷含量(P):钼锑抗比色法[31]测定;碱性磷酸酶活性(ALP):磷酸苯二钠比色法[32]测定.
土壤重金属总浓度的测定:采用AFS ((JitianAFS-9130,中国))测定As总浓度,采用ICP- MS((I捷伦ICP-MS7700x,USA))测定总Cd、Pb、Zn、Cu、Cr和Ni.
1.3 宏基因组测序
用DNA提取试剂盒(E.Z.N.A.Soil DNA Kit, Omega Bio-Tek,Inc.,GA,USA)提取用于元基因组学的DNA.使用S220聚焦超声仪™(Covaris Inc.,沃本,美国马萨诸塞州)切除和提取剪切DNA片段(~500bp),用于成对末端文库的构建.鸟枪法提取合格的™,用NEB next Ultra DNA Library Prep Kit (Illumina,Inc.,CA,USA)构建成对端测序文库,通过Qubit4.0 荧光定量仪(美国ThermoFisher Science)测量文库浓度, 2100DNA1000Kit(Agilent Technologies, CA,USA)检测文库长度分布.使用Illumina HiSeq XTen测序平台(Illumina,Inc.,CA,USA)在中国上海生工生物技术公司高通量测序中构建合格的测序文库,测序方式为 PE150bp.
1.4 数据处理和分析
采用Excel 2019统计数据,使用Past3和R语言(4.0.2版)绘制图形.采用方差分析计算统计学差异.Shannon指数和Simpson指数箱线图、物种丰度星图和主成分分析(PCA)由R中的vegan包计算、ggplot2绘制.多样性指数表使用Past3计算.微生物物种丰度堆叠图通过Excel 2019绘制.R中的pheatmap包生成了说明微生物群落丰度与金属浓度之间Spearman相关性的热图.
2 结果与分析
2.1 土壤重金属浓度和土壤理化性质
土壤重金属As、Cd、Pb、Zn、Cu、Cr和Ni全量含量见表1.根据《土壤环境质量农业土壤污染风险控制标准(试行)》GB15618-2018设置的风险筛选值与管控值判定,L组As含量在筛选值范围内,其余各土层各金属含量均远低于筛选值,农用地土壤污染风险低,认为L组为无污染对照土壤样本;M组除Cu、Cr、Ni在筛选值范围内,Cd和Pb小于等于风险管制值、As大于等于风险管制值、三者浓度超标,认为M组为复合重金属污染土壤样本;H组除Cr、Ni以外,其余重金属全量均远超风险筛选值,As、Pb比风险管控值高出近50倍和10倍,认为H地为重度复合重金属污染土壤样本.
在D1层中,如表2所示,H组TOC、TN、SOM及有效磷含量显著高于L、M组,碱性磷酸酶活性变化呈现M组>L组>H组的变化趋势,张杰等研究表明碱性磷酸酶活性随重金属浓度增加整体呈现活性抑制状态[28],重金属浓度过高会抑制微生物生长繁殖,不宜于微生物生存.

表1 土壤重金属全量(mg/kg)
注:数值后不同字母表示差异显著(<0.05).

表2 废弃尾矿周边土壤不同环境因子指标
注:表中数据为D1层每组3个重复样本的平均值±标准差,每行数字后面的不同字母表示<0.05水平下存在显著性差异.
2.2 解磷微生物群落多样性
通过对土壤宏全基因组测序获得phoD基因作为筛选解有机磷微生物的标志基因,筛选出443条结果,分属1个真菌门、13个细菌门共59种微生物.以pqqE基因作为筛选解无机磷微生物的标志基因,共筛选出794条结果,1个真菌门、9个细菌门共70种微生物.下文针对解磷微生物多样性分别进行了详细分析.
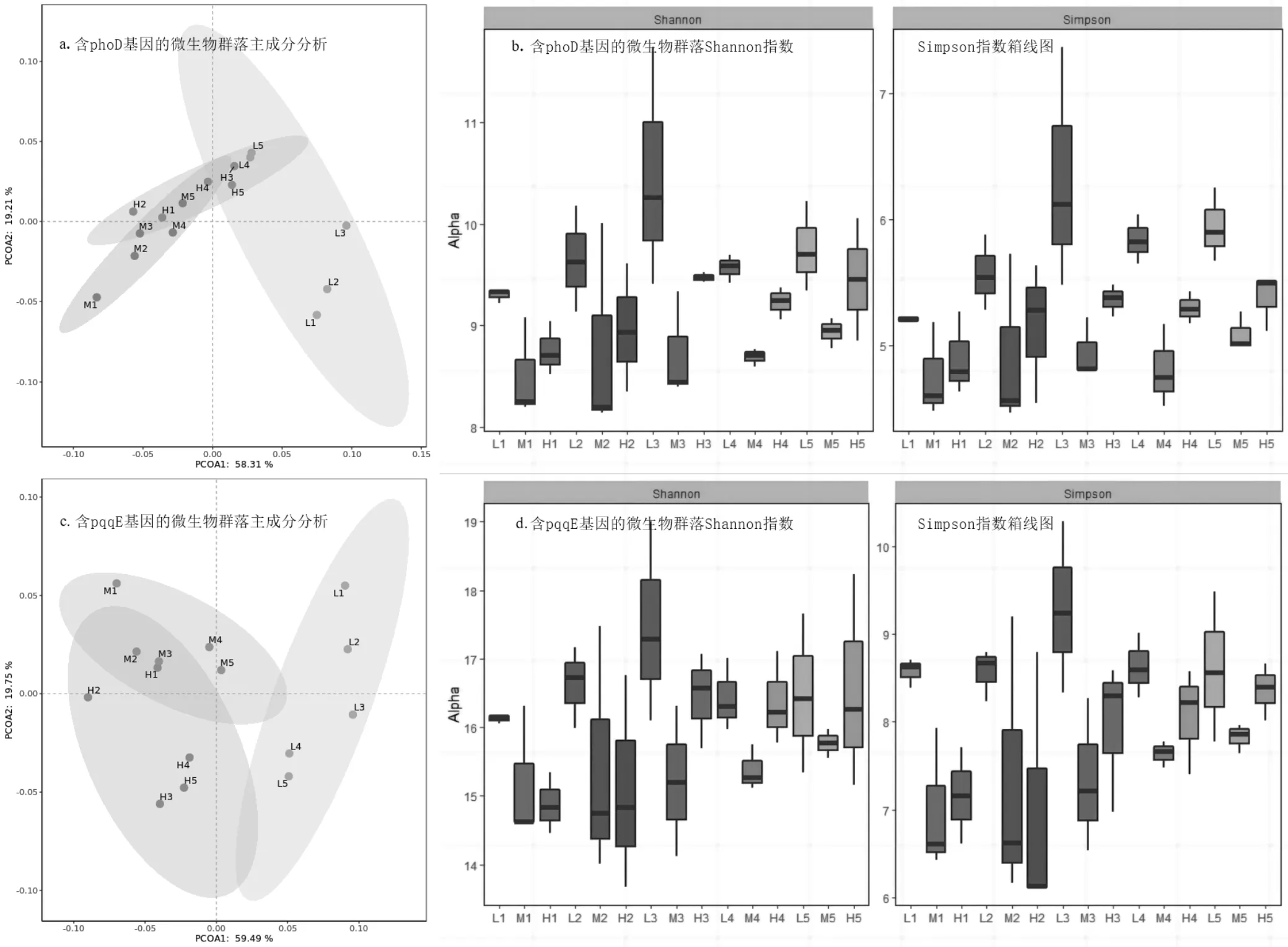
图1 解磷微生物群落多样性分析
不同重金属污染浓度下解磷微生物群落的主坐标分析(PcoA)得解有机磷群落第一主轴占比58.31%(图1(a)),解无机磷群落第一主轴占比59.49%(图1(b)).不同重金属污染浓度下的两种解磷微生物群落规划出分离明显清晰可见的置信椭圆,表明重金属浓度的变化对解有机磷、无机磷微生物群落均有影响;且在不同重金属污染管理下的H组和M组部分样品图上距离近,分布密集,样品间差异不明显,但二者与L组被坐标轴明显分开,存在较大差异,说明重金属污染对解磷微生物群落结构影响差异明显.
同时通过微生物a多样性分析得知,在各个土壤深度下,解磷微生物群落多样性指数都随着重金属浓度的升高呈现出先下降再上升的变化趋势(图1(c)、(d)),L组无污染对照区域土壤中微生物Shannon指数略高,其次是H组和M组,说明重金属浓度会刺激解磷微生物多样性发生变化.这可能与土壤理化环境、微生物间的相互作用有关,有研究表明更高浓度重金属污染激发了微生物某些重金属抗性机制,激发了微生物间的相互作用[33].
表层土壤中含有phoD基因的解有机磷微生物群落与含有pqqE基因的解无机磷微生物群落物种多样性指标见表3.综合两种解磷微生物群落分析,表层Shannon指数和Simpson指数的大小顺序为L>H>M,解磷微生物多样性与复合重金属污染程度之间不存在简单的线性关系.解有机磷群落的Taxa S指数、Evenness指数小于解无机磷群落,但Menhinick和Margalef指数的大小顺序为解有机磷群落>解无机磷群落;说明虽然表层土壤中相较于解无机磷群落,解有机磷群落物种多样性略低,但细菌丰度高,且丰度分布不均匀,解有机磷微生物群落中存在极优势物种.Berger-Parker指数大小顺序为M>L>H,说明M组解磷微生物数量分布最不均匀,重金属刺激了解磷微生物群落组成的改变;Taxa S指数以及Chao-1指数未发生数值变化,说明重金属污染并未影响解磷微生物的物种组成.

表3 解磷微生物群落Alpha多样性指数
此外,微生物多样性随着土壤深度增加而呈现先上升后下降的趋势,群落结构发生改变.D3层解磷微生物多样性指数最大,说明40~60cm土层微生物多样性高于其他土层(图1(c)、(d)).随着土壤深度增加,解磷微生物均匀度表现出与多样性指数相同的先增大后减小变化趋势,猜测可能因为解磷微生物优势物种属好氧菌,随着土壤深度增加其生长所需各种环境要素如阳光、水分、氧气量减少,不利于其生长,表层土壤虽然外部环境适宜,但存在重金属富集累积导致其生长被抑制.有研究证实微生物的生长受到外界条件的影响很大,受外界环境条件和土壤中重金属含量的双重作用[34],且植物生长代谢会在表层土壤中累积重金属[35].
2.3 解磷微生物群落组成
相对丰度堆积分析(图2(a))表明,随重金属浓度增加,解磷微生物相对丰度逐渐降低,重金属会抑制解磷微生物整体活性.重金属污染土壤样本中解有机磷微生物分布集中在细菌门,主要为酸杆菌门(Acidobacteria)、芽单胞菌门(Gemmatimonadetes)、变形菌门(Proteobacteria)、厌氧氨氧化菌门(Candidatus_Rokubacteria)、放线菌门(Actinobacteria),这与其他对不同土壤中解磷微生物群落研究得出的优势门类似[36-38],其中酸杆菌门(Acidobacteria)占解有机磷群落丰度的47%~50%.同时发现古菌群落广古菌门(Euryarchaeota)占所有微生物丰度的0.0016%,古菌中Euryarchaeota已被证实含有phoD基因序列[38].酸杆菌门属、装甲菌门属、游动放线菌属()、固氮弓菌属()、变形杆菌门的伯克氏菌目(Burkholderiales_noname)约占所有解有机磷微生物的90%以上(图2(d)).解无机磷微生物主要由放线菌门(Actinobacteria)、酸杆菌门(Acidobacteria)、变形菌门(Proteobacteria)、奇古菌门(Thaumarchaeota)、硝化螺旋菌门(Nitrospirae)、疣微菌门(Verrucomicrobia)组成(图2(a)),与前人研究得出的解磷微生物优势菌门类似[40-43].生丝微菌属()[13]、、线状微球菌属()、甲基菌属()是解无机磷微生物优势属(图2(e)).
值得注意的是厌氧氨氧化菌目前仍无解磷功能研究记录,但有研究表明Candidatus A. autotrophicum具有产乙酸的机制[39];产酸是解磷菌解磷的机理,我们猜测这是Candidatus A. autotrophicum被筛选出的原因,这将在后续研究中继续证实.解有机磷微生物群落和解无机磷微生物群落组成差异不大,优势门微生物重合率达90%,这也与文献中认为大部分解磷微生物同时具有解有机磷与无机磷观点一致[4].同时本文发现,解磷微生物总丰度顺序为:M>L>H,有研究表明在Cd、Pb复合污染土壤中,较低浓度的重金属离子有利于提高土壤微生物活性,当Cd浓度大于15mg/kg、Pb浓度大于200mg/kg 时微生物活性开始下降[44];M组Cd浓度小于上述临界值,但Pb浓度大于临界值,或许其他重金属之间联合作用影响了微生物的活性与丰度,这将在之后的研究中证实.物种星图直观表现出微生物群落组成的差异情况(图2(b)、(c)),解磷微生物群落的组成及优势类群在L、M、H中大致相同,但各个门的相对丰度却存在显著差异,这同时证实重金属会影响解磷微生物的群落结构.
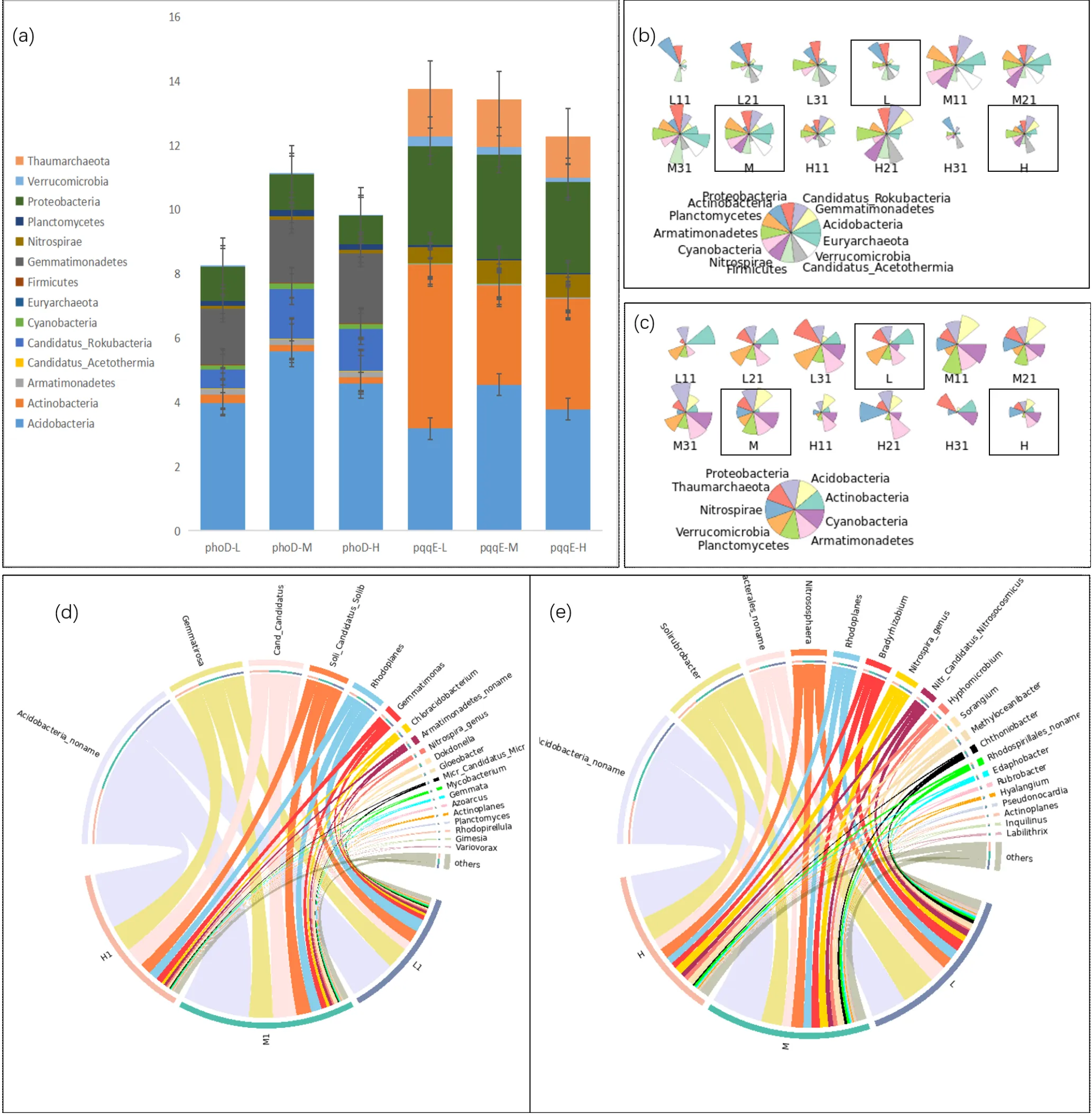
图2 解磷微生物α多样性分析
(a) 横坐标为phoD-L/M/H、pqqE-L/M/H六个样本的门水平微生物丰度堆叠图(0~20cm土壤深度样本);(b)含有phoD基因及(c)含有pqqE基因门水平微生物物种丰度星图,每块扇形区域长度与丰度有关,9个样本为0~20cm表层土壤样本,L/M/H每组最后标注出来的样本数据为三个重复样本求平均所得;(d)含有phoD基因及(e)含有pqqE基因属水平微生物群落弦图
不同微生物对重金属反应各不相同,解磷微生物也存在同样的模式.古菌可以通过一些解毒和代谢机制在重金属污染土壤中存活,解磷微生物群落中奇古菌门(Thaumarchaeota)、广古菌门(Euryarchaeota)对重金属的刺激反应并不显著,在M和H位点保持了高丰度,丰度百分比依次为10.54%、11.32%、10.20%以及1.25%、1.20%、1.20%.然而,细菌对重金属响应不同.Acidobacteria丰度所占平均百分比在L、M、H依次为23.78%、34.05%、30.96%,随着重金属浓度升高呈现出先上升后下降的趋势.细菌丰度与随重金属浓度增加而增大成正相关关系的微生物有Nitrospirae、Candidatus_Rokubacteria、Firmicutes.H中属的的丰度最高.研究表明,在重金属高浓度范围内,巴氏芽孢杆菌可通过生物矿化和生物富集作用修复Cd、Cr(Ⅲ)和Zn等重金属.有研究表明, Proteobacteria和Firmicutes中都含有强金属抗性基因[45],可以解释拟杆菌门厚壁菌门丰度随重金属浓度升高而升高的现象.有研究表明,Proteobacteria可以在高重金属污染环境中生存,具有重金属耐受性[34,46],同样本研究中解磷微生物群落中Proteobacteria丰度并没有受重金属浓度的显著影响. Actinobacteria随重金属浓度增加丰度逐渐减小,有研究表明Actinobacteria与重金属全量极显著负相关[47], Actinobacteria对重金属毒性影响最为敏感[44];但Joan Cáliz等[48]研究发现在重Cd污染酸性土壤中Actinobacteria菌株具有强Cd、Pb耐受性,猜测土壤理化性质及重金属含量的不同会刺激Actinobacteria的重金属抗性.
2.4 解磷微生物群落分布与重金属的相关性
为进一步探讨重金属对解磷微生物的影响,重金属与多数优势门群落表现出显著相关性.对重金属含量和微生物丰度数据进行Spearman相关矩阵分析.如图4所示,重金属与多数优势门群落表现出显著相关性.As、Zn、Pb、Cu、Cd等重金属与解磷微生物中Nitrospirae、Proteobacteria、Planctomycetes、Actinobacteria、Verrucomicrobia和Planctomycetes显著负相关.

图3 解磷微生物群落与不同重金属的RDA分析
不同颜色坐标点:取样地点;黑色箭头:不同重金属;图中英文:门水平微生物(添加显著性标识*)
其中重金属显著抑制Armatimonadete丰度.同时冗余分析表示,As、Pb、Zn对phoD、pqqE微生物群落影响最大(图3),Acidobacteria、Gemmatimonadetes、Proteobacteria、Nitrospirae、Planctomycetes受重金属影响更加明显.
D1/D2/D3/D4/D5分别代表土壤0~20cm、20~40cm、40~60cm、60~80cm、80~100cm.其中值用红色-黄色-蓝色的色阶代替,而显著性则用“*”表示.显著性<0.01为“**”表示极为显著;0.05<<0.01为“**”表示极为显著;>0.05不标注显著性
由图4可知,Nitrospirae是受重金属影响最大的微生物群落,与Cr、Cu、Pb、Zn、As、Cd等重金属都展现了显著正相关性.有研究表明在重金属污染土壤中具有硝酸盐还原作用,参与好氧氨氧化过程的微生物丰度较高[54].Sahu等[55]从被高浓度Cd污染土壤中筛选出了的几株解磷微生物,其中分属Proteobacteria的肠杆菌株具有高重金属耐受性支持了本研究结论[55].Nitrospirae与重金属含量呈极显著负相关,且Actinobacteria呈极显著负相关.随着土壤深度增加,Gemmatimonadetes与重金属的相关性由正相关变为负相关,赵鑫等研究表明Gemmatimonadetes对重金属有一定耐受能力[54].有研究称Planctomycetes、Nitrospirae和Gemmatimonadetes的相对丰度与重金属含量呈现负相关性[56],猜测产生结果差异的因素是土壤类型及土壤层深的不同.Ni、Cr等重金属与解磷微生物并无太大的相关性,这可能是由于Ni、Cr两种重金属在研究样本中均不构成污染且浓度在样本间差别不大.此外,随着垂直深度的增加,解磷微生物Euyarchaeota、Proteobacteria、Armatimonadetes、Planctomycetes、Firmicutes、Candidatus_ Acetothermia、Verrucomicrobia与重金属相关性显著性指数p值逐渐减小,即程度呈现出增强的趋势. 同时发现,解磷微生物群落被重金属复合影响,并未显示出对单一重金属显著相关性.
2.5 解磷微生物群落分布与环境理化性质相关性
除重金属外,大量研究表明,理化性质与解磷微生物之间也存在相关性.phoD解有机磷微生物冗余分析 (RDA)表明(图5),理化性质中土壤有效磷含量与解有机磷群落显著正相关,解释了群落相关性的 48.3%.有研究表明phoD基因群落的丰度和组成与磷储量和磷有效性显著相关[49].同时,有机质含量也与解有机磷微生物显著相关,有研究表明,重金属污染区解磷细菌丰度与有机质含量呈显著正相关(<0.05)[42],有机质能显著影响含有phoD基因的微生物群落结构[50].
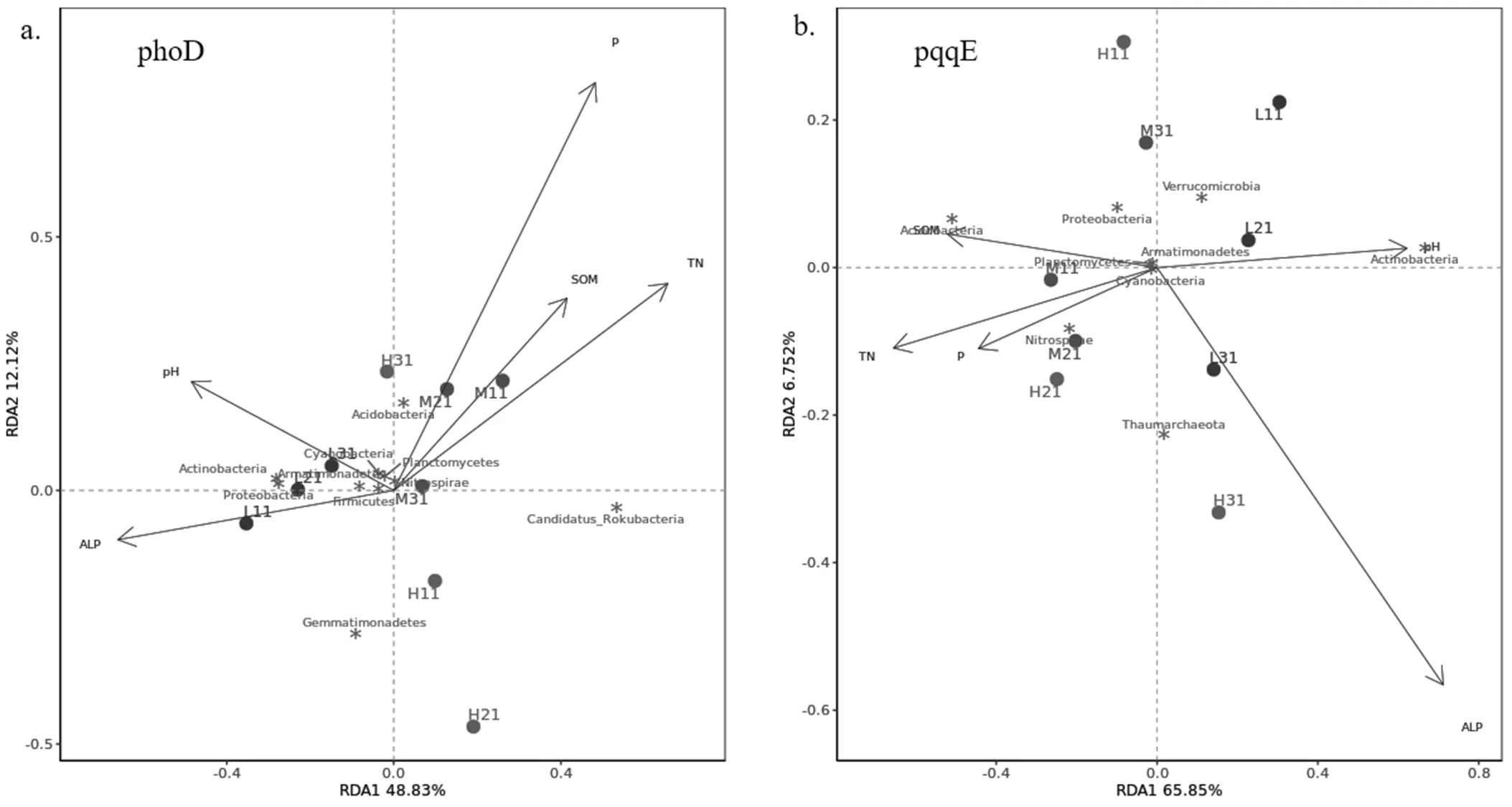
图5 解磷微生物群落与环境因子的相关性
数据为表层0~20cm土壤深度样本,不同颜色坐标点:取样地点;黑色箭头:环境变量;图中英文:门水平微生物(添加显著性标识*)
由于地理环境等的差异以及样本量、研究方法等因素的影响,得到了不同于此前研究的一些结果.很多研究认为pH值是直接和间接决定有机磷矿化相关基因丰度的关键因素的结论[37-38],但在本研究中,由图5可知,pH值射线在所有射线中长度并不突出,说明pH值对phoD微生物有影响但并不显著.将图5中所有理化性质射线延长,同时把土壤样本点垂直投影于延长线上,沿着图中各个变量箭头的方向样本相关性逐渐增大,观察L、M、H样本所在位置:pH值对L组无污染样本土壤的影响最大,证实了pH值是L组解有机磷群落的关键因素;对M、H组,pH值的影响并不突出.本文推测土壤的复合重金属污染影响了pH值与微生物群落的相关性.此外,土壤C:P和N:P比率以及微生物碳是和phoD细菌群落丰度、群落多样性和群落组成的主要预测因子[51],但Mise等[6]Gaiero等[52]研究表明phoD基因微生物群落组成与土壤碳或氮浓度并不相关; Hu等[50]认为土壤有机碳对phoD群落结构有很大影响,磷的影响不大,进一步得出土壤中有机磷矿化与碳矿化是解耦的结论.这些结果之间存在差异的原因或许是采样点土壤类型和地理范围不同导致.此外,环境因素对各微生物门的相关性也存在差异, Actinobacteria、Candidatus_Rokubacteria、Gemmatimonadetes、Proteobacteria呈现出显著相关性.有研究表明,对环境条件的变化比其他微生物更敏感,特别是与土壤有机碳、总氮、NH4+-N和NO3--N浓度呈负相关,与容重呈正相关[53].环境因子对phoD基因解有机磷微生物存在一定影响,但在本样本中,其并不是影响微生物群落变化最主要的变量.
在对pqqE基因解无机磷微生物的冗余分析(RDA)中发现,碱性磷酸酶活性解释了解无机磷微生物群落相关性的65.85%,是与pqqE群落最相关的环境因素(图5(b)).碱性磷酸酶含量越高,表明土壤中解有机磷机制占比越大,有效磷含量增加抑制微生物解无机磷过程,这将在未来的研究中进一步证实.其余环境理化因子对本样本中的解无机磷微生物群落有一定影响但效果不显著.
3 结论
3.1 解磷微生物主要通过调整群落结构来应对重金属压力,不同重金属污染程度下微生物多样性无显著变化.
3.2 解磷微生物在细菌与古菌界中存在且细菌丰度占95%以上,解有机磷群落与解无机磷群落组成重合率达90%,含phoD基因的解有机磷微生物以酸杆菌门(Acidobacteria)为主,其次是芽单胞菌门(Gemmatimonadetes)及变形杆菌门(Proteobacteria),含pqqE基因的解无机磷微生物以酸杆菌门(Acidobacteria)为主,其次是变形杆菌门(Proteobacteria)、放线菌门(Actinobacteria).
3.3 RDA分析发现,无污染土壤中,pH值确是与解磷微生物群落最显著相关的因素,在重金属污染土壤中,相较于pH值、SOM等土壤理化性质,重金属更显著地影响解磷微生物群落多样性,同时相关性分析表明As、Pb和Zn是影响解磷微生物的最关键因子.
[1] Pasek M A. Rethinking early earth phosphorus geochemistry [J]. Proceedings of the National Academy of Sciences of the United States of America, 2008,105(3):853-858.
[2] 王光华,赵 英,周德瑞,等.解磷菌的研究现状与展望[J]. 生态环境, 2003,(1):96-101.
Wang G, Zhao Y, Zhou D, et al. Research status and prospect of phosphorus solubilizing bacteria [J]. Ecological Environment, 2003,(1): 96-101.
[3] 吉 蓉.土壤解磷微生物及其解磷机制综述[J]. 甘肃农业科技, 2013,(8):42-45.
Ji R. A review of soil phosphorus solubilizing microorganisms and their mechanisms [J]. Gansu Agricultural Science and Technology, 2013,(8):42-45.
[4] 赵小蓉,林启美.微生物解磷的研究进展[J]. 土壤肥料, 2001,(3):7- 11.
Zhao X, Lin Q. Research progress of phosphorus solubilization by microorganisms [J]. Soil and Fertilizer, 2001,(3):7-11.
[5] 池景良,郝 敏,王志学,等.解磷微生物研究及应用进展[J]. 微生物学杂志, 2021,41(1):1-7.
Chi J, Hao M, Wang Z, et al. Research and application progress of phosphorus solubilizing microorganisms [J]. Chinese Journal of Microbiology, 2021,41(1):1-7.
[6] Mise K, Fujita K, Kunito T, et al. Phosphorus-mineralizing communities reflect nutrient-rich characteristics in Japanese arable Andisols [J]. Microbes and Environments, 2018,33(3):282-289.
[7] 林钰栅,范 缙,蔡邦平,等.解磷微生物在重金属污染原位修复中的作用及其机理研究进展[J]. 厦门大学学报(自然科学版), 2016, 55(5):697-706.
Lin Y, Fan J, Cai B, et al. Research progress on the role and mechanism of phosphorus solubilizing microorganisms in in-situ remediation of heavy metal contamination [J]. Journal of Xiamen University (Natural Science Edition), 2016,55(5):697-706.
[8] Kim C H, Han S H, Kim K Y, et al. Cloning and expression of pyrroloquinoline quinone (PQQ) genes from a phosphate-solubilizing bacterium Enterobacter intermedium [J]. Current microbiology, 2003, 47(6):457-461.
[9] Rajpurohit Y S, Gopalakrishnan R, Misra H S. Involvement of a protein kinase activity inducer in DNA double strand break repair and radioresistance of Deinococcus radiodurans [J]. American Society for Microbiology, 2008,190(11).
[10] Tahir M, Asif N M, Shahid M, et al. Inoculation of pqqE gene inhabiting Pantoea and Pseudomonas strains improve the growth and grain yield of wheat with a reduced amount of chemical fertilizer [J]. Journal of applied microbiology, 2020,129(3).
[11] 刘 艳,曹永清,孟 静,等.荧光假单胞菌CLW17菌株pqqE和GDH基因的功能[J]. 微生物学通报, 2022,49(2):529-544.
Liu Y, Cao Y, Meng J, et al. Function of pqqE and GDH genes in Fluorescent Pseudomonas CLW17 strain [J]. Bulletin of Microbiology, 2022,49(2):529-544.
[12] 秦 平.不同解磷菌配比解磷能力比较及解无机磷基因的克隆[D]. 哈尔滨:黑龙江大学, 2007.
Qin P. Comparison of phosphorus solubilization ability of different phosphorus solubilizers and cloning of inorganic phosphorus solubilizing gene [D]. Harbin: Heilongjiang University, 2007.
[13] 钟璐芳.生丝微菌pqq及moxF基因簇的表达差异分析[D]. 福州:福建师范大学, 2017.
Zhong L. Expression difference analysis of pqq and moxF gene clusters in Raw silk microbacteria [D]. Fuzhou: Fujian Normal University, 2017.
[14] 李 欣,张 磊,胡景江. 拐枣七内生细菌溶磷相关基因的鉴定[J]. 西北植物学报, 2017,37(8):1500-1506.
Li X, Zhang L, Hu J, et al. Identification of phosphorus- solubility-related genes from endophytic bacteria of[J]. Chin Bull Bot, 2017,37(8):1500-1506.
[15] Bi Q, Li K, Zheng B, et al. Partial replacement of inorganic phosphorus (P) by organic manure reshapes phosphate mobilizing bacterial community and promotes P bioavailability in a paddy soil [J]. Science of The Total Environment, 2020,703:134977.
[16] Mohammad S I, Mohammad K A, Mohammad H A, et al. Sources and ecological risks of heavy metals in soils under different land uses in Bangladesh [J]. Pedosphere, 2019,29(5):665-675.
[17] Evelyn V, Ngozi V E, Verla A W, et al. Bioavailability, average daily dose and risk of heavy metals in soils from children playgrounds within Owerri, Imo State, Nigeria [J]. Chemistry Africa, 2020,3(2):3.
[18] Harika, Narumanchi, Dishant, et al. Environmental pollution; Study findings on environmental pollution are outlined in reports from Maringa State University (Coagulation/Flocculation withand membrane filtration for dairy wastewater treatment) [C]//IEEE International Conference on Smart Cloud. 0.
[19] Jin H P, Nanthi B, Mallavarapu M, et al. Isolation of phosphate solubilizing bacteria and their potential for lead immobilization in soil [J]. Journal of Hazardous Materials, 2010,185(2).
[20] 李 敏,滕泽栋,朱 静,等.解磷微生物修复土壤重金属污染研究进展[J]. 生态学报, 2018,38(10):3393-3402.
Li M, Teng Z, Zhu J, et al. Research progress in remediation of heavy metal pollution by phosphorus solubilization microorganisms [J]. Acta Ecologica Sinica, 2018,38(10):3393-3402.
[21] 周 野.可附着粪基生物质炭表面的微生物对重金属的浸出及固定作用[D]. 长春:吉林农业大学, 2019.
Zhou Y. Leaching and fixation of heavy metals by microorganisms attached to faec-based biochar [D]. Changchun: Jilin Agricultural University, 2019.
[22] 李益斌.解磷菌改良典型重金属污染土壤的应用研究[D]. 北京:北京有色金属研究总院, 2018.
Li Y. Research on application of phosphorus solubilizing bacteria to ameliorate typical heavy metal polluted soil [D]. Beijing: Beijing General Research Institute of Nonferrous Metals, 2018.
[23] 邵 文.重金属铅、铬压力下解磷菌生长代谢及耐受机制的研究[D]. 北京:北京林业大学, 2019.
Shao W. Study on the growth, metabolism and tolerance mechanism of phosphate-solving bacteria under pressure of lead and chromium [D]. Beijing: Beijing Forestry University, 2019.
[24] 吕冰欣.解有机磷菌对酸性土壤铅镉铜钝化效应和机理研究[D]. 西安:西北大学, 2019.
Lv B. Passivation effect and mechanism of organophosphorus deoxidizing bacteria on Pb, CD and Cu in acidic soil [D]. Xi 'an: Northwest University, 2019.
[25] 滕泽栋.解磷菌协同铁基材料对铅污染土壤的修复作用及机制研究[D]. 西安:北京林业大学, 2020.
Teng Z. Study on the remediation effect and mechanism of phosphorus solubilizing bacteria and iron based materials on lead-contaminated soil [D]. Xi 'an: Beijing Forestry University, 2020.
[26] 苏奇倩,徐其静,丁豪杰,等.微生物解磷特性及其铅污染土壤修复应用[J]. 环境科学与技术, 2020,43(12):177-184.
Su Q, Xu Q, Ding H, et al. Phosphorus removal by microorganisms and its application in remediation of lead-contaminated soil [J]. Environmental Science and Technology, 2020,43(12):177-184.
[27] 张克瑶.解磷菌—磷酸三钙胶囊的制备及其对铅污染底泥的稳定修复研究[D]. 北京:北京林业大学, 2020.
Zhang K. Preparation of Tricalcium phosphate capsules by phosphorus solubilizing bacteria and its stable remediation of lead-contaminated sediment [D]. Beijing: Beijing Forestry University, 2020.
[28] 张 杰.生物炭固定化高效解磷菌对铅污染土壤的修复研究[D]. 西安:西北大学, 2019.
Zhang J. Remediation of lead-contaminated soil by immobilized high-efficiency phosphorus solubilizing bacteria with biochar [D]. Xi 'an: Northwest University, 2019.
[29] 中国土壤学会农业化学专业委员会.土壤农业化学常规分析方法[M]. 北京:科学出版社, 1983:20-25.
ACC of CSS. Routine analysis methods of soil agricultural chemistry [M]. Beijing: Science Press, 1983:20-25.
[30] 关松荫,等.土壤酶及其研究法[M]. 北京:农业出版社, 1986:17-22.
Guan S, et al. Soil enzymes and their research methods [M]. Agricultural Press, 1986:17-22.
[31] 张祥胜.钼锑抗比色法测定磷细菌发酵液中有效磷含量测定值的影响因素分析[J]. 安徽农业科学, 2008,(12):4822-4823.
Zhanf X. Analysis of Influencing factors for determination of available phosphorus content in bacterial phosphorus fermentation broth by molybdenum-antimony anti-colorimetric method [J]. Journal of Anhui Agricultural Sciences, 2008,(12):4822-4823.
[32] 石春芳,王志勇,冷小云,等.土壤磷酸酶活性测定方法的改进[J]. 实验技术与管理, 2016,33(7):48-49.
Shi C, Wang Z, Leng X, et al. Improvement of soil phosphatase activity determination method [J]. Experimental Technology and Management, 2016,33(7):48-49.
[33] 王 嘉,王仁卿,郭卫华.重金属对土壤微生物影响的研究进展[J]. 山东农业科学, 2006,(1):101-105.
Wang J, Wang R, Guo W. Research progress of effects of heavy metals on soil microorganisms [J]. Shandong Agricultural Sciences, 2006, (1):101-105.
[34] 李传章.微生物在重金属复合污染耕地土壤的变化特征及驱动机制研究[D]. 南宁:广西大学, 2020.
Li C. Study on the change characteristics and driving mechanism of microorganisms in cultivated soil contaminated by heavy metals [D]. Nanning: Guangxi University, 2020.
[35] Zhang G, Bai J, Zhao Q, et al. Heavy metals in wetland soils along a wetland-forming chronosequence in the Yellow River Delta of China: Levels, sources and toxic risks [J]. Ecological Indicators, 2016,69: 331-339.
[36] 杨 琳.黄土高原沟壑区刺槐林土壤磷素与微生物群落结构特征研究[D]. 杨凌:西北农林科技大学, 2020.
Yang L. Study on Soil Phosphorus and microbial community structure of Robinia pseudoacacia Forest in gully region of Loess Plateau [D]. Xianyang: Northwest A&F University, 2020.
[37] Hao T, Matthieu B, Marlies J M, et al. Long-term phosphorus fertilisation increased the diversity of the total bacterial community and the phoD phosphorus mineraliser group in pasture soils [J]. Biology and fertility of soils: Cooperating Journal of the International Society of Soil Science, 2013,49(6).
[38] Ragot S A, Kertesz M A, Buenemann E K. phoD alkaline phosphatase gene diversity in soil [J]. Applied and Environmental Microbiology, 2015,81(20):7281-7289.
[39] Hao L, Mcilroy S J, Kirkegaard R H, et al. Novel prosthecate bacteria from the candidate phylum Acetothermia [J]. The ISME Journal, 2018,12(9):2225-2237.
[40] 陈炯宇,覃 英,谢显秋,等.甘蔗内生固氮菌DX120E溶磷基因GDH和pqqE的克隆及溶磷特性分析[J]. 热带作物学报, 2021,42(10): 2819-2827.
Chen J, Qin Y, Xie X, et al. Cloning of phosphorus solubilizing genes GDH and pqqE fromDX120E in sugarcane and analysis of Phosphorus solubilizing Characteristics [J]. Journal of Tropical Crops, 2021,42(10):2819-2827.
[41] 李兴霖,秦 平,葛菁萍,等.共培养提高解磷菌解无机磷能力及解无机磷基因(pqqE)的克隆[J]. 中国农学通报, 2015,31(23):47-52.
Li X, Qin P, Ge J, et al. Co-culture of phosphorus solubilizing bacteria and cloning of inorganic phosphorus solubilizing gene (pqqE) [J]. Chinese Agricultural Science Bulletin. 2015,31(23):47-52.
[42] 易艳梅,黄为一.不同生态区土壤溶磷微生物的分布特征及影响因子[J]. 生态与农村环境学报, 2010,26(5):448-453.
Yi Y, Huang W. Distribution characteristics and influencing factors of soil phosphorus soluble microorganisms in different ecological regions [J]. Journal of Ecology and Rural Environment, 2010,26(5):448-453.
[43] Long X, Yao H, Huang Y, et al. Phosphate levels influence the utilisation of rice rhizodeposition carbon and the phosphate- solubilising microbial community in a paddy soil [J]. Soil Biology & Biochemistry, 2018,118:103-114.
[44] 滕 应.重金属污染下红壤微生物生态特征及生物学指标研究[D]. 杭州:浙江大学, 2003.
Teng Y. Study on ecological characteristics and biological indexes of red soil microorganisms under heavy metal pollution [D]. Hangzhou: Zhejiang University, 2003.
[45] Yong C, Yiming J, Haiying H, et al. Long-term and high- concentration heavy-metal contamination strongly influences the microbiome and functional genes in Yellow River sediments [J]. Science of the Total Environment, 2018:637-638.
[46] 李 梦.解有机磷菌对酸性土壤的改良和重金属污染的修复研究[D]. 西安:西北大学, 2017.
Li M. Study on the improvement of acid soil and remediation of heavy metal pollution by organophosphorus detoxifying bacteria [D]. Xi'an: Northwest University, 2017.
[47] 卞方圆,钟哲科,张小平,等.毛竹和伴矿景天对重金属污染土壤的修复作用和对微生物群落的影响[J]. 林业科学, 2018,54(8):106-116.
Bian F, Zhong Z, Zhang X, et al. Remediation of heavy metal contaminated soil by Phyllostachys pubescens and mineralized Sedum [J]. Scientia Silvae Sinicae, 2018,54(8):106-116.
[48] Cáliz J, Montserrat G, Martí E, et al. Emerging resistant microbiota from an acidic soil exposed to toxicity of Cr, Cd and Pb is mainly influenced by the bioavailability of these metals [J]. Journal of Soils and Sediments, 2013,13(2):413-428.
[49] Chen X, Jiang N, Chen Z, et al. Response of soil phoD phosphatase gene to long-term combined applications of chemical fertilizers and organic materials [J]. Applied Soil Ecology, 2017,119:197-204.
[50] Hu Y, Xia Y, Sun Q, et al. Effects of long-term fertilization on phoD-harboring bacterial community in Karst soils [J]. Science of the Total Environment, 2018,628-629:53-63.
[51] Luo G, Sun B, Li L, et al. Understanding how long-term organic amendments increase soil phosphatase activities: Insight into phoD- and phoC-harboring functional microbial populations [J]. Soil Biology & Biochemistry, 2019,139:107632.
[52] Gaiero J R, Tosi M, Bent E, et al. Soil microbial communities influencing organic phosphorus mineralization in a coastal dune chronosequence in New Zealand [J]. Fems Microbiology Ecology, 2021,97(4).
[53] Wu J, Buckley H L, Curry L, et al. Livestock exclusion reduces the spillover effects of pastoral agriculture on soil bacterial communities in adjacent forest fragments [J]. Environmental Microbiology, 2021, 23(6).
[54] 赵 鑫.内蒙古某尾矿库土壤重金属环境风险评价和土壤微生物特征[D]. 包头:内蒙古科技大学, 2020.
Zhao X. Environmental risk assessment and soil microbial characteristics of heavy metals in a tailings pond in Inner Mongolia [D]. Baotou: Inner Mongolia University of Science and Technology, 2020.
[55] Sahu S, Rajbonshi M P, Gujre N, et al. Bacterial strains found in the soils of a municipal solid waste dumping site facilitated phosphate solubilization along with cadmium remediation [J]. Chemosphere, 2022,287:132320.
[56] 安凤秋.外源重金属铅和镉对土壤生物活性及微生物群落多样性的影响研究[D]. 杨凌:西北农林科技大学, 2018.
An F. Effects of exogenous heavy metals Lead and cadmium on soil bioactivity and microbial community diversity [D]. Xianyang: Northwest A&F University, 2018.
Effects of long-term combined heavy metal pollution on soil phosphate solubilizing microorganisms.
LIU Rong-can1, LIU Xiao-xia2, FENG Yang2, ZHAO Qian-cheng1, HU Xue-song1, DU Yan-bin1, YU Cai-hong1*
(1.School of Chemical & Environmental Engineering, China University of Mining and Technology-Beijing, Beijing 100083, China;2.Beijing Cultivated Land Construction and Protection Centre, Beijing 100020, China)., 2023,43(2):915~926
In order to further understand the changes of distribution and potential functions of phosphorus solubilizing microorganisms under long-term heavy metal pollution pressure, the response of phosphorus solubilizing microorganisms containing phoD gene or pqqE gene in the soil around a gold mine in Beijing to different levels of combined heavy metal pollution was systematically analyzed by using macrogenomics technology. It is showed that phosphorus solubilizing microorganisms was affected by heavy metals. With heavy metal concentration increasing, the relative abundance of phosphorus solubilizing microorganisms gradually decreased. Acidobacter and Actinobacteria were the dominant bacteria of phosphorus solubilizing microorganisms in heavy metal contaminated soil. Heavy metals were the most significantly related factors to the phosphorus solubilizing microbial community. The phosphorus solubilizing microorganisms were greatly affected by heavy metals As, Pb, Zn. Heavy metals were susceptibly influence Nitrospirae, Acidobacteria, Gemmatimonadete, Proteobateria, which changed the community structure. Nitrospirae was sensitive to Cr, Cu, Pb, Zn, As, Cd. The concentration of available phosphorus was significantly positively related to the diversity of phosphorus solubilizing microorganisms (<0.05), while Alkaline phosphatase activity was significantly negatively correlated with the diversity of phosphorus solubilizing microorganisms. However, soil organic matter, total nitrogen and pH had no significant effect on the diversity of phosphorus solubilizing microorganisms in heavy metal contaminated soil. The results provided a reference for further exploring the ecological adaptation mechanism of phosphorus releasing microorganisms under long-term heavy metal pollution pressure.
phosphate solubilizing microorganisms;heavy metals;phoD;pqqE
X53
A
1000-6923(2023)02-0915-12
刘荣灿(1998-),女,山东菏泽人,中国矿业大学(北京)研究生,主要研究方向土壤重金属污染修复.发表论文1篇.
2022-06-27
* 责任作者, 教授, caihongyu@cumtb.edu.cn

