锑氧化菌Pseudomonas sp. AO-1的分离鉴定及其对Sb(III)的氧化性能
隆 佩,邓仁健*,杨 宇,金贵忠,黄中杰,周新河,王西峰,王 闯
锑氧化菌sp. AO-1的分离鉴定及其对Sb(III)的氧化性能
隆 佩1,邓仁健1*,杨 宇1,金贵忠2,黄中杰1,周新河3,王西峰1,王 闯1
(1.湖南科技大学土木工程学院,湖南 湘潭 411201;2.锡矿山闪星锑业有限责任公司,湖南 娄底 417500;3.中国煤炭地质总局水文地质局环境公司,河北 邯郸 056001)
采用抗性筛选法从锡矿山筛选出一株锑氧化菌,并利用分子生物学技术对其进行鉴定;考察了其氧化Sb(Ⅲ)的性能和氧化次生矿物的特征.结果表明:锑氧化菌属于假单胞菌属(),将其命名为sp. AO-1(简称:AO-1);影响AO-1氧化Sb(III)的因素主要有溶液pH值、溶解氧和铁锰氧化物(单质铁、FeCl3和MnO2)等; AO-1在好氧和缺氧条件下均能氧化Sb(III),好氧氧化Sb(III)的米门常数m和最大氧化速率max值分别为393.05mmol/L和0.271mmol/(L·min),体现了较强的锑氧化性;AO-1和铁锰氧化物的耦合作用能促进Sb(III)的氧化,且铁锰氧化物促进AO-1氧化Sb(III)的速率依次为:FeCl3> MnO2>单质铁; AO-1和铁锰氧化物耦合氧化Sb(III)生成含Sb(Ⅴ)的次生矿物,次生矿物会加速Sb(III)的氧化以及影响锑在环境中的迁移转化.菌株AO-1的锑氧化性能良好,对于锑的生物化学转化和土壤微生物修复的应用有重要意义.
锑氧化菌;sp. AO-1;Sb(III);氧化;铁锰氧化物
锑(Sb)是具有高毒性和潜在致癌性的危险物质,可通过呼吸道、消化道、皮肤等途径进入人体对肺、肝脏、皮肤甚至心血管系统造成损害[1],因此Sb被许多国家或组织列入优先控制和全球性污染物目录[2].锑及其化合物的毒性取决于其化学形态和氧化态,元素锑比盐类锑毒性大,无机态锑比有机态锑毒性大[3-4].锑最常见的形态是三价(Sb(Ⅲ))和五价(Sb(V)),Sb(Ⅲ)的毒性是Sb(V)的10倍[5], 但Sb(V)在环境中的稳定性和迁移速度远远大于Sb(III),且Sb(V)能够长距离迁移.我国锑矿生产量占全世界的80%以上,这也带来了严重的锑污染[6].在微生物和降雨的耦合作用下[7-8],大量锑矿废石(Sb2S3、FeSb2S4、Sb2S2O)向环境中释放Sb(V)[9-10],导致锑矿区及周围的土壤和水体中锑含量严重超标,锑污染事件频发.可见,微生物介导作用是使含锑固废Sb(Ⅲ)溶解氧化成Sb(V)并向水土环境扩散的关键步骤之一[11-12].
锑氧化菌能够通过溶解氧化、矿化、生物累积等代谢机制参与到锑的生物地球化学循环过程中[13],并影响锑在环境中的化学组分、迁移转化、生物可利用性及最终归趋[5,14].自从Lialikova[15]首次报道第一株锑氧化细菌以来,约有100余株锑氧化菌已被筛选得到[16],其中31.96%属于属,且该属在湖南锡矿山、贵州大龙、日本市之川等锑矿区均有发现.因此,研究者推测属锑氧化菌在含锑固废Sb(Ⅲ)溶解氧化生成Sb(V)过程中扮演重要的角色[16],但是有关该属锑氧化菌氧化Sb(III)的性能和过程机理尚不清楚,有待深入研究.与此同时,具有催化和吸附功能的铁锰氧化物是土壤中常见的矿物[17-18],对Sb(Ⅲ)的氧化和迁移转化具有重要影响[19],其往往与锑氧化菌共存于锑污染土壤中,但是有关两者耦合作用下氧化Sb(Ⅲ)的行为研究鲜见报道[20-22].
基于此,为了阐明典型锑氧化菌和铁锰氧化物耦合作用下Sb(III)的环境行为和过程机理,本文从湖南省锡矿山锑矿区土壤样品中筛选出一株高耐锑的菌株,并利用分子生物学技术对其进行鉴定;系统考察其生长特性、锑耐受性、氧化Sb(Ⅲ)的动力学特征及影响因素;探讨铁锰氧化物介导锑氧化菌氧化Sb(Ⅲ)生成的次生矿物对锑迁移转化的影响,以期为解析锑的生物地球化学循环行为、锑污染防治和低品位锑矿资源化利用奠定理论依据[23].
1 材料与方法
1.1 土壤样品的来源
实验菌株筛选于湖南省冷水江市锡矿山锑矿区5~20cm的表层土壤.该土壤物理化学参数和重金属含量如下: pH 7.25、总氮(TN) 40.3mg/kg、总碳(TC) 32960mg/kg、总铁31.7mg/kg、氯离子85.2mg/kg、硫酸根139.96mg/kg、总锑1269.50mg/kg、总砷23.36mg/kg、总铅44.64mg/kg和总镉5.35mg/kg.
1.2 锑氧化菌的筛选分离方法
首先,在三角瓶中加入10g过筛后的土壤样品及100mL无菌水,用磁力搅拌器搅拌30min;静置30min后, 取1mL上清液加入到100mLCDM液体培养基,培养时间2~3d,培养条件为有光、30℃、150r/min.其次,取稀释102~105倍系列培养液0.05mL,均匀涂布在500mg/L的Sb(Ⅲ) CDM固体培养基上, 30℃下恒温培养,观察菌落的形态和生长情况.最后,用含Sb(Ⅲ)浓度3000mg/L的CDM固体培养基对初筛选菌落再次划线培养, 获得单菌落菌株.
CDM固体培养基配方:MgSO4·7H2O, 2.0g; NH4Cl, 1.0g; Na2SO4, 1.0g; K2HPO4, 0.013g; CaCl2·2H2O, 0.067g;酵母膏粉, 5.0g;琼脂, 15.0g;蒸馏水, 1L; pH 7.2, CDM液体培养基则不加琼脂.
1.3 锑氧化菌对Sb(III)的耐受性和氧化性测定方法
Sb(III)的耐受性:根据文献提供的方法测定纯种菌株对Sb(III)的耐受性[24]. Sb(III)的氧化性:取1mL菌液接种于Sb(Ⅲ)浓度为1mmol/L的CDM液体培养基中;取不同培养时间的上清液测定Sb(Ⅲ)和Sb(Ⅴ)的浓度[25],并计算Sb(Ⅲ)的氧化速率.选取Sb(III)耐受性和氧化性较好的目标菌株作为本文的研究对象.
1.4 锑氧化菌的分子生物学鉴定方法
首先,采用细菌基因抽提试剂盒提取菌株的DNA,并置于-20℃保存备用,具体操作步骤按照试剂盒说明书进行.其次,细菌16S rRNA序列PCR扩增以得到的细菌基因组DNA为模板,采用正向引物M13F(TGTAAAACGACGGCCAGT)和反向引物M13R(CAGGAAACAGCTATGACC)进行PCR扩增[26].PCR扩增体系为(50μL):基因组DNA 2μL, NS1/NS8引物(10mmol/L)各1.5μL,2×Hieff PCR Master Mix 25μL, ddH2O (10μL). PCR反应条件: 95℃下预变性5min; 94℃下循环变性1min, 52℃下退火复性1min, 72℃下延伸1min,共进行30个循环;最后在72℃下再延伸10min.取扩增成功的PCR产物送至中国典型培养物保藏中心(武汉)测序.最后,将序列结果提交至NCBI的GenBank数据库,进行BLAST比对分析,利用MEGA7.0软件和邻接法构建系统发育树.
1.5 锑氧化菌的生长特性实验方法
将活化的纯种锑氧化菌接种至不同Sb(Ⅲ)浓度(0,5,10,50,100,200和300mg/L)的CDM液体培养基中培养,并取样测定其在600nm波长处的吸光值(OD600).培养条件:接种量为1%(体积比)、温度为30℃和摇床速率为150r/min.取样时间:0~48h每隔8h取一次样, 48~144h每隔24h取一次样.根据OD600值绘制锑氧化菌在Sb(Ⅲ)胁迫下的生长曲线.
1.6 氧化动力学参数测定方法
以氧为电子受体,测定目标菌株氧化Sb(III)的动力学参数.该实验菌株培养条件与测定生长曲线时的实验条件相同,培养液中Sb(III)的初始浓度控制在0~2500mmol/L之间,实验过程详见文献[27]. Sb(III)的氧化动力学参数根据米门方程(式1)计算确定[27].
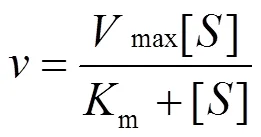
式中:为实验菌株对Sb(III)的氧化反应速率,mmol/(L·min); []为Sb(III)初始浓度,mmol/L;max为实验菌株对Sb(III)的最大氧化速率,mmol/(L·min);m为米门常数.
1.7 锑氧化菌氧化Sb(Ⅲ)的影响因素实验方法
好氧/缺氧影响实验:在pH值为7时,将Sb(Ⅲ)浓度为50mg/L的CDM液体培养基分为3组,并在121℃下高温灭菌30min,冷却至室温.其中第一组为敞开体系(有氧)且不加菌液(对照组),第二组为敞开体系(有氧)且接种1mL的实验菌液,第三组为密闭体系(无氧、50mg/L硝酸盐)且接种1mL的实验菌液;然后在温度为30℃和摇床速率为150r/min的条件下培养,每间隔12h取上清液测定OD600值、Sb(Ⅲ)和Sb(Ⅴ)的浓度.
pH值影响实验:考察pH值为2~7时对AO-1生长及其氧化Sb(Ⅲ)的影响,每组均设无菌空白对照组,其他实验操作同好氧/缺氧影响实验.
应急物流管理系统的本体库包括两种领域本体(即“管理”和“应急物流”),任务方法本体以及由此产生的应急物流管理本体,如图5所示。以上各图中,实线表示等级关系(即“part of”),虚线表示组合关系(即“uses”),箭头表示对任务/方法本体的引用。另外,图中只显示了类及其之间的关系,然而在实际的应用本体创建时会涉及本体的全部元素,包括类、属性、约束条件/关系等。
铁锰氧化物影响实验:在pH值为7时,考察单质铁、FeCl3、MnO2(浓度均为50mg/L)对AO-1生长及其氧化Sb(Ⅲ)的影响,每组均设无菌空白对照组,其他实验操作同好氧/缺氧影响实验.
1.8 分析方法与表征
称取适量的酒石酸锑钾(C8H4K2O12Sb2)溶于去离子水中,制备出1.0g/L的Sb(Ⅲ)标准储备液.取适量储备液稀释得到所需浓度的Sb(Ⅲ)溶液.采用氢化物发生原子荧光光谱仪(HG-AFS, AF-9600,中国北京科创海光仪器有限公司)对Sb(Ⅲ)和Sb(V)的浓度进行测定,该方法的最低检测限为1μg/L,锑的回收率达90%以上,误差率小于1%.所有样品均在实验结束后24h内完成测试,试剂均为优级纯,实验用水均为去离子水.
实验结束后,将有菌组pH值为7未添加铁锰氧化物和添加了单质铁、FeCl3、MnO2的4组溶液在4℃、10000r/min条件下离心5min后,得到菌体及其代谢产物组成的混合物质,于60℃烘干并研磨备用.采用扫描电子显微镜(SEM,JEOL 7800F,日本电子JEOL公司)对氧化Sb(Ⅲ)的氧化产物形貌特征和结构进行表征;采用X射线衍射仪(XRD, D8ADVANCE Da Vinci,德国Bruker公司)对氧化Sb(Ⅲ)的二次矿物晶体结构进行分析,扫描范围为5°~90°,扫描速度为6°/min.
2 结果与讨论
2.1 锑氧化菌的分离与鉴定
目标菌株的菌落形态呈透明状,隆起,表面光滑,菌苔粘稠,直径6~10mm;细胞形态呈长杆状、单个分散,直径为3~5μm,属于兼性好氧/厌氧菌,为革兰氏阴性菌.基于16S rRNA的同源性比较和BLAST对比,构建目标菌株的系统发育树(图1),结果显示与其最为接近的菌种是Ps 9-14,二者相似匹配度为99.86%.
依据《微生物分类学》和《细菌的特征与鉴定手册》,结合目标菌株的形态以及生理生化特征,将其鉴定为假单胞菌(),命名为spAO-1(简称AO-1,GenBank number为MN720563). BLAST对比结果显示未见与AO-1相似匹配度高于99.90%的菌株,暗示AO-1是假单胞菌属中一种新报道的锑氧化菌株.目前已报道的锑氧化菌有100余株[16],其中属占比例最高,达到了32.0%左右,且在湖南锡矿山、贵州大龙、日本市之川等锑矿区均有发现[28-29],可见属是锑氧化菌中数量最多、区域分布广泛、最具有代表性的一个属,在锑的生物地球化学循环中扮演重要的角色[28].因此,以spAO-1为典型锑氧化菌研究其氧化特性可为阐明微生物介导氧化Sb(Ⅲ)提供理论依据.
2.2 Sb(Ⅲ)胁迫下AO-1的生长特征及耐受性
由图2可知,当Sb(Ⅲ)胁迫浓度£50mg/L时, AO-1的生长几乎不受到抑制,且进入对数生长期的时间<5h;当Sb(Ⅲ)胁迫浓度在100~200mg/L时, AO-1的生长受到了明显的抑制,对数期滞后;当Sb(Ⅲ)胁迫浓度达到300mg/L时,最大OD600值只有1.47,仅为无Sb(Ⅲ)胁迫下的65%,生长和对数增长期受到显著的抑制.
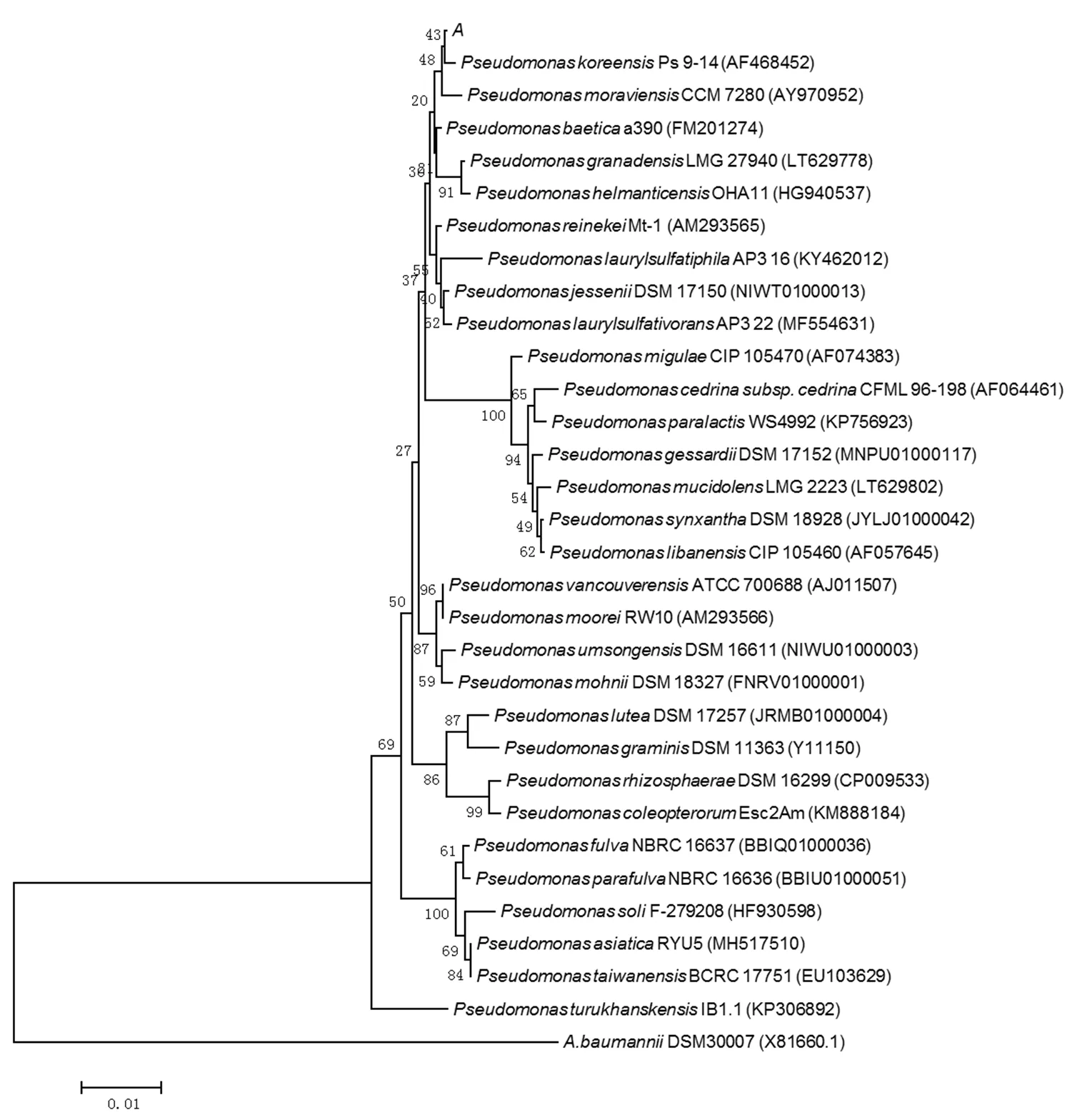
图1 菌株AO-1的系统发育树
该发育树以DSM30007 (X81660.1)为外枝构建;图中A代表sp. AO-1

图2 Sb(Ⅲ)胁迫下AO-1生长曲线
实验表明AO-1在Sb(Ⅲ)含量为8000mg/L的固体培养基中依然能够生长.可见,AO-1对Sb(Ⅲ)具有极高的耐受性,其Sb(Ⅲ)耐受性远高于大多数锑氧化菌及非土著微生物[16],原因可能与长期生存环境有关系[30],即长期在高浓度锑胁迫下AO-1为了自身生存逐渐进化出抵抗Sb(Ⅲ)的性能和代谢机制[13,16],包括锑的转运、氧化还原、甲基化和螯合解毒等机制,但有待进一步研究确定.
2.3 AO-1氧化Sb(III)的动力学特征
Sb(III)氧化速率是评价锑氧化菌氧化性能的重要指标,也反映其在锑生物地球化学循环中的作用[31-33].由图3可知, AO-1氧化Sb(Ⅲ)的米门常数m和最大氧化速率max分别为393.05mmol/L和0.271mmol/(L·min), 其m值高于sp. SPB-24[34](41mmol/L)、sp. NLS4[20](385.83mmol/L),但低于sp. NLS1[20](479.28mmol/L)、sp. JHS3[21](1280.71mmol/L)、sp. JHW3[20](4210.26mmol/L). 可见,AO-1的m值低于大多数已报道的锑氧化菌,暗示对Sb(III)具有较大的亲和力.AO-1的max值比sp. NLS1[20](0.34mmol/(L·min))、sp. NLS4[20](0.37mmol/(L·min))、sp. JHS3[21](1.07mmol/(L·min))、sp. JHW3[20](1.83mmol/(L·min))、sp. SPB-24[34](19.43mmol/(L·min))的max值低;但鉴于max测定条件和方法有差异,不同锑氧化菌的max直接比较意义不大,故研究者更关注的是锑氧化菌平均氧化速率avg.本文测定AO-1的avg为36.5mmol/(L·d),高于大多数锑氧化菌的实测值(0.10~300mmol/ (L·d))[16].对比不同锑氧化菌氧化Sb(III)的m、max和avg值表明: AO-1对Sb(III)具有良好的氧化性能,结合其在环境中的分布数量, 可推测属锑氧化菌在锑的生物地球化学循环过程中扮演重要角色.

2.4 AO-1介导氧化Sb(III)的影响因素
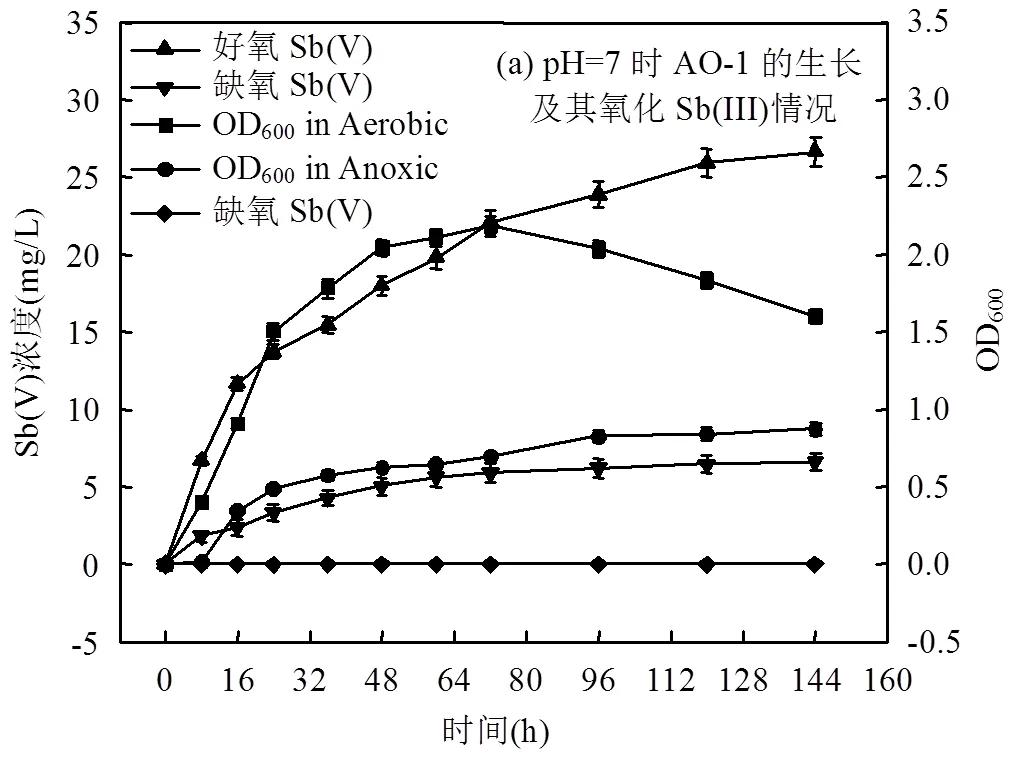
由图4(a)可知, AO-1在好氧、缺氧条件下最大OD600值分别为2.19和0.87,且缺氧条件下对数生长期后移,这表明好氧环境比缺氧环境更有利于AO-1的生长.非生物控制条件下, Sb(V)浓度未见上升;缺氧条件下, AO-1在6d内能将6.61mg/L Sb(III)氧化成Sb(V),缺氧平均氧化速率为9.05mmol/(L·d);而在好氧条件下, AO-1能将26.64mg/L Sb(III)氧化成Sb(V),好氧平均氧化速率为36.50mmol/(L·d),是缺氧平均氧化速率的4.0倍,这与其他研究者发现一致[20,35].Loni等[35]发现XT0.6好氧氧化Sb(III)的速率高达300mmol/(L·d),是缺氧条件下的6.0倍;Nguyen等[20]发现sp. strain NLS4好氧氧化速率(460.8mmol/(L·d))更是缺氧的6.9倍.此外,大部分锑氧化菌只能在好氧条件下氧化Sb(Ⅲ)[16,29],而strain IDSBO-1只能在硝酸盐存在时氧化Sb(III) (55.56mmol/(L·d)).可见,好氧、缺氧会影响细菌氧化Sb(Ⅲ)的性能,且大部分锑氧化菌好氧氧化速率远高于缺氧,原因可能与锑氧化菌有不同的锑代谢途径和氧化机制有关,好氧条件下, AO-1以氧气为电子受体将Sb(Ⅲ)氧化成Sb(V);缺氧条件下, AO-1以硝酸盐为电子受体发生反硝化反应,速度较缓慢,往往发生于氧气稀少的地下环境中[20].值得关注的是:好氧、缺氧条件下AO-1均能氧化Sb(Ⅲ),这对锑污染防控、微生物修复技术的研发具有重要意义.
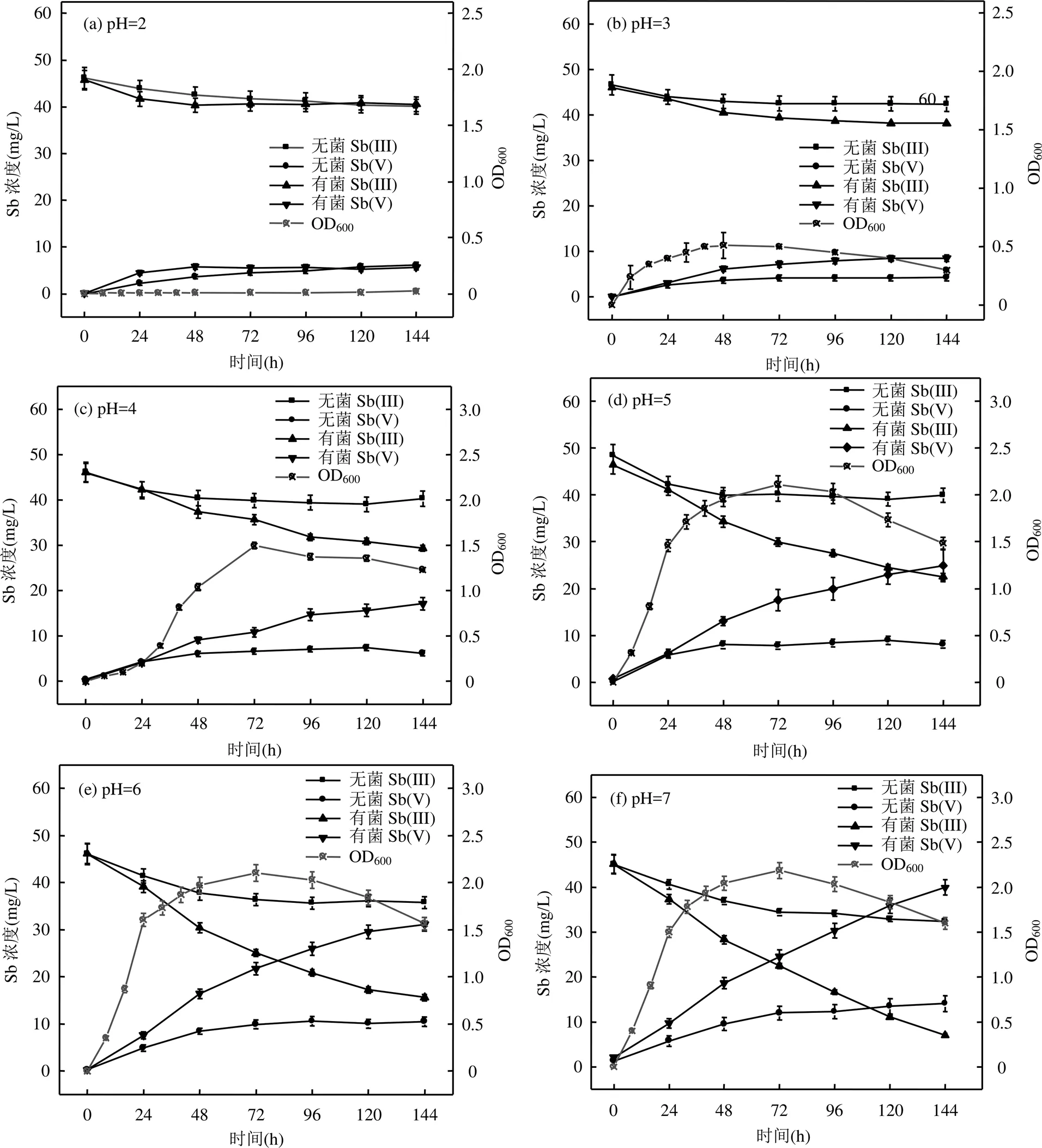
图5 溶液pH对AO-1生长及其氧化Sb(III)的影响
2.4.2 溶液pH值对氧化Sb(III)的影响 溶液pH值是影响微生物氧化Sb(III)的关键因素[35-36].图5给出了pH=2~7时AO-1氧化Sb(III)的情况,并与无菌时进行了比较. pH=2时, AO-1未见生长; pH值从3升高到5时,最大OD600值从0.51增加到2.11; pH值继续升高到6和7时,最大OD600未见增加,这表明pH<5时会抑制AO-1的生长, pH值为5~7时不会对AO-1的生长产生影响.
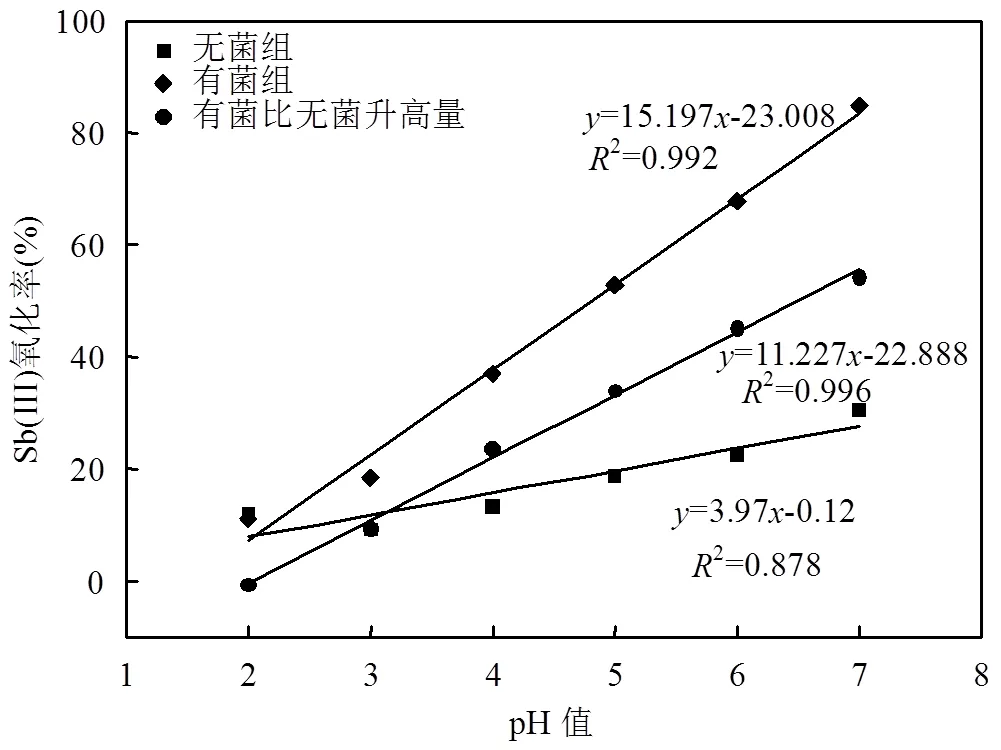
图6 溶液pH值与6d内Sb(III)氧化率的关系
无菌时, Sb(III)氧化主要属于化学氧化.由图5可知,当pH=2~7时,无菌组培养6d后Sb(III)氧化率分别为13.18%、9.08%、12.62%、17.47%、22.41%和28.27%, Sb(III)氧化率随pH值升高而升高,即pH值升高会促进化学氧化Sb(III),这与其他研究者的结论一致[37];但是Xi等[38]发现pH<7.0时,水中的Sb(III) 35d内未被氧化,究其原因可能是本实验过程一直存在光照,诱发了光催化氧化Sb(III)的反应[39-40].而有菌组培养6d后Sb(III)氧化率分别为11.42%、17.14%、36.13%、51.51%、66.14%和84.32%,可见AO-1氧化Sb(III)的效率随pH值升高而提高.当pH=3~7时,有菌组Sb(III)氧化率分别比无菌组提高8.06%、23.51%、34.04%、43.73%和56.05%.与此同时,无菌组氧化率、有菌组氧化率及有菌组比无菌组提高量均与pH值呈线性关系(图6),且有菌组的斜率(15.197)大于无菌组(3.97),这表明在pH值为2~7时, pH值升高对于氧化Sb(III)的促进作用有菌组大于无菌组.以上结果表明pH值升高会通过化学与生物作用共同促进氧化,分析原因:首先,弱酸性和中性不会影响AO-1的生长和繁殖,为AO-1氧化Sb(III)提供了良好的基础,这与本文前期研究[41]和Loni[35]的发现一致;其二,锑氧化菌氧化Sb(III)的酶促和非酶促(H2O2催化反应)反应均受pH值的影响,且在中性条件下反应速率最快[16,31,42-43];第三,锑氧化菌新陈代谢会生成碱性矿物提高微环境的pH值[35],进而促进Sb(III)氧化,如AO-1会生成NH4Mg (PO4)·6H2O矿物(图9).综上, AO-1氧化Sb(Ⅲ)是生物、化学联合作用过程,此过程中pH值是影响氧化速率和氧化程度的主导因素,锑氧化速率会随着pH值的增大而增大.

2.4.3 铁锰氧化物对氧化Sb(III)的影响 铁锰氧化物是土壤中常见的矿物[17-18],对锑的生物地球化学循环过程影响重大.图7给出了单质铁、FeCl3和MnO2分别对AO-1生长及其氧化Sb(III)的影响.由图7可知,不同条件下AO-1生长具有类似的规律且其最大OD600均在2.0左右,暗示了单质铁、FeCl3和MnO2不会影响AO-1的生长.
无菌条件下,单质铁、FeCl3和MnO2均能在120h内将0.4mmol/L的Sb(Ⅲ)氧化90.00%以上,远高于无菌且无铁锰氧化物时(26.95%,图5(f)),可见铁锰氧化物能促进Sb(Ⅲ)的氧化,这与他人研究结论一致[19,44].Nelson等[19]认为铁锰氧化物氧化Sb(Ⅲ)包括四个过程:①Sb(OH)3首先被吸附于Fe(OH)3或MnO2等表面; ②Sb(III)转移两个电子到Fe(OH)3或MnO2上;③将氧化生成的Sb(V)释放至溶液中; ④Fe(OH)3或MnO2得到电子生成Fe2+或Mn2+释放至溶液中,加速电子转移[45].江南等[46]认为铁锰氧化物促进Sb(III)氧化的原因包括:其一,通过促进溶解氧氧化Sb(III)而提升氧化效果;其二,反应过程中存在Fe2+/Fe3+或Mn2+/Mn3+循环并产生了强氧化性的羟基自由基(•OH),可促进Sb(III)的氧化.AO-1与单质铁、FeCl3和MnO2耦合氧化Sb(Ⅲ)的速率均比对应的单质铁、FeCl3和MnO2单独氧化Sb(Ⅲ)要快(图7),可见铁锰氧化物与AO-1耦合作用能进一步促进Sb(Ⅲ)氧化,究其原因:一是AO-1可直接生物氧化Sb(III);二是AO-1会代谢生成碱性的NH4Mg (PO4)·6H2O次生矿物,提高微环境的pH值促进Sb(III)氧化[35];三是AO-1代谢生成NaSb(OH)6、CaSb2O5(OH)2和MgSb2O6等难溶性的Sb(V)次生矿物(图9),促进Sb(III)氧化反应的进行.同时,与无菌组相比,AO-1与单质铁、FeCl3和MnO2耦合氧化90%的Sb(Ⅲ)(0.4mmol/L)所需时间分别缩短至96,72和84h(图7),可见3种铁锰氧化物促进AO-1氧化的速率依次为:FeCl3>MnO2>单质铁,原因主要与3种铁锰氧化物具有不同价态的铁锰循环及生成不同的二次矿物有关.综上所述,属锑氧化菌和铁锰氧化物广泛共存于锑污染土壤中,两者耦合作用加速Sb(III)的氧化,进而影响水土环境中锑的赋存形态、迁移转化与最终归趋.
2.5 AO-1氧化Sb(III)的次生矿物特征及对土壤中锑迁移转化的影响

图8给出了AO-1、AO-1+Fe、AO-1+ FeCl3、AO-1+ MnO2分别氧化Sb(III)后沉淀物的SEM图像.由图8(a)可知,AO-1单独氧化Sb(III)后沉淀产物表面光滑,内有凸起的不规则颗粒状晶体,推测为Sb(III)氧化后生成了锑酸盐类结晶体[47];图8(b)显示AO-1+Fe耦合氧化Sb(III)后沉淀物表面粗糙,具有较多的孔洞,原因有待进一步研究,图8(c~d)显示AO-1+FeCl3和AO-1+MnO2氧化Sb(III)后沉淀物表面粗糙,成层次鳞状结构,这与沉淀物中含有FeOOH和MnOOH等产物有关.

微生物氧化过程中形成的次生矿物种类对Sb(III)的氧化速率和锑迁移转化有重要的影响[13].由图9可知,无论AO-1单独氧化还是与铁锰氧化物耦合氧化,均生成了NH4Mg(PO4)·6H2O、NaSb (OH)6、CaSb2O5(OH)2和MgSb2O6等次生矿物,其中NH4Mg(PO4)·6H2O属于碱性矿物,能够提高微环境的pH值[35],这也是AO-1能促进氧化Sb(III)的主要原因之一.AO-1+单质铁耦合氧化Sb(III)还生成了FeSb2O4次生矿物(图9(b)),暗示该反应过程存在Fe0+/Fe2+循环;相关研究表明均相溶液中Fe(II)能够催化溶解氧氧化Sb(III)[46],使得AO-1+单质铁耦合氧化Sb(III)的速率比AO-1单独氧化要快.如图9(c)所示,AO-1+FeCl3耦合氧化Sb(III)还生成了FeOOH和FeSb2O4等次生矿物,暗示反应过程中存在Fe2+/Fe3+循环; Fe2+/Fe3+循环会加速电子转移和•OH的生成[45],从而促进Sb(III)氧化;且FeOOH对Sb(III)具有良好的吸附再氧化作用[19],因此AO-1+FeCl3氧化Sb(III)的速率比AO-1+单质铁氧化要快.AO-1+ MnO2氧化Sb(III)过程中生成了MnSb2O6和MnOOH等二次矿物(图9(d)),表明该反应过程中存在Mn2+/Mn3+循环,该循环可促进电子转移[19],但锰氧化物不能催化溶解氧氧化Sb(III)[46],导致AO-1+ MnO2氧化Sb(III)的速率慢于AO-1+FeCl3, 但比AO-1+单质铁要快.综上,3种铁锰氧化物促进AO-1氧化Sb(III)的速率依次为: FeCl3> MnO2>单质铁. AO-1+铁锰氧化物耦合氧化Sb(III)过程中存在Fe2+/Fe3+或Mn2+/Mn3+循环、生成了NH4Mg (PO4)·6H2O及多种含Sb(V)的次生矿物均会促进Sb(III)氧化,进而影响锑在环境中的迁移转化.值得关注的是NaSb(OH)6、CaSb2O5(OH)2和FeSb2O4等次生矿物均是属于微溶物,其溶解度分别为0.4[35]、0.038[47-48]和<10-5[14]g/100g H2O,在降雨淋溶等作用下这些次生矿物会缓慢释放出Sb(V)离子,造成持续的、低浓度的二次锑污染,尤其在铁锰氧化物丰富的锑污染土壤中更要引起重视.
3 结论
3.1 从湖南省锡矿山锑矿区土壤中筛选得到一株耐锑浓度高达8000mg/L的锑氧化菌,结合其形态和生理生化特征,将其鉴定为假单胞菌(sp.),命名为spAO-1;通过16S rRNA的同源性比较和BLAST对比分析,显示与AO-1最为接近的种是Ps 9-14,二者相似匹配度高达99.86%;未见与AO-1相似匹配度高于99.90%的菌株,因此spAO-1属于假单胞菌属中一种新发现的锑氧化菌株.AO-1氧化Sb(III)的动力学显示,好氧氧化Sb(III)的m和max值分别为393.05mmol/L和0.271mmol/(L·min),体现了较强的锑氧化性;结合属锑氧化菌在环境中的分布情况,推测其在锑的生物地球化学循环中扮演着重要的角色.
3.2 影响AO-1氧化Sb(III)的因素主要有溶解氧、pH值和铁锰氧化物.在好氧和缺氧条件下, AO-1均能氧化Sb(III),且好氧氧化速率大于缺氧; AO-1氧化Sb(Ⅲ)是生物、化学联合作用过程,在中性和弱酸性条件下,锑氧化速率会随着pH值的增大而增大; AO-1和铁锰氧化物耦合作用会促进Sb(III)氧化,且铁锰氧化物促进AO-1氧化Sb(III)的速率依次为: FeCl3>MnO2>单质铁; 但两者耦合氧化机制有待进一步研究.AO-1和铁锰氧化物耦合氧化Sb(III)会生成NaSb(OH)6、CaSb2O5(OH)2、MgSb2O6、FeSb2O4等次生矿物,加速Sb(III)的氧化和影响锑在环境中迁移转化.这些次生矿物在降雨淋溶等作用下易造成持续的、低浓度的二次锑污染,应该引起注意.
[1] Li J, Zheng B H, He Y, et al. Antimony contamination, consequences and removal techniques: A review [J]. Ecotoxicology & Environmental Safety, 2018,156:125-134.
[2] Fort M, Grimalt J O, Querol X, et al. Evaluation of atmospheric inputs as possible sources of antimony in pregnant women from urban areas [J]. Science of The Total Environment, 2016,544:391-399.
[3] Zhang D, Pan X, Mu G, et al. Toxic effects of antimony on photosystem II ofsp. as probed by in vivo chlorophyll fluorescence [J]. Journal of Applied Phycology, 2010,22(4):479-488.
[4] Shtangeeva I, Bali R, Harris A. Bioavailability and toxicity of antimony [J]. Journal of Geochemical Exploration, 2011,110(1):40- 45.
[5] He M, Wang N, Long X, et al. Antimony speciation in the environment: Recent advances in understanding the biogeochemical processes and ecological effects [J]. Journal of Environmental Sciences, 2019,75:14-39.
[6] Xiang L, Liu C, Liu D, et al. Antimony transformation and mobilization from stibnite by an antimonite oxidizing bacterium Bosea sp. AS-1 [J]. Journal of Environmental Sciences, 2022,111:273-281.
[7] Wang N, Wang A, Xie J, et al. Responses of soil fungal and archaeal communities to environmental factors in an ongoing antimony mine area [J]. Science of The Total Environment, 2018,652:1030-1039.
[8] Kuang J L, Huang L N, Chen L X, et al. Contemporary environmental variation determines microbial diversity patterns in acid mine drainage [J]. Isme Journal, 2013,7(5):1038-1050.
[9] Ren M, Wang D, Ding S, et al. Seasonal mobility of antimony in sediment-water systems in algae- and macrophyte-dominated zones of Lake Taihu (China) [J]. Chemosphere, 2019,223:108-116.
[10] Palmer M J, Chetelat J, Richardson M, et al. Seasonal variation of arsenic and antimony in surface waters of small subarctic lakes impacted by legacy mining pollution near Yellowknife, NT, Canada [J]. Science of the Total Environment, 2019,684:326-339.
[11] Wang A, He M, Ouyang W, et al. Effects of antimony (III/V) on microbial activities and bacterial community structure in soil [J]. Science of the Total Environment, 2021,789:148073.
[12] Li B, Xu R, Sun X, et al. Microbiome-environment interactions in antimony-contaminated rice paddies and the correlation of core microbiome with arsenic and antimony contamination [J]. Chemosphere, 2021,263:128227.
[13] Rong Q, Ling C, Lu D, et al. Sb(III) resistance mechanism and oxidation characteristics ofX [J]. Chemosphere, 2022,293:133453.
[14] 刘晓芸,刘晶晶,柯 勇,等.水体中锑的形态及转化规律研究进展[J]. 中国有色金属学报, 2021,31(5):1330-1346.
Liu X Y, Liu J J, Ke Y, et al. Research progress on speciation of antimony in natural water [J]. The Chinese Journal of Nonferrous Metals, 2021,31(5):1330-1346.
[15] Lialikova N N. Stibiobacter senarmontii-a new microorganism oxidizing antimony [J]. Mikrobiologiia, 1974,43(6):941-948.
[16] Deng R, Chen Y, Deng X, et al. A critical review of resistance and oxidation mechanisms of Sb-oxidizing bacteria for the bioremediation of Sb(III) pollution [J]. Frontiers in Microbiology, 2021,12:738596.
[17] Yan L, Chan T, Jing C. Mechanistic study for stibnite oxidative dissolution and sequestration on pyrite [J]. Environ. Pollut., 2020,262:114309.
[18] Ying S C, Kocar B D, Fendorf S. Oxidation and competitive retention of arsenic between iron and manganese oxides [J]. Geochimica et Cosmochimica Acta, 2012,96:294-303.
[19] Belzile N, Chen Y W, Wang Z. Oxidation of antimony (III) by amorphous iron and manganese oxyhydroxides [J]. Chemical Geology, 2001,174(4):379-387.
[20] Nguyen V K, Choi W, Yu J, et al. Microbial oxidation of antimonite and arsenite by bacteria isolated from antimony-contaminated soils [J]. International Journal of Hydrogen Energy, 2017,42(45):27832-27842.
[21] Nguyen V K, Tran H T, Park Y, et al. Microbial arsenite oxidation with oxygen, nitrate, or an electrode as the sole electron acceptor [J]. Journal of Industrial Microbiology & Biotechnology, 2017,44(6):1-12.
[22] Li Y, Wu J, Hu W, et al. A mechanistic analysis of the influence of iron-oxidizing bacteria on antimony (V) removal from water by microscale zero-valent iron [J]. Journal of Chemical Technology & Biotechnology, 2018,93(9):2527-2534.
[23] Li J, Zheng B, He Y, et al. Antimony contamination, consequences and removal techniques: A review [J]. Ecotoxicology and Environmental Safety, 2018,156:125-134.
[24] Huang F, Guo C L, Lu G N, et al. Bioaccumulation characterization of cadmium by growing Bacillus cereus RC-1and its mechanism [J]. Chemosphere, 2014,109:134-142.
[25] Lu X, Zhang Y, Liu C, et al. Characterization of the antimonite- and arsenite-oxidizingsp. AS-1 and its potential application in arsenic removal [J]. Journal of Hazardous Materials, 2018,359:527-534.
[26] Bundt M, Widmer F, Pesaro M, et al. Preferential flow paths: Biological 'hot spots' in soils [J]. Soil Biology & Biochemistry, 2001,33(6):729-738.
[27] Bahar M M, Megharaj M, Naidu R. Kinetics of arsenite oxidation bysp. MM-1isolated from a soil and identification of arsenite oxidase gene [J]. Journal of Hazardous Materials, 2013,262:997-1003.
[28] Wang N, Zhang S, He M. Bacterial community profile of contaminated soils in a typical antimony mining site [J]. Environmental Science & Pollution Research International, 2016,25 (6):1-12.
[29] Terry L R, Kulp T R, Wiatrowski H, et al. Microbiological oxidation of antimony(III) with oxygen or nitrate by bacteria isolated from contaminated mine sediments [J]. Applied and Environmental Microbiology, 2015,81(24):8478-8488.
[30] Gu J, Sunahara G, Duran R, et al. Sb(III)-resistance mechanisms of a novel bacterium from non-ferrous metal tailings [J]. Ecotoxicology and Environmental Safety, 2019,186:109773.
[31] 李璟欣.根癌农杆菌GW4中酶促和H2O2介导的非酶促锑氧化机制[D]. 武汉:华中农业大学, 2017.
Li J X. The mechanisms of enzymatic and H2O2-mediated non-enzymatic antimonite oxidation inGW4 [D]. Wuhan: Huazhong Agricultural University, 2017.
[32] Leuz A K, Moench H, Johnson C A. Sorption of Sb(III) and Sb(V) to goethite: influence on Sb(III) oxidation and mobilization [J]. Environmental Science and Technology, 2006,40(23):7277-7282.
[33] Thanabalasingam P, Pickering W F. Specific sorption of antimony (III) by the hydrous oxides of Mn, Fe, and Al [J]. Water Air and Soil Pollution, 1990,49(1):175-185.
[34] Bachate S P, Khapare R M, Kodam K M. Oxidation of arsenite by two β-proteobacteria isolated from soil [J]. Applied Microbiology and Biotechnology, 2012,93(5):2135-2145.
[35] Loni P C, Wu M, Wang W, et al. Mechanism of microbial dissolution and oxidation of antimony in stibnite under ambient conditions [J]. Journal of Hazardous Materials, 2019,385:121561.
[36] Herath I, Vithanage M, Bundschuh J. Antimony as a global dilemma: Geochemistry, mobility, fate and transport [J]. Environmental Pollution, 2017,223:545-559.
[37] Asta M P, Nordstrom D K, Mccleskey R B. Simultaneous oxidation of arsenic and antimony at low and circumneutral pH, with and without microbial catalysis [J]. Applied Geochemistry, 2012,27(1):281-291.
[38] Xi J, He M, Wang K, et al. Adsorption of antimony(III) on goethite in the presence of competitive anions[J]. Journal of Geochemical Exploration, 2013,132:201-208.
[39] Hu X, He M, Kong L. Photopromoted oxidative dissolution of stibnite [J]. Applied Geochemistry, 2015,61:53-61.
[40] Hu X, Kong L, He M. Kinetics and mechanism of photopromoted oxidative dissolution of antimony trioxide [J]. Environmental Science & Technology, 2014,48(24):14266-14272.
[41] Jin C, Deng R, Ren B, et al. Enhanced biosorption of Sb(III) onto living rhodotorula mucilaginosa strain DJHN070401: Optimization and mechanism [J]. Current microbiology, 2020,77(9):2071-2083.
[42] Wang D, Zhu F, Wang Q, et al. Disrupting ROS-protection mechanism allows hydrogen peroxide to accumulate and oxidize Sb(III) to Sb(V) in Pseudomonas stutzeri TS44 [J]. BMC Microbiology, 2016,16(279):1-11.
[43] Sun L, Guo B, Lyu W, et al. Genomic and physiological characterization of an antimony and arsenite-oxidizing bacterium Roseomonas rhizosphaerae [J]. Environmental Research, 2020,191: 110136.
[44] Yao S, Zhu X, Wang Y, et al. Simultaneous oxidation and removal of Sb(III) from water by using synthesized CTAB/MnFe2O4/MnO2composite [J]. Chemosphere, 2020,245:125601.
[45] Zhang C, He M, Ouyang W, et al. Influence of Fe(II) on Sb(III) oxidation and adsorption by MnO2under acidic conditions [J]. Science of the Total Environment, 2020,724:138209.
[46] 江 南,李小倩,周爱国,等.pH值和氧化剂对硫化锑氧化溶解的影响机制[J]. 地质科技通报, 2020,39(4):76-84.
Jiang N, Li X Q, Zhou A G, et al. Effect of pH value and Fe(Ⅲ) on the oxidative dissolution of stibnite [J]. Bulletin of Geological Science and Technology, 2020,39(4):76-84.
[47] Biver M, Shotyk W. Stibiconite (Sb3O6OH), senarmontite (Sb2O3) and valentinite (Sb2O3): Dissolution rates at pH 2-11and isoelectric points [J]. Geochimica et Cosmochimica Acta, 2013,109(3):268-279.
[48] Multani R S, Feldmann T, Demopoulos G P. Antimony in the metallurgical industry: A review of its chemistry and environmental stabilization options [J]. Hydrometallurgy, 2016,164:141-153.
Isolation and identification of antimony-oxidizing bacteriumspAO-1 and its oxidation properties for Sb(III).
LONG Pei1, DENG Ren-jian1*, YANG Yu1, JIN Gui-zhong2, HUANG Zhong-jie1, ZHOU Xin-he3, WANG Xi-feng1, WANG Chuang1
(1.School of Civil Engineering, Hunan University of Science and Technology, Xiangtan411201, China;2.Xikuangshan Shanxing Antimony Industry Co., Ltd, Loudi 417500, China;3.Environmental company of China National Administration of Coal Geology, Handan 056001, China)., 2023,43(2):904~914
An antimony-oxidizing bacterium was screened from Xikuangshan by the resistance screening method and identified by molecular biology techniques. And its oxidation properties for Sb(III) and the characteristics of oxidized secondary minerals were investigated. The results showed that the antimony-oxidizing bacterium belonged to the genussp., which was namedsp. AO-1 (AO-1). The main factors affecting the oxidation of Sb(III) by AO-1 were solution pH, dissolved oxygen and iron/manganese oxide (elemental iron, FeCl3and MnO2). In addition, AO-1 could oxidize Sb(III) under both aerobic and anoxic conditions, and the Michaelis-Menten constant and maximum oxidation rate of aerobic oxidation of Sb(III) were 393.05mmol/L and 0.271mmol/(L·min), respectively, presenting strong oxidizing ability to antimony. The combination of AO-1 and iron/manganese oxides could promote Sb(III) oxidation, and the rate of iron/manganese oxides promoting the oxidation of Sb(III) by AO-1 was in the following order: FeCl3> MnO2> elemental iron. Furthermore, the coupled oxidation of Sb(III) by AO-1 and iron/manganese oxides generated secondary minerals containing Sb(V), which accelerated Sb(III) oxidation and affected the migration and transformation of antimony in the environment. AO-1indeed exhibits satisfactory antimony oxidation performance, which is of great significance for the biogeochemical transformation of antimony and the application of soil microbial remediation.
antimony-oxidizing bacteria;sp. AO-1;Sb(III);oxidation;iron/manganese oxide
X53
A
1000-6923(2023)02-0904-11
隆 佩(1998-),女,湖南长沙人,湖南科技大学硕士研究生,主要从事重金属废水处理技术研究.
2022-06-27
湖南省研究生科研创新项目(CX20210994);湖南省自然科学基金资助项目(2022JJ30248,2021JJ30243);湖南省教育厅科学研究项目(19B193);国家自然科学基金资助项目(41672350)
* 责任作者, 教授, deng800912@163.com

