堆肥防治土传病害作用机理及其影响因素研究
刘佳琪,常瑞雪*,李彦明,李 季
堆肥防治土传病害作用机理及其影响因素研究
刘佳琪1,2,常瑞雪1,2*,李彦明1,2,李 季1,2
(1.中国农业大学资源与环境学院,北京 100193;2.中国农业大学有机循环研究院(苏州),江苏 苏州 215100)
植物土传病害是限制农业发展的主要原因之一,防治不当会产生巨大的经济损失.应用堆肥防治植物土传病害是一种简单易行且无二次污染的生物防治方法,但因其影响因素多、施用后效果不可预测且作用不稳定等原因未得到广泛应用.因此,本文基于文献调研,综述了堆肥抑制土传病原菌的作用机理,明确堆肥发挥抑病作用的最主要因素为微生物,并对比分析了好氧堆肥过程中的微生物种群的演变特点、堆肥中具有抑病效果的主要微生物种群类别和堆肥施用后对土壤微生物影响等,得出可能影响抑病效果发挥的堆肥自身因素和堆肥施用因素.最后,基于目前堆肥对植物土传病害抑制效果的研究进展和我国堆肥产业的发展现状指出了应用该技术的主要问题.
堆肥;土传病害;影响因素;微生物;生物防治
土传病害是潜伏在土壤中的病原菌在条件适宜时侵染植物根部或茎部而引起的植物病害,能够引起全球主要农作物总产量10%~15%的损失,每年直接经济损失高达数千亿美元,其中以真菌病害为主[1],致病菌包括丝核菌属()、镰刀菌属()、疫霉属()、轮枝菌属()等[2].连作和长期单一栽培的种植模式导致土壤有机质含量低,微生物群落数量和多样性减少,这会诱导土传病害的发生和传播[3],严重威胁农业的可持续发展.目前,防治植物土传病害的主要方法是使用化学杀菌剂,但已证实其会引起环境污染和植物抗性,不利于农业的可持续发展,因此很多杀菌剂已被禁用,目前尚未发现比较理想的替代药品或替代技术[4].抗病育种、嫁接换根、轮作、微生物制剂等农业防控和生物防控方法具有较好杀菌效果被用来辅助或替代化学方法.生防技术因其经济有效又不会危害环境的特点得到了快速发展,即在农业生态系统中利用生物或其产物来调节植物的微生物环境,抑制病原菌的生长,减少病原菌所致病害的发生[5],其中发挥作用的微生物组群包括生防真菌、生防细菌、噬菌体和病毒等.使用堆肥防治土传病原菌也是生防技术的一种.堆肥化是微生物对有机废弃物进行氧化分解的过程,堆肥产品施用于土壤中可以提供缓释养分和有机质、改良土壤、提高作物产量,从而有效抑制土传病原菌对植物的危害[6-7],对于修复退化土壤和防治土传病害具有重要作用.自1975年首次提出以来,已经证实使用堆肥是进行生物防控经济有效且可操作性高的一种方式[2,6-9].近年来,堆肥化处理得到了大力推崇,堆肥产品数量也在逐年增加.尽管已经有较多文献证明施用堆肥能够抑制土传病害,并且在有机农业生产等方面得到了较为普遍的应用,但研究多集中在从某种堆肥中筛选具有抑菌效果的微生物菌株[10],或在盆栽种植中探究堆肥对植株的抑病效果和长势的影响[1]等,并未系统分析堆肥产生抑病效果的原因及众多因素的影响,如何提高或稳定堆肥的抑病效果,是首要解决的问题.本文通过综合分析堆肥抑制植物土传病害的文献,总结了堆肥产品抑制病原菌的作用机理,以及影响抑病效果的主要因素,尤其是具有抑病效果的主要微生物种群及施用后对土壤微生物的影响,并在此基础上探索可能实现堆肥稳定抑病的方法,以期为应用堆肥抑制植物土传病害的深入研究和实现工厂化生产提供理论基础.
1 堆肥防治土传病害作用机理
1.1 堆肥微生物直接作用
堆肥中富含的微生物被认为是对病原菌产生抑制作用的主要因素,将堆肥进行灭菌处理后,随着堆肥中微生物数量的减少,对病原菌的抑制效果也显著降低[11-13].除此之外,病原菌的种类也会影响抑病效果,部分土传病原菌可以被多种有益微生物抑制,如疫霉和腐霉等引起植物烂根病的土传病原菌,施用堆肥或其他有机物料后可以给微生物提供充足的能源达到抗病的效果,因此施用堆肥或其他有机物料可以达到稳定的抑病效果;而其他病原微生物需要特定的微生物存在才可以达到抑制其活性的目的,如立枯丝核菌,镰刀菌和白绢病菌等.因此,要确保堆肥发挥良好的抑病效果,需要明确其抑病作用的主要微生物机理:例如微生物种群之间的养分竞争、抗生、寄生和吞噬、诱导系统抗性等等.

图1 堆肥防治土传病害作用机理
1.1.1 竞争作用 在任何生态系统中,微生物都会因资源约束而存在竞争关系.自养型病原微生物,如腐霉属()和疫霉属(),想要在植物表面生存和繁殖就必须与有益微生物竞争养分,甚至是生存的空间.因此,在植物表面环境中,如果存在一种微生物可以与病原微生物就某一种养分资源形成竞争关系,就有可能起到生物防控的作用[14].应用堆肥作为土壤调理剂种植番茄时,因尖孢镰刀菌(sp.)、棘壳孢菌()、腐霉菌()、和丝核菌()等病原菌引发的植物疾病大量减少,引起这种变化就是由番茄根区产生铁载体的微生物数量增加造成的[15],因为大量的铁载体会将根区范围内的铁离子浓度大量降低,通过竞争根区环境中为数不多的铁离子,抑制病原菌的孢子形成[16].
1.1.2 抗生作用 抗生作用是指两种有机体之间的关系,即一种生物通过产生特性或非特性的特殊代谢产物伤害或杀死另一种生物,或这种有机体直接作用于另一种有机体[14].Mehta等[1]指出堆肥中的微生物产生的抗生作用也应该被认为是抑制植物土传病害微生物的一种作用机理,在培养皿中加入堆肥能够抑制病原微生物生长,从而证实堆肥中会普遍产生具有抗生作用的代谢产物.假单胞菌因其拮抗特性可以对镰刀菌萎蔫病、马铃薯疮痂病、苹果连作病等植物病害的致病菌产生良好的抗生效果[17],有效的减少植物病害,同时还可以减少侵入性致病菌对植物根系的伤害[18];肠杆菌属的微生物菌株所产生的几丁质(甲壳素)消化酶可以对一些如立枯丝核菌的真菌性病原菌产生抗生效果[19];蜡样芽孢杆菌属的微生物可以产生双效菌素和卡那霉素水解物,二者可以有效抑制疫霉等真菌性病原菌[20-21].
1.1.3 重寄生 重寄生是一种微生物有机体直接攻击并杀死致病菌的直接拮抗作用[22].重寄生微生物主要包括四种类群:专性寄生性病原菌、低毒性病毒、任择性寄生虫和食肉动物.如细菌性寄生虫侵入巴斯德氏芽菌就是通过重寄生方式抵制根结线虫完成生物防控的代表性例子[23].真菌中的寄生作用也有很多例子,非致病性微生物可以通过寄生或溶解致病性土壤真菌性病原菌的菌丝体、卵孢子、菌丝或菌核等达到抑制病害的效果,如腐霉属、疫霉病和黄萎病等类别的致病菌都可以得到有效抑制[24].应用木霉防治由丝核菌引起的植物病害已经被作用重寄生物学的大众案例[25],因此堆肥中普遍存在的木霉一般被作为抑制丝核菌的代表性微生物[26].通过寄生作用可以控制多种在植物病害中起主要作用的病原菌的数量,一方面因为某些致病菌可以被多种寄生生物寄生,如顶孢霉、白粉菌重寄生菌、尖孢枝孢等都可以通过寄生防治白粉病致病菌[27];另一方面则是某些致病菌可以被多种有益放线菌或真菌寄生从而达到生防效果,如疫霉菌就可以作为支顶孢属、腐质霉属和厚孢轮枝菌等种群的寄主[28].
1.1.4 诱导系统抗性 系统获得抗性(Systematic acquired resistance,SAR)和诱导系统抗性(Induced systematic resistance,ISR)是植物机体对病原性攻击的两种诱导抵抗行为,二者都是通过预处理或预先接种的方式产生植物体对病原菌或寄生菌的抵抗能力[29].堆肥中大量的微生物可以诱导植物产生系统抗性[30],一方面施用的堆肥和病原菌相互作用会使植物SAR相关的基因表达增强[31],另一方面堆肥中的多种细菌和真菌可以引发植物自身的诱导系统抗性,进一步加强对植物病害的抵抗能力[32]. Kavroulakis等[33]研究添加堆肥的基质中生长的番茄发现,即便植株体内的发病基因表达也不一定会引起植物病害,这可能是由堆肥中的微生物种群所引发的,也可能与堆肥的非生物的特性有关系.而Sang等[34]则通过堆肥浸提液可以减少辣椒和黄瓜叶片的炭疽病证实堆肥可以调节植物机体的诱导系统抗性的特点.
1.2 堆肥对土壤微生物的招募作用
土壤中的微生物群落是响应土壤健康和植物病害的主要因素之一,土壤和根际中的微生物的多样性、种群结构具有较大的可塑性、可变性和时空异质性等特点[35].
堆肥中的微生物组与土壤和根际的微生物种群存在较大的差异,堆肥和有机肥对土壤微生物的富集、招募是堆肥产生抑病效果的关键因素.有研究发现生物有机肥中的微生物种群多样性和丰度与其抑制病害的效果无直接相关性,但却能对土壤或根际的微生物群落产生显著影响,推测可能是其对土壤以及土壤中微生物的影响间接导致了抑病功能[36-37].牛粪堆肥能够改变土壤细菌和真菌的群落结构[38];添加芽孢杆菌的有机肥能够引起微生物群落结构的特定变化,增加土壤中具有促生作用的根部细菌和内生菌[39].Tao等[37]研究发现施加堆肥富集了土壤中的假单胞菌,假单胞菌与堆肥中的芽孢杆菌密切相关,会产生积极的相互作用,影响土壤pH值、TOC、TON和速效磷含量,降低了香蕉枯萎病的发病率.堆肥能够改变根际微生物,招募、富集可能具有抑病效果的有益微生物,进而提高植物的抗病效果[40],而堆肥招募微生物的结构也会受到土壤类型、植物种类等影响[41].
堆肥以及土壤中的微生物种群及其抑制土传病害的作用机制还应进一步研究.特别是微生物群(在丰度、丰富度、多样性、均匀度和功能方面)、抗病堆肥的理化性质(如土壤有机质含量和腐殖化程度)与目标宿主和病原菌之间的数量关系应在进一步的研究中仍有待深入阐明.
1.3 堆肥对土壤理化性质的改良
堆肥施入土壤可以调节土壤理化性质,改良土壤物理结构和微生态环境,提高了土壤的孔隙率和保水能力等,这些都有利于堆肥发挥促生抗逆和抑制土传病害的功能[42].有机质承载着土壤中养分元素,对微生物活动以及矿质转化具有重要作用.对于土壤功能的发挥起着关键作用,而现代农业连做和单一种植导致土壤有机质含量低,易诱导土传病害的发生,加入堆肥能够增加土壤养分,提高有机质含量,进而增强对病原菌的抵御能力.
2 堆肥化过程对其抑病效果的影响
目前,已经有大量研究证明施用堆肥可以对植物土传病害产生较好防治效果,大多都只关注某种堆肥对某种病害的抑制效果,但是并非所有堆肥都能抑病,而且堆肥的抑病效果不能确定[43-44]. Termorshuizen等[9]随机选择市售堆肥检测它们对植物病害的抑制作用也发现,只有一半的堆肥产品具有显著的抑病效果,抑病效果从14%到61%不等,造成差异性结果的原因可能是多方面的.相关性结果显示,原料种类、有机质降解程度、堆肥腐熟度、理化条件和微生物菌剂等都与堆肥抑病效果相关.
2.1 堆肥物料
堆肥物料来源广泛,不同物料堆肥的抑病效果存在较大差异[45-48].如园林废弃物和葡萄渣为物料的堆肥,通常会表现出良好的抑病效果,而猪粪为物料的堆肥抑病效果较差[49].基于这些已有的研究成果分析物料差异会对抑病效果产生的影响的主要原因:(1)物料差异会对微生物的活性产生影响,因为微生物分解有机物较适宜的C/N为25左右,最佳范围为25:1~30:1,一般据此调整堆肥混合物料的C/N来保证微生物的最大活性.但是,混合物料的C/N一般只分析总碳/总氮的含量,但物料中易降解有机碳氮的含量才是直接影响微生物活性的关键因素[50],因为混合物料的水溶性有机质是直接被微生物利用的部分,会对堆肥中有益微生物的数量产生显著影响[51];(2)物料差异会对微生物种群类别产生影响,不同物料中有机组分的构成不同,这使得混合物料中糖、淀粉、蛋白、木质纤维素等不同的有机组分的比例存在较大差异,而每种有机组分所对应的优势降解微生物也不同,这就使得不同物料混合后,微生物种群存在较大差异,而这些微生物中,只有部分具有抑病效果,因此相同物料大多具有类似的抑病效果[2].
除以上常规农业废弃物外,19世纪以来,除虫菊、烟草、鱼藤、砂地柏、马齿苋等作物在农业病虫害防治中均表现出良好的防治作用,同时可以刺激作物生长、改善农产品品质.到目前为止,研究的植物种类达数千种,开发成功的植物源农药产品也很多,并已在生产实践中被广泛应用.如贾利元等对苦参提取物(黄酮类化合物和生物碱等)的抑菌效果进行试验,证实了黄酮类化合物具有更好的抑菌效果,可以有效减少茄子黄萎病菌的菌丝干质量,同时可以降低菌丝的毒素含量和胞外酶活性,从而有效减少低茄子黄萎病的发生[52].应用堆肥技术处理这些具有特殊功能的药用植物残渣目前受到越来越多的关注,并且在应用过程中表现出了有效的抑制病原菌的作用[53],且证实砂地柏和马齿苋可以通过提高植株超氧化物歧化酶、过氧化物酶和过氧化氢酶活性来增强作物的抗病能力,同时可以有效抑制病原菌孢子的萌发和根结线虫卵囊的孵化.张建华等则通过番茄盆栽试验证实,中药渣堆肥可以有效防治青枯病的发生,且效果优于污泥堆肥和猪粪堆肥[54],Greff等[55]总结中药渣辅助堆肥的相关研究,残留在中草药残渣中的生物活性化合物可能会影响堆肥生物量中的微生物活性,从而影响最终堆肥质量与抑病效果.Du等[56]和Shi等[57]证实醋糟堆肥可以有效黄瓜枯萎病的发生.更有研究人员从橄榄渣堆肥中提取出14株放线、1株节杆菌属的菌株和一株类酵母真菌,这些都可以有效抑制植物性病原菌[58-59].
因此,物料影响抑病效果主要是由于其中有机组分的不同,影响微生物的活性和种类,进而影响降解过程,特殊物料中具有的特殊有机组分导致其具有较好的抑病效果,但不适用于大规模常规堆肥.
2.2 理化性质
理化特点首先影响的是堆肥发酵过程,除了会对微生物种群的活性和代谢活动产生影响外,还会通过改良养分条件、调节有机分子组成和提供有益的生物活性物质等方式优化有益微生物的生存环境[60-61],辅助保护植物抵抗病原菌的侵害,或诱导系统抗性.
堆肥过程可以根据温度变化分为升温阶段、高温阶段和降温阶段,温度变化对微生物尤其是细菌多样性和群落产生较大影响,进而影响对病原菌的抑制[62].
Borrero[63]等研究表明堆肥的pH值会影响作物对枯萎病的抗病能力,因为高的pH值能降低基质中大量元素和微量元素的可利用性.Segarra等[64]发现当向含有10μmoL/L Fe的非酸性土壤中接种棘孢木霉T34时,由尖孢镰刀菌引发的西红柿枯萎病明显低于对照组,但在含Fe浓度高(100~1000μmol/L)的土壤中接种时西红柿枯萎病发病率虽有所降低,但效果不明显.
具有较高电导率的堆肥也能抑制病原菌的繁殖,减少植物土传病害的发生,这与堆肥中的盐离子浓度密切相关[65].Hoitink[66]指出高盐浓度的堆肥会增加腐霉菌和疫霉菌的感染,应在种植前提前几个月施用堆肥并通过淋溶作用来降低盐浓度.畜禽粪便堆肥通常含有较高的可溶性离子含量,这也是前文提到的畜禽粪便具有较低的抑病效果的重要因素之一,因此在使用过程中应注意堆肥中无机盐的浓度和应用作物的差异[67].另一方面,有机肥施入土壤后,其中的无机盐类可直接抑制病原菌[68],林春花等[69]以橡胶树棒孢霉落叶病病原菌及其产生的粗毒素为供试材料,研究了10种无机盐对多主棒孢菌株菌丝生长、分生孢子萌发的抑制作用,结果表明不同的无机盐类别会表现出不同的抑病效果.
2.3 腐熟程度
有机质的降解和腐熟度是影响堆肥抑病效果的重要因素之一.De Ceuster等[70]研究表明将对抑制病害有效的微生物菌株接种到新鲜的有机质中,它们往往无法起作用.这是因为并未经过发酵腐熟的堆肥物料中往往含有有毒有害物质,它们会影响作物生长且使它们提前感染病虫害.而向树皮堆肥中加入过腐熟的泥炭则会降低病害抑制能力,因为它们没有防治生物病害的能力.由此看来,未腐熟或过腐熟的堆肥都不利于对病原菌的抑制作用.
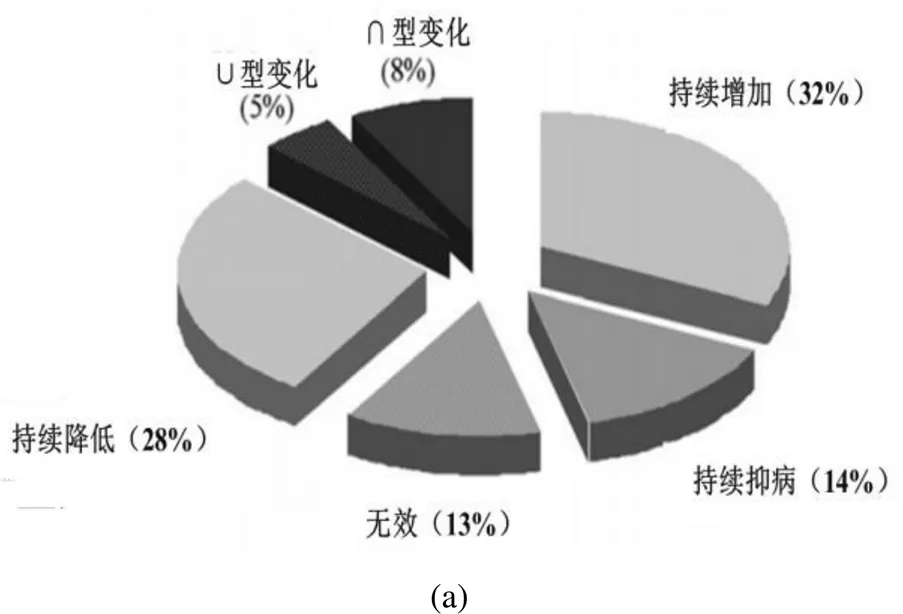
Bonanomi等[71]对部分有机物料的抑病性进行了归纳分析后,结果表明随物料的降解其抑病效果会表现出不同的变化趋势(如图1(a)所示),仅有46%的物料可以在应用过程中保证具有防治土传病原菌的效果,对这些物料进行降解程度与抑病效果相关关系的模拟,结果如图1(b)所示.未经过腐熟的作物秸秆和有机废弃物的抑病效果可正可负,与物料类别有关,而随腐熟时间的增加,表现为诱导致病的比例越来越小,而抑病效果逐渐增加,据此判断我国通常为数周到数月的堆肥周期所得的堆肥产品应该表现出良好的抑病效果,相比欧美堆肥周期较长的产品效果更佳.
有机物质降解过程还会产生对病原菌有毒的挥发性物质来抑制土传病害的发生[72],向土壤中添加十字花科蔬菜的菜渣可抑制豌豆根腐病,因为菜渣分解过程中释放的硫醇、硫化氢等气体能够抑制病原菌[73].具有类似作用的物质,如大蒜废弃物等也被证实具有抑制病原菌的效果[74],这与其所蕴含的功能性组分密不可分.
腐殖质含量的差异是影响堆肥抑病效果的重要因素,因为腐殖质的主要成分腐殖酸具有很高的离子交换容量,它们能吸纳金属离子、氧化物和氢氧化物,并在植物需要时慢慢连续地释放出来,还可以作为生物催化剂和生物刺激素促进植物生长以及增强作物抗逆性[26].不同堆肥产品的腐殖酸中可能含有其特殊的功能型成分或结构,或具有特殊功能的官能团,如羧基碳、酚羟基碳等,亟需进一步探索和确定[75].
综上所述,堆肥中有机质的降解程度和腐殖化程度显著影响着堆肥的抑病效果,而堆肥物料中不同的有机组分和堆肥工艺参数等会导致有机质降解程度的差异,进而影响达到堆肥腐熟的时间,而发酵时间又是影响堆肥微生物的关键因素,因此推测堆肥产品抑病效果不稳定的原因可能与其腐熟度不同有关,但如何通过发酵程度来预判堆肥抑病效果仍需进一步明确.
2.4 堆肥过程中微生物的演替
通常来说,抑制不同植物病害的微生物种群可以被分为竞争性的腐生菌和兼性植物共生体或兼性重寄生生物,这些微生物可以以死亡的植物体为食物,在新的植物体中生存并表达抗性基因[45].堆肥过程恰好提供了这些微生物生长繁殖的理想化环境条件,将堆肥中的有益微生物补充到土壤中以提高对土传病原菌的抑制有望成为一种较好的策略[48],堆肥过程微生物种群随有机质组分和温度的变化而演替,主要分为三个阶段(1)升温阶段,堆肥初期阶段,堆体温度逐步从环境温度上升到45℃左右,主导微生物以嗜温性微生物为主,主要包括假单胞菌属()、克雷伯氏菌属()与芽孢杆菌属()等[76],假单胞菌属是重要的解脂肪菌,芽孢杆菌属则有降解蛋白质、淀粉的功能,它们是堆肥过程中易降解有机物的主要分解者.在堆肥的升温阶段,微生物主要分解底物以糖类和淀粉类为主;(2)高温阶段:堆温升至45℃以上,嗜温微生物活性受到抑制,嗜热微生物上升为主导微生物,堆肥中残留的和新形成的可溶性有机物质继续被氧化分解,复杂的有机物如蛋白质等也开始被强烈分解.通常50℃左右最活跃的是嗜热性真菌和放线菌,温度上升到60℃时真菌几乎停止活动,仅有嗜热性细菌和放线菌活动,其中多数为杆菌,如芽孢杆菌属(),因能形成很厚的孢子壁而能耐受高温、腐烛、营养物缺乏等不良环境条件,真菌和放线菌在温度高达75℃时很少存活[77];(3)降温阶段:温度逐渐降低,嗜温微生物又开始占据优势,对残余较难分解的有机物作进一步的分解,有机物趋于稳定化,堆肥进入腐熟或后熟阶段.
堆肥产生抑病效果的主要原因是微生物,而堆肥过程中不同时期微生物种群具有较大差异,可能会直接影响抑病效果;随着堆肥过程中微生物的演替,有机质进行降解、腐熟程度增加,不同微生物分解的底物不同,造成堆肥中有机组分的变化,而腐熟程度和物料均会引起抑病效果的改变.

图3 堆肥过程中微生物种群随温度的变化过程
2.5 其他因素
虽然微生物作用是堆肥抑制病原菌的主要机理,但是堆肥抑病并非全是由于微生物间的直接作用,还包括非生物作用,Milinković等[78]对堆肥茶进行杀菌后,其对病原菌的抑制效果降低但并没有完全失去抑制效果.表明抑制机制的复杂性,包括生物和化学成分的作用.Varo-Suárez等[79]发现堆肥释放的挥发性化合物会能够抑制黄萎病菌()的菌丝体生长,其中家禽粪便堆肥甚至能够产生杀菌作用,而不是简单的抑菌,可能是由于堆肥产生了类似于熏蒸剂的抗菌作用[80].堆肥中含有的酚类和挥发性有机酸等化合物及其一些降解产物对各种土传病原体表现出杀真菌活性,酚类是一类植物次生代谢产物,含有一个或多个苯环羟基衍生物,广泛分布于植物体内,参与宿主防御反应[72],在许多宿主-病原体相互作用中表现出抗菌特性[81-82],并在宿主防御感应和防御触发中发挥关键作用[83].
3 堆肥施用过程对其抑病效果的影响
3.1 堆肥施用方式
堆肥施用方式主要有直接施用和以堆肥茶的形式施用,经过二次发酵的堆肥茶可最大化地提取堆肥中功能性物质和养分,并促进有益微生物菌群的扩增繁殖,表现出更好的抗病、促生和营养功能,De Corato等[84]将植物废弃物堆肥的提取液加入到城市固体废弃物堆肥中以提高抑病效果, Milinković等[78]将堆肥和水以1:3的体积混合制备堆肥茶,经过曝气制备的堆肥茶显著提高了对立枯丝核菌的抑制作用.可能是因为在堆肥茶的制备过程中,腐殖质和营养物质含量增加,腐殖质能够促进植物生长和抑制植物病害[85].因此,堆肥的施用方式应根据作物对养分的需求、施肥方式及所用肥料的搭配方式等建立.
3.2 堆肥施用周期及施用量
堆肥施用于土壤后,其抑病作用持续的时间不同,因此使用周期会影响抑病效果,Tubeileh[86]研究发现,四种农业废弃物堆肥堆病原菌的抑制作用在前两周最强,其中牛粪堆肥施用八周后抑病效果消失,葡萄渣堆肥、橄榄渣牛粪混合堆肥和作物残渣堆肥施用十四周后抑病效果消失,也有研究表明,牛粪堆肥对三种植物病害的抑制作用持续了两个月[87].将低氮素含量的树皮或园林废弃物堆肥按每公顷500~750m3投加到观赏作物的种植园,与15~20cm表层土壤混匀,可以达到良好的防治土传病原菌,减少化学农药投入的效果,这种方法自1970年代开始在美国广泛应用.将高氮堆肥,如畜禽粪便堆肥,按照每公顷250m3投加到10cm的表层土壤中,可以有效促进木本植物发芽和草坪草生长.Abdel-Razzak等[88]施用不同比例的番茄废弃物堆肥(TWC)并对番茄、辣椒、黄瓜和西葫芦等经济蔬菜的幼苗质量进行了评价,结果表明添加5%和10% TWC的混合基质能促进种子萌发,改善幼苗形态;Rashwan等[89]研究发现10%和15%的TWC能够提高番茄和西葫芦产量. Pugliese等[90]施加20%堆肥显著降低了发病率,促进了植株发育.为避免堆肥施用可能对作物产生的铵态氮毒害或其它问题,应将其在种植作物前几周时施入土壤,使堆肥中的铵态氮可以被土壤有机组分吸附或被微生物转化为硝态氮,若畜禽粪便堆肥施入的土壤中将种植敏感性作物,应提前几个月施入避免造成危害.
3.3 外源微生物
堆肥中经常通过添加外源微生物作为功能微生物来提高抑病效果,添加堆肥的基质中的微生物群体就起到了生物防控添加剂的作用.被广泛研究的微生物类别包括细菌中的假单胞菌、芽孢杆菌、伯克霍尔德菌和溶杆菌等,真菌中的木霉和非致病性的病原菌等[91].假单胞菌的生防机制包括:噬铁素对铁的营养竞争[92]、有效的根际定殖[93]、抗生素作用[94]和诱导植物系统抗性[95]等;生防用芽胞杆菌包括枯草芽孢杆菌[96]、多粘类芽胞杆菌和蜡状芽孢杆菌等[97-99],通过分泌抗菌物质抑制病原菌生长、与病原菌竞争营养和侵染位点、诱导植物产生系统抗病性等达到生物防治的目的,Tao等[37]在有机肥和灭菌有机肥中加入芽孢杆菌,其对香蕉枯萎病的抑病率均显著高于未接种芽孢杆菌的有机肥,能够引起土壤中微生物群落如假单胞菌的特定变化,通过与这种特定的假单胞菌的积极相互作用提高抑病效果;含有木霉及其代谢产物的生防菌剂占生防菌剂总量的60%以上[100],木霉能通过与病原菌竞争、增加内生菌等抑制植物病害[95],应用最多的哈茨木霉能够产生几丁质酶、葡聚糖酶和蛋白酶等物质,通过降解病原菌的细胞壁等达到拮抗丝核菌属、核盘菌属、镰刀菌属、腐霉属和疫霉属等土传病原菌的作用[101-104].除此之外,噬菌体也因为能够裂解病原菌而有望作为一种新的生物防治剂[105].但大多添加外源微生物并不能直接抑制病原菌,存在定殖难的问题,而是通过影响堆肥进程和土壤微生物群落来发挥抑病效果.

表1 堆肥中常用生防菌剂及其功效
除被广泛研究的主要生防菌外,非致病性的病原菌如非致病性的尖孢镰刀菌,存在于几乎所有应用堆肥的农业土壤中,作为植物内生菌生存在植物体内,且不会对植物产生病害[30].非致病病原菌具有与病原菌相同或者相似的特点,不仅不会致病,而且可能会竞争相同的生态位、诱导植物产生抗性等来抑制病原菌,在堆肥防治土传病害中也发挥了重要的作用[106].黄春艳采用分子生物学技术手段获得缺陷型病原菌,还通过高温灭菌得到灭活菌丝体,加入西瓜连做土壤后,显著提高了对西瓜枯萎病的抑制效果,提高西瓜的产量[107];类似地,Varo等[108]加入非致病尖孢镰刀菌FO12,产生了较好的抑病效果.但Varo-Suárez等[79]在堆肥中加入非致病尖孢镰刀菌并没有增强抑病效果,可能是因为人为接种的病原菌浓度显著高于自然条件下受到感染的病原菌浓度,过高的病原菌浓度导致非治病病原菌并未表现出抑病效果.除了非致病尖孢镰刀菌外,堆肥中的木霉、芽孢杆菌、哈兹木霉、解淀粉芽孢杆菌也已经被证明具有抑病效果(表1),但国内外筛选出的堆肥中主要抑病菌多是单一菌株,且鲜有将所得微生物菌株再次添加到堆肥中的研究,若可以解决所筛微生物在堆肥过程的定植、高温演替对微生物的影响,施入土壤后在土壤定植等一系列问题,将堆肥中微生物中的两种或三种复合使用,使其在抑制土传病原菌时协同作用,对于提高堆肥抑病的稳定性具有重要意义.
3.4 土壤自身性质
堆肥作为一种土壤调理剂施用于土壤,可以调节土壤理化性质,改良土壤环境,施用的土壤的性质影响着堆肥的抑病效果,Watson等[114]将七种堆肥加入到三种不同土壤中,均能够对果树起到抑病促生的作用,但不同土壤加入堆肥后对植物生长的影响存在差异,Watson认为应进一步研究不同土壤与不同堆肥直接诱导植物生长的差异性,而植物病害的发生频率和严重程度与土壤肥力密切相关,缺乏养分或根际养分过剩都会导致植物易被病原菌侵袭,表现最明显的养分为氮素,因为在堆肥过程中氮素最易发生转化为无机氮并对植物疾病产生较大影响.无机氮含量较高的堆肥可能会加重某些植物病害如细菌性叶斑病和枯萎病等的发生,畜禽粪便堆肥总氮含量一般占干重的1.7%~2.5%,不添加辅料进行堆肥时可能会超过4%,这些氮素中有超过90%为植物不可直接利用的氮素,在施入土壤后的前3个月有超过30%的氮素会被转化为无机氮素,若此时土壤中有植物生长,某些植物疾病就会迅速爆发.肥料中高铵态氮低硝态氮的特点会加重镰刀菌引发的枯萎病,即使是在水培条件下也会有这种现象发生,而未腐熟的堆肥中通常含有较高的铵态氮含量,这势必会影响堆肥抑病的效果.可利用氮素含量较低的未腐熟堆肥施用到土壤中后,用于降解物料中有机质的微生物大量生长繁殖,造成植物可用氮素缺乏,此时病原菌极易侵袭植物根系.与之相对应,含有较低铵态氮养分的树皮堆肥和园林废弃物堆肥等表现出良好的抑病功效,这种效果在堆肥配合木霉属菌株使用时效果更加显著.因此在施用堆肥时要特别注意土壤中养分含量、施用堆肥的腐熟度、养分含量和播种植物类别.
堆肥施用方式、施用周期及施用量、外源微生物土壤本身性质等影响着堆肥抑病效果,因为施入土壤后对土壤微生物和根际微生物的种群、结构和多样性及抑病作用都产生了较大影响,堆肥抑病关系到外源微生物、堆肥、土壤和植物这样一个复杂的体系.
4 结语
堆肥化处理可以实现废弃物资源的减量化和无害化,并得到具有一定抑病效果的堆肥产品.堆肥应用在农田、果园、草坪或菜地中有助于实现农业绿色发展、降低环境风险的目的.尽管堆肥在提高土壤抑病能力方面具有很大潜力,但抑病效果受到许多因素影响,难以在实际生产中大面积推广应用.堆肥物料和生产工艺的差别会在一定程度上影响其对土传病原菌的防治作用,降低对土传病害的防控效果;堆肥中发挥抑病作用的微生物种群在植物表面或根区土壤中适用性不佳,不足以与土著微生物或病原菌竞争养分或空间,难以进一步生长繁殖并发挥抑病作用;缺乏适宜的施用方法和技术,不能发挥预期作用.针对不同的施用作物,其对有机肥的需求量和需求时段存在差异,盲目施用堆肥不仅不会提高抑病效果,还可能因养分供应不适宜而增加发病的风险.
基于现有的研究进展和我国的现状,堆肥的应用在抑制植物病害方面所发挥的作用和功能总体上已经取得了一定的进展,但堆肥防治土传病原菌的研究不应只关注某一种堆肥对某一种病害的抑制效果,应进一步规范我国堆肥生产工艺和产品性状,探究堆肥产品性质与植物和病原菌之间的相关性及其作用机理,明确发挥最佳抑病效果的堆肥施用工艺和使用量,构建具有较好效果的、稳定的抑病堆肥体系;探明堆肥对土壤微生物招募作用,如不同种类的堆肥、土壤、作物对根际微生物组的结构和功能的影响,提高堆肥产品中具有抑病活性的有益微生物的种类、活性和数量,对堆肥或土壤中的微生物群落及其抑制土传病原菌的作用机制、微生物群落变量与堆肥主要理化性质之间的关系等有待于进一步的研究,并根据作物特点确定具有针对性的堆肥施用方案,有助于提高堆肥的抑病效果,促进绿色农业发展.
[1] Mehta C M, Palni U, Franke-Whittle I H, et al. Compost: Its role, mechanism and impact on reducing soil-borne plant diseases [J]. Waste Management, 2014,34(3):607-622.
[2] Noble R, Coventry E. Suppression of soil-borne plant diseases with composts: a review [J]. Biocontrol Science and Technology, 2005, 15(1):3-20.
[3] Pervaiz Z H, Iqbal J, Zhang Q, et al. Continuous cropping alters multiple biotic and abiotic indicators of soil health [J]. Soil Systems, 2020,4(4):59.
[4] Fernando W G D, Nakkeeran S, Zhang Y, et al. Biological control of Sclerotinia sclerotiorum (Lib.) de Bary by Pseudomonas and Bacillus species on canola petals [J]. Crop Protection, 2007,26(2):100-107.
[5] Bakker P A H M, Bakker A W, Marugg J D, et al. Bioassay for studying the role of siderophores in potato growth stimulation by Pseudomonas spp in short potato rotations [J]. Soil Biology and Biochemistry, 1987,19(4):443-449.
[6] Lillywhite R D, Dimambro M E, Rahn C R. Effect of five municipal waste derived composts on a cereal crop [J]. Compost Science & Utilization, 2009,17(3):173-179.
[7] Yu Z, Zeng G M, Chen Y N, et al. Effects of inoculation with Phanerochaete chrysosporium on remediation of pentachlorophenol- contaminated soil waste by composting [J]. Process Biochemistry, 2011,46(6):1285-1291.
[8] Noble R, Roberts S J. Eradication of plant pathogens and nematodes during composting: a review [J]. Plant Pathology, 2004,53(5):548- 568.
[9] Termorshuizen A J, Van Rijn E, Van Der Gaag D J, et al. Suppressiveness of 18 composts against 7 pathosystems: Variability in pathogen response [J]. Soil Biology and Biochemistry, 2006,38(8): 2461-2477.
[10] Du N, Shi L, Yuan Y, et al. Isolation of a potential biocontrol agent Paenibacillus polymyxa NSY50 from vinegar waste compost and its induction of host defense responses against Fusarium wilt of cucumber [J]. Microbiological Research, 2017,202:1-10..
[11] De Corato U, Viola E, Arcieri G, et al. Use of composted agro-energy co-products and agricultural residues against soil-borne pathogens in horticultural soil-less systems [J]. Scientia Horticulturae, 2016,210: 166-179.
[12] 韩 超.堆肥提取液对草莓黄萎病的防治效果及其机制研究 [D]. 太原:山西大学,2017.
Han C. Biocontrol effect of compost extracts on strawberry verticillium wilt and corresponding mechanism [D]. Taiyuan: Shanxi University, 2017.
[13] 毕延刚,田永强.堆肥和枯草芽孢杆菌协同调控黄瓜幼苗生长的机制探究[J]. 中国农学通报, 2015,31(28):71-78.
Bi Y G, Tian Y Q. Mechanism Exploration of the coordinated regulation effects of compost andon cucumber seedling growth [J]. Chinese Agricultural Science Bulletin, 2015,31 (28):71-78.
[14] Litterick A, Wood M. The use of composts and compost extracts in plant disease control [J]. Disease control in crops: Biological and environmentally friendly approaches, 2009:93-121.
[15] De Brito A M, Gagne S, Antoun H. Effect of compost on rhizosphere microflora of the tomato and on the incidence of plant growth- promoting rhizobacteria [J]. Applied and Environmental Microbiology, 1995,61(1):194-199.
[16] Elad Y, Baker R. Influence of trace amounts of cations and siderophore-producing pseudomonads on chlamydospore germination of Fusarium oxysporum [J]. Phytopathology, 1985,75(9):1047-1052.
[17] Haas D, Défago G. Biological control of soil-borne pathogens by fluorescent pseudomonads [J]. Nature reviews. Microbiology, 2005, 3(4):307.
[18] Chernin L, Ismailov Z, Haran S, et al. Chitinolytic enterobacter agglomerans antagonistic to fungal plant pathogens [J]. Applied and Environmental Microbiology, 1995,61(5):1720-1726.
[19] Silo-Suh L A, Lethbridge B J, Raffel S J, et al. Biological activities of two fungistatic antibiotics produced by Bacillus cereus UW85 [J]. Applied and Environmental Microbiology, 1994,60(6):2023-2030.
[20] Milner J L, Silo-Suh L, Lee J C, et al. Production of kanosamine by Bacillus cereus UW85 [J]. Applied and Environmental Microbiology, 1996,62(8):3061-3065.
[21] Ajith P S, Lakshmidevi N. Zygosporium masonii: a new fungal antagonist against Colletotrichum capsici incitant of anthracnose on bellpeppers [J]. Journal of Agricultural Technology, 2012,8(3):931- 939.
[22] Heydari A, Pessarakli M. A review on biological control of fungal plant pathogens using microbial antagonists [J]. Journal of Biological Sciences, 2010,10(4):273-290.
[23] Pal K K, Gardener B M S. Biological control of plant pathogens [J]. The plant health instructor, 2006,2:1117-1142.
[24] Diánez F, Santos M, Tello J C. Suppression of soilborne pathogens by compost: suppressive effects of grape marc compost on phytopathogenic oomycetes [C]//International Symposium on Soilless Culture and Hydroponics 697. 2004:441-460.
[25] Chet I, Baker R. Induction of suppressiveness toin soil [J]. Phytopathology, 1980,70(10):994-998.
[26] Kuter G A, Nelson E B, Hoitink H A J, et al. Fungal populations in container media amended with composted hardwood bark suppressive and conducive to Rhizoctonia damping-off [J]. Phytopathology, 1983, 73(10):1450-1456.
[27] Kiss L. A review of fungal antagonists of powdery mildews and their potential as biocontrol agents [J]. Pest Management Science, 2003, 59(4):475-483.
[28] Sutherland E D, Papavizas G C. Evaluation of oospore hyperparasites for the control of Phytophthora crown rot of pepper [J]. Journal of Phytopathology, 1991,131(1):33-39.
[29] Vallad G E, Goodman R M. Systemic acquired resistance and induced systemic resistance in conventional agriculture [J]. Crop Science, 2004,44(6):1920-1934.
[30] De Meyer G, Höfte M. Salicylic acid produced by the rhizobacterium7NSK2 induces resistance to leaf infection by Botrytis cinerea on bean [J]. Phytopathology, 1997,87(6):588-593.
[31] Zhang W, Dick W A, Hoitink H A J. Compost-induced systemic acquired resistance in cucumber to Pythium root rot and anthracnose [J]. Phytopathology, 1996,86(10):1066-1070.
[32] Van Loon L C, Bakker P, Pieterse C M J. Systemic resistance induced by rhizosphere bacteria [J]. Annual Review of Phytopathology, 1998, 36(1):453-483.
[33] Kavroulakis N, Papadopoulou K K, Ntougias S, et al. Cytological and other aspects of pathogenesis-related gene expression in tomato plants grown on a suppressive compost [J]. Annals of Botany, 2006, 98(3):555-564.
[34] Sang M K, Kim K D. Biocontrol activity and primed systemic resistance by compost water extracts against anthracnoses of pepper and cucumber [J]. Phytopathology, 2011,101(6):732-740.
[35] 王 宁,李蕙秀,李 季,等.堆肥调控作物根际微生物组抑制植物病害的研究进展 [J]. 生物技术通报, 2022,38(5):4-12.
Wang N, LI H X, LI J, et al. Advances in compost regulation of rhizospheric microbiome to suppress plant diseases [J]. Biotechnology Bulletin, 2022,38(5):4-12.
[36] Shen Z, Ruan Y, Wang B, et al., Effect of biofertilizer for suppressing Fusarium wilt disease of banana as well as enhancing microbial and chemical properties of soil under greenhouse trial. Applied Soil Ecology, 2015, 93:111-119.
[37] Tao C, Li R, Xiong W, et al. Bio-organic fertilizers stimulate indigenous soil Pseudomonas populations to enhance plant disease suppression [J]. Microbiome, 2020,8(1):137:https:doi.org/10.1186/ S40168-020-00892-Z.
[38] Zhen Z. Effects of manure compost application on soil microbial community diversity and soil microenvironments in a temperate cropland in China. PloS one, 2014,9(10):e108555.
[39] Castaño R, Borrero C, Avilés M. Organic matter fractions by SP-MAS 13C NMR and microbial communities involved in the suppression of Fusarium wilt in organic growth media [J]. Biological Control, 2011,58(3):286-293.
[40] 蔡燕飞,廖宗文,章家恩,等.生态有机肥对番茄青枯病及土壤微生物多样性的影响[J]. 应用生态学报, 2003,14(3):349-353.
Cai Y F, Liao Z W, Zhang J E, et al. Effect of ecological organic fertilizer on tomato bacterial wilt and soil microbial diversities [J]. Chinese Journal of Applied Ecology, 2003,14(3):349-353.
[41] Schreiter S, Ding G C, Grosch R, et al. Soil type-dependent effects of a potential biocontrol inoculant on indigenous bacterial communities in the rhizosphere of field-grown lettuce [J]. FEMS Microbiol. Ecol., 2014,90(3):718-730.
[42] Pane C, Spaccini R, Piccolo A, et al. Disease suppressiveness of agricultural greenwaste composts as related to chemical and bio-based properties shaped by different on-farm composting methods [J]. Biological Control, 2019,137:104026.
[43] De Corato U, Patruno L, Avella N, et al. Composts from green sources show an increased suppressiveness to soilborne plant pathogenic fungi: Relationships between physicochemical properties, disease suppression, and the microbiome [J]. Crop Protection, 2019,124: 104870.
[44] Pane C, Sorrentino R, Scotti R, et al. Alpha and beta-diversity of microbial communities associated to plant disease suppressive functions of on-farm green composts [J]. Agriculture, 2020,10(4):113.
[45] Vitullo D, Altieri R, Espasito A, et al. Suppressive biomasses and antagonist bacteria for an eco-compatible control of Verticillium dahliae on nursery-grown olive plants [J]. International Journal of Environmental Science and Technology, 2013,10(2):209-220.
[46] Erhart E, Burian K, Hartl W, et al. Suppression ofby biowaste composts in relation to compost microbial biomass, activity and content of phenolic compounds [J]. Journal of Phytopathology, 1999,147(5):299-305.
[47] Avilés, M. and C. Borrero, identifying characteristics of verticillium wilt suppressiveness in olive mill composts [J]. Plant Disease, 2017, 101(9):p.1568-1577.
[48] Li X, Wang X, Shi X, et al. Compost tea-mediated induction of resistance in biocontrol of strawberry Verticillium wilt. Journal of Plant Diseases and Protection, 2020,127(2):257-268.
[49] St. Martin C C G, Brathwaite R A I. Compost and compost tea: Principles and prospects as substrates and soil-borne disease management strategies in soil-less vegetable production [J]. Biological agriculture & horticulture, 2012,28(1):1-33.
[50] 常瑞雪,王 骞,甘晶晶,等.易降解有机质含量对黄瓜秧堆肥腐熟和氮损失的影响 [J]. 农业工程学报, 2017,33(1):231-237.
Chang R X, Wang Q, Gan J J,,et al. Influence of easily-degraded organic matter content on maturity and nitrogen loss during composting of cucumber vine. Transactions of the Chinese Society of Agricultural Engineering, 2017,33(1):231-237.
[51] 李文圣.不同组群奶牛粪便堆积过程中温室气体排放及碳氮转化规律 [D]. 杨凌:西北农林科技大学, 2015.
Li W S. Emissions of greenhouse gas and transformations of substance during dairy manure compsoting [D]. Yangling: Northwest Agriculture and Forestry University, 2015.
[52] 贾利元,张淑红,张恩平,等.苦参提取物对茄子黄萎病菌的化感效应研究初报[J]. 中国蔬菜, 2012,(4):43-47.
Jia L Y, Zhang S H, Zhang E P, et al. Preliminary studies about allelopathic effect ofextracts onof eggplant [J]. China Vegetables, 2012,(4):43-47.
[53] 李春霄.两种药用植物残渣堆肥对黄瓜生长及其病害发展的影响 [D]. 杨凌:西北农林科技大学, 2008.
Li C X. Effect of the pesticide plants refuse compost ofandon growth and diseases development of cucumber [D]. Yangling: Northwest Agriculture and Forestry University, 2008.
[54] 张建华,郭玉双,田光明,等.三种堆肥对番茄生长及青枯病防治效果的影响[J]. 植物营养与肥料学报, 2012,18(5):1185-1192.
Zhang J H, Guo Y S, Tian G M, et al. Effects of three composts on growth and bacterial wilt of tomato [J]. Plant Nutrition and Fertilizer Science, 2012,18(5):1185-1192.
[55] Greff, B, et al. Co-composting with herbal wastes: Potential effects of essential oil residues on microbial pathogens during composting [J]. Critical Reviews in Environmental Science and Technology, 2021,51(5):457-511.
[56] Du N, Shi L, Du L, et al. Effect of vinegar residue compost amendments on cucumber growth and Fusarium wilt [J]. Environmental Science and Pollution Research, 2015,22(23):19133- 19141.
[57] Shi L, Du N, Yuan Y, et al. Vinegar residue compost as a growth substrate enhances cucumber resistance against thepathogenby regulating physiological and biochemical responses [J]. Environmental Science and Pollution Research, 2016,23(18):18277-18287.
[58] Papasotiriou F G, Varypatakis K G, Christofi N, et al. Olive mill wastes: a source of resistance for plants againstand a reservoir of biocontrol agents [J]. Biological Control, 2013,67(1): 51-60.
[59] Cuesta G, García-de-la-Fuente R, Abad M, et al. Isolation and identification of actinomycetes from a compost-amended soil with potential as biocontrol agents [J]. Journal of Environmental Management, 2012,95:S280-S284.
[60] Siddiqui Y, Meon S, Ismail M R, et al. Trichoderma-fortified compost extracts for the control of choanephora wet rot in okra production [J]. Crop Protection, 2008,27(3):385-390.
[61] Spatafora C, Tringali C. Valorization of vegetable waste: Identification of bioactive compounds and their chemo-enzymatic optimization [J]. Open Agric. J., 2012,6:9-16.
[62] Chang R, Li Y, Li N, et al., Effect of microbial transformation induced by metallic compound additives and temperature variations during composting on suppression of soil-borne pathogens [J]. Journal of Environmental Management, 2021,279:111816.
[63] Borrero C, Trillas M I, Ordovás J, et al. Predictive factors for the suppression of Fusarium wilt of tomato in plant growth media [J]. Phytopathology, 2004,94(10):1094-1101.
[64] Segarra G, Casanova E, Avilés M, et al. Trichoderma asperellum strain T34 controls Fusarium wilt disease in tomato plants in soilless culture through competition for iron [J]. Microbial Ecology, 2010,59(1):141- 149.
[65] Cotxarrera L, Trillas-Gay M I, Steinberg C, et al. Use of sewage sludge compost and Trichoderma asperellum isolates to suppress Fusarium wilt of tomato [J]. Soil Biology and Biochemistry, 2002, 34(4):467-476.
[66] Hoitink H, Ramos L. Impacts of compost on soil and plant health [J]. Ohio State University, Wooster, OH, USA, 2008.
[67] 漆艳香,张 欣,蒲金基,等.10种化合物对香蕉枯萎病菌的抑菌作用及对毒素钝化的效果[J]. 果树学报, 2008,(1):78-82.
Qi Y X, Zhang X, Pu J J, et al. Inactivation effect of 10 compounds onf. sp. cubense [J]. Journal of Fruit Science, 2008,(1):78-82.
[68] 龙 翔,李文庆.有机肥对植物土传病害控制的研究[J]. 北方园艺, 2009,(7):132-136.
Tang L X, Li W Q. Studies on plant soil borne disease control with manure [J]. Northern Horticulture, 2009,(7):132-136.
[69] 林春花,彭建华,刘先宝,等.10种无机盐对橡胶树多主棒孢病菌的抑菌作用及对粗毒素的钝化[J]. 热带作物学报, 2010,31(7):1143- 1147.
Lin C H, Peng J H, Liu X B, et al. Inactivation effect of 10 compounds onand its toxin [J]. Chinese Journal of Tropical Crops, 2010,31(7):1143-1147.
[70] De Ceuster T J J, Hoitink H A J. Prospects for composts and biocontrol agents as substitutes for methyl bromide in biological control of plant diseases [J]. Compost Science & Utilization, 1999,7(3):6-15.
[71] Bonanomi G, Antignani V, Capodilupo M, et al. Identifying the characteristics of organic soil amendments that suppress soilborne plant diseases [J]. Soil Biology and Biochemistry, 2010,42(2):136- 144.
[72] Jain A, Singh A, Singh S, et al., Phenols enhancement effect of microbial consortium in pea plants restrains[J]. Biological Control, 2015,89:23-32.
[73] 郝永娟,王万立,刘耕春,等.土壤添加剂防治作物土传病害研究概述[J]. 天津农业科学, 2000,6(2):52-54.
Hao Y J, Wang W L, Liu G C, et al. The review of soil amendment to control soil-borne diseases [J]. Tianjin Agricultural Sciences, 2000, 6(2):52-54.
[74] Candole B L, Rothrock C S. Characterization of the suppressiveness of hairy vetch-amended soils to[J]. Phytopathology, 1997,87(2):197-202.
[75] 高晓荔,宋永辉,胡林潮,等.大蒜废弃物对农作物病原菌的抑制效果[J]. 农业环境科学学报, 2012,31(1):192-199.
Gao X L, Song Y H, Hu L C, et al. Inhibitory effects of garlic waste on pathogenic microorganisms of corps [J]. Journal of Agro- Environment Science. 2012,31(1):192-199.
[76] 柴晓利,张 华,赵由才.固体废物堆肥原理与技术[M]. 北京:化学工业出版社环境科学与工程出版中心, 2005.
Chai X, Zhang H, Zhao Y, et al. Solid waste composting principle and technology [M]. Beijing: Chemical Industry Press, 2005.
[77] Beffa T, Blanc M, Lyon P F, et al. Isolation of Thermus strains from hot composts (60 to 80 degrees C) [J]. Applied and Environmental Microbiology, 1996,62(5):1723-1727.
[78] Milinković M, Lalević B, Jovičić-Petrović J, et al. Biopotential of compost and compost products derived from horticultural waste—Effect on plant growth and plant pathogens' suppression [J]. Process Safety and Environmental Protection, 2019,121:299-306.
[79] Varo-Suárez A, Raya-Ortega M C, Agustí-Brisach C, et al. Evaluation of organic amendments from agro-industry waste for the control of verticillium wilt of olive [J]. Plant Pathology, 2018,67(4): 860-870.
[80] Yangui T, Sayadin S, Gargoubi A, et al. Fungicidal effect of hydroxytyrosol-rich preparations from olive mill wastewater against Verticillium dahliae [J]. Crop Protection, 2010,29(10):1208-1213.
[81] Hammerschmidt R. Phenols and plant–pathogen interactions: the saga continues [J]. Physiological and Molecular Plant Pathology, 2005, 66:77–8.
[82] Obied H K, Allen M S, Bedgood D R, et al. Bioactivity and analysis of biophenols recovered from olive mill waste [J]. Journal of Agricultural and Food Chemistry, 2005,53:2–7.
[83] Beckman C H. Phenolic-storing cells: Keys to programmed cell death and periderm formation in wilt disease resistance and in general defence responses in plants [J]. Physiological and Molecular Plant Pathology, 2000,57(1):1–10.
[84] De Corato U, Salimbeni R, De Pretis A, et al. Microbiota from ‘next-generation green compost’ improves suppressiveness of composted Municipal-Solid-Waste to soil-borne plant pathogens [J]. Biological Control, 2018,124:1-17.
[85] Gholami H, et al. Humic acid and vermicompost increased bioactive components, antioxidant activity and herb yield of Chicory (Cichorium intybus L.). Biocatalysis and Agricultural Biotechnology, 2018,14: 286-292.
[86] Tubeileh A M, Stephenson G T. Soil amendment by composted plant wastes reduces theabundance and changes soil chemical properties in a bell pepper cropping system [J]. Current Plant Biology, 2020,22:100148.
[87] Darby H M, Stone A G, Dick R P. Compost and manure mediated impacts on soilborne pathogens and soil quality [J]. Soil Science Society of America Journal, 2006,70(2):347-358.
[88] Abdel-Razzak H, Alkoaik F, Rashwan M, et al. Tomato waste compost as an alternative substrate to peat moss for the production of vegetable seedlings [J]. Journal of Plant Nutrition, 2019,42(3):287-295.
[89] Rashwan M A, et al. Influence of tomato waste compost ratios on plant growth and fruit quality of cucumber and summer squash [J]. J. Air Waste Manag. Assoc., 2021,71(9):1067-1075.
[90] Pugliese M, Gullino M L, Garibaldi A. Use of compost to partially substitute non-renewable growing media and suppress soil-borne pathogens on potted vegetable plants [J]. Acta Horticulturae, 2020, (1270):p.263-266.
[91] Castaño R, Borrero C, Avilés M. Organic matter fractions by SP-MAS 13C NMR and microbial communities involved in the suppression of Fusarium wilt in organic growth media [J]. Biological Control, 2011, 58(3):286-293.
[92] 王 平,李 慧,邱译萱,等.荧光假单胞菌株P13分泌铁载体抑制油菜菌核病菌[J]. 上海师范大学学报(自然科学版), 2010,39(2):200- 203.
Wang P, Li H, Qiu Y X, et al. Siderophores produced by pseudomonas fluorescens P13 against sclerotinia selerotiorum [J]. Journal of Shanghai Normal University (Natural Sciences), 2010,39(2):200-203.
[93] Barahona E, Navazo A, Martínez-Granero F, et al. Pseudomonas fluorescens F113 mutant with enhanced competitive colonization ability and improved biocontrol activity against fungal root pathogens [J]. Applied and environmental microbiology, 2011,77(15):5412-5419.
[94] Almario J, Prigent-Combaret C, Muller D, et al. Effect of clay mineralogy on iron bioavailability and rhizosphere transcription of 2, 4-diacetylphloroglucinol biosynthetic genes in biocontrol[J]. Molecular plant-microbe interactions, 2013,26(5):566- 574.
[95] Diyansah B, Aini L Q, Hadiastono T. The effect of PGPR (plant growth promoting rhizobacteria) Pseudomonas fluorescens and Bacillus subtilis on leaf mustard plant (L.) infected by TuMV (turnip mosaic virus) [J]. Journal of Tropical Plant Protection, 2017,1(1):30-38.
[96] Rosmana A, Taufik M, Asman A, et al. Dynamic of vascular streak dieback disease incidence on susceptible cacao treated with composted plant residues andin field [J]. Agronomy, 2019,9(10):650.
[97] Reva O N, Dixeliu C, Meijer J, et al. Taxonomic characterization and plant colonizing abilities of some bacteria related to Baicllus amyloliquefaciens and Bacillus subtilis [J]. FEMS Microbiology Ecology, 2004,48(2):249-259.
[98] Tenover F C. Mechanisms of antimicrobial resistance in bacteria [J]. American Journal of Infection Control, 2006,34(5):S3-S10.
[99] Ongena M, Jacques P. Bacillus lipopeptides: versatile weapons for plant disease biocontrol [J]. Trends in Microbiology, 2008,16(3):115- 125.
[100] Zeilinger S, Gruber S, Bansal R, et al. Secondary metabolism in Trichoderma–Chemistry meets genomics [J]. Fungal Biology Reviews, 2016,30(2):74-90.
[101] 于 新,田淑慧,徐文兴,等.木霉菌生防作用的生化机制研究进展[J]. 中山大学学报(自然科学版), 2005,44(2):86-90.
Yu X, Tian S H, Xu W X, et al. Progress in the biochemical mechanisms of biocontrol effect research with trichoderma [J]. Acta Scientiarum Naturalium Universitatis Sunyatseni, 2005,44(2):86-90.
[102] Vinale F, Sivasithamparam K, Ghisalberti E L, et al. Trichoderma– plant–pathogen interactions [J]. Soil Biology and Biochemistry, 2008,40(1):1-10.
[103] Mukherjee M, Mukherjee P K, Horwitz B A, et al. Trichoderma– plant–pathogen interactions: advances in genetics of biological control [J]. Indian Journal of Microbiology, 2012,52(4):522-529.
[104] Mutawila C, Vinale F, Halleen F, et al. Isolation, production and in vitro effects of the major secondary metabolite produced by Trichoderma species used for the control of grapevine trunk diseases [J]. Plant Pathology, 2016,65(1):104-113.
[105] Sasaki R, Miyashita S, Ando S, et al. Isolation and characterization of a novel jumbo phage from leaf litter compost and its suppressive effect on rice seedling rot diseases [J]. Viruses, 2021,13(4):591.
[106] Larkin R P, Fravel D R. Effects of varying environmental conditions on biological control of Fusarium wilt of tomato by nonpathogenic Fusarium spp [J]. Phytopathology, 2002,92(11):1160-1166.
[107] 黄春艳.尖孢镰刀菌毒素缺陷型菌株的构建及其与灭活菌体防治西连作障碍的研究 [D]. 南京:南京师范大学, 2017.
Huang C Y. Targeted acquisition off.sp.niveum toxin-deficient strains and it with the inactivated mucelium’s effect on overcoming cintinuous cropping obstacle of watermelon [D]. Nanjing: Nanjing Normal University, 2017.
[108] Varo A, Moral J, Lozano-Tóvar M D, et al. Development and validation of an inoculation method to assess the efficacy of biological treatments against Verticillium wilt in olive trees [J]. Bio. Control, 2016,61(3):283-292.
[109] Rasool M, Akhter A, Soja G, et al. Role of biochar, compost and plant growth promoting rhizobacteria in the management of tomato early blight disease [J]. Scientific Reports, 2021,11(1):191-203.
[110] Yang X, Chen L, Yong X, et al. Formulations can affect rhizosphere colonization and biocontrol efficiency of Trichoderma harzianum SQR-T037against Fusarium wilt of cucumbers [J]. Biology and Fertility of Soils, 2011,47(3):239-248.
[111] Zhao Q, Dong C, Yang X, et al. Biocontrol of Fusarium wilt disease for Cucumis melo melon using bio-organic fertilizer [J]. Applied Soil Ecology, 2011,47(1):67-75.
[112] Trillas M I, Casanova E, Cotxarrera L, et al. Composts from agricultural waste and thestrain T- 34 suppressin cucumber seedlings [J]. Biological Control, 2006,39(1):32-38.
[113] Lang J, Hu J, Ran W, et al. Control of cottonand fungal diversity of rhizosphere soils by bio-organic fertilizer [J]. Biology and Fertility of Soils, 2012,48(2):191-203.
[114] Watson T T, Nelson L M, Forge T A. Preplant soil incorporation of compost to mitigate replant disease: soil biological factors associated with plant growth promotion in orchard soil [J]. Compost Science & Utilization, 2018,26(4):286-296.
Research on mechanism and influencing factors of control soil-borne diseases by compost.
LIU Jia-qi1,2, CHANG Rui-xue1,2*, LI Yan-ming1,2, LI Ji1,2*
(1.College of Resources and Environment sciences, China Agricultural University, Beijing 100193;2.Organic Recycling Institute (Suzhou), China Agricultural University, Suzhou 215100, China)., 2023,43(2):722~734
Soil-borne diseases are one of the main factors that restrict the development of agriculture. Improper control will cause huge economic losses. The application of compost to control soil-borne diseases is a simple and easy biological control method without secondary pollution, but it has not been widely used because of many influencing factors, unpredictable and unstable effects after application. Based on literature research, the paper summarizes the suppressive mechanism of compost and makes sure the important role of microorganisms in inhibiting soil-borne pathogens. The microbial dynamics during aerobic composting, the main microbial types with biocontrol effect and their effects on soil microorganisms were compared and analyzed, therefore the factors of compost itself and compost application which may affect the suppressive effect were obtained. Finally, the main problems in the application of composting technology were pointed out based on the research progress of the inhibition effect of composting on soil-borne diseases and the development status of composting industry in China.
compost;soil-borne diseases;influence factors;microorganisms;biocontrol
X705
A
1000-6923(2023)02-0722-13
刘佳琪(1999-),女,内蒙古赤峰人,中国农业大学硕士研究生,主要从事废弃物处理与资源化研究.
2022-07-13
北京市设施蔬菜创新团队项目(BAIC01-2022)
* 责任作者, 副教授, changrx@cau.edu.cn

