絮凝控制高浓度藻华对水质和植被恢复的影响
杨瑾晟,姜 磊,芦 津,陈开宁,谢三桃,张 民,史小丽*
絮凝控制高浓度藻华对水质和植被恢复的影响
杨瑾晟1,2,姜磊1,2,芦津1,2,陈开宁1,谢三桃3,张民1,史小丽1*
(1.中国科学院南京地理与湖泊研究所,湖泊与环境国家重点实验室,江苏 南京 210008;2.中国科学院大学,北京 100049;3.安徽省水利水电勘测设计研究总院有限公司,安徽 合肥 230088)
模拟了叶绿素a浓度为 1001.63μg/L的高浓度蓝藻水华,选用聚合氯化铝(PAC),氯化铁(FeCl3),阳离子淀粉-壳聚糖(CSC) 3种絮凝剂实施应急控藻,探究其对水质和沉水植被恢复的影响.研究发现, FeCl3和CSC处理后水体DO分别降至1.35, 0.61mg/L,氨氮则高达24.93, 45.74mg/L,引发水体持续的重度黑臭;相比之下, PAC处理后ORP、DO、氨氮明显改善,分别为-76.00mV、3.64mg/L、9.25mg/L,且优于空白处理的-140.43mV、2.34mg/L、13.10mg/L,水体重度黑臭持续时长从15d减少至4d,沉水植被恢复潜力提升,其中伊乐藻()的生物量显著增加,优于无藻华对照(<0.05); FeCl3和CSC处理未能缓解苦草(),伊乐藻受到的生长胁迫,甚至加剧了对伊乐藻的生长胁迫,且CSC处理显著抑制了伊乐藻的叶数,株高,生物量的增长(<0.05).结果表明,絮凝沉降可以快速控制湖滨带高浓度蓝藻水华,但可能会产生黑臭,应考虑增加曝气增氧等措施以缓解水质恶化,并选取合适的沉水植被进行生态修复,以期实现长效控藻目标.
湖滨带;絮凝控藻;高浓度藻华;水体黑臭;沉水植物恢复
湖泊富营养化及其蓝藻水华是全球范围内的重大水环境问题.蓝藻水华会对水生生态系统造成极大危害,甚至威胁饮用水安全[1-3].长期的野外原位观测表明,蓝藻能够快速增殖暴发水华,并在大型富营养化湖泊下风向湖滨带形成高浓度蓝藻水华[4].湖滨带作为与人类生产生活联系最紧密的区域,同时也是实施内源削减、水生植物修复的主要区域,对于富营养化水体的系统修复具有重要意义[5],受到湖泊管理者的高度重视.因此,有必要针对大型富营养化湖泊湖滨带高浓度藻华实施科学合理的应急防控方法,减轻可能产生的生态灾害,并促进湖泊的生态恢复.
目前较为常见的蓝藻水华应急防控方法可以分为物理、化学和生物方法.物理方法通常需要大量基础设施投资,仅在设备运行时能收到一定成效,对高浓度藻华的缓解显得乏力[6-7].以杀灭或抑制藻类生长为主的化学方法一般存在非特异性、持续时间短等问题[8-10].蓝藻水华产生的低DO环境极易导致非经典生物操纵的鲢鳙等滤食性鱼类死亡,微生物控藻方法目前亦缺少实际有效的运用案例[5].
相比之下,利用低剂量的天然或化学改性混凝剂或粘土,通过絮凝、沉淀过程,被证实可以应急控制藻华或原位固定水体中磷[5].国内外已有较多运用铝、铁等传统金属盐类,或阳离子淀粉、壳聚糖等可生物降解的天然药剂实现应急控藻的研究和报道,但初始叶绿素a(Chl-a)浓度通常不超过300μg/ L[11-12].本文前期研究补充了在Chl-a浓度高达400~ 1700μg/L时絮凝控藻的适用性,证明其是唯一一种能够有效应对大型富营养化湖泊湖滨带高浓度蓝藻水华的应急方法[4].然而,通过高剂量絮凝剂控制高浓度藻华(Chl-a浓度超过1000μg/L)是否会产生水质恶化的潜在风险,如大量藻类在湖底堆积腐烂造成水体严重黑臭等,以及可能会对湖泊后续的恢复策略产生哪些负面影响等,仍需进一步研究.
本文模拟了高浓度藻华体系(Chl-a浓度为1001.63μg/L),选取聚合氯化铝、氯化铁和阳离子淀粉-壳聚糖3种絮凝剂实施应急控藻,探究其在絮凝控制高浓度藻华后的环境变化;随后在体系中种植苦草()、狐尾藻()、伊乐藻()等3种沉水植物,比较1周后的生长情况变化,以评估不同絮凝剂实施絮凝控藻后对沉水植被恢复的影响.
1 材料和方法
1.1 样品采集和高浓度藻华模拟
实验用水,底泥和蓝藻水华样品均采集自2019年9月巢湖原位.使用水样采集器(聚乙烯材质)采集巢湖原位的表层和中层混合水样;使用柱状采样器(Ф90mm×500mm,Rigo公司,日本)收集巢湖底部沉积物样品;使用浮游生物网(200目, 64µm)富集藻类.
采集的样品于当天在低温黑暗环境下转运至实验室,将沉积物样品搅拌均匀后,取200mL样品加入2L塑料烧杯中,采用虹吸法向烧杯内缓慢注入水样,避免沉积物受水力扰动而再悬浮;将富集的藻类样品加入烧杯中模拟高浓度藻华,采用丙酮提取、紫外分光光度法(HJ 897-2017)测定Chl-浓度为1001.63μg/L.使用黑色遮光胶带将烧杯外壁从底部进行捆绑遮蔽,至2/3高度处,模拟湖泊下层环境.
1.2 絮凝降藻
分别采用聚合氯化铝(PAC)、氯化铁(FeCl3)和阳离子淀粉-壳聚糖(CSC)作为絮凝剂,根据此前报道的处理剂量[4],分别选择162mg PAC-2.70g硅藻土、216mg FeCl3-2.16g硅藻土和7.2g阳离子淀粉-1.8g壳聚糖加入高浓度藻华体系,藻类24h沉降率分别达到99.9%,99.9%,93.1%.设置1组藻华空白处理对照,空白和不同絮凝处理每组设置3个平行,共12个;同时,设置1个无藻华的对照实验.
在絮凝处理后的第1, 4, 9, 15, 24, 29d对各处理的水质和嗅味物质进行跟踪监测.使用多功能水质参数测定仪(YSI660,美国)测定水体中的氧化还原电位(ORP)、溶解氧(DO)、电导率(EC)和浊度,采用纳氏试剂分光光度法(HJ 535-2009)测定氨氮,采用顶空固相微萃取和气相色谱-质谱联用仪(GC-MS, agilent公司,美国)测定水体中的嗅味物质[13],包括2-甲基异莰醇(2-Methylisoborneol)、β-环柠檬醛(beta- Cyclocitral)、二甲萘烷醇(Geosmin,土臭素)等.
1.3 沉水植被恢复
在无藻华对照、藻华空白和絮凝处理组中种植苦草()、狐尾藻()和伊乐藻() 3种耐污能力强的沉水植物,每个处理组设置3个平行.置于光照培养箱生长1周后,观察并记录各植株的生长状况,包括叶或杈数、株高、叶宽、根长、总重.
1.4 数据分析

表1 沉水植被恢复潜力的判定
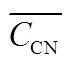
此外,基于沉水植被的生长变化情况,对其恢复潜力进行评价,计算公式和评价方法如表1所示.本研究中所有实验结果取3次平行实验均值,使用SPSS独立样本检验进行差异比较,<0.05认为存在显著差异.
2 结果与分析
2.1 水质变化
由于藻类大量堆积,藻华空白处理组的ORP、DO在前4d出现骤降,分别从(-54.33±71.91)mV、(8.71±0.06)mg/L降至(-376.98±15.11)mV、(1.83±0.22)mg/L,浊度则在前9d持续上升.随后藻类逐步消亡, ORP缓慢上升并在第29d恢复到(-140.43±8.27)mV,浊度下降至(910.33±591.90)NTU,而DO无明显变化(=0.934).同时,氨氮在此过程中亦出现下降.相比之下,絮凝处理后,水体ORP下降幅度较小并始终优于空白处理(<0.001), EC增加(<0.038),浊度下降(<0.001).其中, PAC处理后DO从(11.23±0.28)mg/L降至(3.67±0.28)mg/L,但始终优于其他处理(<0.001);氨氮在前15d内持续降至(6.76±0.63)mg/L,并保持最低(<0.003); EC在第24d回到初始水平.然而, FeCl3和CSC处理后, DO在第24d后低于空白处理(<0.001),并且氨氮、EC均显著高于空白处理(<0.001).在CSC处理9d后,氨氮、EC分别达到(51.10±3.38)mg/L、(7303.67±74.09) µS/cm,高于其他处理组(<0.001)(图1).

图1 絮凝后水质参数的变化情况
2.2 嗅味物质
在空白处理组中,嗅味物质在第9d达到峰值, 3种嗅味物质分别为(103.61±9.13), (1392.95±560.20), (1.70±0.95)ng/L.相比之下,絮凝控藻显著抑制了2-甲基异莰醇(<0.001)、β-环柠檬醛(<0.002)的释放, FeCl3和CSC处理对二甲萘烷醇同样有显著抑制作用(<0.040).但PAC处理前期存在2-甲基异莰醇释放,浓度可达9.86~11.38ng/L,处理后期二甲萘烷醇浓度持续增加并在第29d时达到(1.37±0.45)ng/L,显著高于其他处理(<0.001)(图2).

图2 絮凝后水体嗅味物质含量变化
2.3 黑臭状况
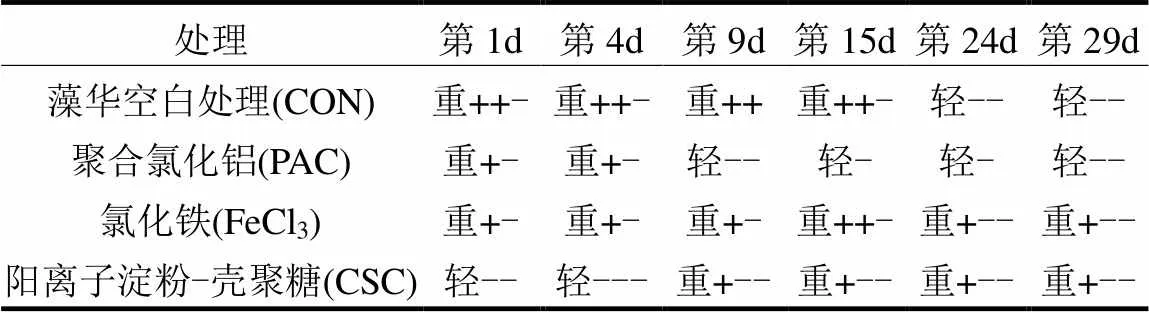
表2 絮凝后水体黑臭状况*
注:*表内“+”代表有1个指标达到“重度黑臭”;“-”代表有1个指标达到“轻度黑臭”.
高浓度蓝藻水华暴发后,水体重度黑臭状态维持超过15d,此后有所减轻.不同絮凝方法对于水体黑臭的影响不同. PAC处理后,水体自第9d起一直保持轻度黑臭状态,明显优于其他处理.而FeCl3处理虽然在4~9d时较空白有所好转,但水体始终处于重度黑臭状态; CSC处理后的第1~4d,水体处于轻度黑臭状态,随后情况恶化达到重度黑臭水平,直至实验结束也未出现明显改善(表2).
2.4 沉水植被恢复潜力

图3 絮凝后实施沉水植被恢复潜力
如图3所示,不同絮凝处理对于不同沉水植被恢复的影响不同. PAC处理后,苦草、伊乐藻和狐尾藻的生长情况总体优于藻华空白处理,其中狐尾藻和伊乐藻的叶/杈数、株高、总重的恢复潜力评价均值分别达1.76, 1.94, 2.36和1.56, 1.31, 3.13,狐尾藻杈数和伊乐藻总重增长显著优于无藻对照(<0.05),说明PAC处理增加了其恢复潜力. FeCl3处理后,虽然苦草叶宽、根长评价值显著高于0,但3种沉水植被的生长情况与藻华空白处理总体上无显著差异,表明该处理并不能缓解高浓度藻华对沉水植被生长的抑制;此外,伊乐藻叶数的评价均值为-3.73,显著劣于藻华空白处理(=0.019),说明加剧了对伊乐藻叶片生长的抑制.CSC处理后,狐尾藻杈数、株高、总重的评价均值接近1,与无藻对照组生长情况相似(<0.05);除根长外,苦草的生长情况与藻华空白处理无显著差异;而伊乐藻的叶数、株高和总重的评价均值分别达-5.91, -0.55和-1.77,显著低于0(<0.05),表明其受到的生长胁迫明显加重.
3 讨论
3.1 絮凝控制高浓度藻华后的水质恶化风险
藻类大量堆积极易造成水体缺氧,加之沉降至沉积物表层后光合作用减弱,藻类产氧减少,水中DO消耗迅速;此外,由于湖泊水体或沉积物中大量藻源性有机质在微生物作用下分解,需要消耗水中大量的氧气,使得微生物厌氧呼吸加剧,从而在还原条件下形成许多致黑臭物质[14-15].因此,虽然絮凝控藻可以有效缓解藻华,但沉降的藻类仍有引发水体黑臭的风险.本研究中,无论是在空白处理还是在不同的絮凝处理中,水体中的DO和ORP出现不同程度的下降.
研究发现,不同絮凝处理对于水环境的影响是不同的.在PAC处理后, DO始终保持较高值.一方面,相较于仍保持着高藻类生物量、高活性的空白处理,絮凝后水体中藻类生物量大幅削减, DO消耗亦同步削减;另一方面, Al3+具有杀藻或抑藻效果[16-17],可能进一步抑制沉降藻类的呼吸.通常DO被认为是黑臭治理的关键因素,维持3~4mg/L以上水体自净能力可以得到明显提升,因此氨氮能够持续下降,水体黑臭也得到显著改善.虽然在此过程中伴随有少量嗅味物质的释放,但其浓度均低于2-甲基异莰醇15ng/L、β-环柠檬醛19.3ng/L、二甲萘烷醇10ng/L的嗅阈值[18].
相比之下,即便Fe3+被报道会引起细胞氧化应激,从而破坏细胞膜、脂质、蛋白和DNA等导致藻细胞死亡[19],从而减少水中DO的消耗,但在FeCl3和CSC处理后期,水体中DO始终低于1.5mg/L,水质不断恶化并持续保持黑臭.这可能是由于微氧条件下兼性微生物活性强,相较于专性厌氧微生物要求ORP在-200~-400mV之间,兼性微生物在100mV以下即可进行无氧呼吸,此时泥水界面主要的微生物过程包括水解酸化、氮呼吸和铁锰呼吸.其中,氮呼吸过程产生氨氮、亚硝酸盐,铁锰呼吸过程将Fe3+还原为Fe2+,过程中需要消耗氧气,并且产生酸性物质[20-22].FeCl3、阳离子淀粉和壳聚糖分别提供了Fe3+、有机氮和生物可降解的有机大分子,可能加剧了这些过程,造成水体中DO的持续消耗和氨氮增加,进而引发持续黑臭.这与此前3种絮凝剂控制蓝藻水华后短期内(1d) DO基本保持在2~4mg/L以上、总溶解氮(TDN)保持在0.6~2.4mg/L[4]的水质监测结果不一致.本研究补充了絮凝控制高浓度藻华的后较长一段时间内(30d)的水质变化情况,结果表明, FeCl3和CSC处理均会导致水体DO持续下降(<2mg/L)和氨氮急剧释放(>20mg/L),与此前CSC处理较高浓度蓝藻水华时观察到的沉积物TOC骤增、TDN在1~8h后释放[4]结论基本一致.因此,不同絮凝方法对水环境影响具有较大差异,在实施絮凝控藻前,应充分评估不同絮凝剂所产生的环境风险,必要时应在絮凝后一段时间内增加曝气增氧操作,以防止水体黑臭.
3.2 絮凝控制高浓度藻华后的沉水植被恢复策略
沉水植被具有加速悬浮物沉降、完善湖泊生态系统结构和功能、抑制藻类生长等重要生态作用,对于提升湖体抗冲击能力、长效防控蓝藻水华有积极意义[23-24].絮凝处理能够有效沉降藻类,降低水体浊度,实现较低的藻类覆盖度和较高的透明度,从而有利于大型水生植被恢复[25-26].但也有相关研究证实了藻华腐烂分解会导致沉水植物消亡[27].因此,能否在实施絮凝后采取沉水植被恢复的生态修复策略改善湖泊生态还有待评估.
本研究表明,不同絮凝处理体系和不同修复物种选取均会对沉水植被的恢复产生明显差异.就絮凝方法而言,PAC处理适宜3种沉水植物恢复, FeCl3处理减轻了沉水植被在高浓度藻华环境中的生长压力, CSC处理则会加重对苦草,伊乐藻的生长胁迫;就物种选取而言,狐尾藻在使用3种絮凝剂应急控制高浓度藻华后均表现出了良好的生长潜力,苦草次之,而伊乐藻在FeCl3和CSC处理中受到的生长抑制更加严重.
这可能与沉水植物的生长策略和对不同环境因子耐受性相关.由于各处理均出现了不同程度的黑臭,植物根茎极易腐烂,而狐尾藻可以依靠不定根和茎叶从水体和沉积物中获取营养,维持植株正常生长[28].此外,对狐尾藻具有毒害作用的金属和有机物可以在脱毒后储存在其体内或在体内被降解[29-31],这些特征可使狐尾藻在不同处理中均表现出较好的生长潜力.有研究报道,氨氮1.5~4.0mg/L时狐尾藻可正常生长,当氨氮达到8.0mg/L时狐尾藻更合适成为生态恢复的先锋种[32].相比之下,苦草对氨氮的最大耐受浓度为6.0mg/L,而伊乐藻的耐受性差于苦草[33-34],这解释了在氨氮较低的PAC处理中, 3种植物均展现出了较好的生长潜力;而在氨氮保持高浓度的CSC处理中,苦草、狐尾藻所受到的生长抑制更加严重.另一方面, FeCl3处理中沉水植被根和茎暴露于铁中可能受到氧化应激[35], CSC处理产生的高电导率,均会影响沉水植物的生长.因此,在对大型富营养化湖泊湖滨带的高浓度蓝藻水华实施絮凝应急控制工程时,使用不同絮凝剂后湖泊后续实施沉水植被恢复的策略需作出相应调整,应充分评估不同絮凝方法产生的环境影响和不同修复物种的耐受性与生长潜力,以确定最合适的湖泊修复策略.
4 结论
4.1 在大型富营养化湖泊下风向的湖滨带易形成Chl-高于1000μg/L的高浓度蓝藻水华,投加高剂量的絮凝剂可能是唯一适用的方法,但易引发水体黑臭,进而影响湖泊后续修复策略.
4.2 PAC处理后,水体DO保持在3.67~11.23mg/L,氨氮持续降至6.76mg/L,优于其他处理(<0.05),水体重度黑臭由15d缩至4d.而FeCl3和CSC处理则造成DO持续降至1.35, 0.61mg/L,氨氮升高至24.93, 45.74mg/L,导致水体在较长一段时间内仍处于重度黑臭状态.
4.3 不同絮凝处理中, PAC絮凝后狐尾藻、苦草、伊乐藻均表现出最优的恢复潜力,其中伊乐藻生物量显著优于无藻华对照(<0.05),而FeCl3和CSC絮凝未能缓解高浓度藻华对苦草和伊乐藻产生的生长胁迫,CSC处理甚至显著抑制了伊乐藻的生长(<0.05).
[1] Yang Z, Buley R P, Fernandez-Figueroa E G, et al. Hydrogen peroxide treatment promotes chlorophytes over toxic cyanobacteria in a hyper-eutrophic aquaculture pond [J]. Environmental Pollution, 2018, 240:590-598.
[2] Chen C, Shi X L, Yang Z, et al. An integrated method for controlling the offensive odor and suspended matter originating from algae- induced black blooms [J]. Chemosphere, 2019,221:526-532.
[3] Kibuye F A, Zamyadi A, Wert E C. A critical review on operation and performance of source water control strategies for cyanobacterial blooms: Part I-chemical control methods [J]. Harmful Algae, 2021, doi:10.1016/j.hal.2021.102099.
[4] Liu K X, Jiang L, Yang J S, et al. Comparison of three flocculants for heavy cyanobacterial bloom mitigation and subsequent environmental impacts [J]. Journal of Oceanology and Limnology, 2022,doi:10.1007/ s00343-022-1351-7.
[5] 史小丽,杨瑾晟,陈开宁,等.湖泊蓝藻水华防控方法综述 [J]. 湖泊科学, 2022,34(2):349-375.
Shi X L, Yang J S, Chen K N, et al. Review on the control and mitigation strategies of lake cyanobacterial blooms [J]. Journal of Lake Sciences, 2022,34(2):349-375.
[6] 范帆,李文朝,柯凡.巢湖市水源地铜绿微囊藻()藻团粒径时空分布规律 [J]. 湖泊科学, 2013,25(2):213- 220.
Fan F, Li W C, Ke F. Spatio-temporal distribution ofcolony diameters in the water source region of Chaohu City [J]. Journal of Lake Sciences, 2013,25(2):213-220.
[7] Fan F, Shi X L, Zhang M, et al. Comparison of algal harvest and hydrogen peroxide treatment in mitigating cyanobacterial blooms via an in situ mesocosm experiment [J]. Science of the Total Environment, 2019,694:133721.
[8] Lürling M, Mucci M. Mitigating eutrophication nuisance: In-lake measures are becoming inevitable in eutrophic waters in the Netherlands [J]. Hydrobiologia, 2020,847(21):4447-4467.
[9] Matthijs H C, Visser P M, Reeze B, et al. Selective suppression of harmful cyanobacteria in an entire lake with hydrogen peroxide [J]. Water Research, 2012,46(5):1460-1472.
[10] Liu M X, Shi X L, Chen C, et al. Responses ofcolonies of different sizes to hydrogen peroxide stress [J]. Toxins, 2017,9(10), doi:10.3390/toxins9100306.
[11] Ma X X, Wang Y A, Feng S Q, et al. Comparison of four flocculants for removing algae in Dianchi Lake [J]. Environmental Earth Sciences, 2015,74(5):3795-3804.
[12] Aktas T S, Takeda F, Maruo C, et al. Comparison of four kinds of coagulants for the removal of picophytoplankton [J]. Desalination and Water Treatment, 2013,51(16-18):3547-3557.
[13] 吕成旭,石瑞洁,季铭,等.高外源性藻类输入的城市河道嗅味物质分布特征及影响因素 [J]. 环境化学, 2022,41(5):1-12.
Lv C X, Shi R J, Ji M, et al. Distribution characteristics and influencing factors of odorants in urban rivers with high exogenous algae input [J]. Environmental Chemistry, 2022,41(5):1-12.
[14] 范成新.太湖湖泛形成研究进展与展望.湖泊科学, 2015,27(4):553- 566.
Fan C X. Progress and prospect in formation of black bloom in Lake Taihu: A review [J]. Journal of Lake Sciences, 2015,27(4):553-566.
[15] 邢鹏,胡万婷,吴瑜凡,等.浅水湖泊湖泛(黑水团)中的微生物生态学研究进展 [J]. 湖泊科学, 2015,27(4):567-574.
Xing P, Hu W T, Wu Y F, et al. Major progress in microbial ecology of hypoxia in the shallow eutrophic lakes [J]. Journal of Lake Sciences, 2015,27(4):567-574.
[16] Gensemer R W, Playle R C. The bioavailability and toxicity of aluminum in aquatic environments [J]. Critical Reviews in Environmental Science and Technology, 1999,29(4):315-450.
[17] Jančula D, Maršálek B. Seven years from the first application of polyaluminium chloride in the Czech Republic - effects on phytoplankton communities in three water bodies [J]. Chemistry and Ecology, 2012,28(6):535-544.
[18] Watson S B. Aquatic taste and odor: A primary signal of drinking-water integrity [J]. Journal of Toxicology and Environmental Health-Part a-Current Issues, 2004,67(20-22):1779-1795.
[19] Foyer C H, DescourviÈRes P, Kunert K J. Protection against oxygen radicals: an important defence mechanism studied in transgenic plants [J]. Plant, Cell & Environment, 1994,17(5):507-523.
[20] 马晨,周顺桂,庄莉,等.微生物胞外呼吸电子传递机制研究进展 [J]. 生态学报, 2011,31(7):2008-2018.
Ma C, Zhou S, Zhuang L, et al. Electron transfer mechanism of extracellular respiration: a review. Acta Ecologica Sinica, 2011,31(7): 2008-2018.
[21] 陆文俊.生境氧化还原电位影响淀粉酸化末端产物分布规律研究 [D]. 上海:华东理工大学, 2013.
Lu W J. Influence of oxidation-reduction potential on distrubition and variation of end products in the process of starch hydrolysis and acidification [D]. Shanghai: East China University of Science and Technology, 2013.
[22] 赵志瑞,刘硕,李铎,等.脱氮菌剂在低溶解氧黑臭水体中氮代谢特征 [J]. 环境科学, 2020,41(1):304-312.
Zhao Z R, Liu S, Li D, et al. Characteristics of nitrogen metabolism by denitrifying bacterial agents in low dissolved oxygen black odor water [J]. Environmental Science, 2020,41(1):304-312.
[23] 刘正文,张修峰,陈非洲,等.浅水湖泊底栖-敞水生境耦合对富营养化的响应与稳态转换机理:对湖泊修复的启示 [J]. 湖泊科学, 2020, 32(1):1-10.
Liu Z W, Zhang X F, Chen F Z, et al. The responses of the benthic- pelagic coupling to eutrophication and regime shifts in shallow lakes: Implication for lake restoration [J]. Journal of Lake Sciences, 2020, 32(1):1-10.
[24] 刘永,郭怀成,周丰,等.湖泊水位变动对水生植被的影响机理及其调控方法 [J]. 生态学报, 2006,26(9):3117-3126.
Liu Y, Guo H C, Zhou F, et al. Role of water level fluctuation on aquatic vegetation in lakes [J]. Acta Ecologica Sinica, 2006,26(9): 3117-3126.
[25] Xu F L, Tao S, Xu Z R. The restoration of riparian wetlands and macrophytes in Lake Chao, an eutrophic Chinese lake: possibilities and effects [J]. Hydrobiologia, 1999,405:169-178.
[26] Gulati R D, Pires L M D, Van Donk E. Lake restoration studies: Failures, bottlenecks and prospects of new ecotechnological measures [J]. Limnologica, 2008,38(3/4):233-247.
[27] 刘丽贞,秦伯强,朱广伟,等.太湖蓝藻死亡腐烂产物对狐尾藻和水质的影响 [J]. 生态学报, 2012,32(10):3154-3159.
Liu L Z, Qin B Q, Zhu G W, et al. Effect of decomposition products of cyanobacteria onand water quality in Lake Taihu, China [J]. Acta Ecologica Sinica, 2012,32(10):3154-3159.
[28] 高莹,余小敏,刘杰,等.狐尾藻断枝上不定根与芽发生的初步研究 [J]. 水生生物学报, 2007,31(5):726-730.
Gao Y, Yu X M, Liu J, et al. Production of adventitious roots and buds on fragments ofL. [J]. Acta Hydrobiologica Sinica, 2007,31(5):726-730.
[29] Stanley R A. Toxicity of heavy metals and salts to Eurasian watermilfoil (L.) [J]. Archives of environmental contamination and toxicology, 1974,2(4):331-41.
[30] Yabanli M, Yozukmaz A, Sel F. Heavy metal accumulation in the leaves, stem and root of the invasive submerged macrophyteL. (Haloragaceae): an example of Kadin Creek (Mugla, Turkey) [J]. Brazilian Archives of Biology and Technology, 2014,57(3):434-440.
[31] 刘少博,冉彬,曾冠军,等.高铵条件下绿狐尾藻的生理与氮磷吸收特征 [J]. 环境科学, 2017,38(9):3731-3737.
Liu S B, Ran B, Zeng G J, et al. Physiological characteristics and nitrogen and phosphorus uptake ofunder high ammonium conditions [J]. Environmental Science, 2017,38(9): 3731-3737.
[32] 金相灿,郭俊秀,许秋瑾,等.不同质量浓度氨氮对轮叶黑藻和穗花狐尾藻抗氧化酶系统的影响 [J]. 生态环境, 2008,17(1):1-5.
Jin X C, Guo J X, Xu Q J, et al. Effects of different concentrations of NH4+on antioxidant system ofand[J]. Ecology and Environment, 2008,17(1):1-5.
[33] 周金波,金树权,包薇红,等.不同浓度氨氮对4种沉水植物的生长影响比较研究 [J]. 农业资源与环境学报, 2018,35(1):74-81.
Zhou J B, Jin S Q, Bao W H, et al. Comparison of effects of ammonia nitrogen concentrations on growth of four kinds of submerged macrophytes [J]. Journal of Agricultural Resources and Environment, 2018,35(1):74-81.
[34] 赵温.苦草和伊乐藻对水体铵态氮、磷浓度的响应 [D]. 武汉:华中农业大学, 2013.
Zhao W. Responses ofandto ammonium nitrogen and phosphorus concentrations in water environment [D]. Wuhan:Huazhong Agricultural University, 2013.
[35] Sinha S, Basant A, Malik A, et al. Iron-induced oxidative stress in a macrophyte: A chemometric approach [J]. Ecotoxicology and Environmental Safety, 2009,72(2):585-595.
Effects of controlling heavy cyanobacterial blooms through flocculation on water quality and submerged macrophyte restoration.
YANG Jin-sheng1,2, JIANG Lei1,2, LU Jin1,2, CHEN Kai-ning1, XIE San-tao3, ZHANG Min1, SHI Xiao-li1*
(1.State Key Laboratory of Lake Science and Environment, Nanjing Institute of Geography and limnology, Chinese Academy of Sciences, Nanjing 210008, China;2.University of Chinese Academy of Sciences, Beijing 100049, China;3.Anhui Water Resources and Hydropower Survey, design and Research Institute Co., Ltd, Hefei 230088, China)., 2023,43(2):561~567
Cyanobacterial blooms could accumulate and form high concentration algal scum in the leeward lakeside, which could seriously damage the aquatic ecology health. Flocculation-sinking is one of the most effective approaches for rapidly mitigating heavy cyanobacterial blooms. But the potential risk of water deterioration would affect the subsequent lake restoration strategies. In this study, three flocculants including polyaluminum chloride (PAC), ferric chloride (FeCl3) and cationic starch with chitosan (CSC), were used to control heavy cyanobacterial blooms with the chlorophyll-a concentration of 1001.63μg/L. Then, the impacts of flocculation on water quality and submerged macrophyte restoration were evaluated. The result showed that the water turned to black and odorous in FeCl3and CSC treatments, with DO dropping to 1.35mg/L and 0.61mg/L, and ammonia nitrogen increasing to 24.93mg/L and 45.74mg/L, respectively. While in PAC treatment, ORP (-76.00mV), DO (3.64mg/L) and ammonia nitrogen (9.25mg/L) were ameliorated, compared with those of -140.43mV, 2.34mg/L, and 13.10mg/L in control treatment, respectively. The duration of severe black-and-odorous water decreased from 15d to 4d, and the restoration potential of submerged macrophyte was promoted. Particularly, the biomass ofincreased significantly, compared with that of the control without cyanobacterial blooms (<0.05). However, the growth stress ofandin FeCl3and CSC treatments was not to be alleviated. CSC treatment could inhibit the growth of leaf, plant height and biomass of(<0.05). Results showed that flocculation and sedimentation could quickly control the heavy cyanobacterial blooms in the lakeside area, but black and odorous water event may occur. Measures, such as aeration for oxygenation, should be implemented to alleviate the deterioration of water quality. Afterwards, appropriate submerged macrophyte should be selected for ecological restoration, for achieving the goal of long-term algal control.
lakeside area;flocculation;heavy cyanobacterial blooms;black and odorous water;submerged macrophyte restoration
X524
A
1000-6923(2023)02-0561-07
杨瑾晟(1999-),江苏淮安人,中国科学院南京地理与湖泊研究所硕士研究生,主要研究方向为蓝藻水华防控和湖泊生态修复.
2022-06-20
中国科学院STS项目(KFJ-STS-QYZD-2021-01-002);国家自然科学基金资助项目(32071573,41877544)
* 责任作者, 研究员, xlshi@niglas.ac.cn

