不同频率电针介导PINK1/Parkin 通路治疗STC 模型大鼠的机制研究
吴姝雯 刘 敏 楼毅杰 崔宇胜 刘承浩
慢传输型便秘(slow transit constipation,STC)是临床常见的便秘类型,占16%~40%[1]。电针“后三里”穴位可改善肠易激综合征便秘大鼠结肠肌间神经丛的可塑性,推测该方法有助于治疗便秘[2]。而STC 结肠肌间神经丛病理改变,以结肠Cajal 间质细胞(interstitial cells of Cajal,ICC)神经丛及突起分支减少、细胞网络损毁为典型表现[3]。在STC 中线粒体自噬相关蛋白(phosphatase and tensin homolog deleted on chromosome ten-in-duced kinase 1,PINK1)/帕金蛋白(Parkin protein,Parkin)通路被激活,PINK1、Parkin、自噬效应蛋白1(Beclin-1,Beclin1)、自噬相关蛋白3(light chain 3,LC3)表达升高,而原癌基因(C-kit)、p62 表达下降,导致ICC 细胞自噬增多、ICC 细胞减少[4]。本研究拟探讨电针对STC 的作用与机制。
1 实验材料
1.1 动 物 8 周龄雄性健康SD 大鼠34 只,体质量200~250 g,购自上海加科生物科技有限公司,许可证号:SCXK(沪)2020-0001。饲养条件依据清洁级要求,饲养室温度保持在20~25 ℃,相对湿度50%~65%。饲养室采用光照定时装置,提供适当的(12 h光照,12 h 黑暗)昼夜光变化周期,均予啮齿动物标准颗粒饲料和饮水。本研究经浙江中医药大学实验动物伦理委员会审批通过(院准字202004-001)。
1.2 试剂洛哌丁胺(上海华氏制药有限公司第十五制药厂,批号20020913);墨汁(德国DOKUMENTAL 公司);10%活性炭悬液(河南中聚净化材料有限公司,批号20201014);苏木素-伊红(hematoxylin-eosin,HE)染色试剂盒(上海碧云天生物科技有限公司,批号190516);电镜固定液、锇酸溶液、醋酸铀水溶液、甲苯胺兰、柠檬酸铅、二氨基联苯胺(diaminobenzidine,DAB)显色液、细胞裂解液、电化学发光液(美国Sigma 公司,批号20200304、20191215、20200117、20200225、20191214、20200311);内源性过氧化物酶(武汉博士德生物技术有限公司,批号R1911178);兔抗鼠C-kit、PINK1、Parkin、Beclin1、p62、LC3、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)单克隆抗体(一抗,Abcam 中国公司,批号190816、190913、190925、190611、191014、191207、191105),羊抗兔C-kit、PINK1、Parkin、Beclin1、p62、LC3、GAPDH 多克隆抗体(过氧化物酶标记)(二抗,Abcam 中国公司,批号190904、191025、191018、190803、191025、191217、191223);二喹啉甲酸(bicinchoninic acid,BCA)试剂盒(美国Bio-rad 公司,批号20191004)。
1.3 仪器 HL-DXG 型大鼠固定架(北京合力科创科技发展有限公司);一次性针灸针(吴江市佳辰针灸器械有限公司,0.25 mm×25 mm);SDZ-IIB 型华佗牌电子针疗仪(苏州医疗用品厂有限公司);500 型游标卡尺(上海九量五金工具有限公司);RM2235 型组织切片机(德国Leica 公司);PowerTome-XL 型超薄切片机(美国RMC 公司);CX31 型光学显微镜(日本Olympus 公司);EVOS M5000 型免疫荧光共聚焦显微镜(美国Thermo 公司);T10 型组织匀浆机(德国IKA 公司);Image Pro-plus 6.0 软件(Media Cybernetics 公司);DYCA 24F 蛋白质凝胶电泳仪(北京六一仪器厂);170-3940 型转膜仪(美国Bio-Rad 公司);SC 320 型摇床(上海达姆实业有限公司)。
2 实验方法
2.1 建模方法 将34 只SD 大鼠采用随机数字表分为正常对照组7 只和建模组27 只。建模组采用洛哌丁胺混悬液灌胃法制备STC 模型大鼠[5],剂量3.0 mg/kg,正常对照组同时灌胃等量无菌生理盐水,均每天1 次,连续6 d。末次灌胃结束,均灌胃2 mL 墨汁,自由饮水6 h,记录建模组与正常对照组首粒黑便排出时间,即从墨汁灌胃结束到首粒黑便排出时间间隔,若建模组首粒黑便排出时间较正常对照组显著延长,则认为建模成功[6]。于建模组、正常对照组中各随机处死1 只大鼠暴露肠管、分离肠系膜,将回盲部上端与直肠末端结扎并剪断肠管,取出大肠后轻拉成直线,剖开盲肠至直肠的肠系带观察粪便残留情况,计算大肠碳素墨汁推进率,即大肠内墨汁推进距离/大肠全长×100.00%。
2.2 分组及干预方法 验证STC 建模成功后将模型组剩余存活大鼠采用随机数字表分为模型对照组8 只、2 Hz 电针组6 只、50 Hz 电针组6 只、假电针组6 只,正常对照组剩余6 只存活大鼠。“后三里”定位于胫骨平台下方3 寸(约6.87 mm),在胫骨前缘外侧约4.5 mm、腓骨头尖下方0.84 mm 并向前约3.35 mm处,进针角度与胫骨前缘矢状面呈45°,深度约6 mm。在“后三里”下约2 mm 刺入另一毫针作为参考电极(接负极),“后三里”穴位接正极。2 Hz 电针组予以电子针疗仪频率2 Hz、强度10 mA 刺激“后三里”,50 Hz 电针组予以电子针疗仪频率50 Hz、强度10 mA 刺激“后三里”,假电针组针刺“后三里”但电子针疗仪不通电,模型对照组和正常对照组仅固定处理,每天30 min,每天1 次,持续14 d。
2.3 肠道推进率比较 各组大鼠分别于干预14 d后禁食不禁水24 h,灌服10%活性炭悬液2 mL,40 min 后脱臼法处死。参照1.2.1 中方法取出全段肠管,计算肠道推进率,即活性炭前端至幽门的距离/幽门至直肠末端总长度×100.00%。
2.4 结肠组织病理改变、ICC 形态观察 生理盐水冲洗大鼠结肠内容物,分装于37%的甲醛溶液中,固定后梯度浓度乙醇脱水透明(100%→95%→90%→80%→70%,其中每级脱水2~3 min)、石蜡包埋、连续切片(层厚4 μm),以二甲苯溶液脱蜡、酒精溶液水化,苏木精染色后盐酸酒精分化,伊红复染,脱水、封片、光学显微镜下观察。另取1 mm×1 m×1 mm 结肠组织标本分别置于电镜固定液、锇酸溶液中固定,饱和醋酸铀水溶液中避光染色,脱水、干燥后纯环氧丙烷处理,包埋后制作超薄切片(层厚0.2~0.4 μm)。甲苯胺兰染色,再次切片(层厚50~60 nm),加入饱和醋酸铀水溶液,室温避光10 min;柠檬酸铅染色,5 min后免疫荧光共聚焦显微镜观察ICC 形态并分析积分光密度(integrated optical density,IOD)。
2.5 结肠组织C-kit、PINK1、Parkin、Beclin1、p62、LC3 蛋白表达检测 采用蛋白质免疫印迹(Westernblot,WB)法:取大鼠结肠组织研磨匀浆,细胞裂解液裂解,提取总蛋白并以BCA 试剂盒定量。30 μg 蛋白电泳,转至聚偏氟乙烯膜,转印时间35~40 min。冲洗后37 ℃封闭2 h,滴加一抗(稀释倍数均1∶2000),4 ℃孵育过夜,冲洗3 次,剧烈洗涤;滴加二抗(稀释倍数均1∶3000),冲洗3 次并剧烈洗涤。电化学发光法显影,以GAPDH 为内参,检测蛋白条带灰度×面积/(内参条带灰度×面积)即为蛋白相对表达量。
2.6 统计学方法 应用SPSS 21.0 软件对数据进行统计分析。符合正态分布的计量资料采用均数±标准差()表示,多组间比较采用单因素方差分析,多重比较采用SNK-q 检验。P<0.05 为差异有统计学意义。
3 实验结果
3.1 建模、分组情况及各组大鼠干预后肠道推进率比较 建模组大鼠6 d 后均出现活动减少、食量减少、毛发色泽暗淡且枯萎脱落、大便数量减少等表现,正常对照组大鼠活动、食量、大便均正常,毛发有光泽且浓密。建模组大鼠首粒黑便排出时间为306~418(355.67±42.05)min;正常对照组大鼠首粒黑便排出时间为215~297(261.34±34.45)min。建模组较正常对照组显著延长(t=46.753,P<0.001),证实STC 大鼠模型构建成功。另正常对照组大鼠大肠碳素墨汁推进率、粪便含水率分别为65.42%、68.75%,建模组分别为50.12%、53.04%。
干预期间各组大鼠均无死亡。与正常对照组比较,其余各组大鼠肠道推进率下降(P<0.05);与模型对照组和假电针组比较,2 Hz 电针组、50 Hz 电针组肠道推进率均升高(P<0.05);与2 Hz 电针组比较,50 Hz 电针组肠道推进率升高(P<0.05),见表1。
表1 各组大鼠干预后肠道推进率比较(%,)

表1 各组大鼠干预后肠道推进率比较(%,)
注:2 Hz 电针组予以电子针疗仪频率2 Hz、强度10 mA 刺激“后三里”,50 Hz 电针组予以电子针疗仪频率50 Hz、强度10 mA 刺激“后三里”,假电针组针刺“后三里”但不通电,模型对照组和正常对照组仅固定处理,与正常对照组比较,aP<0.05;与模型对照组比较,bP<0.05;与假电针组比较,cP<0.05;与2 Hz 电针组比较,dP<0.05
3.2 各组大鼠结肠组织病理变化 正常对照组大鼠结肠组织可见完整的黏膜,且肠壁黏膜层、黏膜下层、肌层与外膜层均结构清晰、层次明确,柱状细胞与腺体排列整齐;模型对照组和假电针组黏膜层间质有严重充血、扩张表现,各层次结构不清,有严重上皮损伤(肌层显著变薄、绒毛显著减少);2 Hz 电针组黏膜层间质有充血、扩张表现,各层次结构轻微紊乱,可见上皮损伤(肌层变薄、绒毛减少);50 Hz 电针组黏膜层间质基本正常,各层次结构基本清晰,上皮轻微损伤(肌层稍薄、绒毛稍少)。见图1。

图1 各组大鼠结肠组织病理变化(HE 染色,×200,刻度尺:50 μm)
3.3 各组大鼠ICC 形态变化 正常对照组大鼠ICC呈星形,主要分布于环形肌深部肌间神经丛,有3~5个突触,不同ICC 间通过突触连接形成网络,且结构完整,长突触与平滑肌紧密连接、网络清晰;模型对照组和假电针组大鼠ICC 突触显著减少,连接松散,网络样结构遭到显著损坏;2 Hz 电针组ICC 突触减少、连接不紧密,网络样结构遭到损坏;50 Hz 电针组ICC 突触数量、连接基本正常,网络样结构基本完整(见图2)。与正常对照组大鼠比较,其余四组ICC 数量、免疫荧光IOD 值均下降(P<0.05);与模型对照组和假电针组比较,2 Hz 电针组和50 Hz 电针组ICC数量、免疫荧光IOD 值均升高(P<0.05);与2 Hz 电针组比较,50 Hz 电针组ICC 数量、免疫荧光IOD 值均升高(P<0.05),见表2。
表2 各组大鼠ICC 数量、免疫荧光IOD 值比较()

表2 各组大鼠ICC 数量、免疫荧光IOD 值比较()
注:2 Hz 电针组予以电子针疗仪频率2 Hz、强度10 mA 刺激“后三里”;50 Hz 电针组予以电子针疗仪频率50 Hz、强度10 mA 刺激“后三里”;假电针组针刺“后三里”但不通电;模型对照组和正常对照组仅固定处理;ICC 为结肠Cajal 间质细胞;IOD 为积分光密度;与正常对照组比较,aP<0.05;与模型对照组比较,bP<0.05;与假电针组比较,cP<0.05;与2 Hz 电针组比较,dP<0.05

图2 各组大鼠ICC 形态变化(免疫荧光共聚焦显微镜,×200,刻度尺:50 μm)
3.4 各组大鼠结肠组织C-Kit、PINK1、Parkin、Beclin1、p62、LC3 蛋白表达比较 与正常对照组比较,其余四组C-kit、p62 蛋白表达均下降(P<0.05),PINK1、Parkin、Beclin1、LC3 蛋白表达均升高(P <0.05);与模型对照组和假电针组比较,2 Hz 电针组和50 Hz 电针组C-kit、p62 蛋白表达均升高(P<0.05),PINK1、Parkin、Beclin1、LC3 蛋白表达均下降(P<0.05);与2 Hz 电针组比较,50 Hz 电针组C-kit、p62 蛋白表达均升高(P<0.05),PINK1、Parkin、Beclin1、LC3 蛋白表达均下降(P<0.05),见表3。
表3 各组大鼠结肠组织C-Kit、PINK1、Parkin、Beclin1、p62、LC3 蛋白表达比较()
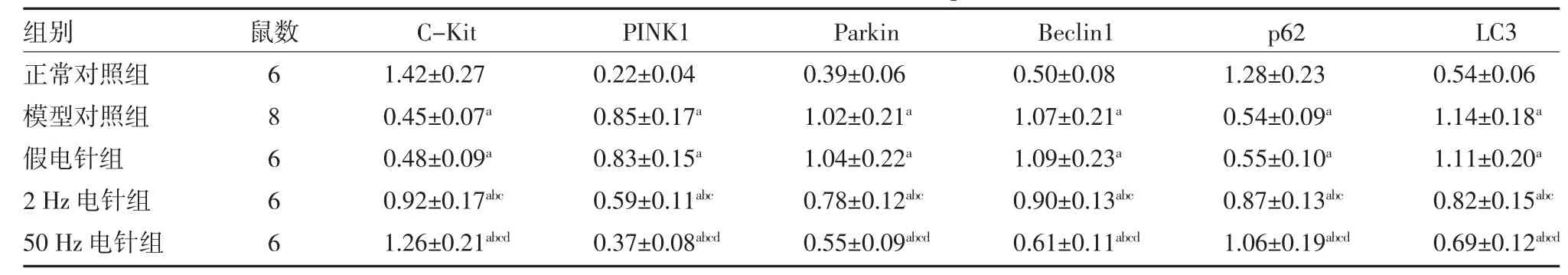
表3 各组大鼠结肠组织C-Kit、PINK1、Parkin、Beclin1、p62、LC3 蛋白表达比较()
注:2 Hz 电针组予以电子针疗仪频率2 Hz、强度10 mA 刺激“后三里”;50 Hz 电针组予以电子针疗仪频率50 Hz、强度10 mA 刺激“后三里”,假电针组针刺“后三里”但不通电;模型对照组和正常对照组仅固定处理;C-Kit 为原癌基因;PINK1 为线粒体自噬相关蛋白;Parkin 为帕金蛋白;Beclin1 为自噬效应蛋白1;p62 为核孔糖蛋白;LC3 为自噬相关蛋白3;与正常对照组比较,aP<0.05;与模型对照组比较,bP<0.05;与假电针组比较,cP<0.05;与2Hz 电针组比较,dP<0.05
4 讨论
STC 发病原因复杂,主要表现为大肠功能紊乱、传导异常,可能与肠神经系统紊乱、ICC 自噬增多、激素水平异常、中枢及自主神经系统调节功能障碍等有关。有研究显示,STC 结肠ICC 细胞突触减少,网络样结构遭损坏,自噬小体增多,细胞自噬严重可导致平滑肌收缩、运动失常,进而引起结肠传导功能障碍[7]。因此减少STC 结肠ICC 自噬是治疗STC 的重要方向。
本研究利用洛哌丁胺混悬液灌胃法制备STC 模型大鼠,建模组首粒黑便排出时间较正常对照组显著延长,证实建模成功,且大肠碳素墨汁推进率、粪便含水率均低于正常对照组,为后续实验提供了条件。本研究还发现,2 Hz 电针组和50 Hz 电针组肠道推进率均低于正常对照组,但均高于模型对照组和假电针组,且50 Hz 电针组肠道推进率高于2 Hz 电针组,表明对STC 模型大鼠予以电针“后三里”有确切效果,且50 Hz 电针效果更佳。电针疗法是针刺法的改良,能够代替手工操作并客观控制刺激量,还可利用电刺激疏经通络、温通气血、祛邪扶正[8]。电针“后三里”穴位可调节五脏六腑功能,促进肠道蠕动,在STC 治疗中有应用价值。而本研究中假电针组肠道推进率与模型对照组相当,说明仅针刺“后三里”对STC 大鼠模型无效,与唐欧风等[9]报道的结论不一致,可能是因为本研究中仅将针刺入“后三里”穴位,但未实施手法治疗,其未通电刺激,而在上述报道中将针刺入穴位后有得气、捻针、留针等操作。本研究还发现,2 Hz 电针组和50 Hz 电针组结肠病理、ICC形态均较模型对照组、假电针组显著减轻,且50 Hz电针组接近正常对照组,与上述分析相符。
STC 结肠ICC 的过度自噬可导致线粒体功能障碍[10]。在此过程中,结肠组织C-Kit 表达下降,而PINK1 转移受阻,PINK1/Parkin 通路被激活,可使得ICC 分化不足或不成熟造成损伤,减低线粒体膜电位,同时还可促进自噬体形成并与溶酶体相融合,产生自噬体溶酶体,启动线粒体自噬,而线粒体大量自噬可导致肠运动及传输功能障碍,最终引发STC[11]。对结肠ICC 阻断PINK1/Parkin 信号通路传导可减少自噬,维持正常的细胞形态与功能,并使得其网络样结构保持完整,且平滑肌的结构和功能也可维持正常,是STC 治疗的新方向[12]。本研究中2 Hz 电针组与50 Hz 电针组结肠组织C-kit、p62 表达均低于正常对照组但均较模型对照组和假电针组升高,而二者结肠组织PINK1、Parkin、Beclin1、LC3 表达均高于正常对照组但均较模型对照组和假电针组降低,推测电针“后三里”很可能能够通过上调结肠组织C-kit 表达,抑制PINK1/Parkin 通路从而发挥对STC 大鼠模型的治疗作用的,且50 Hz 电针的效果更佳。
综上所述,电针“后三里”可能能够提高STC 模型大鼠肠道推进率,减轻结肠组织病理和ICC 形态学改变,减少ICC 线粒体自噬,且可上调结肠组织C-kit 表达,抑制PINK1/Parkin 通路,下调PINK1、Parkin、Beclin1、LC3 表达,抑制p62 表达,其中50 Hz电针的作用显著优于2 Hz 电针。

