高危型HPV感染亚型分布及其与宫颈病变和宫颈癌的关系
木朝宇,张晓梅,范德胜,刘培明,姚慧琳
宫颈癌(cervical cancer,CC)是女性中最常见的癌症之一[1],全球诊断出527 600例新的CC病例,仅2012年就有265 700例CC相关死亡[2]。 CC在15~44岁的女性中普遍存在,是第8位最常见的女性癌症[3]。在全球范围内,中国占新CC病例的11.9%,每年死亡率为11.1%[4]。流行病学评估在无干预的情况下,中国新发CC的发生率可能会从2010年到2050年增加40%~50%[5]。
人乳头瘤病毒(human papillomavirus,HPV)属于高度异质性的DNA病毒,可引起皮肤和黏膜上皮内细胞内瘤变。大约40种HPV基因型感染生殖道黏膜,这已被证明是宫颈鳞状上皮内瘤变(CIN)和CC的主要原因[6]。HPV可根据其与癌前病变的关联性分为高危型(high-risk,HR)和低危型(low-risk,LR),有报道指出HPV高危亚型的持续性或反复性感染是CC及其癌前病变进展的重要危险因素[7]。目前共18种HPV亚型(包括-16,-18,-26,-31,-33,-35,-39,-45,-51,-52,-53,-56,-58,-59,-66,-68,-73和-82等)被归类为能促进宫颈病进展为CC的高危亚型[7]。生殖道高危型HPV感染情况由于地域、气候条件和种族的差别等因素的影响,HPV亚型的分布在全球范围内具有差异性。一项覆盖五大洲数百万病例的研究[8]表明,HPV-16是世界上最流行和致癌的基因型,其次是HPV-18。然而,在巴西排名第二的是HPV-31和HPV-33,在非洲排名第二的是HPV-52[8-9],以上表明在某些地区非HPV-16/18亚型的重要性。有研究[11-13]表明CIN病人中最常见的三种HR HPV亚型是HPV-52、HPV-16和HPV-58[10]。
在我国,HPV的基因型分布也存在地理上的差异[14-19]。因此,为了有效使用HPV疫苗以及优化CC预防策略,HR HPV亚型在特定区域分布以及相关宫颈癌前病变(CPLs)与CC病人中流行特征有必要进行深入的了解。本研究中对安徽北部地区HPV感染女性病人中高危亚型的流行及其CPLs与CC分布特征进行分析,旨在为该地区有效接种HPV疫苗预防CC提供参考依据。
1 对象与方法
1.1 研究对象 2017年3月至2019年5月淮北矿工总医院就诊、筛查和体检并接受HPV分型检测的女性6 382例(淮北矿工总医院集团包括淮北市精神病院等在内的14家分院,27个矿区卫生站,分布在安徽北部的淮北市、宿州市和亳州市),该研究人群年龄19~90岁。根据HPV检测结果,仅有一种亚型感染者定义为单一感染,而两种或者两种以上亚型混合感染者定义为多重混合感染。840例HR HPV感染样本病理结果分为四组:其中正常组(包括慢性宫颈炎病人等)693例,低度鳞状上皮内病变(LSIL)(CIN Ⅰ)组73例,高度鳞状上皮内病变(HSIL)(CIN Ⅱ与CIN Ⅲ)组40例,CC组34例。
1.2 试剂与仪器 HPV核酸扩增分型检测试剂盒、核酸分子快速杂交仪,均为中山大学达安基因股份有限公司配套仪器和试剂;核酸扩增仪为美国ABI7500 PCR仪。
1.3 方法
1.3.1 样本采集 宫颈样本由妇科医生通过细胞刷获得,并将采集宫颈上皮脱落细胞标本置于样本保存液中,4 ℃冰箱储存备用。
1.3.2 核酸抽提 将样品混合并放入带有1 mL细胞保存溶液的1.5 mL离心管中,以12 000 r/min离心3 min,除去上清液,在向沉淀物加入1 mL 0.9%氯化钠溶液后涡旋混匀,以12 000 r/min离心3 min,再次除去上清液,并将100 μL变性试剂(中山大学达安基因股份有限公司)加入到沉淀中并涡旋混匀。然后,将样品在100 ℃温育10 min,并以12 000 r/min离心3 min,收集上清液,并所得核酸用于实验或于-20 ℃中保存待用。
1.3.3 PCR-DNA反向点杂交技术 PCR反应条件为:95 ℃、15 min;95 ℃、40 s,55 ℃、40 s,72 ℃、40 s,40个循环;72 ℃、7 min,4 ℃维持,即可得到扩增的PCR产物。然后,将扩增的产物纯化,变性并杂交。核酸分子杂交及HPV基因分型的显色结果判定分析等过程均参考试剂盒说明书。试剂盒检测的高危亚型包括15种高危亚型(16、18、31、33、35、39、45、51、52、56、58、59、68、73和82)。
1.4 宫颈组织病理活检 对于宫颈液基细胞学和高危型HPV检查结果出现异常的病人会建议其进行宫颈组织病理活检,采取阴道下行宫颈组织活检的检查方法,并将采集的标本送检。本研究中宫颈组织病理检查数据由我院病理科提供。
1.5 统计学方法 采用χ2检验。
2 结果
2.1 HR HPV感染的流行性 本研究中6 382例样本基因分型检测显示HR HPV感染率为13.16%(840/6 382)。HR HPV亚型感染包括高危单一型(530,8.30%),高危混合型(122,1.91%)以及高低危混合型(188,2.95%)。
2.2 HR HPV感染亚型分布 HR HPV 15种亚型均被检出,所有高危亚型总频数为1 114,亚型的前5名依次为HPV-52(17.70%,197/1114)、HPV-16(14.54%,162/1 114)、HPV-58(10.30%,115/1 114)、HPV-51(7.00%,78/1 114)、HPV-56(6.55%,73/1 114)。HPV单一感染中高危亚型总频数为530,主要亚型依次为HPV-16(9.00%,100/1114)、HPV-52(8.20%,91/1 114)、HPV-58(5.50%,61/1 114)、HPV-39和HPV-51(3.14%,35/1 114)以及HPV-68(3.10%,34/1 114)等;HPV高危多重感染中高危亚型总频数为584,主要亚型依次为HPV-52(9.51%,100/1114)、HPV-16(5.57%,62/1114)、HPV-58 和HPV-53(4.84%,54/1114)、HPV-51(3.86%,43/1114)以及HPV-56(3.77%,42/1 114)等。
2.3 HR HPV亚型及宫颈病变在不同年龄组中的分布 不同年龄段女性病人人群HR HPV感染阳性占比以41~50岁年龄段为最高(38.30%),其次是51~60岁(24.40%),31~40岁(20.10%),≥61岁(9.10%),≤30岁(8.10%)。HR HPV感染病人的阳性占比随着年龄的增长而增大,在41~50岁年龄段达到最高,随后呈下降趋势,各年龄组感染差异无统计学意义(χ2=7.53,P>0.05);同时,41~50岁也是HR HPV亚型频数分布最多的年龄段(36.00%),其次是51~60岁(24.10%),31~40岁(19.74%),≥61岁(11.58%),≤30岁(8.61%)。其中主要的亚型依次是HPV-52(18.20%,106/584)、HPV-16(10.60%,62/584)和HPV-58(9.20%,54/584)。此外,HR HPV感染病人中宫颈病变的分布也主要集中在41~50岁(42.09%,63/147),其次是51~60岁(27.20%,40/147),31~40岁(17.00%,25/147),≥61岁(11.60%,17/147),≤30岁(1.40%,2/147)。LSIL与HSIL分布随年龄段增大而增加,在41~50岁达到最高,随后降低;而CC分布则在41~50岁和51~60岁年龄段达到最高,随后呈下降趋势。
2.4 HR HPV感染中CPLs及CC的分布 840例HR HPV感染中病理诊断包括正常组693例,LISL组73例,HSIL组40例及CC组34例。HR HPV单一感染中正常组421例,LISL组52例,HSIL组28例及CC组29例,而多重感染中正常组272例,LISL组21例,HSIL组12例及CC组5例,HR HPV单一感染与多重感染在CPLs及CC分布上差异具有统计学意义(χ2=11.73,P<0.01)。随着宫颈病变等级的增加,HPV感染阳性占比均逐渐降低。同样,随着宫颈病变程度的加重,HR HPV感染的阳性占比也基本呈现降低的趋势。此外,147例宫颈病变病人HR HPV亚型频数分布为:LSIL组分布有16种高危亚型,出现频率较高的亚型依次为HPV-16、HPV-52、HPV-58和HPV-56等;其中HSIL组分布有11种高危亚型,主要亚型依次为HPV-16、HPV-33、HPV-58以及HPV-52等;CC组分布有11种高危亚型,主要亚型依次为HPV-16、HPV-58、HPV-18和HPV-68、HPV-39等(见表1)。
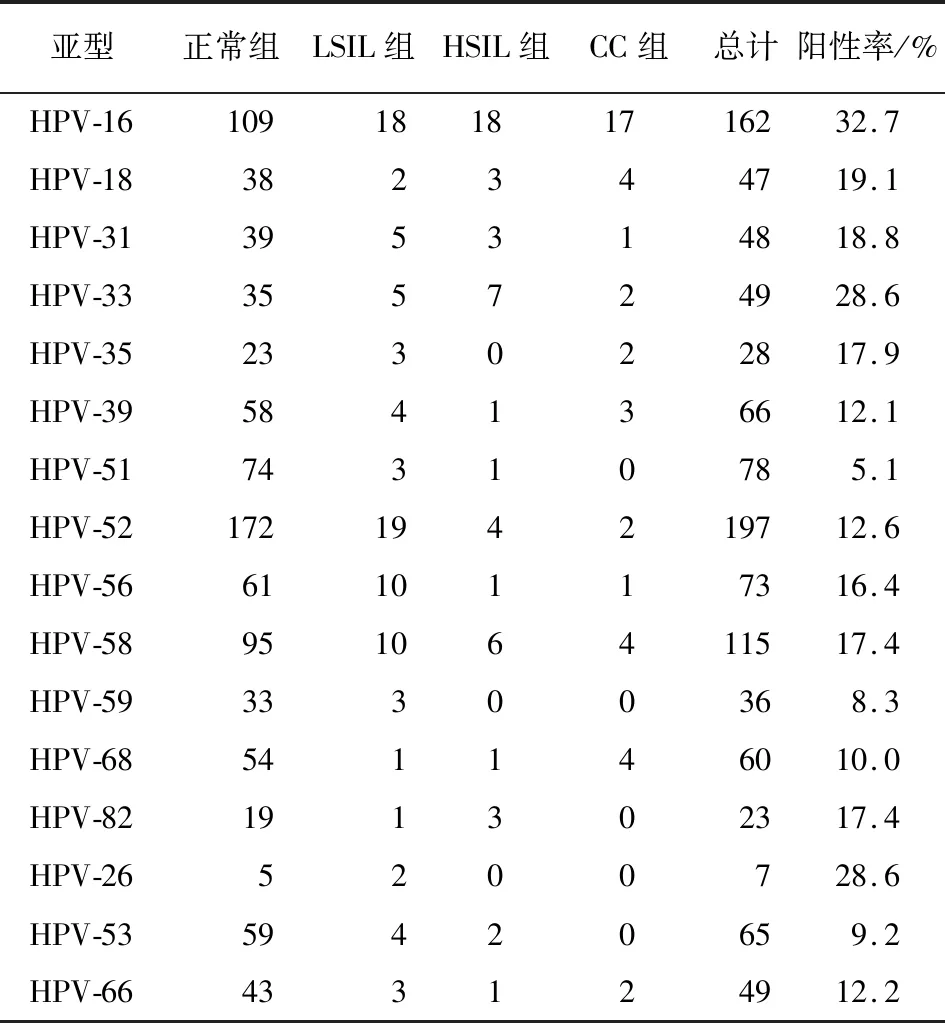
表1 HR HPV感染亚型中LSIL、HSIL及CC的分布
3 讨论
CC是中国女性最常见的癌症之一。据估计,每年有85 000例新病例发展为HPV相关癌症,其中75 000例被诊断为CC[20]。由于HPV感染是CC的主要原因[21],因此有必要评估HPV感染率以及HR HPV亚型在女性中的分布特征,以筛查CC的风险。然而,在我国不同人口和地区之间不仅HPV基因型流行分布具有地域性,同时其感染率也存在差异性。HPV感染率如北京(6.70%)、曲靖(8.30%)、新疆(8.27%)、浙江(10.20%)、云南(12.90%)、山西(14.80%)和辽宁(10.30%)[22-28]。本研究显示,女性病人的总体HPV患病率(包括高风险和低风险HPV)为16.40%,略高于报告的自然感染率。相比于以上地区,本研究中HPV感染率较高。相比以下地区,安徽省北部HPV感染率较低,如青岛(32.20%),哈尔滨(36.45%)和中国东南部(22.30%)[17-18,29]。
本研究中,HR HPV的感染主要基因型为HPV-52、HPV-16和HPV-58,与东亚地区HPV感染中HPV-52和HPV-58占比较高的报道相似[10,13,30]。与我国其他地区相比,这三种最常见的HR-HPV亚型(HPV-16、HPV-52和HPV-58)的流行与青岛市、山西省和辽宁省的报道相似,但与新疆省(HPV-16、HPV-58和HPV-39),中国东南部(HPV-16、HPV-18和HPV-58),北京(HPV-16、HPV-58和HPV-33)和哈尔滨市(HPV-16、HPV-33和HPV-81)的HR HPV流行不同。相比之下,HPV-18尽管被证明是全球第二常见的基因型[8,31],但在本研究中的感染频率较低(47/1 114,4.22%)。特别是HPV18在CC的亚型分布中依然是排名第三的高危亚型,这也说明除了HPV-16、HPV-18的致病力是不容忽视的。
女性HPV感染流行的年龄特异性信息对于设计疫苗和预防CC的保护策略十分重要[18]。本研究中,41~50岁年龄组HR HPV感染阳性占比(38.30%)以及CPL和CC占比(42.90%)最高。其中41~50岁年龄组CPLs分布最高,而41~60岁年龄组CC的分布最高,这提示安徽北部地区41~50岁的女性感染HR HPV和CPLs发生的风险较高,而41~60岁年龄组发生CC的风险较大。安徽省北部地区感染HR HPV的41~50岁、41~60岁年龄组女性分别是CPLs、CC发生的高危人群,这与四川省的报道有所不同[32],临床应加强HR HPV感染的41~60岁女性人群CC的筛查力度。
本研究中HPV-16、HPV-52和HPV-58是导致CPLs和CC的主要基因型。CPLs和CC的HPV感染以单一亚型感染为主,这与CC倾向于HPV单一高危型的感染的报道一致[33]。尤其是HPV-16单一感染中,CPLs和CC占比均最高,与HPV基因型的致病力与宫颈病变、宫颈病变后病情进展以及癌病程度相关的文献报道一致[34-36]。值得注意的是,HPV52在HPV感染流行中排名第一,却在发生CPLs和CC的亚型分布中排名第二且主要引起LSIL,这也和国内的大多数文献报道相似。
综上所述,安徽北部地区HR HPV的感染流行亚型主要是HPV-52、HPV-16和HPV-58,41~50岁以及41~60岁年龄组女性分别是CPLs、CC发生的高危人群。HR HPV单一亚型(尤其HPV16单一亚型)感染是导致CPLs和CC的主要基因型。
(致谢:感谢本院病理科胡亚翎主任在本研究中给予的指导和科室同事们的帮助)

