基于柱前衍生化GC-MS技术探究紫苏叶与白苏叶的质量差异
陈家宝,杨贵雅,郭 龙,齐琳琳,温春秀,郑玉光,王 蕾*
1河北中医学院药学院;2河北省中药炮制技术创新中心;3河北省中药资源利用与质量评价国际联合研究中心,石家庄 050200;4河北省农林科学院经济作物研究所,石家庄 050051;5河北化工医药职业技术学院,石家庄 050026
紫苏Perillafrutescens(L.) Britt.为唇形科紫苏属一年生直立草本植物[1]。历代重要本草称叶两面全紫或面青背紫的为“苏”或“紫苏”,而将叶片全绿的称为“荏”,即“白苏”[2]。二者皆可作为蔬菜食用,但在使用过程中仍有一些区别。紫苏因富含天然色素广泛应用于天然食品着色剂领域[3],参考《中国药典》(2020版)中对紫苏叶药材的“两面紫或上表面绿色,下表面紫色”的性状描述,可知紫苏则为正品紫苏类药材的植物来源[4]。白苏除了作为蔬菜食用,还可用作食品防腐剂[5]。20世纪70年代《中国植物志》参考国外分类学家Elmer Drew Merrill的意见将“紫苏”和“白苏”合并为一种,称该原变种为P.frutescensvar.frutescens[1]。20世纪80年代,国内中医药学者基于对紫苏和白苏本草考证及功效差异的考量,建议将“紫苏”定名为P.frutescensvar.arguta,“白苏”定名为P.frutescensvar.frutescens.[6-8],并且Liu等[9]根据野外观察和栽培试验发现紫苏种子播种后仍全部为紫苏,白苏种子播种后其叶全部为两面绿的白苏,未发现变异。可见,紫苏在植物分类上至今仍存在一定的争议,需相关学者不断寻找可靠、普遍适用的特征作为紫苏与白苏分类的依据。
紫苏叶为紫苏P.frutescens(L.) Britt.的干燥叶(或带嫩枝),具有解表散寒,行气和胃的功效,常用于治疗风寒感冒,咳嗽呕恶,妊娠呕吐,鱼蟹中毒[4]。既然《中国植物志》将紫苏与白苏合并为一种,那么紫苏叶的来源植物也应包括白苏,然而白苏叶与紫苏叶在外观形态、化学成分等方面二者存在较大差异。Li等[10]收集了来自国内各地的不同紫苏种质,种植后观察记录形态特征并采用GC-MS技术确定其化学型,结果显示白苏叶多为两面绿色、PK(紫苏酮)型,紫苏叶多为两面紫色、PA(紫苏醛)型,二者的叶片大小、叶片平整度、叶片边缘等形态特征存在明显差异;Dai等[11]利用HPLC技术对紫苏叶与白苏叶中酚酸类物质的含量进行了比较,发现紫苏叶中原儿茶醛、咖啡酸、阿魏酸与迷迭香酸的含量均高于白苏叶;Shangguan等[12]采用可见分光光度法比较紫苏叶和白苏叶中的总黄酮的含量差异,结果表明紫苏叶中的总黄酮含量高于白苏叶;Huang等[13]利用HPLC技术比较分析了紫苏叶与白苏叶中的迷迭香酸的含量,发现在同一采收期紫苏叶中迷迭香酸的含量高于白苏叶。目前对紫苏叶与白苏叶化学成分差异的研究主要集中于挥发油、黄酮、酚酸等成分,尚缺乏对二者氨基酸、有机酸、糖类等成分含量差异的研究,有必要更加系统全面地分析紫苏叶与白苏叶的差异性。
本研究拟以紫苏叶与白苏叶为研究对象,建立柱前衍生化GC-MS分析方法,测定二者氨基酸、有机酸、糖类、脂肪酸、酚酸类等成分的含量;并通过主成分分析(principal component analysis,PCA)和正交偏最小二乘法判别分析(orthogonal partial least squares discrimination analysis,OPLS-DA)等多元统计分析方法比较二者化学成分差异,筛选出差异性标志物;通过系统研究紫苏叶与白苏叶化学成分差异,将为紫苏植物学分类及紫苏不同种质资源应用提供一定参考。
1 材料
Agilent 7890B-5977B型GC-MS仪(美国Agilent公司);SQP型十万分之一电子分析天平(赛多利斯科学仪器有限公司);BSA224S-CW型万分之一电子分析天平(赛多利斯科学仪器有限公司);Eppendorf 5418型高速台式离心机(艾本德中国有限公司);DUO型GeneVac miVac真空离心浓缩仪(上海德祥科技有限公司);MTH-100型恒温混匀仪(杭州米欧仪器有限公司)。
甲醇(美国飞世尔科技中国有限公司,纯度≥99.9%);甲酸(美国ROE SCIETIFIC INC,纯度≥99%);水(Milli-Q系统制备超纯水);水杨酸(上海罗恩试剂公司,纯度≥99.5%);无水吡啶(上海阿拉丁生化科技股份有限公司,纯度≥99.8%);甲氧胺盐酸盐(美国Sigma Aldrich公司,纯度≥97.5%);衍生化试剂MSTFA[N-甲基-N-(三甲基硅烷基)三氟乙酰胺](美国Sigma Aldrich公司,纯度≥98.5%);氨基酸混标(日本和光纯药株式会社(WAKO),批号:KCN6130,内含L-天冬氨酸、L-苏氨酸、L-丝氨酸、L-谷氨酸、L-脯氨酸、L-甘氨酸、L-丙氨酸、L-胱氨酸、L-缬氨酸、L-甲硫氨酸、L-异亮氨酸、L-亮氨酸、L-酪氨酸、L-苯丙氨酸、L-赖氨酸、L-组氨酸、L-精氨酸);有机酸混标(天津阿尔塔科技有限公司,批号:S051847,内含乳酸、酒石酸、苹果酸、柠檬酸、琥珀酸、富马酸);单糖混标(天津阿尔塔科技有限公司,批号:S029641,内含D-果糖、D-葡萄糖、D-蔗糖、D-麦芽糖、D-乳糖);棕榈酸(天津阿尔塔科技有限公司,批号:1ST1714,纯度≥99.9%);油酸(天津阿尔塔科技有限公司,批号:1ST1738,纯度≥99.5%);α-亚麻酸(天津阿尔塔科技有限公司,批号:1ST1776,纯度≥98.5%);咖啡酸(上海源叶生物科技有限公司,批号:Y09J8C28349,纯度≥98.0%);迷迭香酸(上海源叶生物科技有限公司,批号:Y06A9K67402,纯度≥98.0%)。
12批紫苏叶与10批白苏叶均由河北省农业科学院经济作物研究所温春秀教授提供,经河北中医学院郑玉光教授分别鉴定为紫苏P.frutescensvar.arguta及白苏P.frutescensvar.frutescens的干燥叶,样品存放于河北中医学院中药炮制技术创新中心,样品来源信息见表1。

表1 紫苏叶与白苏叶样品信息Table 1 Information of leaves of Perilla frutescens var.arguta and P.frutescens var.frutescens samples
2 方法
2.1 GC-MS条件
气相色谱条件:以HP-5石英毛细管柱(0.32 mm×30.0 m,0.25 μm)为色谱柱,分流比为5∶1,载气为高纯氦气,进样口温度250 ℃,进样量1 μL,程序升温(初始温度从80 ℃开始,以10 ℃/min升温到200 ℃;以6 ℃/min升到250 ℃,以10 ℃/min升温到310 ℃,保持5 min)。
质谱条件:采用电子轰击离子源(electron impact ion source,EI),离子能量70 eV,接口温度为250 ℃,离子源温度230 ℃,四级杆温度150 ℃,TIC扫描质量范围m/z50~500,溶剂延迟时间为3 min。
2.2 溶液的制备
2.2.1 供试品溶液的制备
将干燥的紫苏叶样品净选后粉碎,过60目筛。分别称取各样品粉末0.1 g,置于1.5 mL离心管中,加入1 mL提取溶剂(甲醇-水-甲酸70∶28∶2),充分振摇,室温下超声(功率300 W,频率40 kHz)15 min。13 000 r/min高速离心10 min,取上清液50 μL,加入20 μL水杨酸(1 mg/mL)作为内标,真空浓缩90 min(40 ℃)挥干溶剂后加入20 μL甲氧胺吡啶溶液(40 mg/mL),充分振摇,在金属浴30 ℃下肟化90 min。接着加入80 μLN-甲基-N-(三甲基硅烷)三氟乙酰胺(MSTFA),在金属浴37 ℃下充分反应30 min,进行硅烷化反应。最后将样本于13 000 r/min离心10 min,取上清液,制备供试品衍生化溶液。
2.2.2 对照品溶液的制备
称取或吸取氨基酸混标、有机酸混标、单糖混标、棕榈酸、油酸、α-亚麻酸、咖啡酸、迷迭香酸对照品适量,加溶剂(甲醇-水-甲酸70∶28∶2)配制成含氨基酸混标2.5 μmol/mL、有机酸混标4.0 mg/mL、单糖混标5.0 mg/mL、棕榈酸0.5 mg/mL、油酸2.0 mg/mL、α-亚麻酸0.5 mg/mL、咖啡酸2.0 mg/mL、迷迭香酸20.0 mg/mL的混合对照品母液。将对照品母液用溶剂(甲醇-水-甲酸70∶28∶2)逐级稀释呈一系列梯度浓度溶液(氨基酸混标0.1562~2.50 μmol/mL、有机酸混标0.25~4.0 mg/mL、单糖混标0.3125~5.0 mg/mL、棕榈酸0.0312~0.5 mg/mL、油酸0.125~2.0 mg/mL、α-亚麻酸0.0312~0.5 mg/mL、咖啡酸0.125~2.0 mg/mL、迷迭香酸1.25~20.0 mg/mL),取上清液20 μL进行衍生化反应,衍生化后按“2.1”项下条件进行GC-MS分析,测定峰面积。
2.3 方法学考察
2.3.1 精密度试验
取紫苏叶(Z1)供试品衍生化溶液,按照“2.1”项下条件进行GC-MS分析,连续进样6次,记录色谱图。以水杨酸(内标)峰为参照峰,计算各代谢物的相对保留时间和相对峰面积,结果各代谢物相对保留时间RSD≤0.07%(n=6),相对峰面积的RSD在0.53%~2.13%(n=6),表明仪器精密度良好。
2.3.2 稳定性试验
取紫苏叶(Z1)供试品衍生化溶液,分别于室温密封条件下在0,2,4,8,12,24 h进样分析,以水杨酸(内标)色谱峰为参照峰,计算各对照品衍生物的相对保留时间和相对峰面积,结果各对照品衍生物相对保留时间RSD≤0.16%(n=6),相对峰面积的RSD在0.83%~2.06%(n=6),表明供试品衍生化溶液在24 h之内稳定性良好。
2.3.3 重复性试验
取紫苏叶(Z1)样品粉末6份,每份0.1 g,按“2.2.1”项下方法平行制备供试品衍生化溶液,按照“2.1”项下条件进行GC-MS分析,以水杨酸(内标)色谱峰为参照峰,计算各对照品衍生物的相对保留时间和相对峰面积,结果各对照品衍生物相对保留时间RSD≤0.24%(n=6),相对峰面积的RSD在0.53%~2.01%(n=6),表明所建方法重复性良好。
2.3.4 加样回收率试验
取已知含量的紫苏叶或白苏叶样品粉末6份,每份0.05 g,分别加入混合对照品溶液适量,按“2.2.1”项下方法平行制备供试品衍生化溶液,进行GC-MS分析,计算含量。结果显示各对照品衍生物的平均加样回收率在96.73%~104.61%(n=6),RSD在0.93%~2.55%(n=6),表明所建的含量测定方法准确性良好,结果见表2。
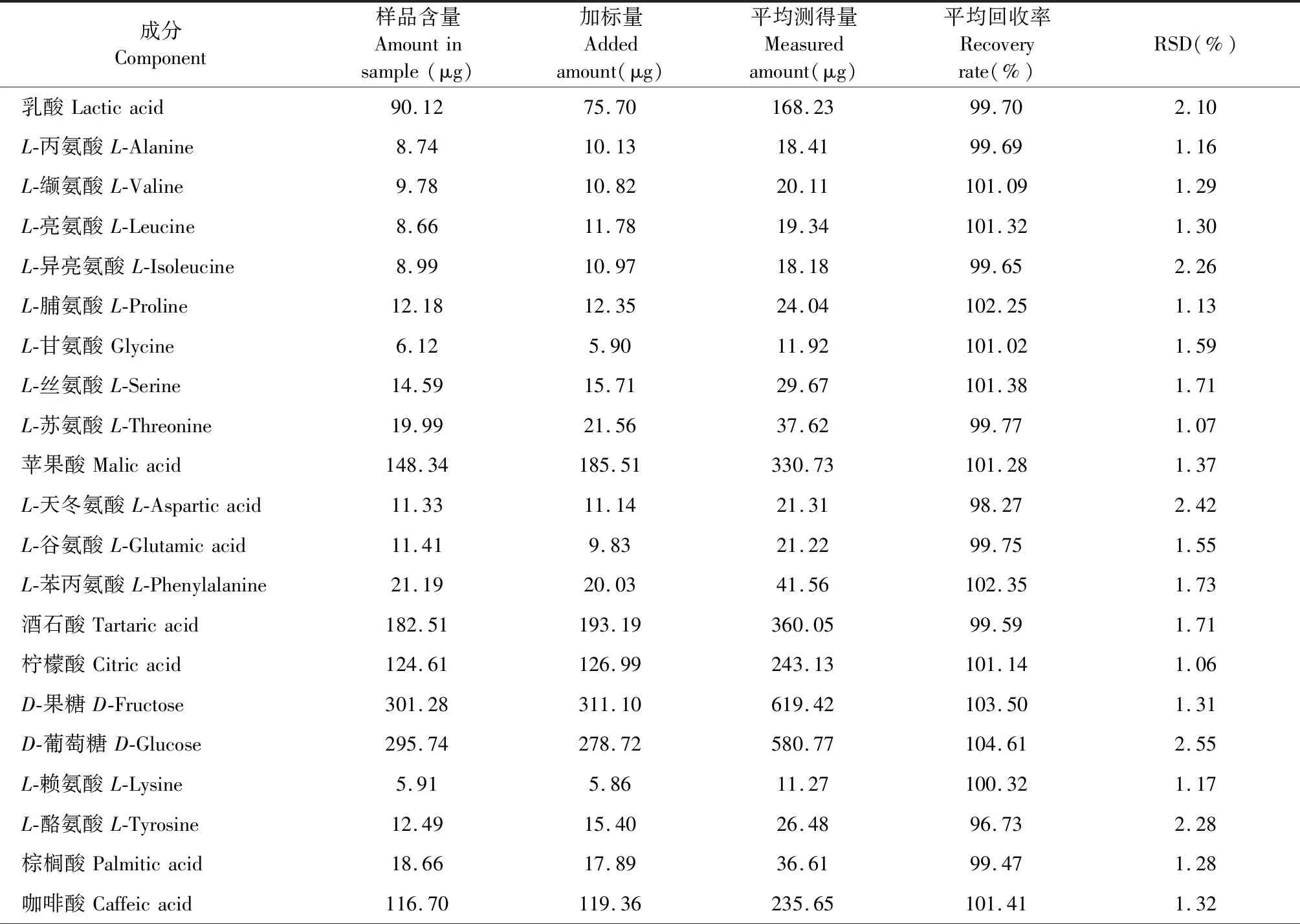
表2 加样回收率考察结果Table 2 Recovery test results of the samples

续表2(Continued Tab.2)
2.4 数据处理与分析
数据经过Qualitative Navigator(B.08.00)软件分析并与NIST17标准质谱检索库进行检索比对,对各色谱峰进行定性分析;利用Quant Analysis(B.09.00)批处理软件提取各样品中对应峰的峰面积;利用多元变量统计分析软件SIMCA 14.1进行主成分分析(PCA)及正交偏最小二乘法判别分析(OPLS-DA)筛选出差异性代谢物(VIP>1,P<0.05);采用Origin 2018软件绘制相关图形。
3 结果与讨论
3.1 定性分析
将“2.2.1”与“2.2.2”项下所得到的供试品与对照品衍生化溶液按“2.1”项下实验条件进样分析,得到紫苏叶和白苏叶样品GC-MS总离子流图(见图1A、1B)与对照品GC-MS总离子流图(见图1C)。采用Qualitative Navigator(B.08.00)软件对样品代谢产物的总离子流图进行匹配。结果,共得到58个特征峰(包含内标水杨酸),约占总峰面积90%。通过将各峰质谱图与NIST17.0数据库进行检索比对,鉴别得到58个特征峰所对应的代谢产物(见表3),分别属于有机酸类、糖类、氨基酸类、脂肪酸类等。
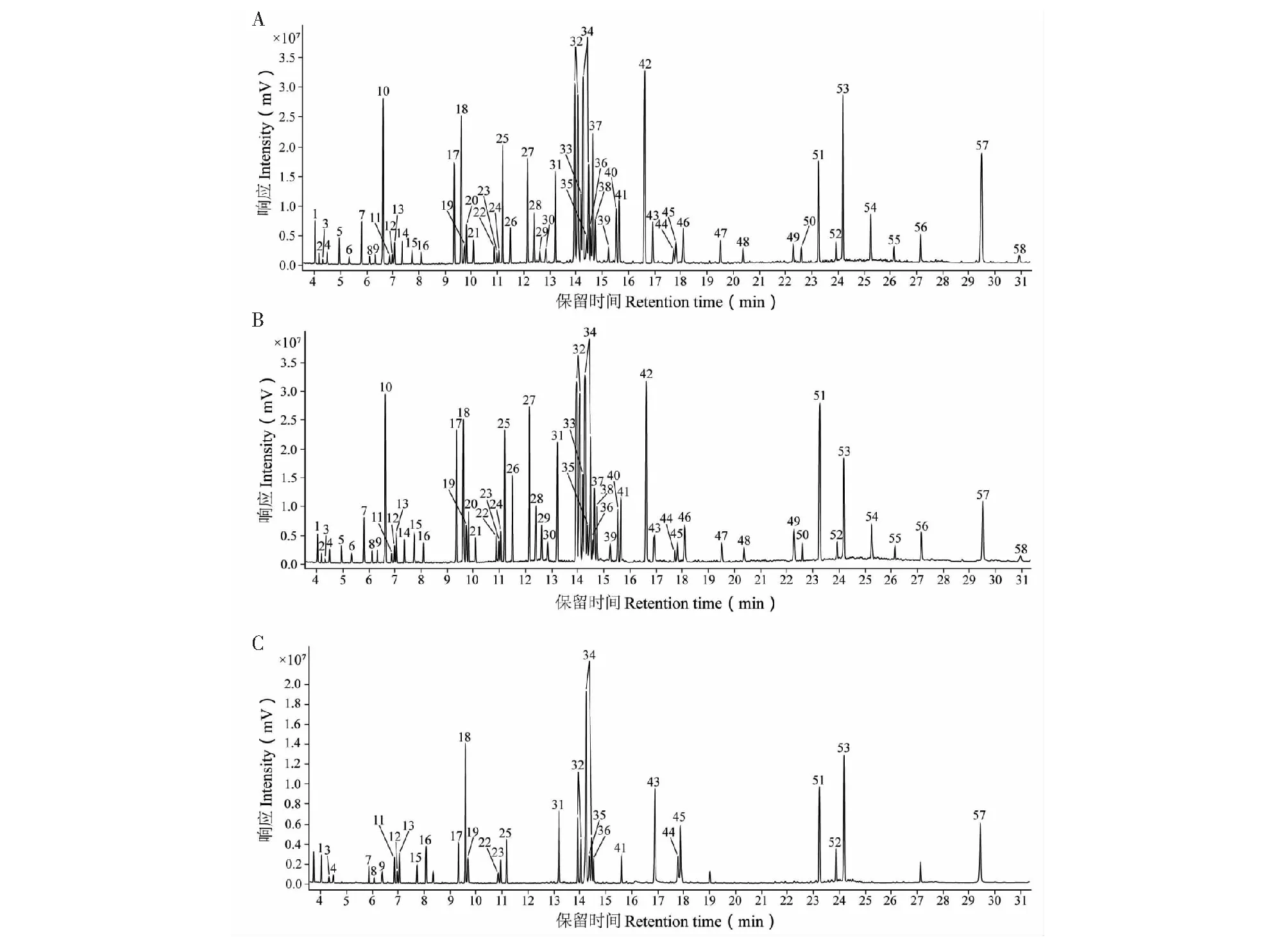
图1 基于柱前衍生化的紫苏叶(A)与白苏叶(B)样品及混合对照品(C)GC-MS总离子流图Fig.1 Total ion chromatograms (TIC) of leaves of P.frutescens var.arguta (A) and P.frutescens var.frutescens (B) and reference substance (C) by GC-MS after pre-column derivatization

表3 紫苏叶与白苏叶代谢产物相关信息Table 3 The information of metabolites in leaves of P.frutescens var.arguta and P.frutescens var.frutescens
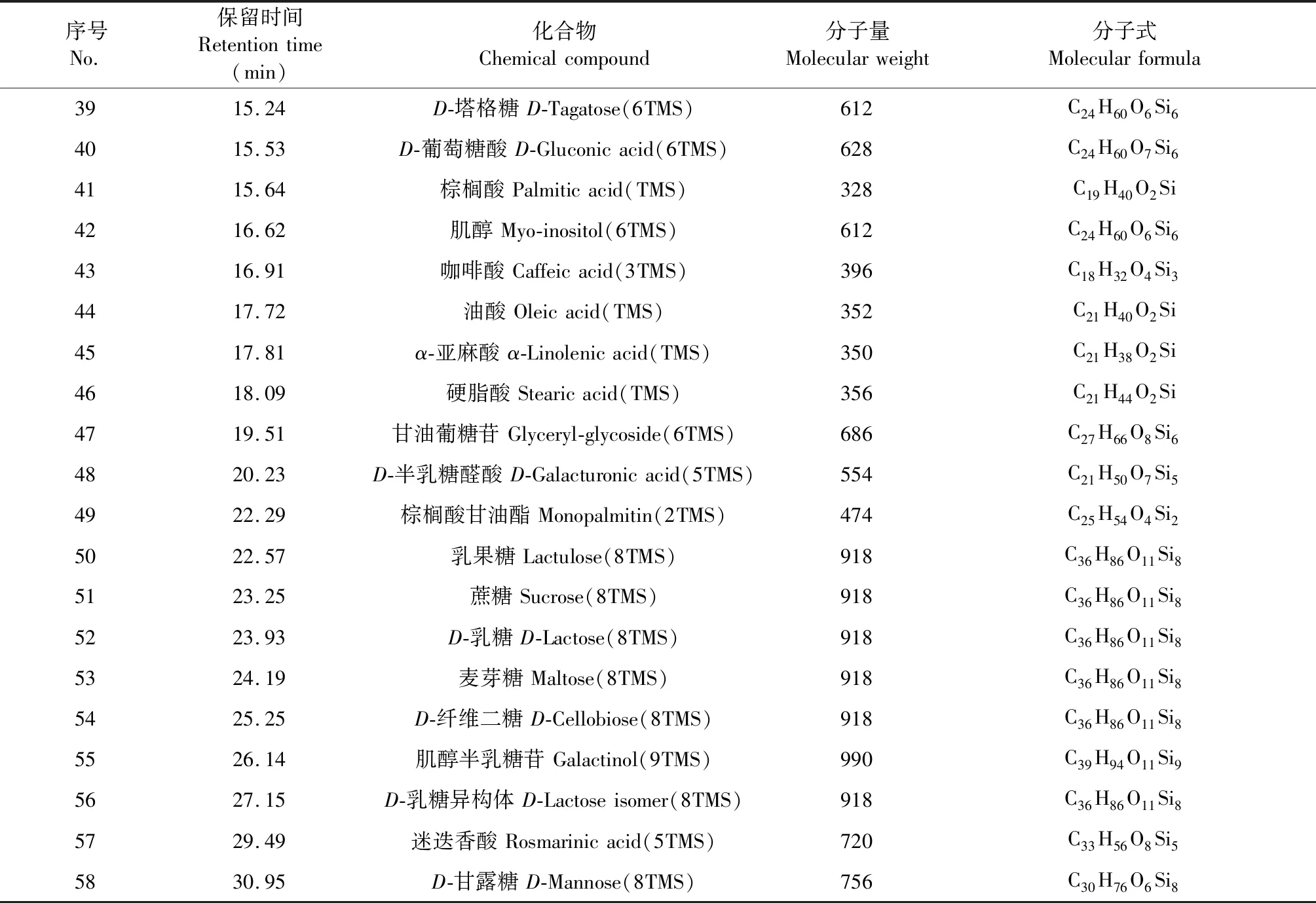
续表3(Continued Tab.3)
3.2 差异性化合物的筛选
为比较紫苏叶和白苏叶化学成分差异,采用Quant Analysis(B.09.00)批处理定量分析软件积分并提取所有样品中所鉴定的代谢产物的峰面积并进行相对含量分析,将共有化合物的峰面积合并归一化后的数据导入SIMCA 14.1软件中进行无监督的主成分分析(PCA)。主成分分析结果显示紫苏叶(Z1~Z12)与白苏叶(B13~B22)明显分布于2个区域(见图2A),提示紫苏叶和白苏叶中代谢产物的含量存在一定差异性。为了进一步区分紫苏叶和白苏叶,寻找二者之间关键差异性成分,在进行了无监督的主成分分析的基础上,进一步对样品数据进行了有监督的正交偏最小二乘法判别分析(OPLS-DA)。建立的偏最小二乘法判别分析模型中,累计解释能力参数R2Y与Q2分别为0.981、0.957,提示所建立的模型稳定性和预测能力较好,可用于区分紫苏叶和白苏叶样品。OPLS-DA得分图与主成分分析结果一致,紫苏叶和白苏叶可以较好地分为2类(见图2B)。进一步根据OPLS-DA模型中各化学成分的变量重要性投影(variable importance in projection,VIP)预测值来筛选差异性化合物。一般认为在95%的置信区间内,VIP>1.0的化合物在2组分类中发挥着重要作用。在此基础上,比较各成分在紫苏叶及白苏叶中的平均相对含量是否存在显著性差异(P<0.05),基于上述标准,从鉴别出来的代谢物中筛选得到8个差异性代谢物,分别为D-阿拉伯糖醇(峰27,VIP=1.109,P<0.001)、D-果糖(峰32,VIP=1.509,P<0.001)、D-半乳糖(峰33,VIP=1.022,P<0.001)、D-葡糖醇(峰37,VIP=1.483,P<0.001)、D-山梨糖醇(峰38,VIP=1.236,P<0.001)、咖啡酸(峰43,VIP=2.022,P<0.001)、麦芽糖(峰53,VIP=3.002,P<0.001)、迷迭香酸(峰57,VIP=4.872,P<0.001)(见图3)。比较这8个差异性代谢物在紫苏叶与白苏叶中的平均含量表明,紫苏叶中D-果糖、D-葡糖醇、咖啡酸、迷迭香酸的含量显著高于白苏叶,D-阿拉伯糖醇、D-半乳糖、D-山梨糖醇的含量显著低于白苏叶(见图4)。

图2 PCA(A)和OPLS-DA(B)的得分图Fig.2 PCA (A) and OPLS-DA (B) score plots注:Z:紫苏叶;B:白苏叶。Note:Z:Leaves of P.frutescens var.arguta;B:Leaves of P.frutescens var.frutescens.
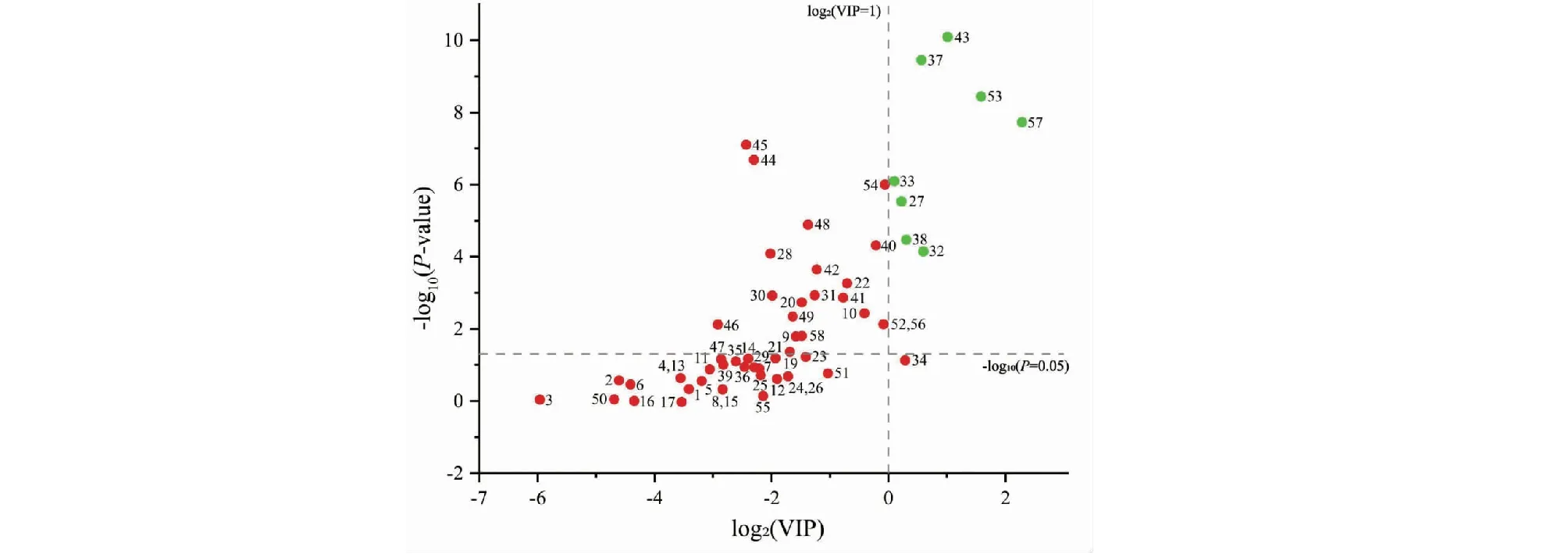
图3 P值与VIP值分布散点图Fig.3 Scatter plot of P-value and VIP value注:绿色的点代表VIP>1、P<0.05的差异性化合物。Note:Green points represent the differential compounds with VIP>1,P<0.05.
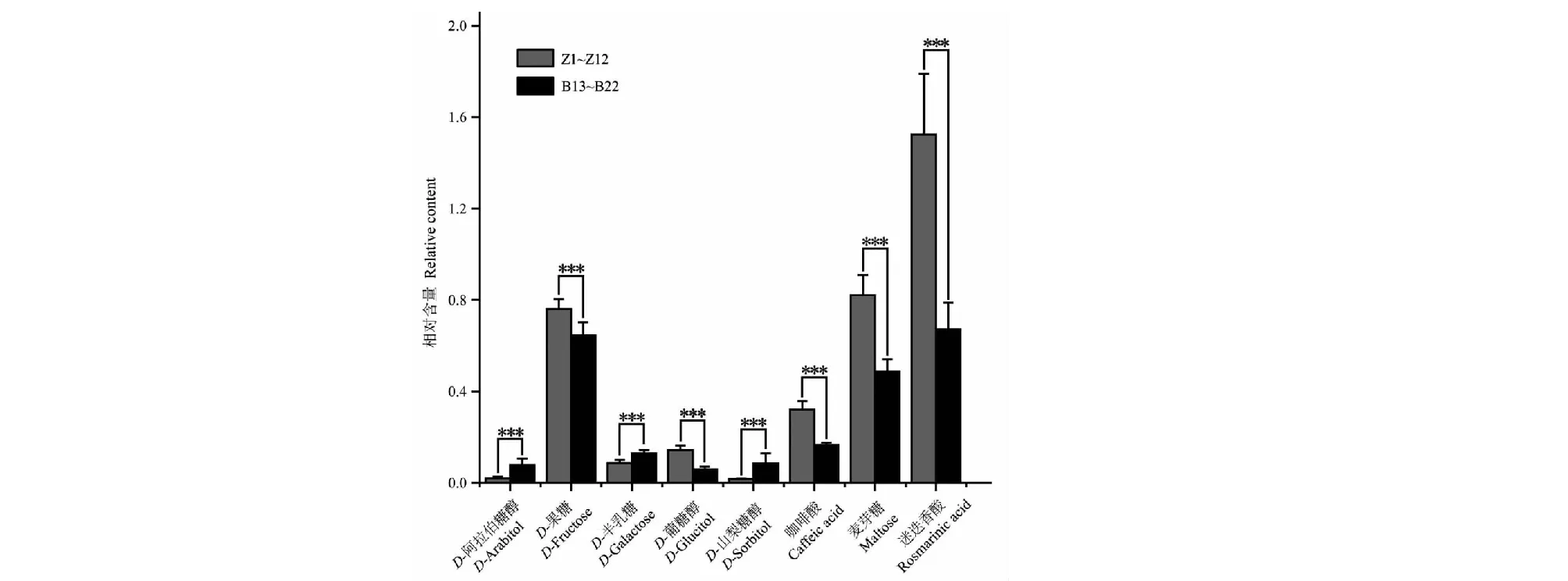
图4 差异性代谢产物柱状图 Fig.4 Bar chart of significantly different metabolites 注:二者相互比较,*P<0.05,**P<0.01,***P<0.001。Note:Both compared with each other,*P<0.05,**P<0.01,***P<0.001.
3.3 定量分析
3.3.1 线性关系考察
分别以对照品质量浓度(mg/mL)为横坐标(X),相应对照品衍生物的峰面积为纵坐标(Y),绘制标准曲线,得到各成分回归方程。所测定的27个化学成分在各自质量浓度范围内呈良好线性关系,R2在0.997 2~0.999 6之间(见表4)。

表4 对照品的线性回归方程及相关系数Table 4 Linear regression equation and correlation coefficient of reference substances
3.3.2 含量测定
按照“2.2.1”项下方法制备22批样品供试品衍生化溶液,按“2.1”项下条件进行GC-MS分析,将测定的各对照品成分的峰面积代入各回归方程进行计算,得到样品中各对照品成分的含量,计算紫苏叶与白苏叶中各成分含量的平均值见表5。其中紫苏叶中的L-亮氨酸、L-天冬氨酸、咖啡酸、α-亚麻酸、乳糖、麦芽糖及迷迭香酸平均含量显著高于白苏叶;而L-谷氨酸、棕榈酸、油酸平均含量则显著低于白苏叶(P<0.05)。

表5 紫苏叶和白苏叶中对照品成分的含量测定结果Table 5 Results of the determination of reference substances in leaves of P.frutescens var.arguta and P.frutescens var.frutescens
4 讨论与结论
当前紫苏与白苏的分类争议尚未解决,《中国植物志》的拉丁名将紫苏与白苏合并为一种,但《中国药典》性状描述中明确提出叶片单面紫或双面紫,可见药典规定的药用紫苏品种不包括白苏。多年来,对紫苏叶与白苏叶差异性研究主要集中于次级代谢产物,目前已在紫苏叶中分离鉴定出超过两百种[14]化学物,主要为挥发油类(紫苏醛、紫苏酮等)、酚酸类(迷迭香酸、咖啡酸等)与黄酮类(木犀草素、芹菜素等)。这些成分对紫苏叶的品质有重要贡献[15-17]。其实,除了这些前人研究较多的次级代谢产物外,紫苏叶中还存在一些极性较强的初级代谢产物,如糖类、氨基酸、有机酸等,对紫苏叶品质亦有重要贡献[18,19]。对于这些初级代谢产物的研究较少的部分原因是缺乏完善的分析方法。为了比较紫苏叶与白苏叶中这些成分的含量差异,本文采用了柱前衍生化GC-MS技术,该技术是在样品进行GC-MS分析前利用化学方法将目标物质修饰成类似化合物,从而使目标化合物的极性和沸点降低,增强物质的挥发性和热稳定性,更方便于非挥发性物质定性定量分析的一种技术。本研究所建立的紫苏叶样品柱前衍生化方法,条件温和、操作简单、样品稳定性好、结果准确,可以用作紫苏叶中氨基酸类、糖类、脂肪酸类、酚酸类等成分快速、高通量分析测定的方法。
紫苏叶为传统的药食两用植物。本研究对紫苏叶与白苏叶中多种成分的定性和定量分析结果显示二者中均含有6种人体必需氨基酸(L-缬氨酸、L-亮氨酸、L-异亮氨酸、L-苏氨酸、L-苯丙氨酸、L-赖氨酸),且它们在紫苏叶中的平均含量均高于白苏叶,表明就氨基酸水平而言,紫苏叶的营养价值优于白苏叶。同时发现紫苏叶与白苏叶中均含有较高含量的迷迭香酸。迷迭香酸是一种天然存在的酚酸类物质,主要有抗炎、抗癌、抗菌、抗氧化和免疫抑制等多种活性[20-24],比较结果显示紫苏叶中迷迭香酸含量显著高于白苏叶,提示紫苏叶为更好的药用植物来源。而白苏叶中酒石酸、L-丙氨酸、L-甘氨酸、L-谷氨酸、棕榈酸、油酸等成分的含量高于紫苏叶,也存在一定食用与药用价值。上述结果表明紫苏叶与白苏叶的初级代谢产物存在显著差异,在植物学分类上将紫苏与白苏分开,有利于紫苏类药材的正本清源。上述结果对于紫苏叶的质量控制及优质紫苏种质的筛选具有重要的意义。

