对离子交换法软化自来水效果的研究
孟子纯
(陆军特种作战学院,广东 广州 510630)
随着社会经济的快速发展,人们的生活水平有了显著提升,同时也伴随着对饮用水水质要求的不断提高。而自来水中含有较多的钙、镁离子。过量的钙、镁离子易在脏器内形成积石或导致血管硬化,对身体健康造成负面影响;同时,这些钙、镁离子在工业生产过程中,容易在机器设备内壁形成水垢、水渣,易造成昂贵设备的使用寿命缩短、热能利用效率降低等后果。因此,生活或工业生产过程中,自来水在使用前应首先降低其钙、镁离子含量,而上述降低钙、镁离子含量甚至将其基本除去的过程就称为水的软化[1]。
在高等院校化学实验室中,通常使用离子交换法,以软化自来水的方式制备去离子水[2]。离子交换法降低自来水硬度的原理为:当自来水以一定速率流过树脂时,树脂上的H+与水中的Ca2+、Mg2+等阳离子交换,使水中多了H+而少了其它的阳离子;同样,自来水继续流过阴离子树脂时,树脂上的OH-与水中的Cl-等阴离子交换,使水中多了OH-而少了其它的阴离子;最终,水中的H+与OH-再次结合生成水,从而起到净化水的作用。交换反应以CaCl2为例,反应如下:



尽管离子交换法具有节能、成本低、易于管理、净化效果显著等优点,且应用范围日益扩大,但对于其软化自来水的效果,目前尚无明确的表征方法[3]。因此,本文在离子交换法处理自来水样品的基础上,采用分光光度法,测量并比较离子交换法处理前后自来水样品的吸光度值,以期定性确定水样中的Ca2+浓度变化情况,为离子交换法净化效果的表征提供相应的数据积累。
1 实验
1.1 试剂和仪器
实验所需药品试剂及仪器见表1、表2。
1.2 离子交换法处理自来水样品
用 500 mL 烧杯取自来水样 400 mL,令其依次通过阳离子交换柱、阴离子交换柱,并于出口处取得净化后水样。
1.3 样品溶液的配制
称取 1 g 偶氮胂Ⅲ,用 5 mL 氨水及 45 mL 超吹水溶解后,转入 1 L 容量瓶中,加超纯水至刻度线,配成0.1%偶氮胂Ⅲ溶液;称取 15 g 乙酸铵,用 80 mL 冰醋酸溶解后,转入 250 mL 容量瓶中,加超纯水至刻度线,配成pH=4的乙酸-乙酸铵缓冲溶液。
分别用 25 mL 比色管配制空白样(参比样)、处理后样品与处理前样品,配方见表3。

表1 实验药品试剂

表2 实验仪器

表3 样品溶液配方
上表中,除0.1%偶氮胂Ⅲ溶液使用 5 mL 吸量管进行移取、超纯水使用洗瓶定容至刻度线外,其余试剂均使用 10 mL 移液管进行移取。
1.4 分光光度法确定最佳吸收波长
第一步,用装有去离子水的比色皿,将分光光度计吸光度数值调为0.000,随后用另外一支比色皿取参比样,在550~750 nm 的范围内,以 10 nm 为变化梯度,分别测量参比溶液的吸光度值并记录;
第二步,比较上述测得的吸光度数值大小,判断吸光度数值的变化趋势,找出吸光度数值突然出现增大时对应的测量波长;
第三步,重复步骤一、二,得到四组测量数据;
第四步,比较第三步中测得的数值,将分光光度计测量波长设置为上述最佳吸收波长。
1.5 分光光度法检测钙离子
第一步,将参比样、待测样分别装入3支比色皿,外壁用滤纸擦干,放入样品室,盖上试样室盖;
第二步,将参比样拉入光路,按下“Zero”键,使显示器显示读数为0.000;
第三步,将待测样分别拉入光路,读取测试数据;
第四步,重复步骤一至三,得到四组测量数据;
第五步,测量完毕后,将比色皿从试样池中取出,清洗干净,擦干,放回比色皿盒(毛玻璃面朝上)。
2 结果与讨论
2.1 最佳吸收波长的确定
利用分光光度法确定最佳吸收波长的相关实验数值,详见表4,并绘制成折线图如图1所示。由图表可以看出,四组数据均在 650 nm 处出现了吸光度数值的突然增大,与数值的整体变化趋势(依次减小)相违背,因此,可确定 650 nm 为最佳测量波长。这是因为Ca2+与偶氮胂Ⅲ形成的配合物,在 650 nm 处有第二吸收峰[5]。
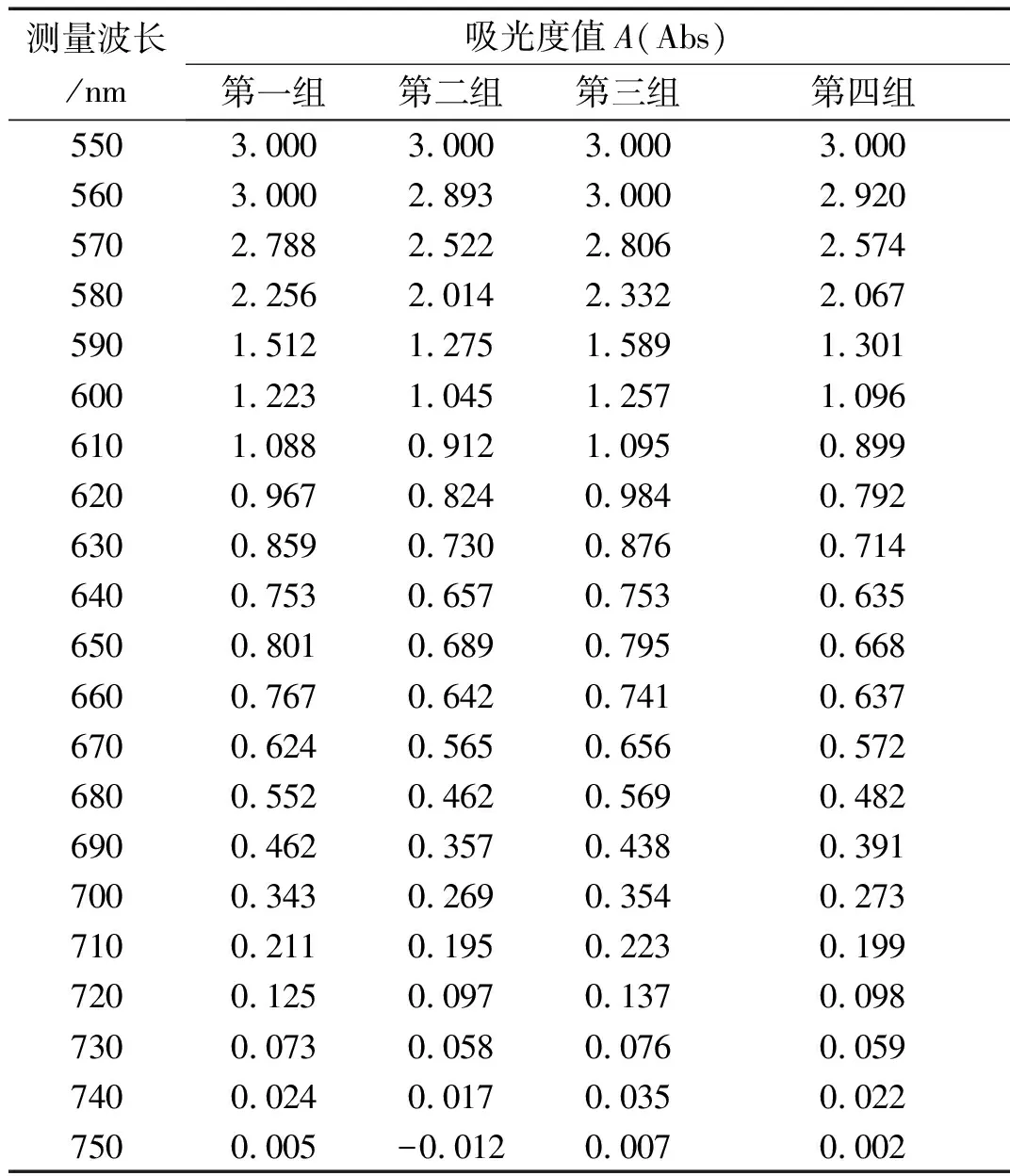
表4 分光光度法确定最佳吸收波长的四组相关数据

图1 测量波长λ与溶液吸光度A之间的定量关系
2.2 离子交换柱净化效果的确定
表5为 650 nm 下四组处理前、处理后样品的吸光度数值以及净化率。可以看出,离子交换法的净化率均高于90%,说明其对于水样中钙离子的去除效果较好;但净化率未达到100%,可能的原因在于水样中的部分Ca2+未被离子交换剂颗粒吸附,或吸附后的部分Ca2+未与与离子交换剂上的离子进行相互交换[6]。
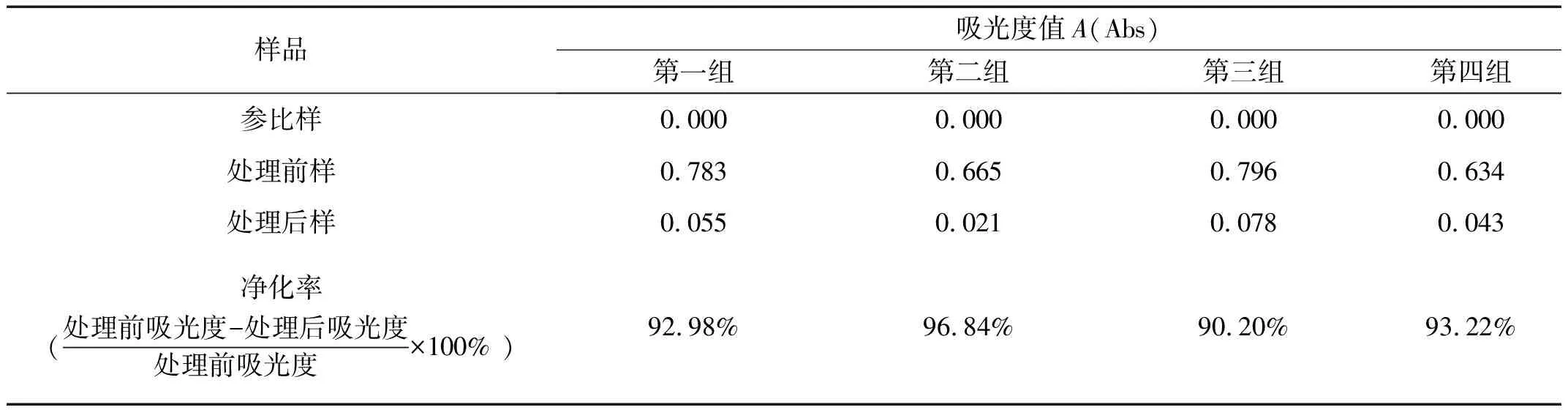
表5 处理前、处理后样品溶液的吸光度值及净化率
3 结语
本文对离子交换法软化自来水的效果进行了实验分析,确定检测时的最佳测量波长为 650 nm,与Ca2+和偶氮胂Ⅲ形成配合物的第二吸收峰对应波长相一致;同时,首次测得了离子交换柱的净化率,表明离子交换法可有效去除自来水中的Ca2+,但不彻底。上述实验结论为离子交换法净化效果的表征提供了相应的数据积累。

