草甘膦在环境介质中的残留及对环境生物的影响
沈文静,刘来盘,刘 标
(生态环境部南京环境科学研究所,南京 210042)
草甘膦,化学全称为N-磷酸甲基甘氨酸,化学式为C3H8NO5P,纯品为非挥发性白色无臭固体,主要存在形态为酸和盐类,熔点为230℃。溶于水,难溶于乙醇、乙醚和苯等有机溶剂,稳定性好,不可燃、不爆炸。20世纪70年代,人们发现该物质具有广谱除草功能。1974年,孟山都公司研发了草甘膦的商业产品‘农达’并将其推向市场,开启了将草甘膦作为除草剂大规模使用的序幕[1]。
草甘膦是一种内吸传导型、广谱灭生性有机膦类除草剂,通过竞争性地与植物体内5-烯醇式丙酮酰莽草酸-3-磷酸合酶(5-EPSP合酶)结合而抑制其活性,使得芳香族氨基酸合成代谢受阻,最终导致植物死亡[2]。草甘膦由于具有非选择性强、除草效果好等优点而被广泛使用,特别是随着耐草甘膦转基因作物的大面积种植,草甘膦已成为目前全球使用量最大的除草剂[3]。
本文总结了国内外关于草甘膦在土壤和水体中的降解、残留及其对土壤生物、水生/两栖动物、昆虫和鸟类等环境生物的影响的研究结果,以期为草甘膦在我国大面积使用后的环境安全管理提供科学参考。
1 耐草甘膦转基因作物的研发与草甘膦的大规模应用
20世纪90年代以来,转基因作物的田间种植规模逐渐扩大,2019年全球共种植转基因作物面积达1.9亿hm2,耐除草剂性状的作物占到转基因作物总种植面积的88%,其中耐草甘膦性状占绝大部分[4]。据估算,2020年草甘膦的全球使用量在60万~75万t,预计到2025年,其使用量在74万~92万t,快速上涨态势明显[5]。耐草甘膦转基因作物的大规模推广既提高了生产效率,降低了除草成本,具有显著经济效益,又因其他长残留除草剂使用量的减少而减轻了对水体和土壤的污染[6]。耐草甘膦转基因作物在带来收益的同时,也会引起多种环境问题。长期大量使用单一草甘膦除草剂,会导致杂草抗性的产生和发展,威胁草甘膦的持续使用。截至2021年,全球共有48种杂草对草甘膦产生抗性[7]。另外,随着草甘膦的大量施用,其在农田及周边土壤和水域中不断累积,并随着降水、侵蚀及径流进入河流湖泊、地下水、甚至是海洋中,威胁着生物多样性及生态环境安全。
2 草甘膦在环境介质中的残留
草甘膦进入土壤后与土壤颗粒结合紧密,在土壤中具有较低移动性和淋溶性,其污染水体的风险较低[8-9]。以比利时居民区为对象的研究结果显示,从雨水排放口中截获的草甘膦总量不足使用量的0.5%,说明绝大部分草甘膦留存在土壤中[10]。进入土壤和水体等环境中的草甘膦易发生水解、光解和微生物降解,其中微生物降解是草甘膦在自然环境中的主要降解方式。微生物降解草甘膦主要有2种途径,一是草甘膦在转氨酶的作用下C-N键氧化断裂生成中间产物氨甲基磷酸(AMPA),这是主要的降解途径;二是草甘膦在C-P键裂解酶的作用下生成肌氨酸,后者可直接被微生物利用[11]。
2.1 草甘膦在土壤中的残留
受土壤颗粒、pH、有机质含量、温度和含水量等多因素复合影响,草甘膦在不同土壤中的半衰期差异较大(1~151 d),不同调查结果也显示草甘膦在土壤中残留水平波动幅度较大[12-13]。由于长期使用草甘膦,阿根廷潘帕地区农田中的草甘膦和AMPA残留量分别达到2 299±476μg/kg和4 204±2 258μg/kg。据研究者推算,每使用5次草甘膦,每1 kg土壤将增加1 mg草甘膦[14]。在使用草甘膦42 d后,湖南、浙江和广西地区不同类型土壤中的草甘膦残留量在130~910μg/kg,不同地区红壤中的残留量有显著差异,pH值可能是影响草甘膦残留量的关键因素[15]。斯里兰卡农田土壤中的草甘膦和AMPA残留检出率均为100%,残留浓度分别为270~690μg/kg和2~8μg/kg,研究者认为土壤颗粒中阳离子(Fe3+和Al3+)与草甘膦形成络合物,是草甘膦大量残留的关键[16]。表1汇总了近年来全球不同地区土壤中的草甘膦和AMPA残留量数据[16-22],其中农田及其周边土壤中的草甘膦和AMPA残留量大,检出率高。Karasali等[22]报道在印度城市土壤中的草甘膦和AMPA也有一定的检出率和残留量,可能是由园林绿化所用的草甘膦残留扩散引起的。因此,我们不仅需要关注农田中的草甘膦和AMPA残留情况,也需要对城市、公园绿地等人类聚集场所加强监测力度[23]。

表1 不同国家土壤中的草甘膦及其代谢产物AMPA残留数据
2.2 草甘膦在水体中的残留
由于草甘膦使用量大,降雨、侵蚀等过程也会将土壤中的草甘膦和AMPA淋溶冲刷至水体。越来越多的报道表明,草甘膦已经广泛存在于各种天然水域和沉积物中[24-25]。表2汇总近年来全球不同地区地表水和地下水中的草甘膦和AMPA残留情况[16-32],由此可以看出不仅农田周边水体的草甘膦和AMPA残留量大、检出率高,大型河流、入海口也存在较高的检出率,说明草甘膦可通过径流运输扩散至全球水体中。综合亚洲、欧洲、北美洲、南美洲、大洋洲等地区的报道,目前全球水体中的草甘膦和AMPA最大残留量分别在1.69~427μg/L和0.6~397μg/L(表2)。波罗的海入海河口中的草甘膦和AMPA检出率均高达90%以上,残留量分别在0.03~1.69μg/L和0.05~4.16μg/L,而不同地点残留量随着水体中盐浓度的增加而下降,说明草甘膦已经由内陆河流向海洋扩散[26]。采自我国10个省份地区196个地表水样品中的草甘膦和AMPA检出率分别为14.3%和15.8%,最高残留量分别为32.49μg/L和10.31μg/L;694个地下水样品中的草甘膦和AMPA检出率分别为1.01%和0.86%,最高残留量分别为2.09μg/L和5.13 μg/L[29]。我国地下水中的草甘膦和AMPA残留量相比地表水处于低水平,但仍有少量检出,说明地表水和土壤中的草甘膦和AMPA残留存在向地下水渗透的风险。地表水中溶解和颗粒吸附的草甘膦和AMPA会沉积到水体底部[21,24],沉积物中这2种物质的生物降解要慢于地表水中[21,24-25]。许多研究显示,沉积物中的草甘膦和AMPA浓度要高于采集于同一位置的水体[14,16,19,33]。由于水体中草甘膦和AMPA残留浓度受降雨、径流等因素影响,而沉积物相对稳定且降解慢,因此沉积物中的污染物浓度更能体现水体受污染的历史和程度。
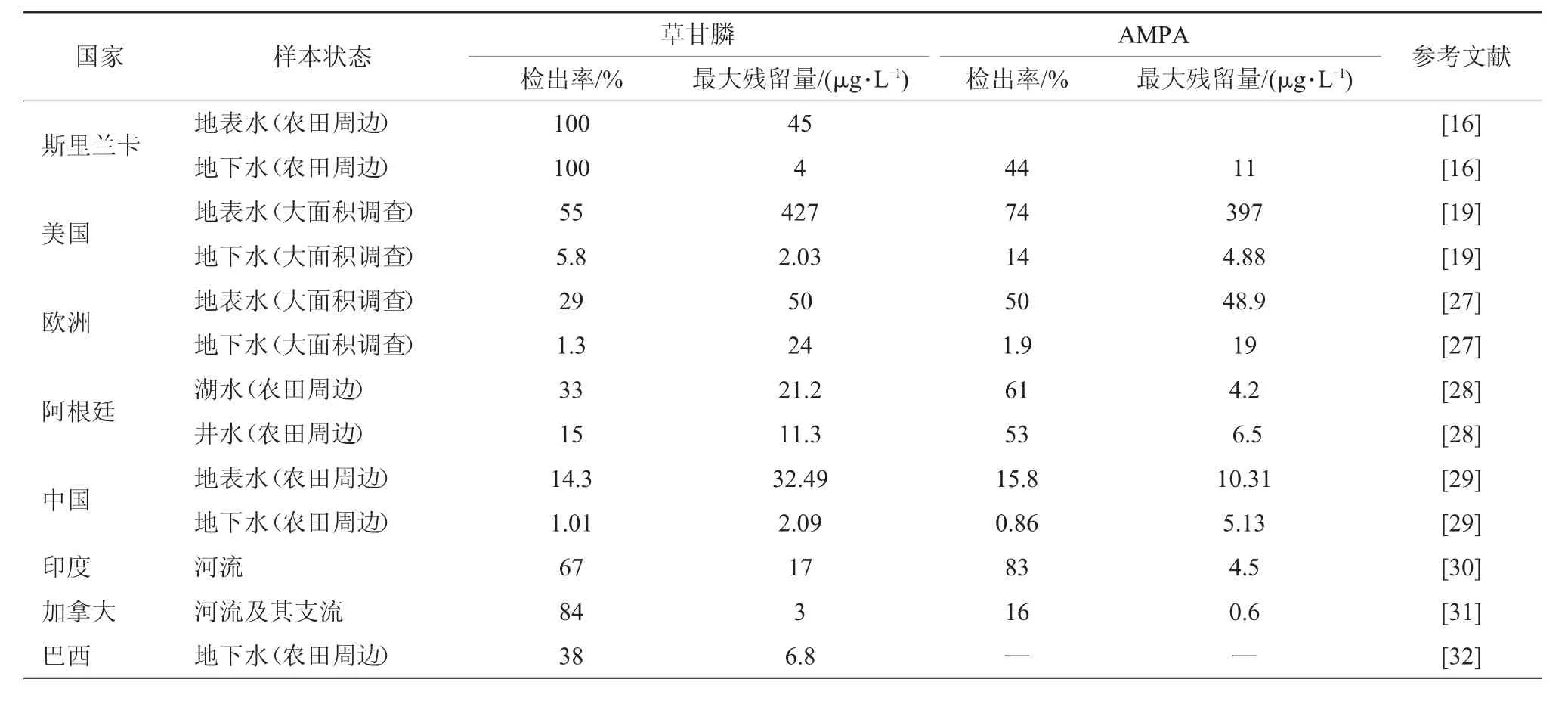
表2 不同国家水体中的草甘膦及其代谢产物AMPA残留数据
3 草甘膦对环境生物的影响
虽然动物体内因无莽草酸途径而不受草甘膦急性灭生毒性的影响[34-35],但越来越多的研究结果显示,草甘膦及其商业化产品对土壤动物、水生生物、两栖动物、昆虫和鸟类等环境生物具有氧化应激、遗传毒性、神经毒性和生长毒性等不利作用[23,36-39]。草甘膦商业化产品配方中用以提高活性成分渗透性的佐剂被认为对环境生物的影响更大[40-42]。
3.1 草甘膦对土壤动物的影响
土壤中的无脊椎动物(蚯蚓、线虫等)不可避免地会遇到草甘膦及其代谢产物并受其影响。法国土壤中的草甘膦和AMPA残留检出率分别为88%和58%(n=120),对应地点采集的蚯蚓组织中草甘膦和AMPA残留检出率分别达到74%和38%,说明草甘膦和AMPA在蚯蚓组织内的累积量高于预期[43]。表3汇总了近年来关于草甘膦及其商业化产品对土壤动物影响的研究报道[42-46],以及相关文献中的结果显示,草甘膦及其商业化产品虽然很少导致蚯蚓死亡,但对蚯蚓的组织器官、具有重要生理功能的酶活性、进食和运动行为等均产生不利影响[47-50]。长时间暴露在草甘膦商业化产品‘农达’(推荐使用剂量)中对南美岸蚓(Pontoscolex corethrurus)的体重和繁殖均产生显著不利影响[44]。3种蚯蚓暴露在‘农达’(115.49 mL/m2)中8 w后,蚯蚓肠道细菌群落发生巨大变化,泛菌属(Pantoea)、肠杆菌属(Enterobacter)和假单胞菌属(Pseudomonas)这3个属的相对丰度由不足1%上升至80%,说明草甘膦影响了蚯蚓肠道微生物群落组成,但其生物学效应还有待进一步研究[46]。暴露在草甘膦商业化产品‘Touchdown’(含量3%~10%)0.5 h后,秀丽隐杆线虫(Caenorhabditis elegans)体内的电子传递链复合物Ⅱ(琥珀酸脱氢酶)受到抑制,ATP水平降低,过氧化氢含量增加,说明该产品对秀丽隐杆线虫具有一定的神经毒性[46]。
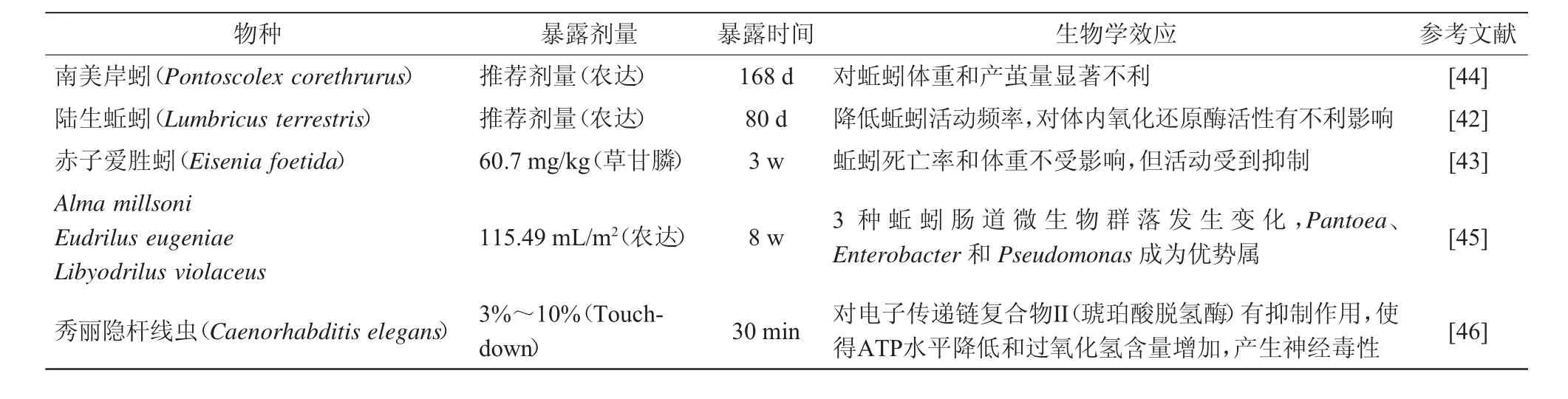
表3 草甘膦对土壤动物的生物学效应
3.2 草甘膦对水生生物的影响
水生溞类全生命史均生活在水中,高繁殖率和快速的世代更替使得水生溞类对环境变化反应敏感迅速。大型溞(Daphnia magna)已经成为水生生态毒理学模式生物[51-52]。根据表4汇总的溞类研究报道[53-57]及大量相关研究发现,草甘膦及其商业化产品会影响水生溞类行为、生长发育和繁殖等,并具有遗传毒性[58-60]。持续暴露在高浓度‘农达’(25 mg/L和50 mg/L)下,大型溞连续4个世代的初始繁育时间均推迟,新生溞数量均显著降低,第4代的新生溞数量相对于1~3代有所提升,说明对其显示出一定的适应性[53]。暴露在1 mg/L草甘膦下,大型溞(4种不同基因型)的细胞DNA损伤显著,肠道微生物群落组成结构发生变化,损害和变化程度依据基因型的不同而有所差异[61]。暴露在草甘膦商业化产品‘Faena’(0~3.15 mg/L)下,Daphnia exilis产生的后代即使在正常环境中,其生长也受到不利影响,说明草甘膦可能具有遗传毒性[56]。
鱼类可用于评估环境污染物的潜在风险[62]。结合表4汇总的关于鱼类的研究报道[63-67]及相关文献,发现草甘膦对鱼类毒性效应主要表现在生化生理、内分泌、行为、生殖发育毒性和遗传毒性等多个方面[68-71]。斑马鱼(Danio rerio)、鳉鱼(Jenynsia multidentate)和鲤鱼(Cyprinus carpio)等多种鱼类暴露在不同浓度草甘膦及其商业化产品中,均被发现行为异常,表现为社交、探索、记忆能力下降,游动模式改变,甚至影响到性行为,这些均说明了受试鱼对草甘膦的焦虑及其逃避倾向[65,72-74]。斑马鱼胚胎暴露于草甘膦(0.05~10.000μg/L)下120 h,胚胎的脑电生理信号改变,运动能力下降,神经传递失调,同时还引起发育过程中神经血管畸形[63]。胡孟牙汉鱼(Odontesthes humensis)暴露在农达(3.68 mg/L)下24 h,鱼体内发生氧化应激反应,产生DNA损伤、细胞凋亡等现象[66]。虹鳟(Oncorhynchus mykiss)亲代(F0)暴露在草甘膦(1μg/L)条件下,F1代的生长生殖未受到影响,但是F2代头部变大以及发育早期细胞色素氧化酶活性降低,说明鱼类接触草甘膦会导致后代发育异常并增加对病毒的易感性[75]。草甘膦和AMPA对斑马鱼幼鱼具有遗传毒性,两者的最低影响浓度均为1.7 mg/L[76]。
两栖动物的皮肤具有高渗透性,允许气体、水和离子交换,外界有害物质也可以通过皮肤扩散进体内,特别是在胚胎和幼体阶段受到的毒害,会持续影响后续生长、发育和繁殖,因此两栖动物很容易受到水中化学品的影响[77-79]。表4汇总了近年来关于草甘膦及其商业化产品对两栖动物胚胎和蝌蚪影响的报道[80-84],结果显示草甘膦可以影响两栖动物的胚胎活性,具有致畸性、内分泌干扰作用和遗传毒性。长时间暴露在草甘膦商业化产品(2.5 mg/L)下,会导致蝌蚪发育畸形、DNA损伤和激素紊乱;乙酰胆碱酯酶(AChE)和丁酰胆碱酯酶(BChE)活性显著增加,显示草甘膦商业化产品可能具有神经毒性[85]。草甘膦降解产物AMPA影响了刺蟾蜍(Bufo spinosus)胚胎存活率,推测可能是氧化应激引起胚胎死亡;低浓度AMPA(0.07μg/L)对胚胎发育和孵化形态相比高浓度(3.6μg/L)影响更大[80,86]。急性毒性试验存活下来的斑绿蛙(Lithobates pipiens)在其蝌蚪发育成熟后,存在颅面、口腔畸形和眼睛异常等缺陷[81]。彗星试验和微核试验表明,草甘膦商业化产品对阿根廷本地蟾蜍(Rhinella arenarum)的成体可能具有遗传毒性和致突变性,并对暴露个体及其后代产生长期负面影响[88]。

表4 草甘膦对水生生物的生物学效应
3.3 草甘膦对昆虫的影响
蜜蜂等传粉昆虫是维持生态系统和农业生产力的关键因素。蜜蜂通过喷雾扩散、污染漂浮物和食物残留等多种途径接触到草甘膦[89-90]。结合表5汇总的各品种蜜蜂研究结果[91-95]及越来越多的文献表明,草甘膦和AMPA对蜜蜂的生存、感官和认知能力、繁殖、肠道微生物群落等带来不利影响[96-99]。取食含有5 mg/L草甘膦的蔗糖溶液后,欧洲熊蜂(Bombus terrestris)的体温调节能力受到抑制,个体维持种群育雏温度的能力降低25%以上[100]。取食含有6.6μL/mL草甘膦商业化产品(30%,w/w)的蔗糖溶液后,意大利蜜蜂(Apis mellifera)和中华蜜蜂(Apis cerana)的免疫系统、消化系统、神经系统、氨基酸和碳水化合物代谢以及生长发育均受到不利影响,但中华蜜蜂受到影响程度较轻,对草甘膦商业化产品的抗性更好[93]。长时间(20 d)经口取食低浓度草甘膦(10μg/L),发现其显著降低了意大利蜜蜂的存活率,对蜜蜂的解毒与抗氧化应激、神经系统、新陈代谢以及免疫等产生了系统性不利影响;短时间暴露在高浓度‘农达’(3.6 mg/L)下,意大利蜜蜂取食行为受到抑制,学习、记忆以及攀爬能力下降[96,101]。蜜蜂依靠其肠道微生物群落实现食物加工、免疫系统调节和防御病原体等多种功能。在饲喂含有5 mg/L草甘膦的蔗糖溶液5 d后,蜜蜂的肠道微生物群落发生显著变化,4种主要肠道细菌阿尔维斯诺德格拉斯菌(Snodgrassella alvi)、双歧杆菌属(Bifidobacterium spp.)、乳酸杆菌属(Lactobacillus spp.),厚壁菌门(Firmicutes)的相对和绝对丰度下降,这种变化使得蜜蜂易感染粘质沙雷菌(Serratia marcescens)并导致其死亡[99]。草甘膦商业化产品和表面活性剂聚乙氧基化牛脂胺(POEA)通过增强细胞凋亡来降低细胞活力,从而抑制黑腹果蝇(Drosophila melanogaster)的繁殖力,故相比草甘膦,后两者对黑腹果蝇更具毒性[102]。
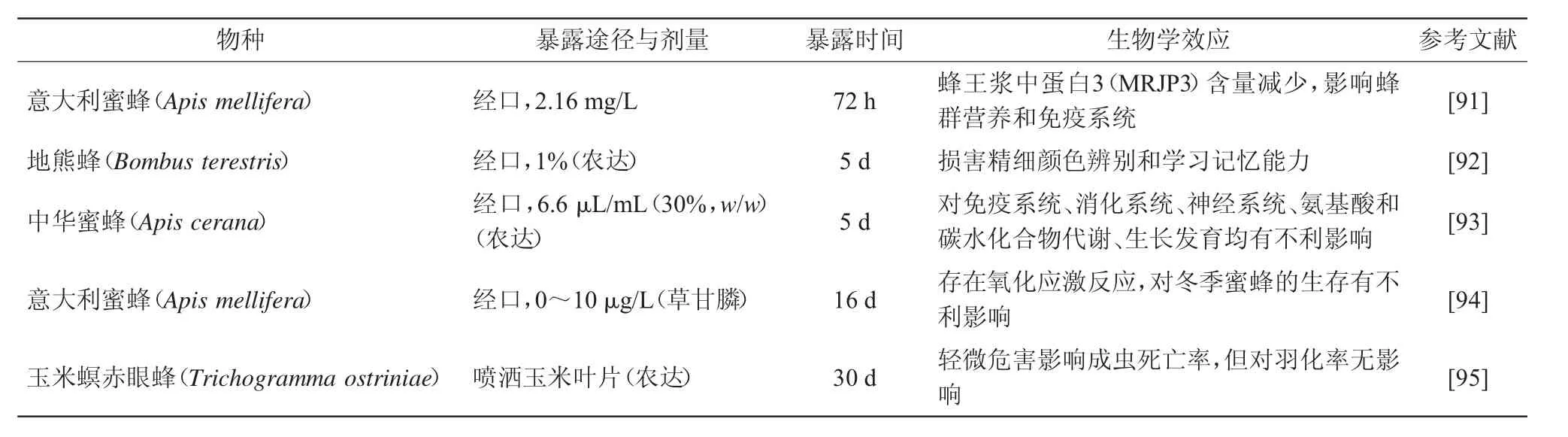
表5 草甘膦对昆虫的生物学效应
3.4 草甘膦对鸟类的影响
随着草甘膦用量的增加,越来越多的鸟类摄取含有草甘膦残留的食物,从而受到草甘膦的影响[103]。草甘膦可以通过鸟类的摄食而转移到蛋中,这对鸟类繁殖(产蛋率、孵化率和胚胎发育情况)具有负面效应,对成体的正常生理活动也造成一定干扰[104-108](表6)。长时间(52 w)饲喂日本鹌鹑(Coturnix japonica)(160 mg/kg,农达),草甘膦和AMPA在肝脏内积聚,影响了肝脏抗氧化酶活性和肝脏解毒功能,同时降低雄性日本鹌鹑在青春期的血浆睾酮水平,改变肠道微生物组成[104]。母鸡被饲喂含47 mg/kg草甘膦的饲料,所产鸡蛋的胚胎死亡率显著提高,胚胎发育明显延迟,胚胎体积减少;雏鸡的胫骨长度和软组织体积减少,而骨骼体积增加,上述异常表型在暴露停止2 w后所产蛋的发育过程中消失[109]。饮食暴露(46.8 mg/kg)5 w后,在公鸡的血浆和精液中均能检出草甘膦和AMPA,精子活力和DNA甲基化程度均显著降低,这些负面影响在饮食暴露停止2 w后消失[110]。
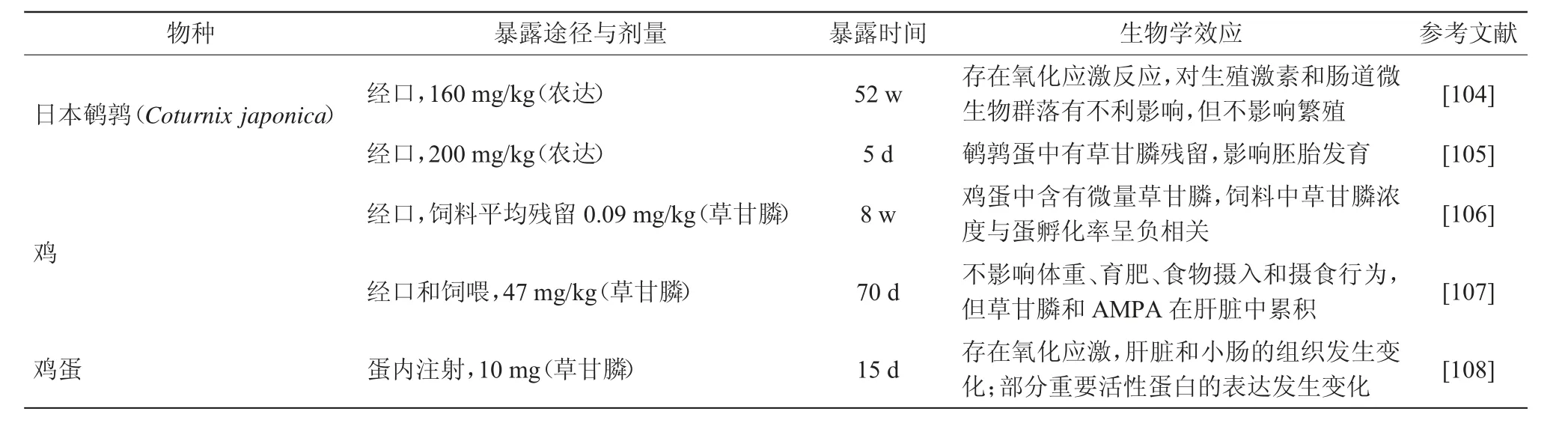
表6 草甘膦对鸟类的生物学效应
4 展望
近年来,我国转基因产业化进程加快,截至2022年底,我国自主研发的8个转基因大豆、玉米品系获得了生产应用安全证书,其中7个品系具有草甘膦抗性。随着转基因大豆、玉米品种审定标准的出台,我国转基因作物商品化种植规模不断扩大。耐草甘膦转基因作物的大面积种植必然带来大面积使用草甘膦现象,大量进入环境中的草甘膦及其代谢产物将对环境生物和生态安全带来冲击。越来越多的研究表明,草甘膦及其代谢产物AMPA会对土壤生物、水生生物等环境生物的生长、发育和繁殖带来不利影响,特别是草甘膦还可能具有遗传毒性和内分泌干扰物作用。为了管理和控制草甘膦大规模应用可能产生的环境风险,建议采取如下应对措施:一是建立适合我国实际情况的草甘膦及其代谢产物在各类环境介质(水、土壤、空气)中的限值。目前,我国尚未建立土壤中草甘膦的残留限值标准,GB 5749—2006《生活饮用水卫生标准》中的草甘膦限值参照美国标准,设定为700μg/L,远远高出欧盟0.1μg/L标准,且与环境实际值背离。我国地域辽阔,不同地区的土壤质量、温度和降水等环境因素存在巨大差异,草甘膦在不同地区的降解和残留规律也可能有很大差异,通过建立草甘膦及其代谢产物在各类环境介质中的限值,可确保在环境安全的前提下为国家转基因产业发展政策的制定提供依据。二是根据我国环境生物的特点,遴选适合草甘膦生态毒理评价需求的本土模式生物。目前,我国生态毒理模式生物基本源自国外,获得的测试结果未必适用于本土物种和环境,而开发本土物种作为生态毒理模式生物,能够更贴近我国生态环境的实际情况,为草甘膦的风险管理提供可靠的数据。三是开展关于草甘膦对环境影响的大规模调查,制定草甘膦环境风险管控的技术标准。
在当前我国大规模种植耐草甘膦转基因作物的背景下,我们相信通过制定相应的环境风险管控措施并予以实施,能有效降低草甘膦在环境中的残留水平,减少其对环境生物产生的毒性影响,为保护绿色生态环境提供科学合理的技术支持。

