针对SARS-CoV-2核衣壳蛋白的单克隆抗体的制备和鉴定
徐双媛,刘 钧,曹李妍,丁睿清,尚月月,康喜龙,3,顾 丹,3,焦新安,3,潘志明,3,孟 闯,3
新型冠状病毒(SARS-CoV-2)感染引起的新型冠状病毒肺炎(COVID-19)自2020年起已呈全球大流行状态,对经济发展和人类生命健康造成了重大威胁[1]。SARS-CoV-2是一种β-冠状病毒属的正链RNA病毒,基因组全长约30 kb,其与SARS-CoV相似性约80%,与中东呼吸综合征冠状病毒(Middle East Respiratory Syndrome Coronavirus,MERS-CoV)相似性约50%[2]。SARS-CoV和MERS-CoV曾引起了大范围流行传播,感染后死亡率较高,分别为9%和26.6%~59.4%,SARS-CoV-2导致的死亡率有所降低,但传染性更强,危害更严重[3-5]。SARS-CoV-2结构蛋白编码区主要编码刺突蛋白(Spike,S)、膜蛋白(Membrane,M)、包膜蛋白(Envelope,E)和核衣壳蛋白(Nucleocapsid,N) 4种结构蛋白。其中,N蛋白含量最丰富,位于病毒内部,在病毒颗粒组装时与病毒RNA结合形成螺旋核衣壳,保护病毒基因组。研究发现,SARS-CoV-2的 N蛋白参与病毒RNA的转录和复制、病毒基因组的包装,还可抑制宿主细胞干扰素产生、肌动蛋白重组和细胞凋亡[6-9]。Wang等[10]评估发现病人血浆中SARS-CoV-2 N蛋白的浓度与疾病严重程度相关,表明该蛋白是潜在检测靶标。SARS-CoV-2 的N蛋白单克隆抗体的研制是建立免疫学检测方法的重要基础。
本研究通过大肠杆菌系统制备SARS-CoV-2重组N蛋白,利用B细胞杂交瘤技术制备了N蛋白特异性单克隆抗体,并通过间接免疫荧光试验和间接ELISA分析了其对不同来源SARS-CoV-2 N蛋白的反应性和用于SARS-CoV-2检测的潜能,为下一步研究提供了重要基础材料。
1 材料与方法
1.1 质粒、细胞及实验动物 pGEX-6P-1质粒、pET-28a质粒、HEK-293T细胞、骨髓瘤细胞SP2/0由江苏省人兽共患病学重点实验室保存。6~8周龄、9~10周龄雌性BALB/c小鼠以及6~8周龄雌性ICR小鼠购自扬州大学比较医学中心。实验动物操作符合扬州大学实验动物伦理委员会规定(伦理审查编号:202102101)。

1.3 目的序列的扩增和重组载体的构建 参考NCBI中SARS-CoV-2 N的全长基因序列(Gene ID:43740575),合成DNA片段作为PCR模板,同时利用Primer Premier 5.0软件设计引物。引物序列如表1所示,下划线部分为同源臂序列,引物由擎科生物科技有限公司合成,DNA模板由南京金斯瑞生物技术有限公司合成,PCR反应条件为:95 ℃ 3 min;95 ℃ 30 s,52 ℃ 30 s,72 ℃ 1 min,34个循环;72 ℃ 5 min。将pET-28a载体质粒经NcoⅠ和XhoⅠ双酶切,pGEX-6P-1载体质粒经BamH Ⅰ和EcoR Ⅰ双酶切,与纯化后的PCR产物连接转化至E.coliDH5α感受态细胞,进行菌落PCR和测序筛选鉴定阳性重组质粒,命名为pET-28a-N、pGEX-6P-1-N。

表1 N目的基因原核和真核表达质粒构建PCR扩增引物Tab.1 PCR amplification primers for prokaryotic and eukaryotic N target gene expression plasmids
1.4 重组蛋白的表达和纯化 将pET-28a-N、pGEX-6P-1-N重组质粒转化BL21(DE3)感受态细胞获得重组菌BL21(DE3)-pET-28a-N和BL21(DE3)-pGEX-6P-1-N,接种至含相应抗性的液体LB培养基,加入工作浓度为0.4 mmol/L的IPTG进行诱导表达,其中BL21(DE3)-pET-28a-N于37 ℃振荡培养5 h,BL21(DE3)-pGEX-6P-1-N于15 ℃振荡培养16 h;离心收集菌体进行超声裂解(30 Hz,超声3 s暂停5 s),裂解物于4 ℃、10 000 r/min离心10 min,分别收集上清和沉淀,SDS-PAGE分析重组蛋白的表达情况。取可溶性表达的His-N和GST-N裂解上清液,分别利用Ni2+亲和层析、GST标签蛋白纯化柱进行纯化,SDS-PAGE和BCA蛋白浓度测定试剂盒分析纯化蛋白的纯度和浓度。
1.5 重组蛋白的Western blot鉴定 分别将纯化的His-N、GST-N重组蛋白和空载体对照进行SDS-PAGE,使用Pyxis Protein Transfer Stack试剂盒快速转印NC膜,含5%脱脂奶的PBST室温封闭2 h,PBST洗涤3次,分别加入1∶5 000稀释的抗His、抗GST标签蛋白单抗或1∶500稀释的健康人阳性血清(接种新冠病毒灭活疫苗)和阴性血清,4 ℃过夜孵育,分别加入1∶5 000稀释的羊抗鼠-HRP、羊抗人IgG-HRP二抗,室温孵育2 h,PBST洗涤6次,BeyoECL Star显色液显色,超灵敏多功能成像仪观察并保存结果。
1.6 小鼠免疫与间接ELISA方法的建立 以His-N为免疫原,皮下多点免疫6~8周龄雌性BALB/c小鼠,80 μg/只,第1次免疫以弗氏完全佐剂,第2和3次用弗氏不完全佐剂乳化蛋白,每次免疫间隔2周。第3次免疫7 d后,对小鼠进行眼眶静脉采血,4 ℃、4 000 r/min离心10 min,取上清,测定小鼠血清中抗体的效价,选择效价最高的小鼠,腹腔注射80 μg蛋白进行加强免疫,3 d后按常规细胞融合方法进行融合[11]。以纯化的GST-N蛋白作为检测原,利用方阵试验确定最佳蛋白包被浓度和样品稀释倍数,建立用于检测抗体效价的间接ELISA方法,具体步骤参考文献[12]进行。
1.7 阳性杂交瘤细胞的筛选与鉴定 以1.6建立的间接ELISA方法检测杂交瘤细胞培养上清中抗体的效价,筛选阳性杂交瘤细胞,通过有限稀释法进一步纯化,选取效价高的阳性杂交瘤细胞腹腔注射10周龄的BALB/c小鼠,体内诱生法制备单抗腹水[12]。将采集好的腹水送去南京金斯瑞生物科技有限公司进行纯化,利用间接ELISA方法测定腹水效价和亲和力,亲和力测定公式:K=([Ag′]/[Ag]t-1)/2(n[Ab′]-[Ab]t),其中:[Ab′]表示抗原浓度为[Ag′]时OD=1/2 ODmax对应的抗体摩尔浓度,[Ab]t表示抗原浓度为[Ag]t时OD=1/2 ODmax对应的抗体摩尔浓度,n为抗原[Ag′]与[Ag]t间的稀释倍数。使用鼠源单克隆抗体亚类鉴定试剂盒(Sigma)测定单抗体亚类。
1.8 单抗的Western blot分析 取纯化的His-N、GST-N重组蛋白和空载体对照进行SDS-PAGE,以1∶5 000稀释的11F4单抗纯化后腹水抗体作为一抗,加入1∶5 000稀释的羊抗鼠IgG-HRP作为二抗,Western blot分析单抗特异性识别重组蛋白的能力,具体操作步骤同1.5。
1.9 间接免疫荧光试验分析单抗反应性
1.9.1 真核表达质粒的构建 根据表1中列出的引物,通过PCR分别扩增SARS-CoV-2、SARS-CoV及传染性支气管炎病毒(Infectious Bronchitis virus,IBV)N蛋白目的片段,PCR扩增条件为:95 ℃ 3 min;95 ℃ 30 s,60 ℃ 30 s,72 ℃ 1 min,34个循环;72 ℃ 5 min,应用DNA胶回收试剂盒纯化PCR产物。以限制性核酸内切酶SalⅠ和NotⅠ对pCMV-Myc载体质粒进行双酶切,用ClonExpress One Step Cloning一步法连接试剂盒连接目的片段与载体,构建重组载体,测序验证后将阳性重组质粒分别命名为pCMV-SARS-CoV-2-N、pCMV-SARS-CoV-N以及pCMV-IBV-N。
1.9.2 间接免疫荧光试验 将HEK-293T细胞以2×105个/孔置于24孔板中,继续培养约16 h,使用LipofectamineTM2000分别将重组的真核表达质粒和空载体转染细胞,具体操作按照说明书要求进行。转染24 h后进行间接免疫荧光试验,用冰甲醇固定细胞,含5% BSA的PBST封闭2 h,依次加入1∶100稀释的单抗细胞上清、1∶1 000稀释的羊抗鼠IgG-FITC作为一抗和二抗,同时使用His-N蛋白免疫后的小鼠多抗血清作为阳性对照,进行间接免疫荧光试验,于荧光显微镜下观察细胞中的荧光强度并拍照保存。
1.10 间接ELISA检测不同冠状病毒N蛋白 以商品化SARS-CoV-2、SARS-CoV、MERS-CoV、HCoV-229E重组N蛋白为包被抗原,以1 μg/mL包被于ELISA板,以1∶10 000稀释的11F4单抗纯化腹水为一抗,同时设立小鼠血清作为阳性对照和PBS作为阴性对照,37 ℃孵育2 h,PBST洗涤5遍,加入1∶5 000稀释的羊抗鼠IgG-HRP二抗,37 ℃孵育1 h,PBST洗涤7遍,TMB显色,酶标仪检测OD450值。
2 结 果
2.1 目的片段与表达载体的鉴定 N基因目的片段的PCR扩增结果如图1,在约1 260 bp处均存在清晰单一的条带,结果符合预期值,结合重组表达质粒的PCR鉴定结果与测序分析,说明目的片段的扩增和表达载体的构建正确。
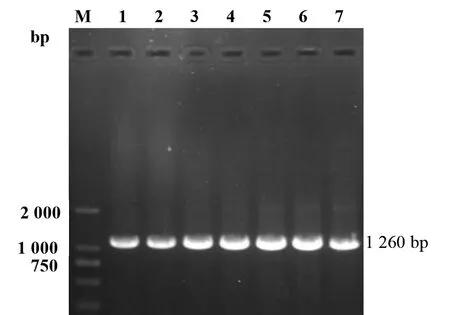
M:DL2000 DNA marker;1-3:pET-28a-N;4-7:pGEX-6P-1-N图1 N基因目的片段的PCR扩增Fig.1 PCR amplification of the target N gene
2.2 重组N蛋白的SDS-PAGE分析 SDS-PAGE分析重组蛋白His-N(图2A)和GST-N(图2B)的表达和纯化情况,结果表明2种蛋白均主要以可溶性形式在上清中大量表达,大小与理论分子量相符。BCA蛋白试剂盒测定纯化His-N蛋白浓度为3.55 mg/mL,GST-N蛋白浓度为1.15 mg/mL。

M:蛋白marker;1:BL21(DE3)-pET-28a 空载体对照;2:BL21(DE3)-pET-28a-N 诱导后上清;3:BL21(DE3)-pET-28a-N 诱导后沉淀;4:纯化后His-N 蛋白;5:BL21(DE3)-pGEX-6P-1空载体对照;6:BL21(DE3)-pGEX-6P-1-N 诱导后上清;7:BL21(DE3)-pGEX-6P-1-N诱导后沉淀;8:纯化后GST-N 蛋白图2 重组His-N(A)和重组GST-N(B)蛋白的SDS-PAGE分析Fig.2 SDS-PAGE analysis of recombinant His-N (A) and recombinant GST-N (B) proteins
2.3 重组N蛋白的Western blot分析 使用抗His、GST标签蛋白单抗对重组蛋白进行Western blot分析,His-N(图3A)和GST-N(图3B)分别在53 kD,73 kD处出现符合预期大小的单一条带,表明纯化的蛋白纯度较高。进一步使用接种新冠病毒灭活疫苗的人阳性血清以及未接种疫苗的阴性血清作为一抗进行Western blot分析,结果显示,His-N(图4A)和GST-N(图4B)与人血清中的天然抗体具有良好的反应性,其大小符合预期,表明重组蛋白作为SARS-CoV-2天然N蛋白替代物的可行性。
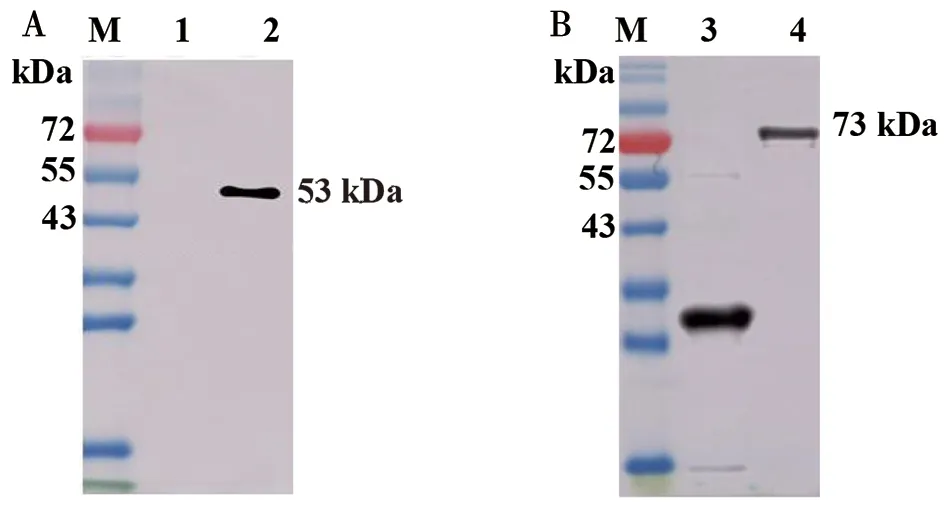
M:蛋白marker;1:BL21(DE3)-pET-28a 空载体对照;2:纯化后 His-N蛋白;3:BL21(DE3)-pGEX-6P-1 空载体对照;4:纯化后 GST-N蛋白图3 抗标签蛋白单抗鉴定重组蛋白His-N(A)和GST-N(B)Fig.3 Identification of His-N (A) and GST-N (B) with mAbs to tag proteins
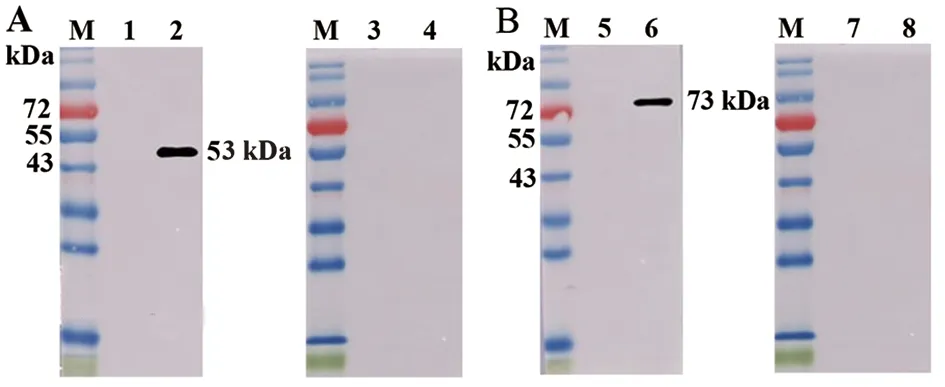
M:蛋白marker;1,3:BL21(DE3)-pET-28a 空载体对照;2,4:纯化后His-N protein;5,7:BL21(DE3)-pGEX-6P-1空载体对照;6,8:纯化后GST-N蛋白;1,2,5,6:一抗为人阳性血清;3,4,7,8:一抗为人阴性血清图4 人血清鉴定重组蛋白His-N(A)和GST-N(B)Fig.4 Identification of His-N (A) and GST-N (B) with human serum
2.4 N蛋白单克隆抗体的制备 利用有限稀释法将保持阳性的杂交瘤细胞亚克隆,获得了1株稳定分泌抗N重组蛋白单抗的杂交瘤细胞株,并命名为11F4。利用小鼠单抗亚类鉴定试剂盒测定11F4单抗的亚型为IgG1,通过间接ELISA方法测其细胞上清、腹水效价和亲和力分别为2.0×104、2.0×107以上和4.44×108M-1。
2.5 单抗的Western blot分析 以11F4单抗纯化后腹水为一抗,Western blot分析其与重组蛋白His-N、GST-N以及空载体对照的反应性,结果如图5所示。单抗对重组His-N、GST-N蛋白表现出良好的反应性,出现与预期大小一致的单一条带,而与空载体对照均无反应性,表明制备的单抗具有良好的特异性。
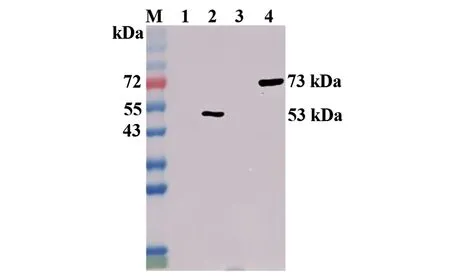
M:蛋白 marker;1:BL21(DE3)-pET-28a 空载体对照;2:纯化后His-N蛋白;3:BL21(DE3)-pGEX-6P-1 空载体对照;4:纯化后GST-N蛋白图5 11F4单抗的Western blot分析Fig.5 Western blot analysis of 11F4 mAb
2.6 单抗的间接免疫荧光分析 通过间接免疫荧光试验分析单抗与HEK-293T细胞表达的SARS-CoV-2 N蛋白的特异性反应。首先构建了SARS-CoV-2、SARS-CoV及IBV的N基因真核表达质粒,结合PCR鉴定结果和测序分析表明重组质粒的构建正确。将重组质粒转染HEK-293T细胞,以11F4单抗细胞上清和小鼠阳性血清为一抗进行间接免疫荧光试验。结果如图6所示,SARS-CoV-2-N转染组胞浆中产生大量荧光斑点,SARS-CoV-N转染组有少量荧光斑点,而IBV-N转染组和空载体对照组无荧光,显示11F4单抗能特异性结合真核表达的SARS-CoV-2 N蛋白。

图6 间接免疫荧光分析11F4单抗与真核表达N蛋白的反应性(10×)Fig.6 Indirect immunofluorescence analysis of 11F4 mAb to eukaryotically expressed N proteins(10×)
2.7 单抗在不同冠状病毒N蛋白检测中的应用 利用间接ELISA方法进一步分析11F4单抗在不同冠状病毒中N蛋白检测中的应用潜力。以SARS-CoV-2、SARS-CoV、MERS-CoV及HCoV-229E重组N蛋白作为包被原,11F4单抗抗体为一抗进行间接ELISA检测。结果如图7所示,11F4单抗与SARS-CoV-2 N蛋白表现出强阳性反应,与SARS-CoV的N蛋白呈弱阳性反应(OD450约为0.5),而不与MERS-CoV、HCoV-229E的N蛋白反应,显示11F4单抗具备特异性识别SARS-CoV-2 重组N蛋白的能力,具备用于SARS-CoV-2检测的潜能。
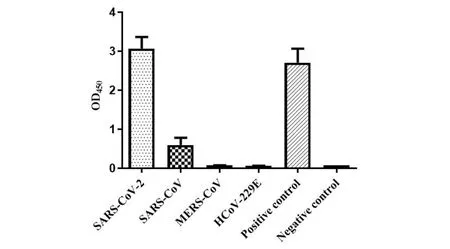
图7 间接ELISA分析11F4单抗在不同冠状病毒中的应用Fig.7 Indirect ELISA analysis of the application of 11F4 mAbs to different coronaviruses
3 讨 论
SARS-CoV-2具有高传染性、高致病性的特点,截至2022年5月11日全球累计约5.1亿确诊病例,其中625万人死亡,是严重的全球性健康威胁[13]。SARS-CoV-2基因突变率高,已出现很多变异株,其中Alpha、Beta、Gamma、Delta、Omicron是发生大范围传播的主要变异株。不同SARS-CoV-2变异株主要在S蛋白上发生多个错义突变,而N蛋白基因序列相对更保守。Surjit等[14]分析不同患者样本发现N蛋白基因序列的变异最小,笔者对主要变异株N蛋白序列(包括Omicron株)的相似性进行了分析,确认了N蛋白的高度保守性。Omicron变异株目前占主导地位,相比其他变异株传播速度更快,相比Delta变异株的临床病死率更高,显示其致病性并不低,特别是对于高龄和未接种疫苗等高危人群[15-17]。新型冠状病毒肺炎疫情形势仍旧严峻,无症状感染者的存在进一步加大了SARS-CoV-2追踪的难度,快速灵敏的检测方法对精准发现传染源、有效控制扩散十分重要[18]。目前,实时荧光定量PCR仍然是SARS-CoV-2检测的“金标准”方法,但需要专门的仪器设备和技术人员,检测结果易受各种因素影响[19]。利用单克隆抗体的抗原/抗体的检测已成为SARS-CoV-2快速筛查、回溯分析以及免疫应答评价的有效工具。SARS-CoV-2不同变异株N蛋白的高度保守性,进一步彰显了其在检测中的重要应用潜力。
SARS-CoV-2的 N蛋白在病毒的复制中起重要作用,感染早期患者的血液中即存在高水平的N蛋白[20]。N蛋白具有良好的免疫原性,感染后7 d产生IgM抗体,感染后7~14 d可检测到IgG,抗体出现时间早且持续时间长[21-23]。N蛋白及其特异性抗体,均是SARS-CoV-2感染的重要检测靶标。研究显示,针对SARS-CoV-2以及SARS-CoV的 N蛋白抗体的检测相比S蛋白均表现出更高的敏感性[24]。本研究利用大肠杆菌系统构建SARS-CoV-2的N蛋白重组表达菌,经诱导表达和纯化获得大量可溶性重组N蛋白。Western blot分析显示该蛋白与接种SARS-CoV-2灭活疫苗的人血清中天然抗体呈特异性反应,显示出良好的免疫反应性,表明原核表达的重组N蛋白能用于SARS-CoV-2感染的血清学检测。国内也有学者通过大肠杆菌系统制备了SARS-CoV-2重组N蛋白,免疫小鼠获得的多抗血清能特异性结合HEK-293T细胞表达的 N蛋白,表明原核表达N蛋白用于制备N蛋白单克隆抗体的可行性[25]。基于此,本研究进一步利用制备的重组N蛋白作为免疫原,通过B细胞杂交瘤技术筛选鉴定了一株特异性识别SARS-CoV-2重组N蛋白的单克隆抗体11F4,其亲和力、腹水效价较高。
通过比较其他冠状病毒与SARS-CoV-2的N蛋白氨基酸序列的相似性发现,SARS-CoV、MERS-CoV、HCoV-229E、IBV的相似性较高,分别达89%、54%、38%和42%,可能会对基于N蛋白的SARS-CoV-2检测造成较大非特异性干扰[26]。此外,大肠杆菌表达系统由于缺乏翻译后修饰功能,其表达的蛋白相比真核细胞表达系统与天然蛋白的构象差异更大。因此,本研究进一步分析了11F4单抗特异性识别不同表达系统表达的SARS-CoV-2、SARS-CoV、MERS-CoV、HCoV-229E和IBV的 N蛋白的能力。间接免疫荧光试验结果表明,11F4单抗与真核细胞表达SARS-CoV-2的N蛋白有良好反应性,而与IBV的 N蛋白无任何交叉反应,表明11F4单抗特异性和免疫反应性良好。进一步利用11F4单抗检测了不同冠状病毒N蛋白,其能特异性识别细胞表达及体外制备SARS-CoV-2的N蛋白,显示出与天然SARS-CoV-2的 N蛋白特异性反应的潜能。间接免疫荧光试验和间接ELISA结果均显示,11F4单抗与SARS-CoV的N蛋白也呈现弱阳性反应。研究显示,SARS-CoV-2与SARS-CoV 的N蛋白氨基酸序列相似性约为90%,都有类似的内在无序区和保守结构区模块化结构[27],表明两种蛋白之间存在较多的共同表位,使11F4单抗出现了交叉反应。很多研究也发现了不同单抗对SARS-CoV-2和SARS-CoV抗原的交叉反应性。Dai等利用SARS-CoV-2的全长N蛋白可与感染SARS-CoV的患者血清发生交叉反应,而将N蛋白截短后减少了非特异性反应且检测敏感性不变[28]。抗SARS-CoV单抗CR3022可与SARS-CoV-2 RBD相结合,并识别与ACE2结合位点不同的表位[29]。恢复期SARS患者的血清可减少S蛋白介导的SARS-CoV-2进入靶细胞并交叉中和SARS-CoV-2的感染[30]。考虑到SARS-CoV的流行现状,11F4单抗的这一交叉反应性不会对其用于SARS-CoV-2的检测造成干扰。相比肖琦等[31]的研究,本研究进一步分析了11F4单抗对真核表达SARS-CoV-2的 N蛋白特异性识别能力及与其他冠状病毒的交叉反应性,并初步明确其用于SARS-CoV-2特异性检测的潜能。
本研究成功制备了SARS-CoV-2 的N蛋白特异性单克隆抗体,其对天然SARS-CoV-2的 N蛋白具有良好的特异性识别能力,与其他冠状病毒N蛋白无交叉反应,具备特异性检测SARS-CoV-2的潜能,为下一步应用研究提供了重要基础材料。
利益冲突:无

