加味黄芪桂枝五物汤抑制线粒体凋亡预防奥沙利铂周围神经毒性机制*
吴艾平 吴林龙 张红颖 魏国利 马骏
(1.淮安市中医院,江苏 淮安 223001;2.南京中医药大学附属中西医结合医院,江苏 南京 210028)
奥沙利铂为临床最常用的化疗药物之一,尤其对消化系统肿瘤常作为基石使用,但奥沙利铂导致的周围神经毒性(Oxa-inducedperipheralneuropathy,OIPN)是其最常见的毒副作用之一,发生率可高达90%,然而目前国内外相关指南未推荐任何可行方法来预防OIPN,严重影响患者的生活质量及疗效[1-2]。OIPN的主要症状为肢体末端的感觉异常、麻木、疼痛及遇冷加重等,归属中医学"血痹"的范畴[3],有研究[4]证实加味黄芪桂枝五物汤可减轻OIPN。氧化应激及线粒体损伤在OIPN的发病机制中处于重要的地位[2,5]。本研究通过OIPN大鼠模型,观察加味黄芪桂枝五物汤对氧化应激及线粒体损伤的影响,探讨加味黄芪桂枝五物汤预防OIPN的作用机制,现将结果报告如下。
1 材料与方法
1.1 实验材料
1.1.1 实验动物 选取健康WISTA雌鼠40只(购自南京君科生物工程有限公司),体重180~220 g。饲养于SPF级动物中心,恒温恒湿,每天8:00~20:00开灯,保证大鼠休息规律。本研究经过医院伦理委员会审核通过。
1.1.2 实验药物 加味黄芪桂枝五物颗粒由黄芪20 g、桂枝10 g、白芍10 g、当归10 g、大枣10 g、生姜10 g组成(购自江阴天江药业有限公司),加入80℃水至25 mL,混匀至残渣消失,备用。奥沙利铂注射液50 mg(购自江苏恒瑞医药股份有限公司,批号:191226AN);谷胱甘肽注射液 1.2 g(山东绿叶制药有限公司,批号:190901205)。
1.1.3 主要实验仪器及试剂 低温高速离心机及荧光酶标仪购自德国Eppendorf;Mini-PROTEAN电泳系统以及MiniTrans-Blot转印系统购自美国Bio-Rad;紫外分光光度计购自美国Beckman;二氧化碳培养箱购自YILIANG;水平脱色摇床购自华利达;ROS试剂盒购自碧云天;特级胎牛血清及PCR试剂盒购自美国ThermoPierce;疼痛触觉测试套件购自美国Stoelting。
1.2 实验方法
1.2.1 分组及造模 将40只WISTA雌鼠随机分为空白组、模型组、谷胱甘肽(GSH)组、加味黄芪桂枝五物汤组,每组各10只。空白组给予相同体积溶剂 (5%葡萄糖溶液) 腹腔注射,模型组、加味黄芪桂枝五物汤组(中药组)和GSH组按照Cheng等[6]方法进行OIPN大鼠造模[在第1、2、8、9、15、16、22、23 d时重复腹腔注射奥沙利铂溶液(2.5 mg/kg,5%葡萄糖溶液稀释)],GSH组在化疗当天及前后2 d分别给予谷胱甘肽1.5 g/m2/d尾静脉注射。
1.2.2 给药 加味黄芪桂枝五物汤灌胃给药(10 mL/kg,1次/日),空白组、模型组、GSH组予0.9%生理盐水灌胃(10 mL/kg,每日1次)。奥沙利铂用药当天,中药于奥沙利铂应用前1 h给药。
1.2.3 检测指标 ①机械疼痛触觉检测:在第0、7、14、21、28 d运用VonFrey试验检测大鼠机械缩足反射阈值。②脊髓过氧化酶活性及产物检测:奥沙利铂造模后第28 d称重,每组选择5只大鼠处死,大鼠背根神经节取出后再取出脊髓研碎,加入生理盐水混匀离心,取上清检测超氧化物歧化酶(Superoxide Dismutase,SOD)、谷胱甘肽过氧化物酶活性(Glutathione Peroxidase,GSH-Px)及丙二醛(Malonic dialdehyde,MDA)含量。③背根神经节细胞的ROS荧光测定 造模第28 d称重,麻醉后取大鼠L4-5背根神经节(Dorsalrootganglion,DRG),制成细胞悬液并离心收集DRG细胞,进行PBS进行重悬→装载荧光探针→培育→混匀→洗涤细胞→冰冻切片,显微镜观察并计量荧光强度。④p53和p53相关线粒体凋亡蛋白表达水平测定:对DRG样品进行总蛋白的提取→总蛋白定量→SDS-PAGE电泳分析→蛋白质转膜→转印膜封闭→一抗(p53、PUMA、Bax、Bcl-2、cytoc、cleavedcaspase-3、cleavedPARP1、GAPDH)杂交→T-TBS漂洗→二抗(Goatanti-MouseIgG(H+L)Secondaryantibody、Goatanti-RabbitIgG(H+L)Secondaryantibody、Rabbitanti-GoatPolyclonal(HRP) Antibody)杂交→T-TBS漂洗。采用SuperSignal®WestDuraExtendedDurationSubstrate,按说明书制备约1mlECL工作液,室温孵育转印膜,去除多余ECL试剂,予以保鲜膜密封,然后在暗盒中放上X-rayfilm曝光5~10 m后进行显影和定影。
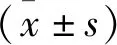
2 结果
2.1 各组大鼠不同时间机械性缩足阈值变化 模型组第7 d即出现机械性缩足阈值下降(P<0.05),并随着时间延长逐渐加重,第21、28 d显著下降,与空白组比较差异有统计学意义(P<0.01)。加味黄芪桂枝五物汤组及GSH组优于模型组(P<0.05),且加味黄芪桂枝五物汤组优于GSH组(P<0.05),表明其可降低OIPN引起的大鼠机械性缩足阈值且优于GSH。见图1。

图1 加味黄芪桂枝五物汤对大鼠机械性缩足反射阈值的影响Figure 1 Effect of Modified Huangqi Guizhi Wuwu Decoction on the threshold of mechanical foot contraction reflex in rats
2.2 各组大鼠脊髓过氧化酶活性及产物含量 第28 d测各组SOD、GSH-Px活性及MDA含量,结果显示模型组SOD、GSH-Px活性显著低于空白组,MDA含量显著高于空白组(均P<0.01),表明OIPN存在显著的氧化应激状态导致DRG损伤;加味黄芪桂枝五物汤组及GSH组在SOD、GSH-Px活性及MDA含量均优于模型组(P<0.01),加味黄芪桂枝五物汤组SOD、GSH-Px活性及MDA含量与GSH组相比差异无统计学意义(P>0.05),表明加味黄芪桂枝五物汤可减轻奥沙利铂引起的大鼠脊髓氧化应激反应,与GSH能力相当。见表1。
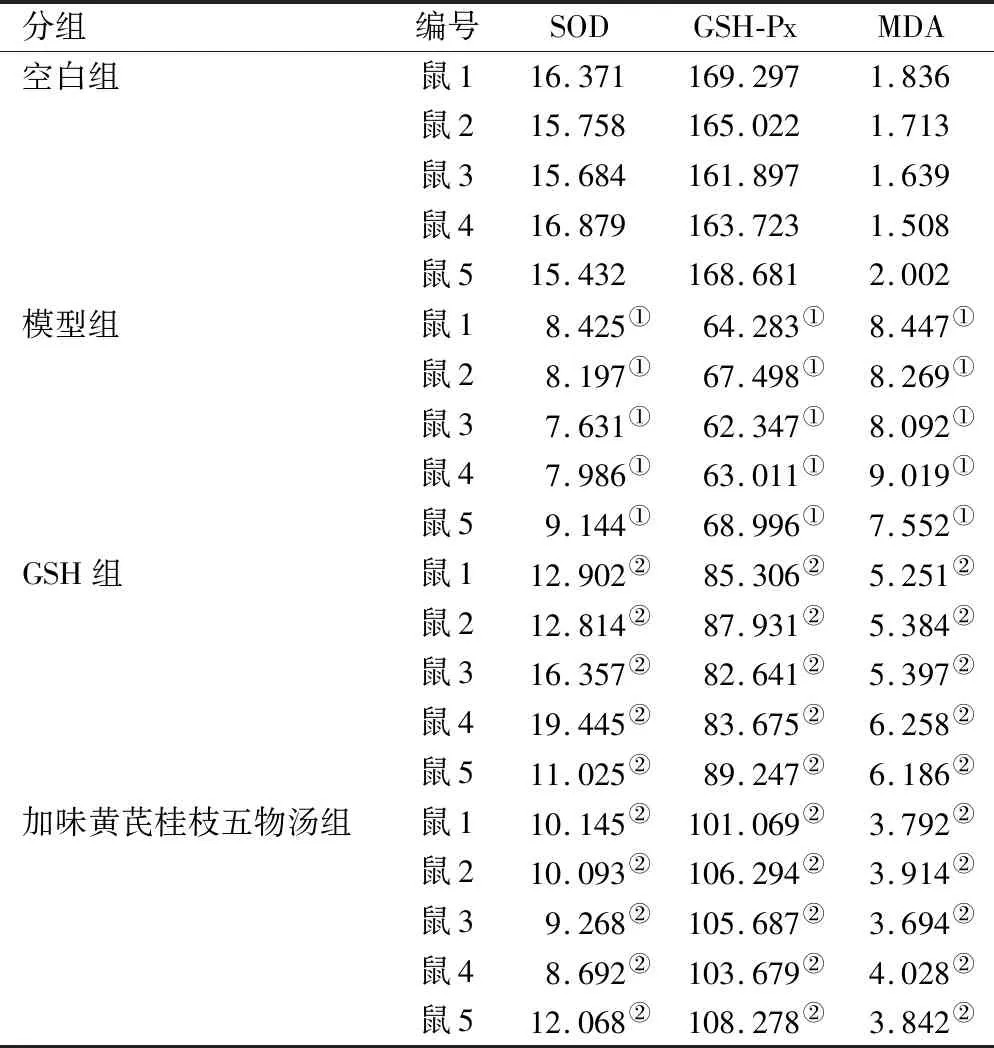
表1 各组大鼠脊髓过氧化相关酶活性及产物含量比较(U/mg)Table 1 Comparison of activity and product content of peroxidation related enzymes in rat spinal cord
2.3 各组大鼠DRG细胞的ROS生成影响 第28 d取出大鼠L4-5背根神经节,经处理后于显微镜观察并计量荧光强度来评定各组ROS生成的影响,结果显示GSH组及加味黄芪桂枝五物汤组荧光强度显著低于模型组(P<0.01),GSH组与加味黄芪桂枝五物汤相比二者荧光强度差异无统计学意义(P>0.05),表明加味黄芪桂枝五物汤可降低OIPN大鼠DRG细胞ROS生成,见图2。

图2 各组大鼠DRG细胞的ROS生成的影响Figure 2 Effect of Modified Huangqi Guizhi Wuwu Decoction on ROS production of DRG cells
2.4 加味黄芪桂枝五物汤对DRG细胞P53蛋白表达的影响 加味黄芪桂枝五物汤对线粒体凋亡关键蛋白P53表达的影响,分离L4-5 DRG,加味黄芪桂枝五物汤可以显著降低P53蛋白的表达(P<0.01),GSH组与加味黄芪桂枝五物汤组曝光强度比较差异无统计学意义(P>0.05)。结果提示抑制P53的表达,可能是加味黄芪桂枝五物汤减少背根神经节损伤预防 OIPN的重要机制。见图3、图4。

图4 各组DRG细胞P53蛋白表达曝光强度比较Figure 4 Comparison of exposure intensity of P53 protein expression in DRG cells of each group
2.5 加味黄芪桂枝五物汤对DRG细胞P53-Bax信号通路关键蛋白表达的影响 为进一步了解P53通路相关的线粒体凋亡途径在加味黄芪桂枝五物汤防治OIPN的作用机制,对P53相关蛋白的表达进行进一步研究,发现加味黄芪桂枝五物汤可以显著降低P53-Bax通路Bax及Caspase-3蛋白的表达,提高Bcl-2蛋白的表达(P<0.01),GSH组与加味黄芪桂枝五物汤曝光强度相比差异无统计学意义(P>0.05)。结果提示P53-Bax通路受抑制,可能是加味黄芪桂枝五物汤抑制背根神经节线粒体凋亡的重要机制。见图5、图6。
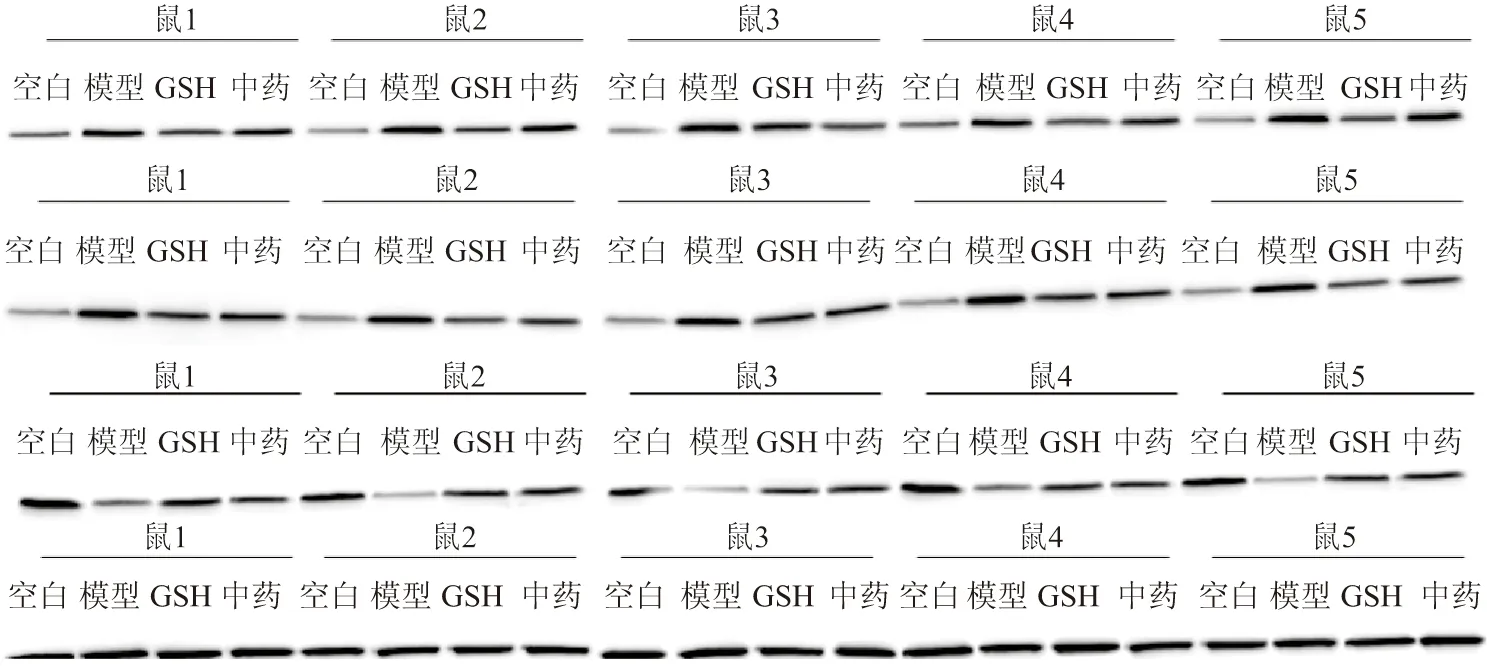
图5 加味黄芪桂枝五物汤对DRG细胞P53-Bax信号通路关键蛋白表达的影响Figure 5 Effect of Jiawei Huangqi Guizhi Wuwu Decoction on the expression of key proteins of P53 Bax signal pathway in DRG cells

图6 各组DRG细胞P53-Bax信号通路关键蛋白表达曝光强度比较Figure 6 Comparison of exposure intensity of key protein expression of P53-Bax signal pathway in DRG cells of each group
3 讨论
2020年,全球新发癌症约1900万,我国的新发癌症病例也达到了450万[7-8],需要一线化疗的患者数量将增加53%,从2018年的980万增加到2040年的1500万[9]。化疗导致的CIPN是临床常见的药物剂量限制性不良反应,因此,CIPN的发病将大大增加。CIPN发生率较高,在所有患者中大于60%,长期遭受CIPN折磨的患者约有20%~30%[10-11]。奥沙利铂在消化系统肿瘤中广泛使用,尤其是结直肠癌的化疗中尤为重要,但对于使用奥沙利铂化疗的患者,发生OIPN的几率远高于其他药物,可达到76%~90%[12-13]。OIPN的发生导致了部分患者不得不减少奥沙利铂的用量甚至停药,严重影响了患者的生存及生活质量,增加了社会及家庭负担。
OIPN的发生机制尚不明确,虽然目前国内外开展了多种药物防治OIPN的临床研究,如钙镁合剂、普瑞巴林、神经节苷脂、乙酰-l-左旋肉碱、甲钴胺、加巴喷丁、维生素E、钙锰福地吡等,但仍无明确的防治效果,且部分药物可能出现不可预测的风险甚至导致肿瘤进展[14-16]。因OIPN发生后尚无有效逆转方法,目前国内外指南无推荐使用的预防药物[2]。
黄芪桂枝五物汤出自《金匮要略》,由黄芪、桂枝、白芍、生姜、大枣组成,是治疗的血痹的特效方,具有益气温经、和营通痹的传统功效,多项研究表明其可降低急、慢性OIPN的发生率并减轻其引起的麻木、疼痛、冷刺激过敏等相关症状,可修复OIPN所致的大鼠背根神经节的损伤[17-19]。因OIPN属血痹气虚血瘀型,手术及化疗可导致血虚,加味黄芪桂枝五物汤为黄芪桂枝五物汤加用当归组成,是治疗OIPN经验方。在临床观察有效的基础上,本人前期开展了加味黄芪桂枝五物汤预防OIPN 的多中心RCT研究,共纳入56例大肠癌根治术后辅助化疗患者,结果显示加味黄芪桂枝五物汤可减轻OIPN症状,并可推迟慢性疼痛出现的时间,减轻奥沙利铂引起的外周神经损伤[20]。
DRG是四肢感觉传导的初级神经元,具有传输和调节机体感觉、接受和传导伤害性感受的功能。奥沙利铂主要是通过损伤DRG上感官神经元,其发生率及病情程度与剂量强度、累积剂量、治疗进度、给药持续时间等密切关[21-22]。铂类药物通可过破坏DRG线粒体结构和生物能量学、增加硝基氧化应激和改变线粒体运输、分裂、融合和有丝分裂吞噬而导致周围感觉神经线粒体损伤,从而出现相关的周围神经毒性症状[23-24]。铂类是通过何途径损伤DRG的线粒体,研究[25-27]显示多个途径可能参与了DRG线粒体损伤,其中P53-Bax通路是DRG线粒体损伤中重要的途径。
目前针对DRG细胞凋亡保护研究极少,尤其是基于P53-Bax通道暂无系统研究,本实验为预防OIPN这一肿瘤治疗领域难点提供新的思路,也为预防OIPN的药物研发奠定一定基础,但加味黄芪桂枝五物汤如何调控P53-Bax通道,抑制氧化应激与抑制P53-Bax通道是否相关,这些问题尚不清楚,需进一步研究明确。
本实验成功建立OIPN模型,并从氧化应激及P53-Bax通道介导的线粒体损伤途径共同探讨了加味黄芪桂枝五物汤对OIPN的防治作用,结果显示加味黄芪桂枝五物汤可降低OIPN引起的大鼠机械性缩足阈值且优于GSH;降低OIPN大鼠DRG细胞ROS生成,减轻奥沙利铂引起的大鼠脊髓氧化应激反应;抑制P53的表达,降低P53-Bax通路Bax及Caspase-3蛋白的表达,提高Bcl-2蛋白的表达。结果表明加味黄芪桂枝五物汤可通过减轻奥沙利铂引起的大鼠脊髓氧化应激反应,并通过P53-Bax通路减轻线粒体损伤从而防治OIPN。
4 结论
本研究结果提示,加味黄芪桂枝五物汤可通过抗氧化应激及抑制P53-Bax通路诱导的DRG细胞线粒体损伤来预防OIPN。

