A型肉毒毒素联合类固醇激素与单独类固醇激素治疗病理性瘢痕的系统评价
张 淼,周虹,赵霞,王一枝,杨璐珊,郭杏
(西南医科大学附属医院整形烧伤外科 四川 泸州 646000)
瘢痕是人体皮肤在创伤修复过程中所形成的产物,而呈过度增生表现的病理性瘢痕又具有复发率高、对治疗反应性差等特点,往往在外观和功能方面给患者带来生理及心理的不适[1]。组织张力、感染、基因等因素均会促进其形成[2-3]。目前治疗方法包括手术切除、病灶内药物注射、放射治疗、压迫治疗、激光治疗以及多模式的联合治疗等[4-6]。A型肉毒毒素是一种由肉毒梭状杆菌产生的神经毒素,主要用于面部皮肤美容。相关研究表明,其能干扰成纤维细胞增殖,调节胶原蛋白代谢,减小皮肤表面张力,预防及治疗瘢痕[7-8]。近年来已有A型肉毒毒素与类固醇激素治疗病理性瘢痕的单中心临床试验开展,但疗效存在差异,且存在评价指标不同、样本量小等问题[9-10]。本次检索了国内外相关临床对照试验,通过对研究数据进行Meta分析,以比较A型肉毒毒素联合类固醇激素与单独类固醇激素治疗病理性瘢痕的有效性及安全性。
1 资料和方法
1.1 纳入和排除标准
1.1.1 纳入标准:①研究对象为病理性瘢痕患者,患者年龄、性别不限,病情缓急、严重程度及累及部位不限。病理性瘢痕诊断标准参考2017年的中国临床瘢痕防治专家共识[1];②干预措施为试验组采用A型肉毒素联合类固醇激素病灶内注射治疗,对照组采用类固醇激素病灶内注射治疗;③结局指标,疗效指标包含目测类比评分(Visual analog score,VAS)评分、瘢痕厚度、瘢痕长度、满意度评分、有效率、复发率,安全性指标包含不良反应发生率;④研究类型为临床对照试验。
1.1.2 排除标准:①3个月内接受过药物治疗、光疗或冷冻治疗的患者;②2年内接受过放疗的患者;③皮损内存在感染者;④随访过程中接受其他治疗方式的患者;⑤合并有严重内科疾病、肿瘤或内分泌系统疾病者;⑥妊娠期或哺乳期女性患者;⑦伴有精神疾病,依从性差者;⑧重复发表或数据无法提取的文献;⑨动物实验、个案报道、综述等文献。
1.2 文献检索:采用自由词与主题词相结合的形式,计算机检索截止2021年3月的Pubmed、EMbase、Cochrane Central Register of controlled Trail、中国知网(CNKI)、万方、维普(VIP)以及中国生物医学文献数据库中公开发表的中英文文献,纳入关于A型肉毒毒素联合类固醇激素与单独类固醇激素治疗病理性瘢痕的临床对照试验。中文检索词包括:“A型肉毒毒素”、“类固醇激素”、“曲安奈德”、“倍他米松”、“瘢痕疙瘩”、“增生性瘢痕”等;英文检索词包括:“botulinum toxin type A”、“steroids”、“volon”、“keloids”、“hypertrophic scars”、“pathological scars”等。以PubMed为例,详细检索策略见图1。

图1 PubMed数据库检索策略
1.3 文献筛选、数据提取及质量评价:由2位研究员按照纳入与排除标准独立筛选文献、提取资料及质量评价,若遇争议,则交由第三方裁决。资料提取内容包括:第一作者、发表年份、研究类型、病灶类型、随访时间、结局指标、试验组及对照组例数、人群组成特征等。纳入文献的质量评价采用Cochrane手册风险偏倚评估工具(https://www.cochranelibrary.com/)进行评估,包含:①随机序列的产生;②是否分配隐藏;③受试者及研究者是否盲法;④研究结局的盲法;⑤结果数据的完整性;⑥选择性报告研究结果;⑦其他偏倚。并用RevMan 5.3软件生成风险偏倚图。
1.4 统计学分析:采用Cochrane协作网提供的RevMan 5.3统计软件进行Meta分析。连续性变量资料采用均数差(Weighted mean difference,WMD)或标准化均数差(Standard mean difference,SMD)及其95%可信区间(95% confidence intervals,95%CI)为效应分析统计量,二分类变量资料采用相对危险度(Relative risk,RR)及其95%CI为效应分析统计量,检验水准P=0.05。采用卡方检验分析各研究结果的统计学异质性,若各临床试验无明显异质性(P≥0.1,I²≤50%),则选用固定效应模型(Fixed-effects model)进行分析;若存在明显异质性(P<0.1或I²>50%)时,分析其异质性来源于临床异质性还是统计学异质性,并采用亚组分析、敏感性分析的方法进行处理,若统计学异质性来源不清且无临床异质性则采用随机效应模型进行分析。采用Stata 14.0软件以Egger检验和漏斗图分析发表偏倚,检验水准α=0.05。
2 结果
2.1 文献检索结果:共检索到相关文献289篇,经逐层筛选,最终纳入11项研究[9-19],包括8项随机对照研究(Randomized controlled trial,RCT)[9-11,13,16-19],3项病例-队列(Case-cohort study,CCT)[12,14-15]。文献筛选流程及结果见图2。
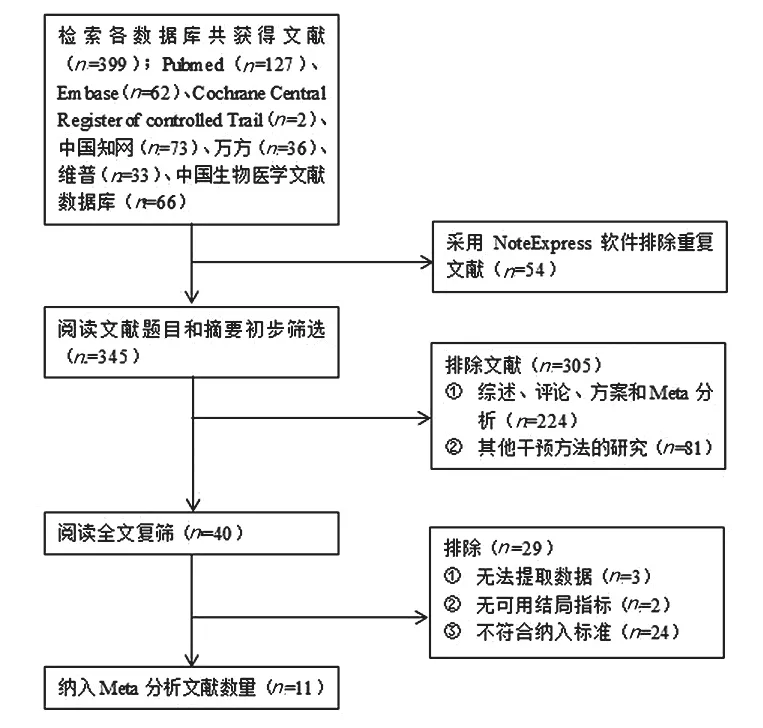
图2 文献筛选流程图
2.2 纳入研究的基本特征与偏倚风险评价结果:纳入11篇文献中640例患者,共679处皮损,采用A型肉毒素联合类固醇激素局灶内注射组皮损共338处,采用单独类固醇激素局灶内注射共341处,详细纳入文献的基本特征见表1。详细偏倚风险评价结果见图3。

表1 纳入文献的基本特征

图3 纳入文献的偏倚风险评估结果汇总
2.3 Meta分析结果
2.3.1 VAS评分:VAS评分是主观评价量表,0分表示无痛,10分为剧痛。共纳入8项研究[9,11,13-15,17-19],各研究间存在异质性(P<0.00001,I²=98%),选择随机效应模型,结果显示试验组在改善VAS评分明显优于对照组[WMD=-2.26,95%CI(-3.07,-1.46),P<0.00001]。见图4。以瘢痕类型进行亚组分析,增生性瘢痕组不存在异质性(P=0.95,I²=0%),而瘢痕疙瘩组存在较大异质性(P<0.00001,I²=99%),因此病灶类型可能是异质性来源。见图5。
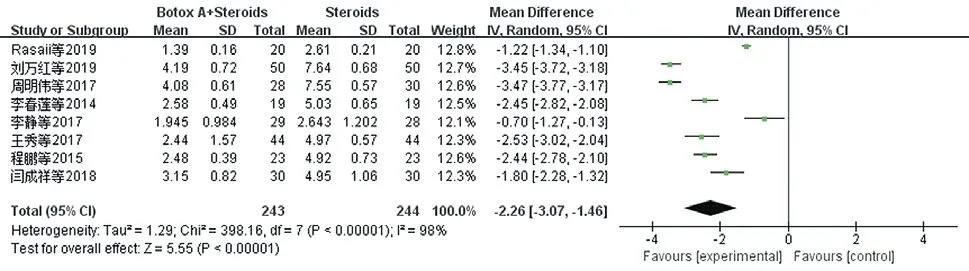
图4 治疗后两组患者VAS评分比较的Meta分析森林图

图5 治疗后两组患者VAS评分比较的Meta分析森林图(病灶类型的亚组分析)
2.3.2 瘢痕厚度:共纳入4项研究[9-11,15],其治疗前瘢痕厚度不存在统计学差异,采用治疗后的瘢痕厚度进行分析。各研究间存在异质性(P<0.00001,I²=98%),通过随机效应模型分析,试验组厚度明显小于对照组[WMD=-0.94,95%CI(-1.82,-0.06),P=0.04]。见图6。根据类固醇激素品种进行亚组分析,曲安奈德组存在轻度异质性(P=0.27,I²=19%),而倍他米松组不存在异质性(P=0.73,I²=0%),推测类固醇激素种类的不同可能是异质性来源。见图7。

图7 治疗后两组患者瘢痕厚度比较的Meta分析森林图(类固醇激素种类的亚组分析)
2.3.3 瘢痕长度:共纳入2项研究[10,16],其治疗前的瘢痕长度不存在统计学差异,采用治疗后的瘢痕长度分析。因其有统计学异质性(P<0.00001,I²=99%),且测量结果的单位不一致,选择随机效应模型及SMD模型,结果显示两组间差异无统计学意义[SMD=-4.30,95%CI(-11.56,2.96),P=0.25]。见图8。
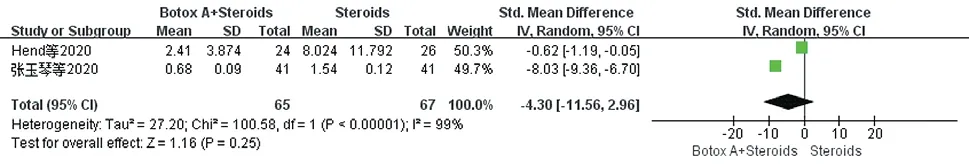
图8 治疗后两组患者瘢痕长度比较的Meta分析森林图
2.3.4 满意度评分:共纳入2项研究[18-19],满意度评分标准一致,0分表示无效,1分为稍有改善,2分为改善,3分为明显改善。研究间未发现异质性(P=0.52,I²=0%),选择固定效应模型,结果显示试验组满意度评分优于对照组[WMD=1.51,95%CI(1.21,1.81),P<0.00001]。见图9。
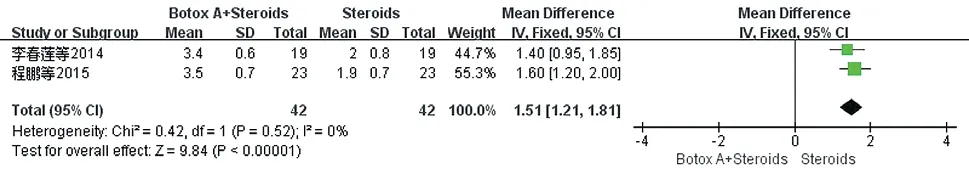
图9 治疗后两组患者满意度评分比较的Meta分析森林图
2.3.5 有效率:共纳入5项研究[12,14,16-17,19],各项研究关于治疗有效的评价标准一致,显效:瘢痕变平变软,与周围皮肤相平,颜色近似于正常皮肤,痛痒症状消失;有效:瘢痕变薄变软,颜色暗红,痛痒症状显著减轻;无效:颜色鲜红,厚度无明显改变,质地硬,瘙痒症状无明显消退。各研究间无异质性(P=0.95,I²=0%),选择固定效应模型,结果显示试验组有效率优于对照组[RR=1.30,95%CI(1.17,1.43),P<0.00001]。见图10。
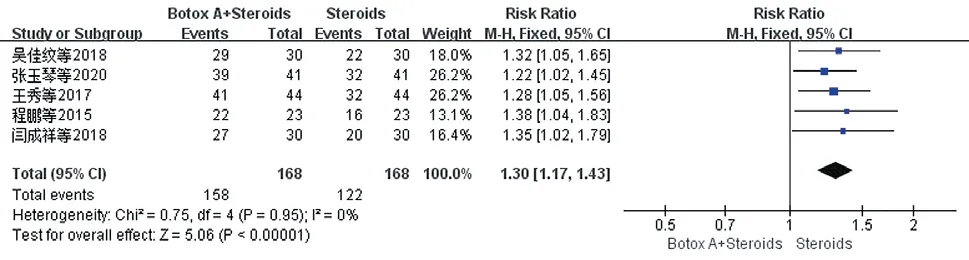
图10 治疗后两组患者有效率比较的Meta分析森林图
2.3.6 复发率:共纳入3项研究[12,14,16],各项研究关于复发的定义标准一致,即瘢痕瘙痒加重、质地变硬、厚度、体积变大。各研究间无异质性(P=0.63,I²=0%),选择固定效应模型,结果显示试验组复发率低于对照组[RR=0.23,95%CI(0.11,0.49),P=0.0002]。见图11。
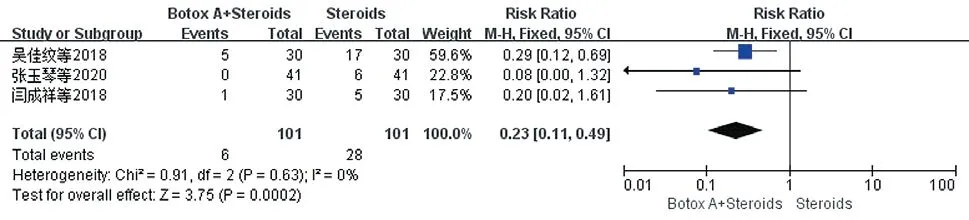
图11 治疗后两组患者复发率比较的Meta分析森林图
2.3.7 不良反应发生率:不良反应主要包括毛细血管扩张、瘙痒、疼痛、色素沉着、色素减退、水肿、红肿、灼热、紫癜及点状坏死。共纳入6项研究[10-12,14-16],各研究间无异质性(P=0.70,I²=0%),选择固定效应模型,结果显示试验组不良反应发生率低于对照组[RR=0.65,95%CI(0.42,0.99),P=0.04]。见图12。
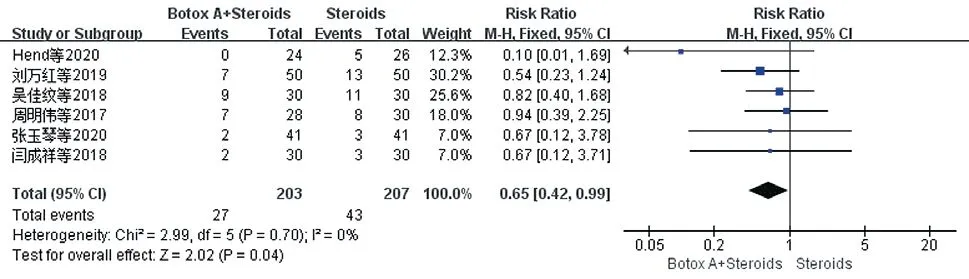
图12 治疗后两组患者不良反应发生率比较的Meta分析森林图
2.4 敏感性分析及发表偏倚分析:对所有结局指标进行敏感性分析,剔除每一项研究后再进行合并,Meta分析结果稳定。采用Egger’s检验和漏斗图检测发表偏倚,结果发现VAS评分及有效率存在发表偏倚(P=0.007,0.014),见图13~14,原因可能与纳入中文文章多以及两项指标的评价存在主观因素影响有关。

图13 纳入研究的VAS评分的发表偏倚分析图
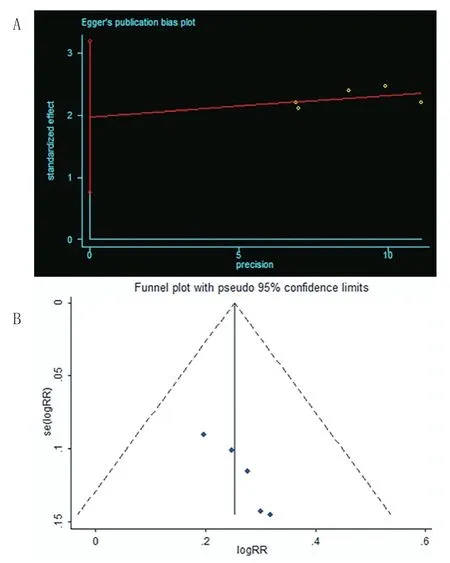
图14 纳入研究的有效率的发表偏倚分析图
3 讨论
近二十年来,随着对A型肉毒毒素治疗瘢痕的研究逐步取得进展,其临床应用得以推广,研究结果大多倾向有效,但所报道的疗效存在差异[20-24]。与此同时多药物的联合治疗模式逐步应用[25]。2019年,Rasaii等[9]研究指出,A型肉毒毒素联合类固醇激素能改善疼痛及瘙痒症状,但在降低高度、软化瘢痕、改善色素沉着等方面与单独类固醇激素治疗并无较大差异,这可能受随访时间仅为1个月的影响。同年,Sun等[26]综合近年来的临床研究,对药物注射治疗病理性瘢痕的疗效进行了网络荟萃分析,指出A型肉毒毒素联合类固醇激素治疗效果最好,优于单独A型肉毒毒素组、单独类固醇激素组及类固醇激素联合5-氟尿嘧啶组,然而其存在结局指标较少、各干预组纳入研究较少等问题。因此有必要进行针对性的Meta分析,比较A型肉毒毒素联合类固醇激素与单独类固醇激素治疗病理性瘢痕的有效性及安全性。
在本研究中,改善VAS评分、降低厚度、提高有效率、减少复发及提升满意度评分,试验组均明显优于对照组。但在VAS评分和瘢痕厚度中,所纳入研究存在异质性。分别行亚组分析及敏感性分析检测,结果在VAS评分中,瘢痕疙瘩组异质性仍较高,而当分别排除刘万红等[11]、周明伟等[15]两篇文献时,瘢痕疙瘩组中异质性均较前降低,该两项研究的患者与亚组内其他患者相比,患病程度有显著差异,因此认为这可能是异质性的来源。对瘢痕厚度的研究行亚组分析,提示类固醇激素种类的不同可能是其异质性的来源。在改善瘢痕长度方面,本研究结果显示,联合治疗组并不优于单独类固醇激素组,这可能与只纳入了2项临床研究,原始数据的单位不统一有关,随着更多RCT的开展、临床数据的进一步更新,应该能得到更为准确的结果。另外,所纳入临床对照实验中,绝大多数只采用了VAS量表进行评分,此项评分具有主观性,更多对于瘢痕的评估量表,如VSS、SBSES、MSS、POSAS并未提及,因此,未来更多的研究应该着重于探讨最佳的药物使用量,统一评价标准。
在安全性方面,本研究中有6篇文献报道了不良反应的发生,均未见较严重并发症及副作用的发生,总体不良反应发生比例中,联合治疗组(27/203)明显低于类固醇激素组(43/207),这与每项研究结论一致。联合治疗组不良反应发生较少,提示A型肉毒毒素能减轻类固醇激素的不良反应,其机制可能与A型肉毒毒素能降低TGF-β有关[7-8],但需要更多相关研究加以证明。各研究采用的药物注射量存在一定差异,但均表明试验组的不良反应更少,这与Yin等[27]研究结论相符。
目前最新指南推荐5-氟尿嘧啶联合激素注射作为主要的局灶类药物治疗方案[28-31],但5-氟尿嘧啶具有抗肿瘤特性,针对具有肿瘤性生长的瘢痕疙瘩效果较好,但会增加不良反应发生的可能[32],对于以炎症表现为主的增生性瘢痕,其效果是否优于A型肉毒毒素,目前尚未更多的临床证据,因此未来可开展A型肉毒毒素联合治疗与5-氟尿嘧啶联合治疗的对比试验,以期对于病理性瘢痕患者的个体化治疗提供参考。
本系统评价的局限性:①纳入中文文献较多,缺乏广泛性,存在一定的发表偏倚;②部分研究为CCT,其余RCT的随机方法也并不一致,这会导致结果的偏倚;③纳入的临床研究在药物注射量、疗程及随访时间上存在差异,这可能会导致治疗效果、复发率及安全性受到不同程度的影响;④评价指标缺乏对治疗费用的统计,这会对患者的接受度造成影响,建议临床研究从成本-疗效角度为临床医生及患者提供个性化选择。
综上所述,A型肉毒毒素联合类固醇激素治疗病理性瘢痕的疗效及安全性均优于单独使用类固醇激素。未来需要多中心、大样本量、高质量的RCT予以证实。
作者贡献:文章选题、论文设计及指导为郭杏,张淼参与文章撰写、资料提取、质量评价及数据分析,赵霞及王一枝参与资料提取、质量评价,周虹及杨璐珊参与第三方核实数据及文献评价。
利益冲突:文章的全部作者声明,在课题研究和文章撰写过程不存在利益冲突。
写作指南:该研究遵守《系统综述和荟萃分析报告规范》(PRlSMA指南)。

